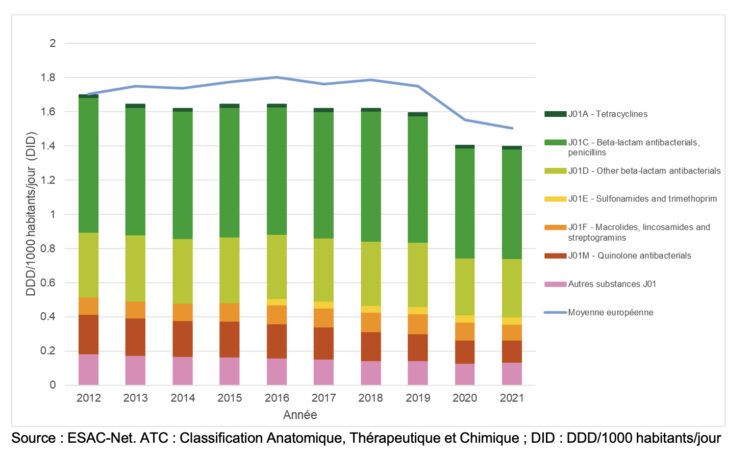
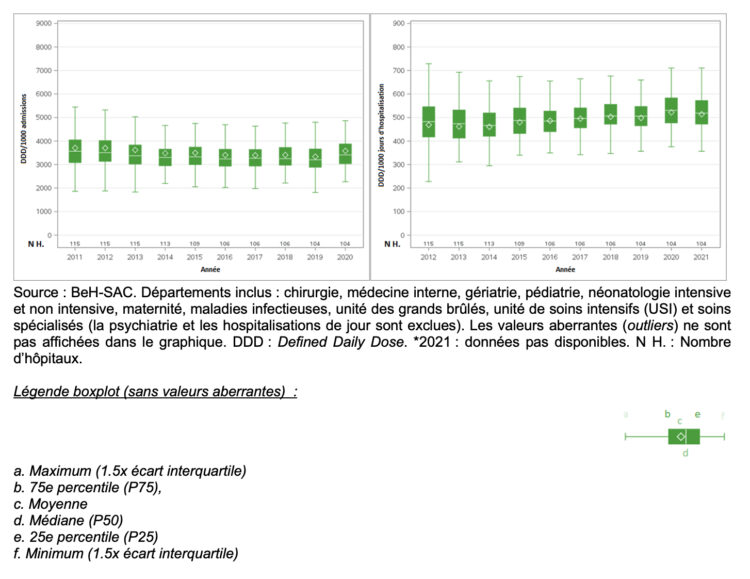
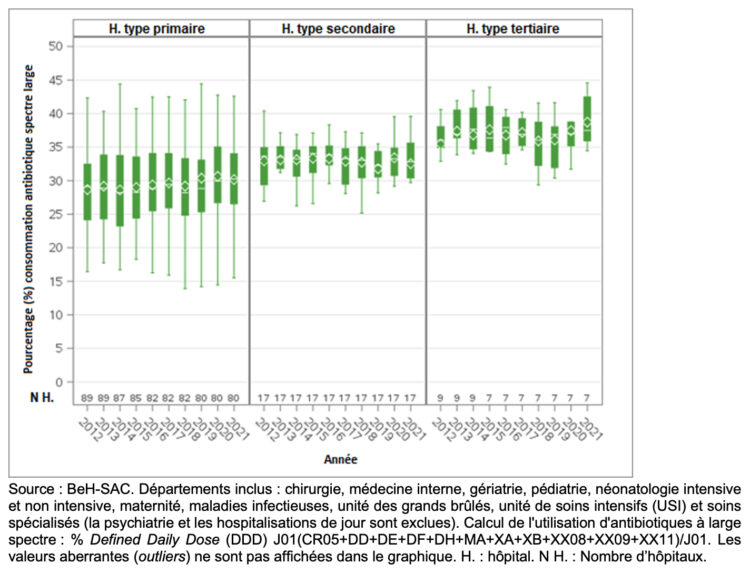
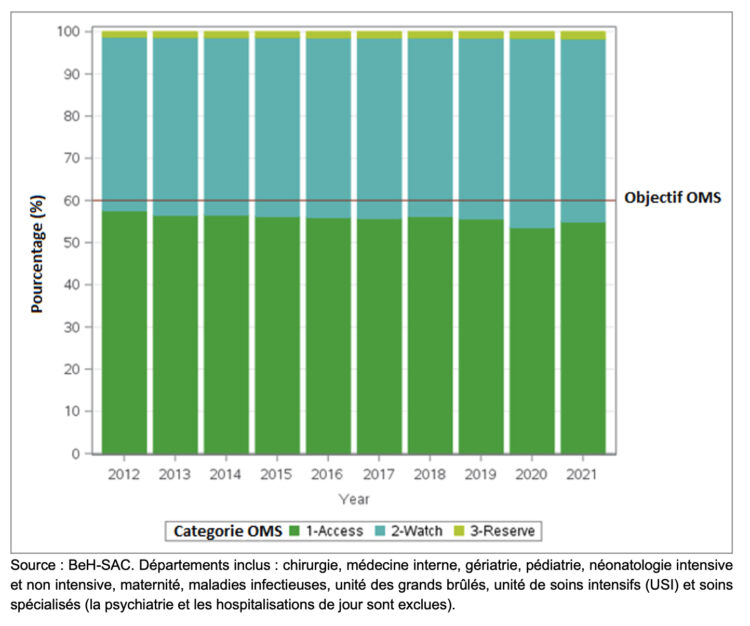
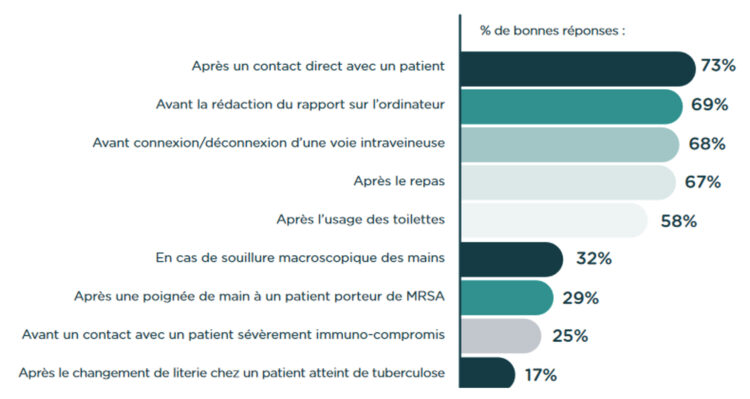
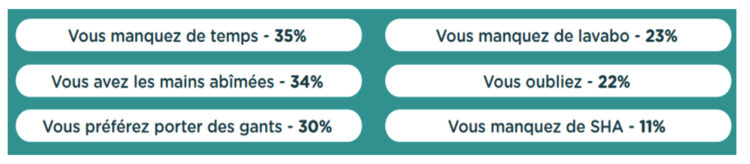
Introduction
La carte de visite d’un établissement de santé est avant toute chose la propreté visuelle de son environnement. Des établissements de soins de santé propres et bien rangés donnent un sentiment de sécurité et augmentent la satisfaction des patients (1). Si cette vision des choses est communément admise, l’environnement d’un établissement de soins compte pourtant parmi les domaines les plus sous-estimés et les moins bien financés des soins de santé. Et ce, malgré le fait que les données de la littérature attestent de l’importance cruciale d’une bonne hygiène environnementale comme facteur de prévention de la propagation des infections associées aux soins et de la résistance aux antimicrobiens (2). Cependant, peu d’études qualitatives ont permis d’établir un lien entre les interventions en matière d’hygiène environnementale et la réduction des infections associées aux soins. Une des difficultés majeures réside dans le fait qu’il est difficile de savoir si une infection associée aux soins découle d’une contamination par un agent pathogène environnemental. Même s’il est notoire que l’environnement des soins de santé constitue le réservoir le plus fréquent de certains agents pathogènes, il est rare de trouver des recherches à ce sujet. En revanche, plusieurs études ont démontré l’impact que pouvait avoir l’hygiène environnementale sur la santé (3). Les agents pathogènes les plus courants dans les soins de santé peuvent survivre sur des surfaces pendant des périodes prolongées allant de quelques jours à plusieurs semaines, voire plus d’un an, pour certains d’entre eux (4,5). Il a aussi été démontré que des manquements à l’hygiène environnementale étaient fortement corrélés aux infections associées aux soins dans une unité de soins intensifs (6).
Ainsi, un patient a 2 fois plus de chances d’être infecté par un agent pathogène si l’occupant précédent de la chambre était colonisé ou infecté par cet agent (7).
Au cours des deux dernières décennies, certaines interventions, comme l’hygiène des mains, ont permis de réduire le nombre d’infections associées aux soins dans les établissements de soins (8). La mauvaise hygiène des mains est reconnue comme l’une des principales causes d’infections nosocomiales chez les patients. Si une bonne hygiène des mains permet de réduire jusqu’à 50 % les infections associées aux soins, des mesures additionnelles peuvent contribuer à réduire encore plus fortement ces taux. A cet égard, l’hygiène environnementale joue un rôle important et est essentielle dans tous les contextes de soins, qu’il s’agisse d’hôpitaux, de maisons de repos et de soins ou de soins à domicile (9).
L’efficacité dépend de plusieurs facteurs techniques et humains. Les facteurs techniques incluent le nettoyage et la désinfection des surfaces, la gestion de l’eau, le contrôle de l’air, la gestion des déchets, la gestion du linge et la stérilisation et le retraitement des dispositifs médicaux (DM). Les facteurs humains concernent à la fois la conception, la mise en œuvre et le suivi des procédures de travail, la formation et la gestion du personnel et l’organisation structurelle des services impliqués dans l’hygiène environnementale.
Ces deux facteurs sont essentiels pour la sécurité des patients et des prestataires de soins de santé et doivent par conséquent être harmonisés.
Cet article se limite à un aspect des facteurs techniques de l’hygiène environnementale, à savoir l’efficacité d’un désinfectant selon le domaine d’application. En guise de préambule, il est important de souligner qu’il ne s’agit que d’un maillon de la chaîne de l’hygiène environnementale. Les autres facteurs et principes de base généraux, tel le nettoyage, sont des maillons tout aussi importants qui régissent le succès où l’échec de la politique d’hygiène environnementale. Les micro-organismes étant souvent transmis par les mains et pouvant contaminer directement l’environnement de soins, l’efficacité des désinfectants pour les mains sera également abordée.
Réglementation
Les désinfectants doivent être soumis à une réglementation et des tests d’efficacité stricts avant leur mise sur le marché. Celle-ci dépend de la région où les produits sont commercialisés et est déterminée par divers organismes de réglementation dans le monde. Nous nous limitons ici à l’Europe, les principaux organismes étant l’ECHA (Agence européenne des produits chimiques) et le CEN (Comité européen de normalisation).
L’ECHA est responsable du cadre réglementaire pour les substances chimiques : REACH. L’acronyme REACH signifie enRegistrement, Évaluation et Autorisation des substances Chimiques. REACH est un règlement de l’Union européenne sur la production, le commerce et l’utilisation de toutes les substances et mélanges chimiques. L’ECHA est chargée de la gestion des aspects techniques, scientifiques et administratifs du cadre réglementaire de REACH. Elle constitue le moteur de la législation européenne en matière de substances et de mélanges chimiques et doit assurer la cohérence de ces aspects dans la législation de l’Union européenne. La mission de l’ECHA est d’assurer une utilisation sûre des produits chimiques. Elle fait par ailleurs office de centre d’excellence pour la gestion durable des produits chimiques. Voici un aperçu des principaux règlements et de leur champ d’application.
Figure 1 : Aperçu du cadre législatif européen pour les substances et mélanges chimiques

La directive DSD (Dangerous Substances Directive) porte sur la classification, l’emballage et le marquage des substances dangereuses. La directive DPD (Dangerous Preparations Directive) s’applique aux mélanges dangereux, et le règlement CLP (Classification, Labelling & Packaging) couvre la classification, l’étiquetage et l’emballage des substances et des mélanges.
L’enregistrement des désinfectants utilisés dans l’environnement des soins de santé est spécifié dans le règlement relatif aux biocides et DM. Pour la désinfection de routine des DM réutilisables et de leurs surfaces (avant et après une utilisation standard sur un patient), le produit doit être enregistré en tant que classe IIa (désinfectants pour les DM non invasifs à la fin du processus de traitement et désinfectants pour les DM invasifs où un processus de désinfection ou de stérilisation est effectué ensuite) ou en tant que classe IIb (désinfectants pour les DM invasifs à la fin du processus de traitement).
Cependant, en présence d’un risque réel d’infection (par exemple, chambre d’isolement dans laquelle séjourne un patient colonisé/infecté par un MDRO [Multi Drug Resistant Organism] ou en cas de situation épidémique), les DM réutilisables et leurs surfaces doivent être décontaminés avec un produit enregistré Biocide efficace contre l’agent pathogène concerné. Pour toutes les autres surfaces de l’environnement de soins qui ne sont pas des DM, on utilise un désinfectant enregistré comme biocide. Deux types de surfaces sont alors à distinguer, à savoir celles qui ne sont pas en contact direct avec les aliments (TP2) et celles qui sont en contact direct avec les aliments (TP4).
Figure 2 : Aperçu du type d’enregistrement par domaine d’application
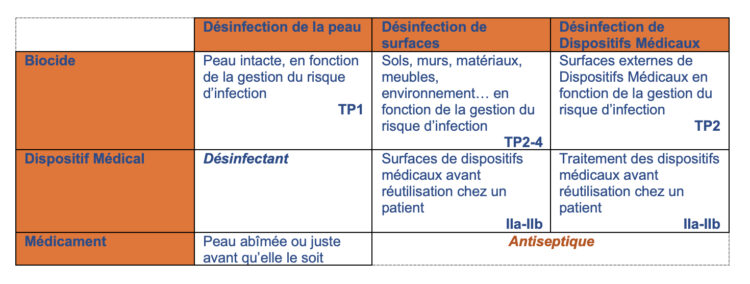
Concernant les désinfectants pour les mains, l’ECHA (10) et la décision d’exécution européenne 2016/904 (11) indiquent clairement que ceux-ci doivent être enregistrés en tant que Biocides TP1, car ils sont spécifiquement utilisés dans le contexte de prévention de la transmission de pathogènes, et non dans un contexte thérapeutique (désinfection des plaies) ou prophylactique (avant rupture de la barrière cutanée ou de la muqueuse) (cf. Enregistrement des médicaments).
Le CEN est un organisme privé et international à but non lucratif chargé de créer des normes. Les normes européennes sont dictées par l’industrie et obtenues grâce à un processus transparent, équilibré et consensuel impliquant les parties prenantes concernées. Le CEN a pour objectif de produire des normes de haute qualité pour les produits et services qui comportent des exigences de qualité, de sécurité, d’environnement, d’interopérabilité et d’accessibilité. Le comité technique 216 du CEN (TC216) est compétent pour la normalisation de la terminologie, des exigences, des méthodes d’essai, y compris l’efficacité potentielle dans les conditions d’utilisation, des recommandations d’utilisation et de l’étiquetage dans l’ensemble du domaine des désinfectants et antiseptiques chimiques. Ce comité élabore, publie et révise toutes les normes relatives aux désinfectants, tant dans les domaines médicaux et vétérinaire que dans celui de l’hygiène alimentaire, de l’industrie, de l’usage domestique et institutionnel.
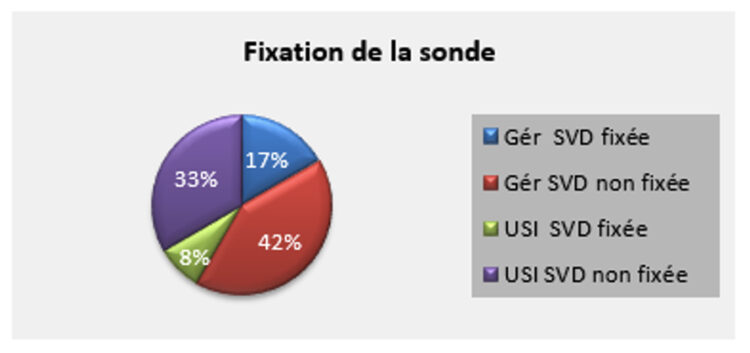
Dans un souci de clarification, le comité a élaboré une norme récapitulative qui donne un aperçu complet de toutes les normes existantes par domaine d’application, à savoir la norme EN 14885. Disons-le, un guide indispensable pour tout expert en prévention des infections qui souhaite comparer l’efficacité des désinfectants ou vérifier que son choix de désinfectant pour une application particulière répond aux exigences d’efficacité nécessaires. Pour la suite de la réflexion, cet article s’appuie sur la version la plus récente de la norme EN 14885, à savoir celle d’août 2022, et se limite aux normes applicables dans le domaine médical.
Domaines d’application et définitions
Pour affirmer qu’un produit possède certaines propriétés désinfectantes adaptées à une utilisation dans le secteur médical, ce produit doit être testé conformément aux normes européennes pertinentes énumérées dans le tableau ci-dessous et y satisfaire (12).
Tableau 1 : normes européennes relatives à la justification d’allégations de produits dans le domaine médical
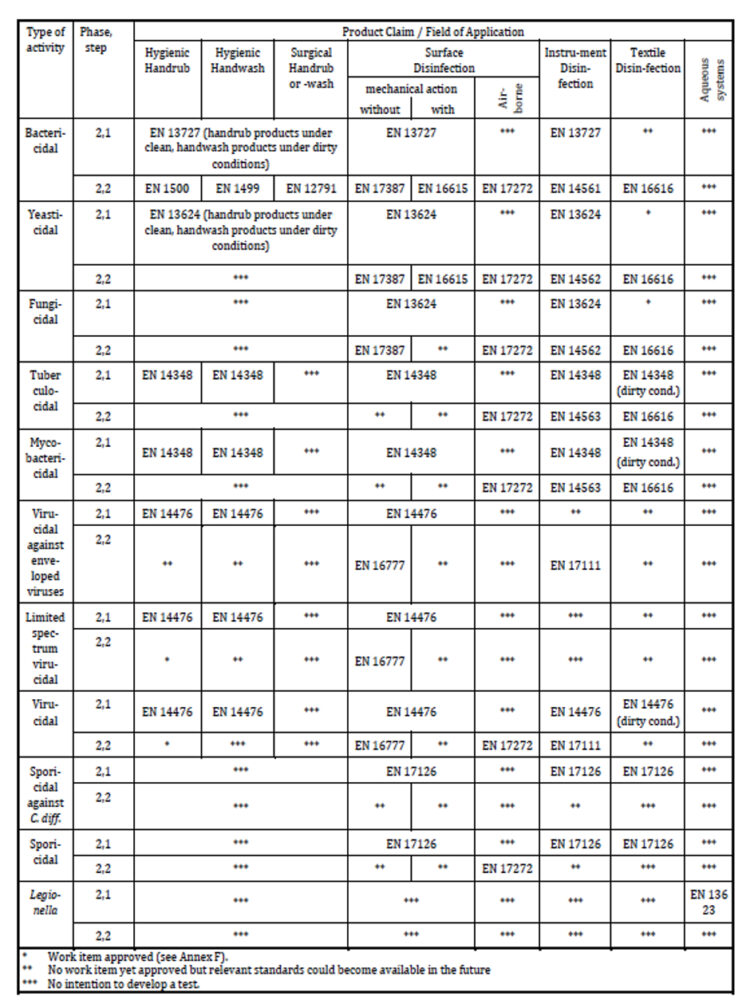
Ce que l’on entend par les différents domaines d’application est clairement défini dans la norme. La friction et le lavage hygiéniques des mains, la friction et le lavage chirurgical des mains, la désinfection du linge et le traitement de l’eau pour lutter contre les légionelles ne nécessitent pas d’explications supplémentaires, car ils sont suffisamment connus et univoques. Cependant, pour les domaines d’application de la décontamination des surfaces et des instruments, il est nécessaire de citer les définitions afin d’éviter toute interprétation erronée. La désinfection de surface est la désinfection chimique d’une surface solide, y compris celle de certains DM qui ne peuvent être immergés, par l’application d’un produit avec ou sans action mécanique (par exemple, arrosage, pulvérisation, nébulisation, essuyage, etc.). Enfin, la désinfection des instruments est la désinfection chimique de certaines surfaces de DM par immersion.
Types de tests antimicrobiens
Les tests se déroulent en 3 phases. Les tests de la phase 1 sont des tests quantitatifs en suspension visant à déterminer que les substances actives ou les formulations des produits ont une activité bactéricide, fongicide ou sporicide, quel que soit le domaine d’application. Ces tests ne peuvent pas être utilisés pour alléguer l’efficacité.
Les tests de la phase 2 se déroulent en 2 étapes :
• Les tests de la phase 2, étape 1, sont des tests quantitatifs en suspension visant à déterminer si un produit a une activité bactéricide, levuricide, fongicide, tuberculocide, mycobactéricide, virucide ou sporicide dans des conditions pratiques simulées (conditions propres ou sales) adaptées à l’utilisation prévue. Ces tests fournissent des informations pertinentes sur l’activité du produit contre des micro-organismes en suspension. Si aucun test de phase 2, étape 2, n’est effectué en plus de ce test, le « temps de contact humide » s’applique. Cela signifie qu’une surface doit rester « mouillée » par le produit pendant tout le temps de contact.
• Les tests de la phase 2, étape 2, sont des tests quantitatifs en laboratoire visant à déterminer si un produit a une activité bactéricide, levuricide, fongicide, tuberculocide, mycobactéricide, virucide ou sporicide lorsqu’il est appliqué sur une surface ou sur la peau dans des conditions pratiques simulées (conditions propres ou sales). Ces tests fournissent des informations sur l’activité contre des micro-organismes déshydratés sur des surfaces inertes ou sur des tissus vivants ou contre des micro-organismes non déshydratés sur des tissus vivants. Pour ces tests, le « temps de contact humide » ne s’applique pas, car le produit est testé tel qu’il est utilisé dans la pratique.
Les tests de phase 2 sont toujours effectués selon les exigences minimales/conditions obligatoires énoncées dans les normes. Selon le domaine d’application du produit, les essais doivent être réalisés dans des conditions normalisées complémentaires (organismes d’essai, température, temps de contact et substances interférentes) comme spécifié dans la norme. Les deux tests — phase 2, étape 1 et phase 2, étape 2 — doivent être combinés pour pouvoir alléguer une certaine efficacité d’un produit. Une dérogation à ce principe n’est autorisée que dans des cas exceptionnels, qui sont spécifiés dans l’annexe B de la norme EN 14885 (2022). En d’autres termes, les résultats des deux tests sont toujours pris en compte pour établir l’allégation d’efficacité.
Les tests de phase 3 sont des tests sur le terrain en conditions réelles. Il n’existe pas encore de méthodologie applicable à ce type de test, mais on pourrait en élaborer à l’avenir. Des directives pour la conception des tests de phase 3 et l’utilisation des données issues des tests de phase 3 sont décrites dans l’annexe C de la norme EN 14885 (2022).
Sélection des micro-organismes et des conditions d’essai en fonction du domaine d’application
Cette section explique pour chaque domaine d’application à quels tests de l’étape 2 le désinfectant doit satisfaire. Pour chaque norme, les micro-organismes testés, les conditions pratiques simulées, la réduction logarithmique requise et le temps de contact sont expliqués.
Hygiène des mains
Le tableau ci-dessous énumère toutes les normes relatives aux savons désinfectants et aux solutions hydroalcooliques. À chaque fois, une distinction est faite entre les différents types de désinfection des mains, à savoir le lavage hygiénique des mains, la friction hygiénique des mains, le lavage chirurgical des mains et la friction chirurgicale des mains. Pour chaque type, renseigné dans la colonne « Norme », les exigences en termes de micro-organismes à tester, de conditions pratiques, de réduction logarithmique requise et de temps de contact sont indiquées.
Tableau 2 : Normes européennes relatives aux désinfectants pour les mains conformément à la norme EN 14885 (2022)
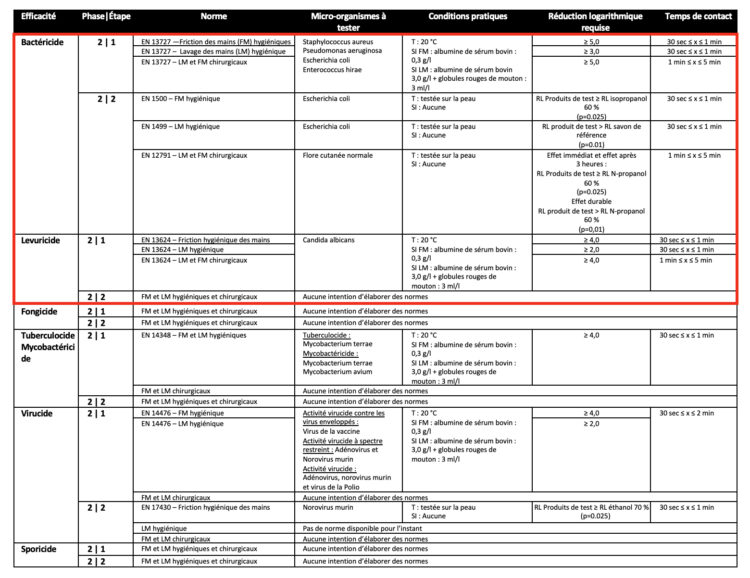
Les normes figurant dans l’encadré rouge sont les exigences requises pour commercialiser un désinfectant pour les mains conformément à la norme EN 14885 (2022). Les autres normes sont additionnelles et donc facultatives. Cependant, pour un certain nombre de micro-organismes, comme le virus de la vaccine testé conformément à la norme EN 14476, l’efficacité est recommandée, étant donné que ce virus est un modèle pour tous les virus enveloppés, y compris les coronavirus. En outre, en termes d’activité virucide, l’efficacité contre les norovirus et les rotavirus en vertu de la norme EN 14476 dans le secteur des soins de santé est également importante. Comme la norme EN 14476 concerne un test de suspension, le temps de contact humide est important ici. En d’autres termes, les mains doivent rester humidifiées par le désinfectant pendant toute la durée de contact pour garantir l’efficacité voulue.
À l’avenir, un test pratique de virucidie (phase 2/étape 2) sera disponible : il s’agit de la norme prEN 17430, actuellement encore en phase de recherche. La phase de validation, ou de vote, a été provisoirement fixée au 14 décembre 2023.
Hygiène des surfaces
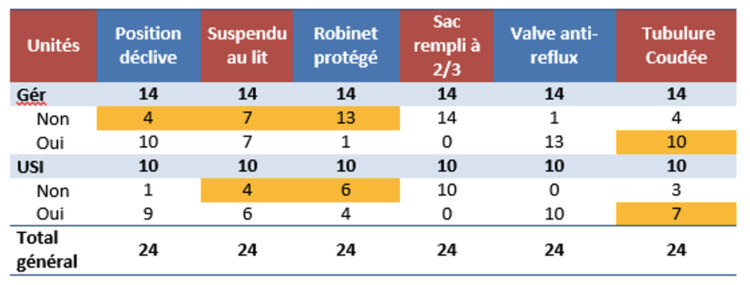
Pour les produits destinés à la désinfection des surfaces non submersibles (cf. application d’un produit sur une surface avec ou sans action mécanique), les normes applicables sont indiquées dans le tableau ci-dessous. La colonne des conditions pratiques différencie un désinfectant pur d’un désinfectant nettoyant. Par conséquent, un produit 2 en 1 qui nettoie et désinfecte simultanément doit toujours être testé dans des conditions sales, à savoir avec des substances interférentes 3,0 g/l d’albumine bovine et 3 ml/l de globules rouges de mouton.
Tableau 3 : Normes européennes relatives aux désinfectants pour surfaces non submersibles conformément à la norme EN 14885 (2022)
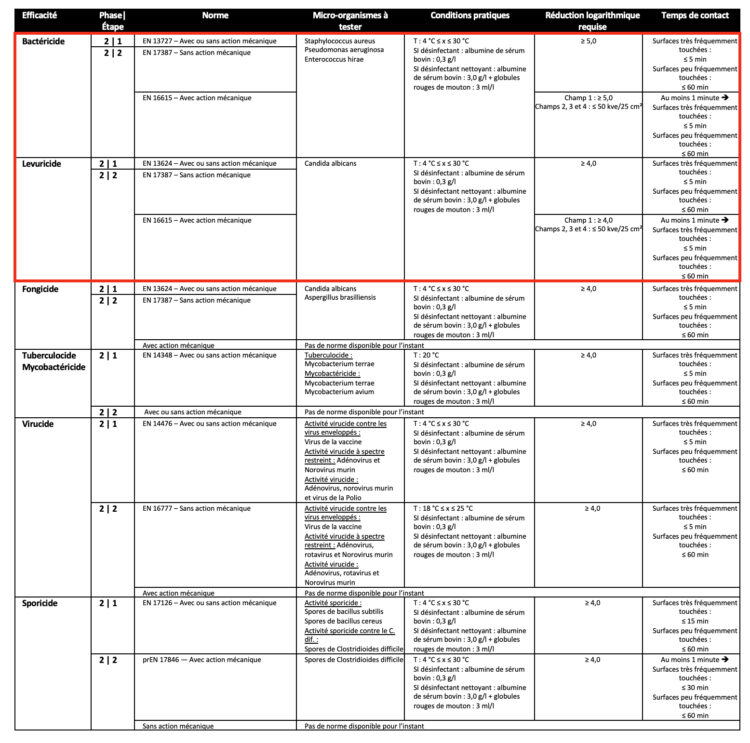 Les normes obligatoires pour pouvoir commercialiser un désinfectant de surfaces, conformément à la norme EN 14885 (2022), sont reprises dans l’encadré rouge. Les autres normes sont facultatives, mais seront requises suivant la nature de la surface (sanitaire, surface fréquemment touchée, DM…) et le contexte (service à risque, chambre d’isolement, épidémiologie…) dans lequel le désinfectant est mis en œuvre. Par exemple, dans le cas d’une chambre d’isolement où réside un patient atteint de diarrhée et infecté par Clostridioides difficile, le désinfectant devra être sporicide. Par conséquent, la performance sporicide de ce produit doit être testée conformément à la norme EN 17126 ainsi qu’à la norme prEN17846. Toutefois, cette dernière est actuellement en phase d’approbation, le vote étant provisoirement fixé au 20 juin 2023. À ce jour, l’efficacité contre les spores de Clostridioides difficile est admise selon la méthodologie de la norme EN 16615 (avec action mécanique) ou EN 17387 (sans action mécanique), ainsi que de la norme EN 17126 pour revendiquer une activité sporicide.
Les normes obligatoires pour pouvoir commercialiser un désinfectant de surfaces, conformément à la norme EN 14885 (2022), sont reprises dans l’encadré rouge. Les autres normes sont facultatives, mais seront requises suivant la nature de la surface (sanitaire, surface fréquemment touchée, DM…) et le contexte (service à risque, chambre d’isolement, épidémiologie…) dans lequel le désinfectant est mis en œuvre. Par exemple, dans le cas d’une chambre d’isolement où réside un patient atteint de diarrhée et infecté par Clostridioides difficile, le désinfectant devra être sporicide. Par conséquent, la performance sporicide de ce produit doit être testée conformément à la norme EN 17126 ainsi qu’à la norme prEN17846. Toutefois, cette dernière est actuellement en phase d’approbation, le vote étant provisoirement fixé au 20 juin 2023. À ce jour, l’efficacité contre les spores de Clostridioides difficile est admise selon la méthodologie de la norme EN 16615 (avec action mécanique) ou EN 17387 (sans action mécanique), ainsi que de la norme EN 17126 pour revendiquer une activité sporicide.
Hygiène des instruments
Les désinfectants dans lesquels des DM ou d’autres matériaux sont immergés doivent être testés conformément aux normes indiquées dans le tableau ci-dessous. Comme pour les normes d’hygiène des surfaces, une distinction est faite dans la méthodologie entre désinfectants purs (conditions propres) et désinfectants nettoyants (conditions sales). L’encadré rouge reprend les exigences requises pour commercialiser un désinfectant destiné à cette application conformément à la norme EN 14885 (2022).
Tableau 4 : Normes européennes relatives aux produits désinfectants pour instruments submersibles conformément à l’EN 14885 (2022)
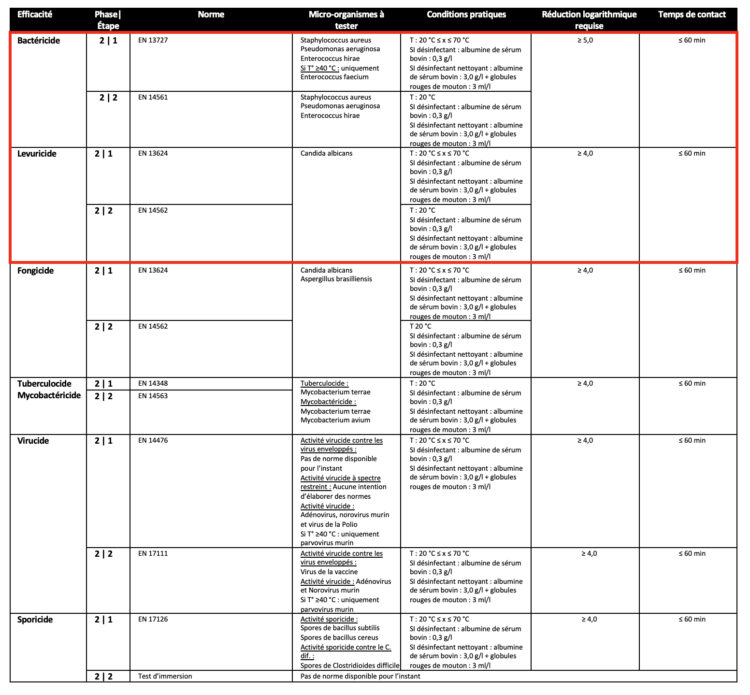
Là encore, les autres normes sont facultatives, mais deviendront obligatoires en fonction du matériau et du type de Dispositif Médical (bassinet rénal, endoscope, instrument chirurgical…) et du contexte (phase de pré-nettoyage, décontamination terminale…) dans lequel le désinfectant est mis en œuvre. Par exemple, un désinfectant dans lequel on immerge les lames de laryngoscope devra avoir un niveau de désinfection intermédiaire. Concrètement, cela signifie que le désinfectant devra être bactéricide (EN 13727 + EN 14561), fongicide (EN 13624 + EN 14562), mycobactéricide (EN 14348 + EN 14563) et virucide (EN 14476 + EN 17111). Si ces lames de laryngoscope sont immergées immédiatement après utilisation et ne reçoivent aucun autre traitement par la suite, le nettoyant-désinfectant doit avoir été testé en conditions sales.
Exigences en matière de désinfectant pour surfaces et instruments en fonction du degré de désinfection
Les désinfectants pour matériaux et DM sont souvent classés en trois niveaux dans la littérature. Le premier niveau concerne la désinfection de bas niveau, ce qui signifie qu’un produit est bactéricide, levuricide et virucide contre les virus enveloppés. Le niveau suivant porte sur la désinfection de niveau intermédiaire. Pour cela, le produit doit être bactéricide, levuricide, fongicide, mycobactéricide et virucide à spectre restreint. Pour le niveau le plus élevé, à savoir la désinfection de haut niveau, une action sporicide et virucide complète est nécessaire en plus de ces dernières. Le tableau suivant traduit cette répartition en normes requises selon la norme EN 14885 (2022), en distinguant les désinfectants pour immersion de ceux appliqués sur une surface.
Figure 3 : Normes européennes relatives aux désinfectants pour surfaces et instruments en fonction du degré de désinfection
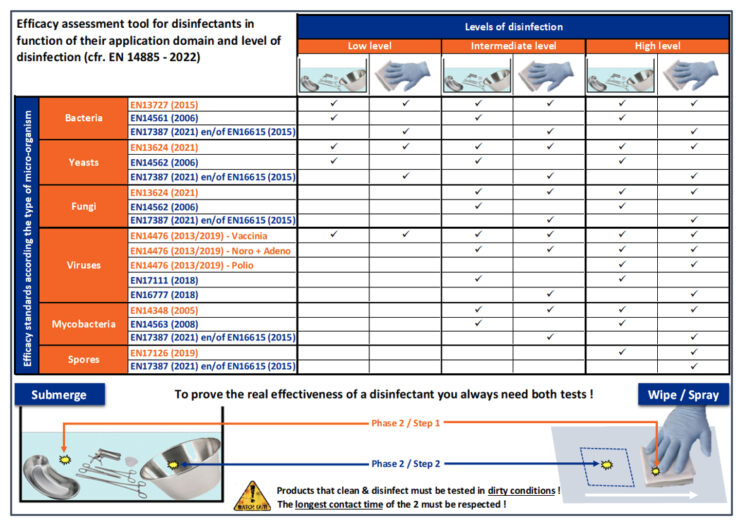
A noter que la norme EN 17387 a été publiée en août 2021 et par conséquent, en vertu des dispositions de la norme EN 14885 (2022) chapitre 8.1, ne remplace définitivement la norme EN 13697 (2015) qu’à partir de février 2023. En d’autres termes, cette dernière norme est encore valable jusqu’à cette date (18 mois après publication de celle qui la remplace). Quant à la norme EN 13624, dont une version plus récente a été publiée en novembre 2021, la version 2013 reste valable même après mai 2023 (18 mois après publication de la nouvelle version de la même norme), car aucune modification technique n’a été apportée à la méthodologie de la norme.
Exigences relatives aux systèmes de décontamination automatique
Les conditions minimales d’essai pour les procédés automatiques de désinfection des surfaces par pulvérisation sont définies dans la norme EN 17272 (2020) . Cette norme remplace la norme française NFT 72-281 depuis octobre 2021. Pour le domaine médical, les micro-organismes suivants doivent être testés :
• Bactéries (min. 5 réductions log.) : Staphylococcus aureus, Enterococcus hirae, Escherichia coli et Acinetobacter baumanii
• Levures et moisissures (min. 4 réductions log.) : Candida albicans et Aspergillus brasiliensis
• Mycobactéries (min. 4 réductions log.) : Mycobacterium terrae et avium
• Virus (min. 4 réductions log.) : Norovirus murin et adénovirus
• Spores de bactéries (min. 4 réductions log.) : Bacillus subtilis
En résumé, le système de pulvérisation de l’ingrédient actif (par exemple, le peroxyde d’hydrogène, l’acide peracétique) est placé dans une chambre d’essai fermée dans des conditions d’essai spécifiques (selon un volume défini à une distance et un emplacement spécifiés [par exemple, pour une chambre de 65 m3, les supports sont placés à 3,6 m du système], les substances interférentes dans des conditions propres [0,3 g/l d’albumine bovine + 1/20 de lait pour les micro-organismes sensibles à la dessiccation], la température [20 ± 1 °C], l’humidité relative [50-70 %]). Le processus est lancé à distance (il n’y a personne dans la pièce) et il désinfecte les surfaces, et non l’air, dans la pièce. La méthode se compose de deux parties principales à réaliser pour chaque système : tout d’abord, le test d’efficacité au cours duquel 3 supports en acier inoxydable (inoculés avec une suspension des micro-organismes et substances interférentes susmentionnés) sont déplacés verticalement à 1 à 1,5 m au-dessus du système dans la pièce. Au terme du processus, les supports sont neutralisés et traités pour exprimer l’efficacité obtenue en réduction logarithmique. La deuxième partie est un test de distribution appliquant la même méthodologie que le test d’efficacité, dans le but d’évaluer l’efficacité du système dans toute la pièce. Pour cette raison, huit supports au total sont placés aux quatre coins de la pièce à des hauteurs et des distances spécifiées par rapport au mur/plancher/plafond. Ce test est effectué avec un seul organisme, à savoir Staphylococcus aureus, et le procédé automatique doit également réussir ce test pour prétendre à la conformité avec la norme EN 17272.
Pour les procédés automatiques de désinfection des surfaces par ultraviolets C (UVC), il n’existe pas à ce jour de norme européenne standardisée. Il est donc difficile de comparer entre eux les appareils UVC existants sur le marché européen. Aux États-Unis, il existe une norme spécifique pour tester les appareils UVC, à savoir la norme ASTM E3135 (2018) . Toutefois, cette norme ne concerne que la préparation des supports. Aucune méthode normalisée n’est décrite pour tester l’appareil. Par conséquent, cette norme ne convient pas pour comparer les appareils UVC entre eux. La norme britannique, BS 8628 (2022) , publiée fin mars 2022, convient mieux pour tester et comparer les appareils UVC.
Cette nouvelle norme se base sur la norme existante EN 17272 (2020) avec quelques différences mineures spécifiques aux appareils UVC. En bref, l’appareil UVC est placé à une certaine distance et à un certain endroit dans une chambre d’essai fermée et plongée dans l’obscurité, puis allumé pendant un certain temps de contact. La principale différence réside dans le fait que la méthode ne comporte qu’une seule phase principale, à savoir le test d’efficacité. Le test de distribution n’est pas effectué, car les appareils UVC ne sont pas censés désinfecter l’ensemble de la pièce, mais plutôt les surfaces à haut risque et très fréquemment touchées. Là encore, 3 supports en acier inoxydable (inoculés avec une suspension des micro-organismes et substances interférentes susmentionnés) sont placés dans la pièce à une distance déterminée de l’appareil. Cependant, ceux-ci sont positionnés horizontalement sur une surface plate et noire, à une certaine hauteur, l’inoculum orienté vers le haut. La température ambiante doit être de 20 ± 1 °C et l’humidité relative de 30-60 %. Le temps de contact total de décontamination par UVC est enregistré depuis l’allumage des lampes UVC jusqu’à leur extinction. Outre cette application des UVC, il existe également des systèmes fermés conçus pour désinfecter les DM ou des appareils plus petits souvent touchés par les mains (smartphones, tablettes, etc.). Ils consistent à placer, enfermer et désinfecter un Dispositif Médical ou un appareil dans une armoire équipée de lampes UVC tout autour. La norme BS 8628 (2022) ne peut pas être invoquée pour le test de ces appareils UVC. Il n’existe pas à ce jour de norme spécifique pour tester et comparer ces appareils UVC.
Conclusion
L’efficacité d’un désinfectant ou d’un système de désinfection dépend de plusieurs facteurs humains et techniques. Lorsqu’il s’agit de choisir entre différents désinfectants ou systèmes de désinfection, une bonne préparation est cruciale. La connaissance de l’épidémiologie de l’établissement de santé et des surfaces critiques/Dispositifs Médicaux à haut risque pour chaque département/service de soins de santé est primordiale. Par conséquent, la réalisation d’analyses de risques est indispensable, également pour connaître la manière de travailler ou le déroulement des différentes procédures au sein de l’établissement de santé. En tant qu’expert en prévention des infections, il est nécessaire de solliciter la contribution des prestataires de soins de santé, du personnel de nettoyage, du personnel technique… bref, de tous les professionnels qui entrent en contact avec l’environnement des soins de santé. Ce n’est qu’après concertation avec ces différentes personnes qu’il sera possible d’opérer un choix quant à la méthode de désinfection par domaine d’application la plus appropriée pour votre établissement de soins de santé. Comme indiqué dans la section sur la réglementation, il importe avant tout que les désinfectants ou systèmes de désinfection choisis soient correctement enregistrés conformément à la réglementation européenne. L’efficacité des désinfectants ou des systèmes de désinfection retenus peut alors être comparée. Pour ce faire, vous vous basez sur les normes européennes spécifiées par domaine d’application et par type de micro-organisme (en fonction du degré de décontamination souhaité ou de l’agent pathogène à éliminer en chambre d’isolement/situation épidémique) comme défini dans la norme EN 14885 (2022). Il est important de comparer entre eux les résultats des versions identiques et valides des normes de la phase 2 — étape 1 et étape 2 — des différents produits. Il est ainsi possible de comparer objectivement l’efficacité de différents produits, qui peuvent ensuite être testés dans la pratique. Les systèmes de désinfection automatique basés sur la pulvérisation peuvent être comparés sur base de la norme EN 17272 (2020). Cependant, pour les systèmes à UVC, il n’existe actuellement aucune méthode d’essai européenne normalisée. La norme BS 8628 (2022) semble néanmoins prometteuse pour comparer les appareils UVC conçus pour décontaminer les surfaces des locaux. Enfin, outre l’efficacité des désinfectants ou des systèmes de désinfection, il convient également d’évaluer les éléments de compatibilité des matériaux, de durabilité (biodégradabilité), de sécurité d’utilisation et de convivialité. Et surtout, après avoir intégré les désinfectants ou les systèmes de désinfection dans les procédures et protocoles existants au sein de l’établissement de santé, n’oubliez pas de prévoir le temps nécessaire à la formation des utilisateurs.
Références
1. Whitehead H. et al. An exploratory study into the factors that influence patients’ perceptions of cleanliness in an acute NHS trust hospital. Journal of Facilities Management (2007);5:275–89.
2. Peters A. et al. Impact of environmental hygiene interventions on healthcare-associated infections and patient colonization: a systematic review. Antimicrobial Resistance & Infection Control (2022) 11:38.
3. CDC. Guidelines for Environmental Infection Control in Health-Care Facilities. (2019)https://www.cdc.gov/infectioncontrol/pdf/guidelines/environmental-guidelines-P.pdf
4. Kramer A. et al. (2006). How long do nosocomial pathogens persist on inanimate surfaces ? A systematic review. BMC Infect Dis.;6:130
5. Kramer A. & Assadian O. (2014). Survival of microorganisms on inanimate surfaces. In: Borkow G, editor. Use of biocidal surfaces for reduction of healthcare acquired infections. Cham : Springer ; p. 7–26
6. Dancer SJ. Controlling hospital-acquired infection: focus on the role of the environment and new technologies for decontamination. Clin Microbiol Rev. 2014;27:665–90.
7. Mitchell BG, Dancer SJ, Anderson M, Dehn E. Risk of organism acquisition from prior room occupants: a systematic review and meta-analysis. J. Hosp Infect. 2015;91:211–7.
8. Vermeil T et al. Hand hygiene in hospitals: anatomy of a revolution. Journal of Hospital Infection (2019);101(4):383–92.
9. Schreiber PW, et al. The preventable proportion of healthcare-associated infections 2005–2016: systematic review and meta-analysis. Infection Control & Hospital Epidemiology (2018);39:1277–95
10. ECHA (2022). Orientation relative à la législation des biocides. Volume II Efficacy – Assessment and Evaluation (Parts B+C https://echa.europa.eu/documents/10162/2324906/bpr_guidance_assessment_evaluation_part_vol_ii_part_bc_en.pdf/2c42983a-ee0b-9e35-c596-b172fee61115?t=1644567032606
11. Union européenne (2016). Décision d’exécution (EU) 2016/904 de la Commission. https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32016D0904&from=FR
12. NBN EN 14885:2022 —Antiseptiques et désinfectants chimiques — Application des Normes européennes sur les antiseptiques et désinfectants chimiques. Comité Européen de Normalisation, Bruxelles.
13. NBN EN 17272:2020. Antiseptiques et désinfectants chimiques — Méthodes de désinfection des pièces par voie aérienne par des procédés automatisés — Détermination de l’activité bactéricide, fongicide, levuricide, sporicide, tuberculocide, mycobactéricide, virucide et phagocide, Comité Européen de Normalisation, Bruxelles.
14. ASTM E3135:2018. Standard Practice for Determining Antimicrobial Efficacy of Ultraviolet Germicidal Irradiation Against Microorganisms on Carriers with Simulated Soil. ASTM International, West Conshohocken.
15. BS 8628:2022. Disinfection using ultraviolet radiation. Methods for quantitative testing of automated ultraviolet disinfection activities by direct illumination. Determination of bactericidal, mycobactericidal, sporicidal, yeasticidal, fu.ngicidal, virucidal and phagocidal activities. British Standards Institution, London.