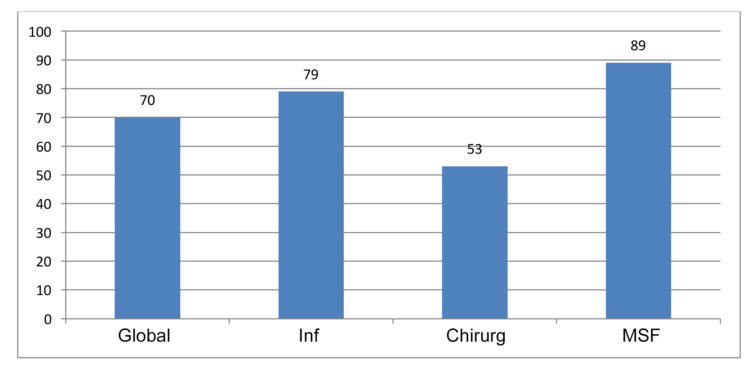
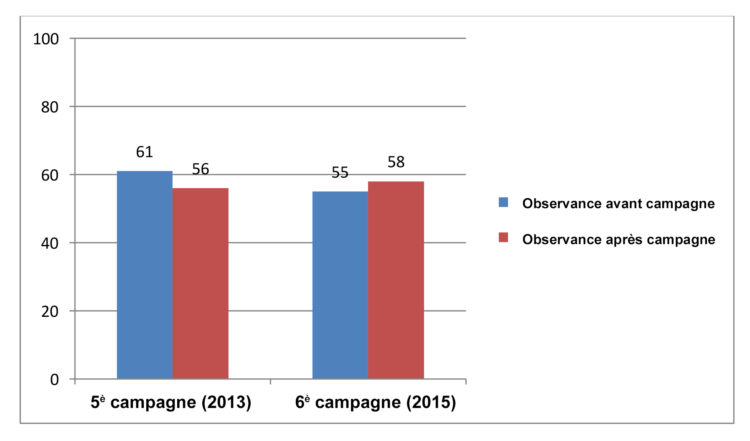
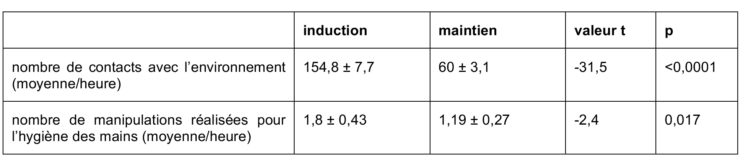
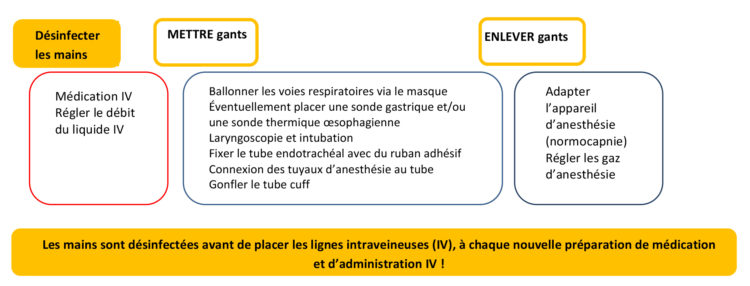
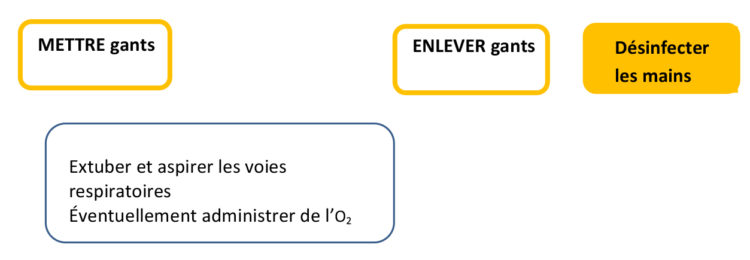
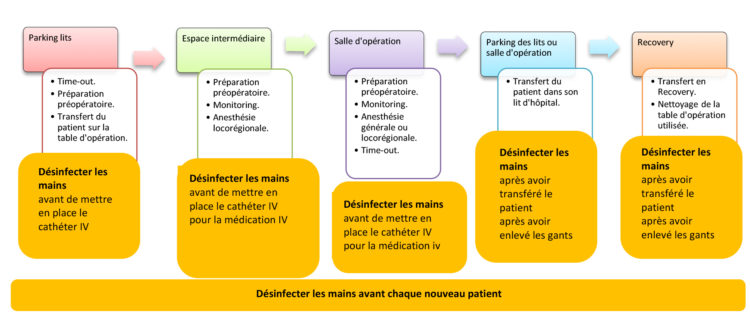
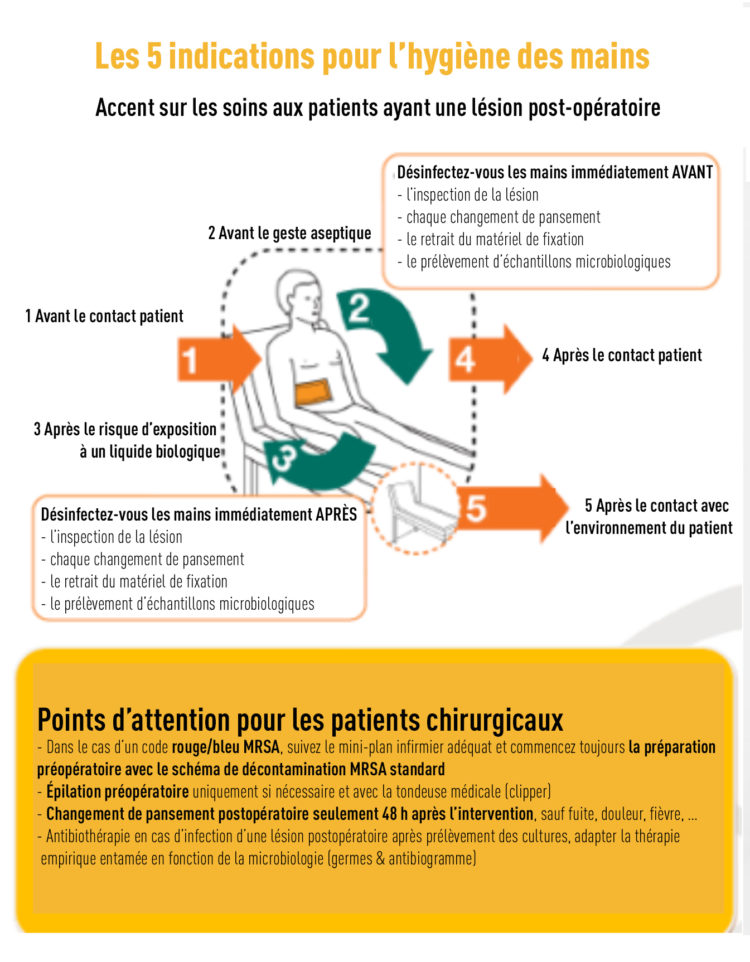
A. L. Traversari, C. Bottenheft, S. P. M. van Heumen, C. A. Goedhart, M. C. Vos
Effect of switcing off unidirectional downflow systems of operating theatres during prolonged inactivity on the period before the operating theatre can safely be used.
American Journal of Infection Control, 2017 vol 45 (2) pp139-144.
L’arrêt des systèmes de conditionnement d’air des blocs opératoires pendant des périodes d’inactivité prolongées (week-end, nuits) peut conduire à de substantielles économies d’énergie. Cependant, nous avons peu de renseignements sur les effets de l’arrêt des conditionnements d’air pendant des périodes d’inactivité prolongée sur la qualité de l’air des blocs opératoires pendant les périodes opérationnelles. Le but de l’étude est de déterminer le temps nécessaire après la remise en route du système de conditionnement d’air pour retrouver une situation stable avec une qualité d’air au moins aussi bonne que lors de l’arrêt du système de conditionnement. Les mesures sont effectuées dans 3 blocs opératoires, chacun équipé d’un système de flux unidirectionnel (UDF). Les mesures (comptage des particules émises présentant une taille ≥ 0,5µm) sont prises pendant la remise en route du système de ventilation pour déterminer quand les degrés de protection pré spécifiés sont atteints. Les températures sont prises pour déterminer quand une différence stable de température est atteinte entre la périphérie et la zone protégée, signifiant une situation stable.
Après la remise en route du système, la zone protégée atteint le degré de protection dans les 20 minutes (limite maximale de confiance 95 %). Une différence de température stable est atteinte dans les 23 minutes (limite maximale de confiance 95 %). Les deux données s’étendent bien dans la période de 25 minutes normalement requise pour la préparation avant le début de l’intervention.
Nous concluons que l’arrêt du système de ventilation pendant des périodes d’inactivité prolongée (la nuit et le week-end) n’a pas d’effet négatif sur la qualité de l’air des salles d’opération UDF pendant les heures d’utilisation.
T. Gormley, T. A. Markel, H. W. Jones III, J. Wagner, D. Greeley, J. H. Clarke, M. Abkowitz, J. Ostojic
Methodology for analysing environmental quality indicators in a dynamic operating room environment.
American Journal of Infection Control, 2017 Vol 45 (4) : 354-359.
Des quantités suffisantes et contrôlées d’air de qualité et un flux unidirectionnel sont des éléments importants pour fournir un environnement sûr pour les blocs opératoires. Pour réaliser des évaluations dynamiques de l’environnement du quartier opératoire, il est nécessaire de produire une méthode validée de test des multiples facteurs influençant la qualité de l’air. Ceci inclut les caractéristiques suivantes ; température, humidité, charge en particules, nombre des contaminants microbiens, pression, vitesse et distribution de l’air. L’équipe a développé les « indicateurs de qualité de l’environnement » (EQIs) pour décrire la qualité générale de l’air basés sur les mesures actuelles de ces caractéristiques relevées pendant des simulations opératoires. Ces indicateurs sont relevés dans 3 hôpitaux différents pendant des simulations d’interventions chirurgicales pour simuler les conditions actuelles en bloc opératoire. EQIs incluent des évaluations microbiennes sur la table d’opérations et sur la table d’instruments, un comptage en temps réel du nombre de particules en 9 endroits définis dans la salle d’opérations. La vitesse de l’air est mesurée à la surface des bouches de pulsion, au niveau du champ stérile, de la table d’instruments et à la grille de reprise.
Le protocole de test a fourni des mesures des indicateurs de qualité de l’air consistantes et comparables entre les institutions. A 20 renouvellements d’air /heure (ACH) et à une température de 66,3 °F (19° C) , la médiane des contaminants microbiens pour les 3 salles d’opérations est de 3-22 unités formant colonies (CFU)/m³ au niveau du champ stérile et de 5-27 CFU/m³ à la table d’instruments. A 20 ACH, le niveau médian de particules de 0,5 µm sur les 3 sites est de 85079, 85325 et 912232 particules/m³ avec une augmentation prévisible en charge particulaire dans l’air filtré par filtre non haute efficience du site de la salle d’opérations. En utilisant une comparaison avec les chambres propres standard, le comptage microbien et particulaire dans les 3 salles d’opérations pendant les simulations est équivalent aux classes 7 et 8 de International Organization for Standardization. Nous concluons que le protocole EQI est mesurable et constant et, de ce fait, peur être sûrement utilisé pour évaluer la qualité de l’air dans un environnement de soins pour donner une guidance aux pratiques opérationnelles et aux exigences réglementaires.
S. Boudjema, C. Tarentini, P. Peretti-Watel, P. Brouqui
Merging video coaching and an anthropologic approach to understand health care provider behavior toward hand hygiene protocols.
American Journal of Infection Control, 2017 Vol 45 (5) : 487-491.
Nous avons utilisé des vidéos de soins de routine pour analyser la déviance des soignants par rapport aux protocoles et avons organisé des interviews de suivi conduits par un anthropologue et une infirmière. Après avoir donné leur consentement, des soignants sont filmés pendant des soins de routine par un système vidéo commandé à distance. Chaque participant est invité à regarder ses comportements enregistrés sur 2 vidéos différentes montrant des pratiques de routine et sa déviance par rapport au protocole et à faire ses commentaires. Après cette étape, une interview plus poussée basée sur les recommandations pré établies est organisée et une discussion engagée sur les explications des déviances constatées. Ce procédé est réalisé dans le but de révéler la subjectivité du soignant ; c’est-à-dire comment ils perçoivent les opportunités à l’hygiène des mains dans leur routine quotidienne, quelles sont les difficultés qu’ils rencontrent et comment ils essaient de les résoudre.
Nous avons sélectionné 43 de 250 prises vidéos créées pendant l’étude ce qui nous a permis d’étudier 15 des 20 soignants. 20 des 43 vidéos montrent une ou plusieurs brèches dans le protocole d’hygiène des mains. Les brèches sont souvent liées à l’utilisation abusive de gants. La déviance au protocole est expliquée par les soignants comme le résultat d’une adaptation du comportement, c’est-à-dire faire face à des contraintes de travail qui ne prennent pas en compte les protocoles de contrôle de l’infection. Les pratiques professionnelles et les protocoles devraient être revus pour aboutir à des messages simples qui sont adaptés aux nécessités dans un environnement clinique réel.
R. E. Taylor
The role of message strategy in improving hand hygiene compliance
American Journal of Infection Control, 2015 Vol 43 (11) : 1166-1170.
Malgré l’augmentation de l’attention à l’hygiène des mains dans la décennie passée, les taux de compliance restent relativement bas. Bien qu’il y ait eu des avancées dans la science de l’hygiène des mains, peu d’attention a été mise dans les messages pour la promouvoir. Un total de 86 soignants membres de l’Association Professionnelle du Contrôle de l’Infection et d’Epidémiologie (ICPs) ont participé à une évaluation online de 6 messages stratégiques. Les participants ont évalué les stratégies en facilité de compréhension, croyance et si les stratégies de messages sont susceptibles d’augmenter l’hygiène des mains. Sur les 6 stratégie, personnelle, sociale, sensorielle, routine, nécessité aiguë et rationnel, la stratégie sociale est considérée comme la plus à même de conduire à l’action. La stratégie sensorielle n’est pas considérée comme la moins pertinente mais même contre productive.
Les ICPs devraient ajouter une stratégie de message social aux programmes de communication promouvant l’hygiène des mains. Bien que des études futures soient nécessaires, les stratégies personnelle, routine et nécessité aiguë montrent une promesse d’entrer à petits pas dans les motivations qui peuvent augmenter la compliance.
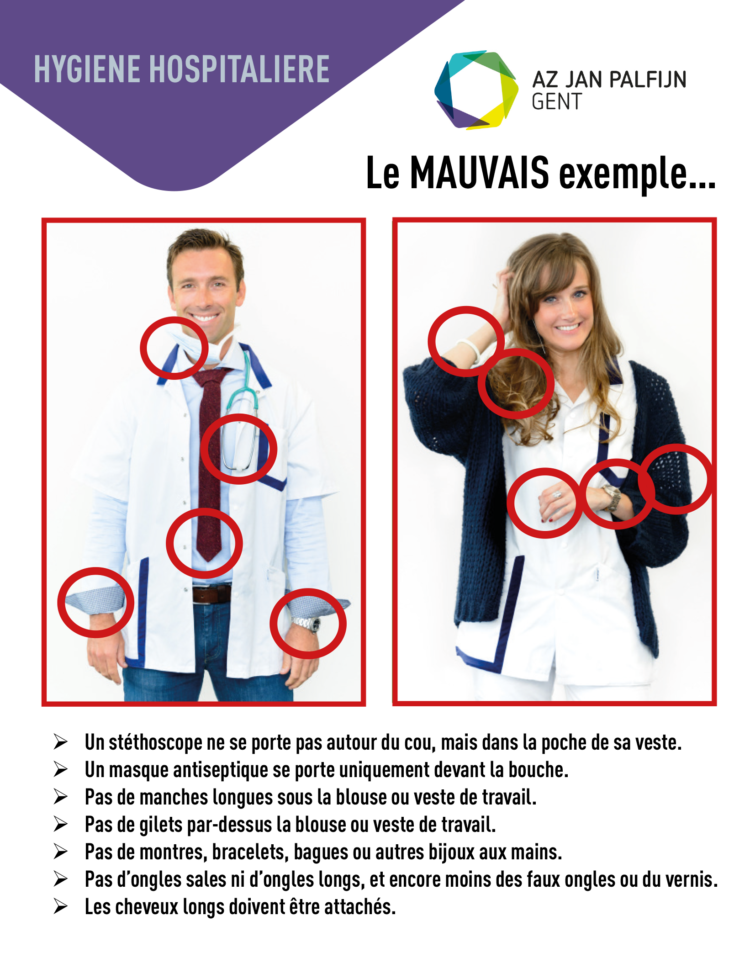
Réaliser une hygiène des mains correcte et une désinfection chirurgicale des mains sont essentiels pour réduire le taux des infections associées aux soins, y compris les infections de la plaie opératoire. Les « Recommandations pour l’hygiène des mains » de l’AORN mises à jour donnent un guide pour l’hygiène des mains et le désinfection chirurgicale des mains, le port de bijoux, les produits d d’entretien des ongles et les ongles artificiels, les soins de la peau adéquats pour éviter les dermatites, le choix des produits d’hygiène des mains et des considérations portant sur l’assurance de qualité ainsi que l’amélioration de la performance. L’article se concentre sur les points principaux des recommandations pour aider les personnel intervenant en péri opératoire à prendre des décision conscientes concernant l’hygiène des mains et la désinfection chirurgicale des mains. Les points cruciaux nécessitent de maintenir les ongles et la peau en parfaite santé, de ne pas porter de bijoux sur les mains ou les poignets dans l’environnement péri opératoire, de réaliser unes hygiène des mains et une désinfection chirurgicale des mains correctes et de faire participer les visiteurs et les patients aux initiatives visant l’hygiène des mains. Les infirmières en environnement péri opératoire devraient revoir complètement les recommandations pour parfaire l’information et la guidance au moment de mettre à jour et de rédiger les politiques et les procédures.
D. J. Gould ; S. Creedon : A. Jeanes ; N. S . Drey ; J. Chudleigh ; D. Moralejo
Impact of observing hand hygiene in practice and research : a methodological reconsideration.
Journal of Hospital Infection,2017 Vol 95 (2) : 169-174.
L’objectif de l’hygiène des mains est de rompre la chaîne de l’infection associée aux soins. Dans beaucoup de pays, l’hygiène des mains est auditée régulièrement comme partie de l’assurance qualité basée sur les recommandations de l’OMS . L’observation directe est la méthode d’audit recommandée mais présente aussi des inconvénients, y compris, pour les personnes observées de modifier leur comportement habituel. L’effet Hawthorne lié à l(hygiène des mains est analogue à l’augmentation de la productivité par augmentation de la fréquence avec laquelle l’hygiène des mains est réalisée. Une observation non intrusive et/ou une observation fréquente pour habituer le personnel à la présence des observateurs est considéré comme une façon acceptable de réduire l’effet Hawthorne mais quelques publications ont interrogé la façon d’implémenter ces techniques ou d’examiner leur efficience. Il est évident qu’être conscient d’être surveillé peut modifier le comportement habituel des individus dans des directions complexes et non prévisibles autres que simplement un effet de productivité. Sous la présence d’auditeurs, le personnel peut différer ou éviter des activités qui requièrent l’hygiène des mains mais ces attitudes ne sont pas visées dans les recommandations pour les études de la pratique ou de recherche. Cet oubli a des implications pour la validité des résultats des audits de l’hygiène des mains. La mesure de l’utilisation des produits d’hygiène compense ces tactiques d’évitement. Il est moins coûteux et cela génère des données continues d’évaluer la compliance de tous les cliniciens sans perturber les soins au patient. Les inconvénients sont le risque de surestimation dû au gaspillage, à l’élimination ou à l’utilisation par les visiteurs et du personnel non soignant qui fréquente les environnements de soins. Les matériels électroniques peuvent compenser les effets Hawthorne et d’évitement mais sont coûteux et peu utilisés hors des études de recherche.
G. Kampf ; A. Kramer ; M. Suchomel
Lack of sustained efficacy for alcohol-based surgical hand rubs containing ‘residual active ingredients’ according to EN 12791.
Journal of Hospital Infection, 2017 Vol 95 (2) : 163-168.
‘OMS recommande l’utilisation de produits pour les mains présentant une ‘activité prolongée’ pour la préparation chirurgicale des mains. Cette étude a pour but de vérifier si une des formulations pour les mains en base alcoolique contenant des ‘composants actifs’ non volatiles comme le digluconate de chlorhexidine (CHG), le mecethronium ethylsulfate (MES) ou l’orthophénylphénol (OPP) présentent une telle activité prolongée pour la désinfection chirurgicale des mains. Nous avons recherché dans la littérature pour trouver des études respectant la norme EN 12791. Les données publiées sont analysées pour vérifier si une des formulations a une efficacité supérieure à (P < ; 0,01) après 3 heures en comparaison à la procédure de référence. Les formulations avec 0,5 et 1 % de CHG en isopropanol ou 61 % d’éthanol ne sont pas supérieures après 3 heures. Les formulations avec 0,2 % MES dans 45 % d’isopropanol et 30 % de n-propanol ne sont aussi pas supérieures lorsqu’elles sont appliquées pendant une minute (une étude), la recommandation d’utilisation est de 1min30 (14 études) et 2 minutes (1 étude). Lorsqu’elles sont appliquées pendant 3 minutes, les formulations sont supérieures dans 3 des 7 études. Le produit pour les mains avec 0,1 % OPP dans 78,2 % éthanol n’est pas non plus supérieur au traitement de référence lorsqu’il est appliqué, comme recommandé, pendant 1,5 minute. Il apparaît raisonnable et responsable de limiter l’exposition dermique et environnementale aux agents biocides avec un avantage clair comme pour les alcools. Par analogie pour éviter les teintures et les fragrances dans les produits pour les mains, les formulations contenant des substances ‘actives’ sans bénéfice clair mais avec des risques potentiels devraient être évités lorsqu’il existe des formulations présentant un même niveau d’activité antimicrobien, de tolérance dermique et d’acceptation pour l’utilisateur.
A. F. Widmer
Surgical hand hygiene: scrub or rub?
Journal of Hospital Infection, 83 (Supplement 1) : S35-S39, février 2013.
La désinfection chirurgicale des mains est un soin standard avant toute procédure chirurgicale. Des perforations péri opératoires des gants sont observées dans presque 30 % des interventions et sont un facteur de risque d’infection post opératoire. Dans le passé, la norme était le lavage des mains à l’eau et avec un savon antibactérien (lavage chirurgical), le plus souvent avec de la chlorhexidine ou de l’iode. Plus récemment, un produit pour les mains en base alcoolique a été introduit avec succès, démontrant une efficacité supérieure, une moindre irritation des mains et requérant moins de temps que le lavage chirurgical des mains. Tous les produits devraient présenter un effet rémanent qui retarde la croissance microbienne sur la main gantée. Certains des produits en base alcoolique sont efficaces (comme déterminé par la norme européenne EN 12791) endéans les 90 secondes alors que d’autres nécessitent 3 à 5 minutes, comme le lavage chirurgical. La procédure courte se fonde fortement sur une technique exacte et un temps déterminé tels que diminuer le temps d’exposition sous les 90 secondes entraîne une efficacité significativement plus faible de l’effet bactéricide. Aujourd’hui, la désinfection chirurgicale des mains devrait rencontrer le prescrit de la norme EN12791 en Europe, ou d’autres standards comme la monographie de la dernière tentative de la Food and Drugs Administration aux USA. L’acte est mieux réalisé en utilisant un produit en base alcoolique mais un lavage en utilisant un savon contenant de la chlorhexidine rencontre aussi ces standards.
A. Tammelin, A.-M. Blomfeldt
Comparison of two sigle-use scrubs suits in terms of effect on air-borne bacteria in the operating room.
Journal of Hospital Infection, 2017 Vol 95 (3) : 324-326.
Un bas niveau de bactéries aéroportées dans le bloc opératoire peut être atteint si toute l’équipe porte des vêtements faits de matériau peu perméable (vêtements air propre). L’étude cherche s’il y a une différence d’efficacité de protection entre 2 brosses à usage unique réalisée en polypropylène en les testant pendant des interventions orthopédiques réalisées en routine. Nous n’avons pas décelé de différence significative entre les 2 brossages pour le comptage d’unités formant colonies/m³ ; le choix peut donc se baser sur le type de brosse le plus confortable pour l’équipe.
Jeffrey D. Ho ; R. K. Ansari ; D. Page.
Hand sanitizers rates in an urban emergency medical service system.
The Journal of Emergency Medicine, 2014 Vol 47 (2) : 163-168.
La désinfection des mains, quoique souvent pratique « oubliée », est démontrée comme un facteur majeur dans la prévention de la transmission des maladies infectieuses dans l’environnement des soins de santé. Des études précédentes ont cherché le taux de désinfection des mains dans les services hospitaliers, mais nous sommes conscients du peu d’études décrivant cela dans les services préhospitaliers. Etant donné que le personnel des services d’urgence médicale (EMS) sont des vecteurs potentiels de la dissémination des maladies infectieuses, il est important de savoir si leur pratique de désinfection des mains est suffisante. L’objectif de cette étude est de décrire le taux de désinfection des mains pour un échantillon acceptable d’un système EMS urbain. Un échantillon convenu de paramédicaux employés par un service d’ambulance urbain (plus de 55000 sorties/an) ont subi une observation prospective en aveugle pendant 6 mois. Les observations sont réalisées par des étudiants paramédicaux sur des périodes de travail de 8 et 12 heures. Les informations recueillies comprennent les modalités de nettoyage des mains (ex : eau et savon, gel ou mousse germicide, lingette germicide) survenant immédiatement après tout contact patient ou repas. L’utilisation de gants pendant le contact patient est aussi recueilli. Le trajet vers la salle de repos n’est pas directement observé et l’hygiène des mains après cette activité est présumée. La durée de l’hygiène des mains n’est pas rapportée. Les données recueillies sont analysées par des statistiques simples et descriptives.
53 paramédicaux (sur 108 employés paramédicaux) sont observés pendant 258 contacts patient. Les paramédicaux sont observés pour l’hygiène des mains après 162 contacts (62,8 %). Si l’hygiène des mains est réalisée dans les 16 premiers trajets vers la salle de repos après contact patient, la compliance augmente jusqu’à 68,9 %. L’hygiène des mains avant contact patient n’est réalisée que 3 fois (1,1 %)et 9 fois pendant le contact patient (3,5 %).Les gants ne sont pas portés pendant 32 des contacts patient (12,4 %). L’hygiène des mains est réalisée avant 8 des 42 repas (19 %)et après 25 des 42 repas (59,5 %).
Les opportunités à l’hygiène des mains sont notées dans cet échantillon convenu la majorité du temps en même temps que le contact patient. Cependant ; il semble qu’il y ait un espace substantiel d’amélioration. Ceci suggère que les services EMS devraient travailler à l’amélioration de la compliance à l’hygiène des mains. Une instruction et une éducation accrues ou un accès à l’équipement d’hygiène devraient être étudiés comme des avenues pour augmenter la compliance dans le futur.
E. Vanyoloss, K. Peto, A. Viszlai, I. Miko, I. Furka, N. Nemeth, P. Orosi
Usage of ultraviolet test method for monitoring the efficacy of surgical hand rub technique among medical students.
Journal of Surgical Education, Vol 72 (3), 2015 : 530-535, 2015, mai-juin 2015.
Des mouvements adéquats des mains sont essentiels dans la désinfection chirurgicale des mains, il est donc important que les étudiants en médecine les apprennent correctement. Pour évaluer l’efficacité, nous avons utilisé le test à lumière ultra-violette (UV) après application d’une solution fluorescente. Nous avons analysé les images digitales des mains de 253 étudiants réalisée lors de la formation « Technique Chirurgicales de Base » des 10ème (période 1) et 14ème (période2) semaine de formation pour tester le processus et le développement des outils. La dernière étape de la formation à la désinfection chirurgicale des mains est réalisée avec une solution fluorescente, puis les mains sont placées sous le lumière UV. Des photos sont réalisées et analysées. Toute surface non couverte est considérée comme une erreur. Le nombre et la localisation endroits oubliés et leur surface sont déterminés. Pour l’évaluation, les côtés palmaires (P) et dorsal (D) des mains sont divisés en région d’intérêt (1-phalange distale, 2-pouce et premier métacarpe, 3-deuxième au cinquième doigt, 4-deuxième au cinquième métacarpien).
Des erreurs variées en nombre et étendue sont survenues chez 123 (48,61 %) étudiants pendant la période 1 et chez 65 (25,69 %) en période 2. Les sites les plus fréquemment oubliées sont les régions D2 et P4 lors de la période 1 et D1 et P4 pour la période 2. Il y a eu une amélioration lors de la période 2 comme montré par la diminution des surfaces oubliées et de leur étendue. Les étudiants droitiers font moins d’erreurs sur leur main non dominante que les étudiants gauchers (n=23). La méthode est intéressante pour évaluer l’efficacité de la technique de désinfection chirurgicale des mains et pour identifier les erreurs et les sites critiques. L’avantage le plus important du test UV est le feed-back immédiat qui a conduit à une amélioration.
L’utilisation du test UV pour l’éducation et l’entraînement des étudiants en médecine peut contribuer à augmenter la compliance et l’efficacité de la technique de désinfection chirurgicale des mains parmi les étudiants.
AORN – Abstract
Réaliser une hygiène des mains correcte et une désinfection chirurgicale des mains sont essentiels pour réduire le taux des infections associées aux soins, y compris les infections de la plaie opératoire. Les « Recommandations pour l’hygiène des mains » de l’AORN mises à jour donnent un guide pour l’hygiène des mains et le désinfection chirurgicale des mains, le port de bijoux, les produits d d’entretien des ongles et les ongles artificiels, les soins de la peau adéquats pour éviter les dermatites, le choix des produits d’hygiène des mains et des considérations portant sur l’assurance de qualité ainsi que l’amélioration de la performance. L’article se concentre sur les points principaux des recommandations pour aider les personnel intervenant en péri opératoire à prendre des décision conscientes concernant l’hygiène des mains et la désinfection chirurgicale des mains. Les points cruciaux nécessitent de maintenir les ongles et la peau en parfaite santé, de ne pas porter de bijoux sur les mains ou les poignets dans l’environnement péri opératoire, de réaliser unes hygiène des mains et une désinfection chirurgicale des mains correctes et de faire participer les visiteurs et les patients aux initiatives visant l’hygiène des mains. Les infirmières en environnement péri opératoire devraient revoir complètement les recommandations pour parfaire l’information et la guidance au moment de mettre à jour et de rédiger les politiques et les procédures.