Durant la pandémie de SARS-CoV-2, la pratique de regroupement des soins en cohorte a été appliquée à large échelle et pendant une période prolongée 1-3. Même si le regroupement en cohorte est traditionnellement évoqué dans les publications dédiées à la gestion d’épidémies 4-7, une opérationnalisation claire de ce concept fait défaut. Selon le nombre de patients infectés concernés, tout un département ou seule une partie de celui-ci devient un département en cohorte. C’est dans ce dernier cas de figure que des discussions avec la direction ont parfois eu lieu par le passé. Un point fréquemment abordé concernait notamment la mesure prévoyant l’affectation d’un personnel distinct « jour et nuit » dans le service pour les soins des patients contaminés et pour ceux des patients non contaminés. Un double effectif induit un surcoût considérable pour l’institution. Ainsi, il a été estimé dans un hôpital belge, qu’une épidémie d’une durée de dix mois causée par une souche d’Acinetobacter baumannii, multirésistante, productrice de carbapénemase de type OXA-24, avait entraîné un coût mensuel supplémentaire de 10 000 euros, dont 59 % étaient liés aux coûts de main-d’œuvre supplémentaires pour le personnel 8.
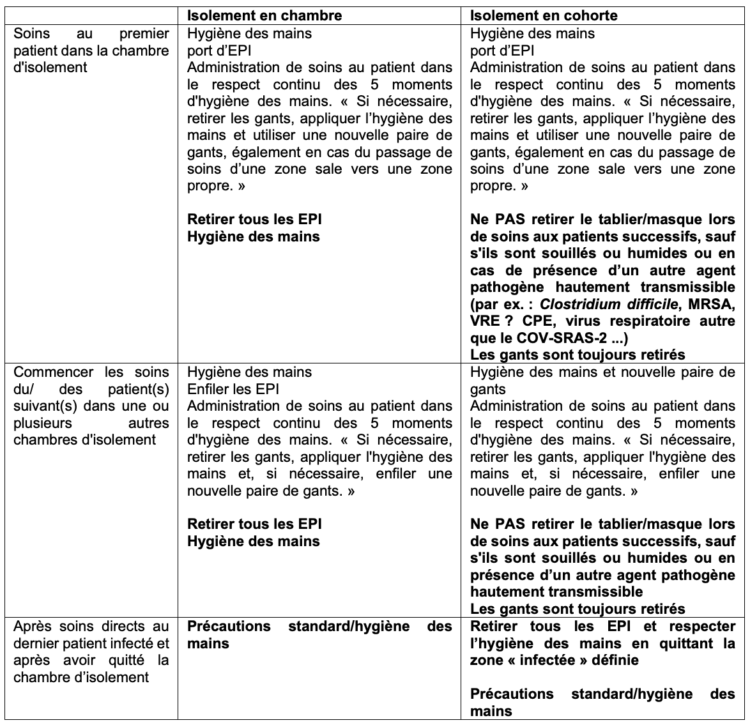
Les principes d’hygiène d’application en temps normal en cas d’isolement en chambre sont en partie ignorés en cas de regroupement en cohorte. Dans ce contexte, il est admis que plusieurs patients infectés par le même microorganisme puissent être soignés avec les mêmes tenues de protection à condition que les précautions générales soient observées. En d’autres termes, dans le cas de soins concomitants, les prestataires de soins peuvent passer d’une chambre d’isolement à l’autre en portant les mêmes équipements de protection individuelle (EPI) pour autant qu’il n’y ait pas d’autres agents pathogènes hautement transmissibles (tels par exemple Clostridium difficile, SARM, VRE, CPE…). Parfois, en cas de regroupement en cohorte, des zones contaminées sont définies, incluant non seulement les chambres des patients infectés et le linge sale, mais aussi les zones communes telles que le poste de soins infirmiers, le local du médecin, … Ce choix suppose un travail continu avec des EPI (potentiellement) contaminés, un principe que nous ne défendons certainement pas. Il est recommandé d’introduire dans un service en cohorte un principe de division par zone avec des recommandations précises en matière d’hygiène et le port des tenues de travail 9. Force est cependant de constater que les points d’attention relatifs à l’hygiène des mains sont souvent formulés de manière fort vague, laissant ainsi place à une interprétation individuelle. Un tel flou peut entraîner des situations de travail dangereuses, avec un risque accru d’épidémie de MDRO ou une hausse du nombre d‘épisodes de CLABSI11,12.
Le tableau 1 illustre la distinction entre l’isolement classique en chambre et le regroupement en cohorte.
Nous pensons que l’isolement en chambre classique pourrait augmenter les risques de non-respect des 5 règles d’hygiène lors des soins prescrites par l’OMS. En plus de l’autoprotection, le collaborateur doit toujours se concentrer sur la sécurité des patients en fonction de la prévention des infections nosocomiales. Il n’est pas aisé de changer fréquemment de gants et d’appliquer l’hygiène des mains auprès d’un même patient lors d’un même moment de soins. En outre, pendant le regroupement en cohorte, il y a un risque que le changement de gants et l’application de l’hygiène des mains ne soient pas suffisamment pris en compte entre différents patients. Surtout pendant la première vague de COVID-19, la crainte du virus inconnu du SRAS-CoV-2 a provoqué l’introduction du port de la double paire de gants dans certains établissements. La paire extérieure de gants est retirée en quittant une chambre d’isolement ou en passant d’un patient à l’autre dans une même chambre d’isolement pour l’administration des soins. La première paire de gants, considérée comme une seconde peau, est désinfectée avec une solution hydroalcoolique pour les mains. Une nouvelle paire de gants est ensuite enfilée par-dessus pour administrer des soins à un autre patient COVID-19. Une telle façon de travailler ne permet pas l’application correcte de l’hygiène des mains et est en désaccord avec les 5 règles d’hygiène des mains lors des soins préconisées par l’OMS.
Moore et coll. (2021) dressent un bilan de l’impact de la pandémie de COVID-19 sur l’observance à l’hygiène des mains dans neuf hôpitaux au cours de la première vague aux États-Unis 13. Une augmentation initiale des taux d’observance de 45 % à 62 % a été suivie d’une baisse hebdomadaire régulière à 53 %. La disponibilité limitée de solutions hydroalcooliques, la substitution de l’hygiène des mains par le port de gants, l’observation moindre des règles par les équipes de soins très sollicitées lors de cette période sont évoquées comme autant de causes possibles de cette diminution d’observance. Lors de la 2e vague de COVID-19, une campagne préalable de l’observance à l’hygiène des mains avait été menée dans notre service Soins intensifs. Toutes les observations ont été effectuées par un infirmier hygiéniste formé lors de plusieurs périodes d’observation de 30 min. L’observance à l’hygiène des mains était globalement de 61 % (n=174), soit une nette diminution par rapport au résultat post-test mesuré en 2019 lors de la 8e campagne nationale d’hygiène des mains et qui était de 77 % (n=173). Il est possible que cette diminution d’observance ait pu résulter de la conjonction de l’effet de baisse classiquement constaté lors des mesures pré-campagne, ainsi que nombre exceptionnellement élevé de patients « COVID-19 » pris en charge en isolement en cohorte. Cette hypothèse pourra éventuellement être confirmée par l’analyse des données nationales disponibles qui ont été recueillies lors de la mesure pré-campagne facultative de la 9e campagne belge d’hygiène des mains. Bien que le port d’une double paire de gants ait été fortement découragé, cette pratique n’a pas pu être empêchée dans la zone COVID-19 du service des urgences. L’équipe mobile composée à la fois d’infirmiers du service des urgences et des soins intensifs a malheureusement également importé cette pratique aux soins intensifs. Suite à cette dérive, l’équipe opérationnelle d’hygiène hospitalière s’est efforcé de convaincre (avec un succès variable) les infirmiers des soins intensifs que cette pratique n’était pas la bonne. L’utilisation d’une double paire de gants en dehors du contexte de la chirurgie à haut risque découle essentiellement des recommandations de prévention de l’infection par le virus Ebola 14.15. Dans le cas de cette fièvre hémorragique virale hautement infectieuse et accompagnée d’un taux de mortalité élevé en l’absence de tout traitement efficace, le port d’une double paire de gants est justifié. Toutefois, dans le contexte de la COVID-19, cette pratique est fortement déconseillée 1 – 3,6. Les recommandations du CSS et de l’OMS sur l’hygiène des mains déconseillent également la désinfection des gants 17-18. Aucune justification sous-jacente n’est donnée. Il semble probable que l’utilisation d’une solution hydroalcoolique sans rinçage sur des gants ne garantisse pas un contact avec toutes les parties des gants en raison de l’absence de sensation. De plus, les solutions hydroalcooliques pourraient également nuire à l’intégrité des gants19.
Seules quelques études expérimentales sont disponibles concernant le rationnel de la désinfection des gants et l’utilisation d’une double paire de gants. Casanova et coll. (2012) ont étudié dans un contexte expérimental chez 18 participants l’effet du port d’une paire unique de gants en comparaison au port d’une double paire de gants sur le transfert du virus vers la peau et sur les vêtements des prestataires de soins lors de la phase de retrait des EPI 20. La contamination par gouttelettes a été simulée par l’application de 5 gouttes de 5 log10 de virus Escherichia MS2 (un bactériophage d’ARN à simple brin, connu pour infecter la bactérie Escherichia coli et d’autres bactéries appartenant à la famille des Enterobacteriaceae). sur la partie antérieure de la blouse de protection individuelle, au niveau de l’épaule, du côté avant droit du masque N95, des lunettes de protection ainsi qu’au niveau de la paume des gants de la main dominante. Un transfert nettement plus faible a été constaté sur les mains, mais pas sur la tenue chirurgicale des prestataires de soins qui portaient une double paire de gants. Les auteurs restaient prudents dans leur conclusions estimant que le bénéfice éventuelle de l’utilisation d’une double paire de gants devait être confirmé par d’autres études contrôlées à plus large échelle. Scheithauer et coll. (2016) ont étudié l’efficacité bactéricide de la désinfection des gants conformément à la norme EN 1500, bien que cette norme ne soit pas prévue à cet effet 21. Plusieurs combinaisons de trois marques de gants avec cinq types de solutions hydroalcooliques sans rinçage ont été testées. L’absence de trous microscopiques a également été vérifiée conformément à la norme EN 455-1. Les gants en nitrile ont obtenu un meilleure score que les gants en latex, mais des différences ont été constatées en fonction du type de solution hydroalcoolique utilisée. Pour certaines combinaisons, les gants en nitrile n’ont pas réussi le test de fuite. Gao et coll. (2016) ont montré les effets néfastes des solutions hydroalcooliques sur la résistance à la traction des gants en latex et en nitrile 22. Un effet négatif a également été observé sur l’élasticité des gants en latex, mais pas sur les gants en nitrile. L’utilisation d’une double paire de gants entraînera dans tous les cas un temps de port plus long et favorisera l’apparition d’une dermatite irritante, un problème qui a été rapporté de manière nettement plus fréquente pendant la pandémie de COVID-19 23. Garrido-Molina et coll. (2021) ont étudié la compatibilité de divers désinfectants sur des gants en nitrile non poudrés 24. Les désinfectants contenant de l’alcool ont un effet négatif sur la résistance à la traction des gants en nitrile. Un gant moins résistant augmente le risque d’auto-contamination de l’utilisateur.
Le risque d’auto-contamination lors de l’enlèvement des EPI est déjà connu suite à des expériences antérieures rapportées pour le SRAS et pour le virus Ebola. Le retrait incorrect des EPI après des soins directs au patient a été identifié comme un facteur de risque majeur d’infection: 60 % des cas de SRAS signalés en 2004 concernaient des prestataires de soins 25. A noter que même après une formation adéquate, le risque d’auto-contamination était de 18,9 % 26.
Alhimidi et coll. (2019) ont étudié le risque d’auto-contamination lors du retrait des gants à l’aide d’une solution fluorescente 27.
Trente-sept soignants sur cent se sont contaminés lors du retrait des gants. Les doigts et les poignets sont les zones plus fréquemment contaminés. Le respect des recommandation du CDC 28 permettait de réduire de manière significative les contaminations28. Dans un test expérimental de contamination au cours duquel une solution fluorescente était appliquée seulement sur la paume des gants, l’auto-contamination s’est avérée moins fréquente grâce au suivi d’une version adaptée de la technique de retrait des gants recommandée par le CDC (le dernier gant est retiré en plaçant l’index et le majeur sous le bord du gant encore présent sur le côté de la main au lieu du côté de la paume).
Il est donc important de continuer à investir dans la formation et la sensibilisation du personnel de soin sur la nécessité du port et du retrait correct des EPI. Ceci s’applique tant aux situations d’isolement en chambre que dans le cadre d’isolements en cohorte, lors de problèmes endémiques mais aussi en cas d’épidémie ou de pandémie. Le retrait des gants contaminés après un soin constitue une manoeuvre à haut risque d’auto-contamination. Des études complémentaires sur l’hygiène des mains et le bon usage des gants sont nécessaires afin d’ évaluer la connaissance des facteurs de risque et aussi d’améliorer l’adhésion du personnel médical et paramédical aux bonnes pratiques 29. Hygiène correcte des mains et bonne utilisation des gants sont deux choses différentes qui sont encore hélas souvent mal appliquées par le personnel soignant lors des soins pendant un isolement en cohorte.
Références
1. Rational use of personal protective equipment for coronavirus disease (COVID-19) and considerations during severe shortage, WHO, interim guidance 6 april 2020.
2. Infection prevention and preparedness for COVID-19 in healthcare setting, ECDC, 6th update, 9 february 2021.
3. Interim infection prevention and control recommendations fort healthcare personnel during the Coronavirus Disease 2019 (COVID-19) pandemic, CDC, 23 febr 2021.
4. Rosenberger (L.) et al., Quarantine, Isolation and Cohorting: from cholera to Klebsiella, Surgical infections, 2012, 13:2, 69-73.
5. Landelle (C.) et al., Protracted outbreak of multidrug-resistant Acinetobacter baumannii after intercontinental transfer of colonized patients, Inf Control Hosp Epidemiol, 2013, 34, 2, 119-124.
6. Enfiel (K.B.) et al., Control of simultaneous outbreaks of carbapenemase-producing Enterobacteriaceae and extensively drug-resistant Acinetobacter baumannii infection in an Intensive Care Unit using interventions promoted in the CDC 2012 carbapenemase-resistant Enterobacteriacae toolkit, Inf Control Hosp Epidemiol, 2014, 34, 7, 810-817.
7. Recommandations en matière de prévention, maîtrise et prise en charge des patients porteurs de bactéries multi-résistantes aux antibiotiques (MDRO) dans les institutions de soins, Avis CSS n° 9277, avril 2019.
8. Demaiter (G.), Management van een OXA-24 Acinetobacter baumannii uitbraak: een ervaringsverslag, Dag van de Ziekenhuishygiëne, UZ Gent, 15 december 2014.
9. Demaiter (G.), Infectiepreventie en controle tijdens COVID-19: kroniek van het grote gelijk ? Noso-info; 2020, 24,2:9-13.
10. Patel (A..) et al., Rapid spread and control of multidrug-resistant gram negative bacteria in COVID-19 patient care units, Emerging Infectious Diseases, 2021, 27(4), 1234-1236.
11. McMullen 5K.M.) et al., Impact of SARS-CoV-2 on hospital acquired infection rates in teh United States: predictions and aerly results, AJIC, 2020, 48:1409-1411.
12. Fakih (MG.) et al., COVID-19 pandemic, CLABSI and CAUTI: the urgent need to refocus on hardwiring prevention efforts, , Inf Control Hosp Epidemiol, 2021, 1-6, https://doi.org/10.1017/ice.2021.70
13. Moore (L.D.) et al., The impact of COVID-19 pandemic on hand hygiene performance in hospitals, AJIC, 2021,49:30-33.
14. Recommandations pratiques concernant l’identification et la prise en charge de patients suspectés ou avérés être porteurs de virus hautement contagieux (de type Ebola ou Marburg) dans le cadre d’une bouffée épidémique en Afrique de l’Ouest, à l’attention des professionnels de la santé et des autorités sanitaires, Avis CSS n° 9188, juillet 2014.
15. Guidance on PPE to be used by healthcare workers during management of patients with confirmed Ebola or persons under investigation for Ebola who are clinically unstable or have bleeding, vomiting or diarrhea in U.S. Hospitals, including procedure for donning and doffing, CDC https://www.cdc.gov/vhf/ebola/healthcare-us/ppe/guidance.html#:~:text=Recommended%20PPE%20When%20Caring%20for,to%20at%20least%20mid%2Dcalf.&text=Single%2Duse%20(disposable)%20impermeable%20coverall.
16. COVID-19: guidance for maintaining services within healthcare setting: IPC recommendations, Public Health England, NHS, version 1.1., january 2021.
17. Recommandations en matière d’hygiène des mains durant les soins (révision 2018), Avis CSS n° 9344, avril 2018.
18. WHO guidelines on handhygiene in healthcare, january 2009.
19. Vandeputte (M.), Hygiëne in het ziekenhuis, Acco, Leuven, 2009, p.66.
20. Casanova (L.M.) et al., Effect of single-versus double gloving on virus transfer to healthcare workers’ skin and clothing during removal of personal protective equipment, AJIC, 2012,40:369-374.
21. Scheithauer (S.) et al., Disinfection of gloves: feasible, but pay attention to the disinfectant/glove combination, Journal of Hospital infection, 2016, 94:268-272.
22. Gao (P.) et al., Effect of multiple alcohol-based hand rub applications on the tensile properties of thirteen brands of medical exam nitrile and latex gloves, J Occup Environ Hyg, 2016:13:905-914.
23. Anedda (J.) et al., Changing gears: medical gloves in the era of coronavirus disease 2019 pandemic, Clin Dermatol. 2020, 38(6):734-736.
24. Garrido-Molina (J.M.) et al., Disinfection of gloved hands during the COVID-19 pandemic, Journal of Hospital Infection, 2021, 107, 5-11.
25. Chan-Yeung (M.), Severe acute respiratory syndrome (SARS) and healthcare workers, Int J Occup Environ Health, 2004;10, 421-7.
26. Tomas (M.E.) et al., Contamination of healthcare personnel during removal of protective equipment, JAMA Intern Med, 2015,175(12),1904-1910.
27. Alhimidi (H.) et al., Contamination of healthcare personal during removal of contaminated gloves, AJIC 2019 (47):850-852.
28. Sequence for putting on personal protective equipment (PPE), availabe from: https://www.cdc.gov/hai/pdfs/ppe/ppe-sequence.pdf
29. Chraïti (M.N.), Allegranzi (B.), Larson (E.), Glove use and handhygiene in Handhygiene: a handbook for medical professionals, ed. Pittet (D.), Boyce (J.M.), Allegranzi (B.), Wiley Blackwell, 2017.