INTRODUCTION
INTRODUCTION
Les infections liées aux soins ont un impact important sur la morbidité et la mortalité1. Une infection liée aux soins est définie comme étant une infection contractée durant un séjour à l’hôpital ou dans une maison de repos, ou suite à des soins infirmiers à domicile.
Une étude pilote belge menée en 1990 (N=858 patients de 6 instituts psychiatriques différents) a démontré que 12,1% des patients présentaient au moins une infection et que le nombre total d’infections atteignait 14,5% ; Les infections les plus courantes étaient des dermatites infectieuses, suivies par les infections des voies respiratoires inférieures et des voies urinaires. Ces résultats ont été confirmés par une étude encore plus vaste menée en 1991 (N=8679 patients de 29 instituts)1 Parmi ces patients, 13% présentaient une ou plusieurs infections et la prévalence d’infection était de 15,4%².
Tout comme dans l’étude-pilote, les dermatites infectieuses arrivaient en tête (31,6%), suivies par les infections des voies respiratoires inférieures (25,8%), puis des voies respiratoires supérieures (12,4%).
Une bonne hygiène des mains constitue un élément essentiel de la prévention des infections associées aux soins. Depuis 2004, une campagne nationale est menée en Belgique pour la promotion de l’hygiène des mains. A partir de la 2e campagne (novembre 2006), les hôpitaux psychiatriques ont également pu participer à cette campagne. Elle est répétée tous les 18 mois3.
Depuis 2001, les infections sont enregistrées tous les ans sous forme d’une enquête de prévalence ponctuelle. A l’origine, seuls les instituts psychiatriques auxquels un infirmier-hygiéniste hospitalier du groupe IDEWE est associé étaient invités à participer à l’étude.
Au fil des ans, d’autres instituts psychiatriques ont également participé.
L’étude avait pour objectif :
1) de connaitre la valeur et l’évolution de la prévalence globale,
2) de connaitre la valeur et l’évolution de la prévalence de patients infectés,
3) de connaitre la valeur et l’évolution de l’utilisation d’antibiotiques,
4) de connaitre la valeur et l’évolution de l’apparition d’escarres,
5) d’évaluer l’impact de la campagne nationale pour l’hygiène des mains (commencé à l’occasion du lancement de la 2e campagne nationale « vous êtes entre de bonnes mains »)
METHODE
L’étude était une étude de cohorte prospective et dynamique.
Entre mai 2001 et décembre 2014, les infections ont été enregistrées tous les ans dans plusieurs instituts psychiatriques belges. Tous les instituts psychiatriques affiliés à l’IDEWE et où l’IDEWE était responsable de l’hygiène hospitalière (n=14) ont été invités à participer à l’enregistrement. Plus tard, les instituts psychiatriques non affiliés à l’IDEWE ont également pu participer. Les services SPHG (service psychiatrique dans un hôpital général) n’ont pas été retenus pour l’étude.
Tous les patients hospitalisés durant la période d’enregistrement (période planifiée de 5 jours) ont pu participer à l’étude.
Variables
Un formulaire d’enregistrement anonyme a été développé et devait être rempli par un médecin ou infirmier formé à cet effet. Des caractéristiques démographiques (âge et genre) et l’apparition de différents types d’infection ont été notées.
Les critères d’infection étaient basés sur ceux des CDC (Centers for Disease Control and Prevention)4. Le critère des 48h minimum révolues à dater de l’admission n’a pas été retenu. Pour des raisons pratiques, notamment l’absence de confirmation microbiologique, il n’a pas non plus été possible d’appliquer les critères McGeer.5
Les types d’infection suivants ont été notés :
• Voies respiratoires supérieures
• Voies respiratoires inférieures
• Infections des voies urinaires
• Infections à MRSA (depuis 2005)
• Dermatites infectieuses
• « Autres » infections
Les porteurs de MRSA hépatite B et C, de virus du rhume et d’escarres ont également été enregistrés, mais ils n’ont pas été comptabilisés dans la prévalence totale. Enfin, l’utilisation d’antibiotique a également été enregistrée.
Méthode de travail
Les médecins et infirmiers ont reçu une formation pour remplir le formulaire d’enregistrement. Un résumé des critères d’infection des CDC était annexé au formulaire d’enregistrement. Si nécessaire, les observateurs pouvaient recourir à un helpdesk. Pour des raisons pratiques, il n’était pas toujours possible de recourir aux mêmes observateurs.
Tous les patients présents devaient être dépistés sur une période de 5 jours à la recherche d’infections, avec la condition supplémentaire que tous les patients d’un même service soient dépistés le même jour.
L’enregistrement était systématiquement effectué au mois de mai entre 2001 et 2004 et au mois de décembre à partir de 2005.
Tous les formulaires remplis étaient rassemblés par l’hygiéniste hospitalier pour être analysés.
Approbation de la commission éthique
Cette étude a été approuvée par la commission éthique de l’Ordre des Médecins sous le numéro 117.
Tableau 1 : Evolution de la démographie des patients observés Analyse statistique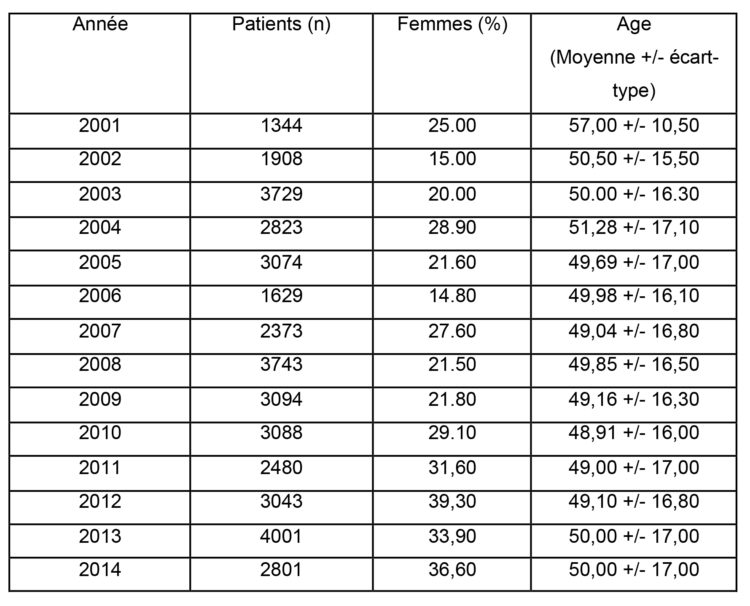 Des prévalences ponctuelles à 95% d’intervalle de confiance ont été calculées pour des infections et des patients. En outre, la différence entre la prévalence d’infection et le nombre de patients infectés a été calculée pendant la période qui a précédé le démarrage de la 2e campagne nationale pour l’hygiène hospitalière et la période qui l’a suivie, plus particulièrement la période avant et après novembre 2006.
Des prévalences ponctuelles à 95% d’intervalle de confiance ont été calculées pour des infections et des patients. En outre, la différence entre la prévalence d’infection et le nombre de patients infectés a été calculée pendant la période qui a précédé le démarrage de la 2e campagne nationale pour l’hygiène hospitalière et la période qui l’a suivie, plus particulièrement la période avant et après novembre 2006.
RESULTATS
Échantillon
Le nombre d’instituts qui ont participé à l’étude oscille entre 6 et 12, avec un nombre médian de 9 (Q1=7,25; Q3=10) par an. Au total, 39.138 patients ont participé à l’étude (range : 1.344-4.009)
Le nombre total de lit des instituts participants oscillait entre 50 et 620.
Prévalence d’infections, d’antibiothérapies et d’escarres
La prévalence moyenne d’infection et la prévalence de patients infectés était de 19,1% (étalement : 14-26,3%) et 16,2% (étalement : 14,0-26,3%). 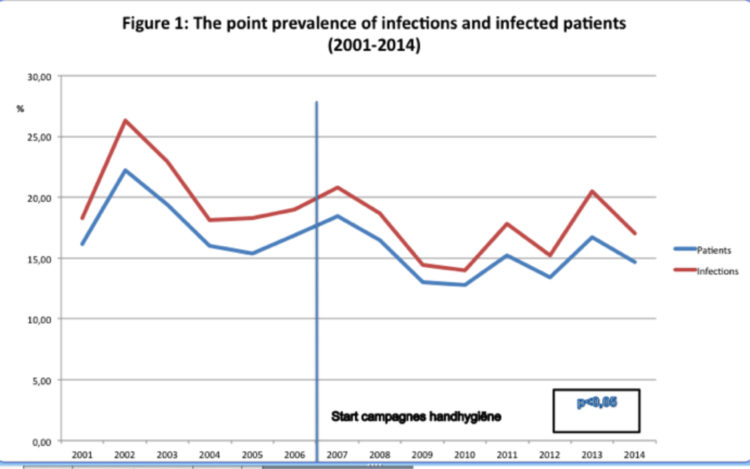
Les trois types d’infection les plus fréquents étaient :
1) dermatites infectées (prévalence moyenne : 6,9%; range : 3,7-11,4%), soit 37,3% de toutes les infections ;
2) infections des voies respiratoires inférieures (prévalence moyenne : 4,1% ; range : 2,6-5,9%), soit 22,2% de toutes les infections et
3) le groupe « autres infections », prévalence moyenne
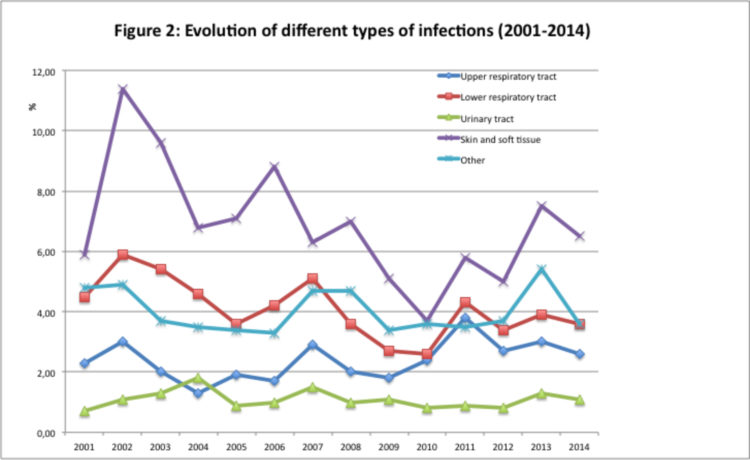
Les dermatites les plus fréquentes étaient les mycoses des pieds (prévalence : 2,1%), suivies par les verrues (prévalence : 0,8%) et les furoncles (prévalence : 0,5%).
La bronchite chronique était l’infection des voies respiratoires inférieures la plus fréquente (prévalence : 3,9%).
Les figures 3, 4 et 5 donnent respectivement un aperçu des différentes infections de la peau, des voies respiratoires inférieures et des infections du groupe « autres infections ».
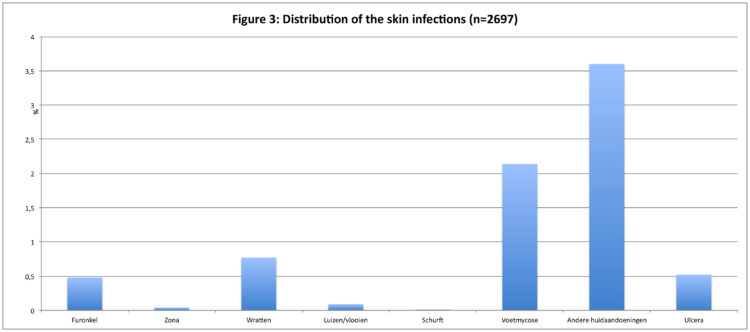
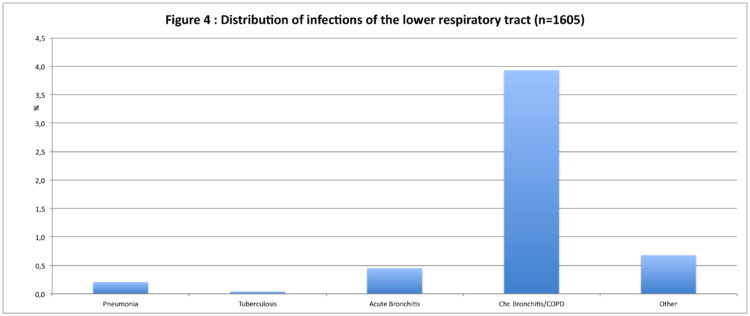
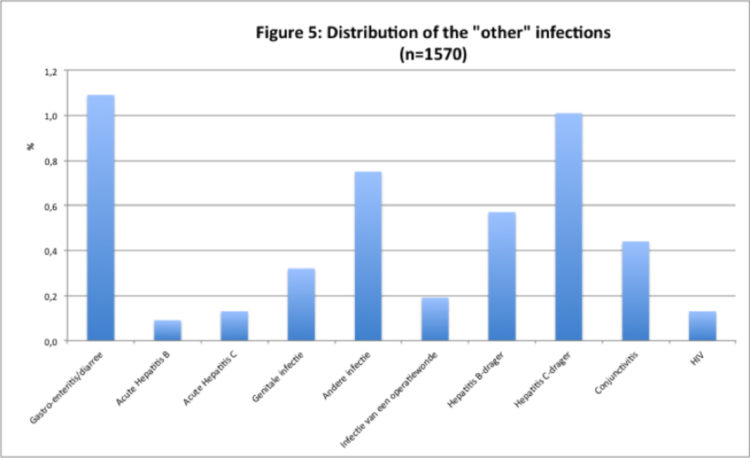
La prévalence moyenne des escarres atteignait 0,9% (range : 0,5-1,5%).
En moyenne, 2,5% des patients prenaient des antibiotiques au moment de l’enquête. Les antibiotiques les plus prescrits étaient les bêta-lactamines, suivis par les antibiotiques pour les voies urinaires et les quinolones (figure 6).
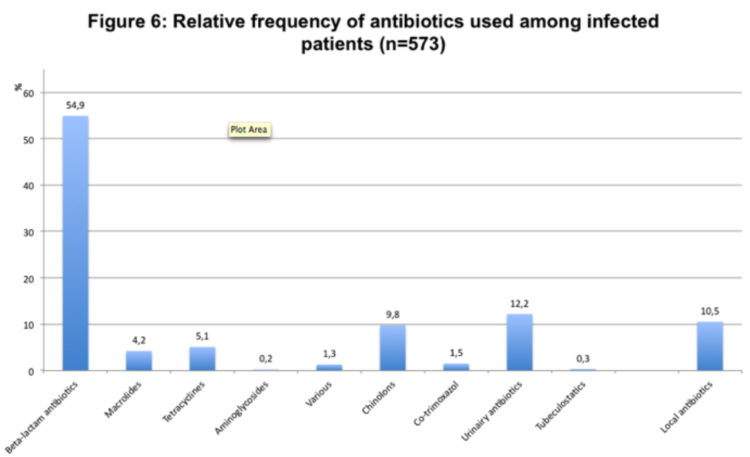
Prévalence avant et après le lancement de la campagne nationale pour l’hygiène des mains (2006)
Au cours de la première période d’enregistrement antérieure à la mise en œuvre des campagnes nationales pour l’hygiène des mains (2001,-2006), la prévalence de patients infectés atteignait 17,7%.
(95% IC : 17.1-18.3). Après introduction de la campagne (2007-2014), la prévalence moyenne était descendue à 14,6% (95 : 14,2-15,1%) (p<0,05).
La différence en termes de prévalence d’infection et de prévalence de patients infectés atteignait respectivement 3,74% et 3,18% (p<0,05).
DISCUSSION
Les trois types d’infection les plus fréquents étaient :
1) dermatites infectieuses,
2) infections des voies respiratoires inférieures et
3) infections des voies respiratoires supérieures.
L’utilisation moyenne d’antibiotiques atteignait 2,5%.
Avant l’introduction de la campagne nationale dans les hôpitaux psychiatriques, la prévalence moyenne de patients infectés était de 17,8% par an. Après sa mise en œuvre, la prévalence avait diminué de manière significative pour atteindre 14,6%.
La prévalence des infections a présenté la même évolution, en passant d’une moyenne de 20,5% avant la mise en œuvre à 16,8% après, ce qui donne une différence de 3,7% pour la prévalence d’infections et de 3,2% pour celle de patients infectés.
La campagne d’hygiène des mains a donc potentiellement évité 37 infections et 32 patients infectés sur 1.000 patients par année. Il ne faut toutefois pas exclure que d’autres facteurs aient pu jouer ici un rôle significatif.
La répartition des différents types d’infection était environ comparable à celle démontrée par une étude similaire menée auprès de résidents de maisons de repos et de soins en Belgiquë6.
Dans la littérature internationale, peu d’articles parlent de la prévalence d’infection chez les patients psychiatriques admis à l’hôpital : dans une étude suédoise menée auprès de 169 patients, principalement des jeunes, la prévalence d’infection était de 4,1%. Une autre étude, norvégienne cette fois, a fait état d’une prévalence d’infection de 1,9% ; dans une étude nationale menée en France en 1996 dans les services SPHG d’hôpitaux spécialisés en maladies aiguës, la prévalence était de 2,9%7.
En 2010, l’étude européenne HALT8,9 (Healthcare Associated infections in Long-Term facilities) a trouvé une prévalence d’infection de 4,7%. Cette étude HALT montrait une utilisation d’antibiotiques (5,3%) supérieure à celle indiquée dans la nôtre (2,5%). Les infections liées aux soins les plus fréquentes dans les 111 maisons de repos et de soins participantes étaient les infections des voies respiratoires (47,9%), principalement des voies respiratoires inférieures, les infections de la peau (20, 8%) et les infections des voies urinaires (9,2%). Toutefois, d’autres critères d’infection ont été utilisés dans cette étude.
Dans (la plupart) des instituts psychiatriques, on ne dépiste pas (ou à peine) les cas de MRSA, ce qui rend également les résultats de notre étude difficiles à interpréter.
Les résultats au sujet de l’efficacité des actions préventives et principalement de l’effet de la promotion de l’hygiène des mains pour les soignants, ont été documentés dans des hôpitaux spécialisés en maladies aiguës10-15. Dans un aperçu de plus de 20 études menées dans des hôpitaux sur l’impact de l’hygiène des mains et sur les infections liées aux soins, publiées entre 1977 et 2008, seules trois études ne sont pas parvenues à montrer une réduction du nombre d’infections liées aux soins après une campagne de sensibilisation à l’hygiène des mains.
Plusieurs études menées dans des hôpitaux psychiatriques ont démontré que la promotion de l’hygiène des mains avait un effet positif sur la prévention de la transmission du MRSA16, du norovirus17 et du métapneumovirus humain18.
Limites de l’étude
Plusieurs facteurs risquent de biaiser les résultats de cette étude, notamment :
1) le nombre variable de professionnels de la santé à qui incombait la responsabilité de remplir le formulaire d’enregistrement,
2) des périodes d’enregistrement différentes : au mois de mai jusqu’en 2004, au mois de décembre ensuite,
3) définition de critères.
En conclusion, nous pouvons établir que :
1) il faut prévenir et accorder plus d’attention aux infections liées aux soins dans les instituts psychiatriques ;
2) les campagnes de promotion d’hygiène des mains contribuent à la prévention des infections liées aux soins
3) il convient d’envisager la rédaction de critères d’infection standardisés pour ce secteur particulier.
Les auteurs tiennent à remercier les établissements participants, ainsi que les collègues Laura Jacobs, Chris Apers et Kristien Johannik pour l’aide apportée au traitement des données.
ANNEXE : instructions pour le bon remplissage du formulaire
1) – Critères d’infection des voies respiratoires supérieures
Diagnostic clinique des affections renseignées
2) – Critères d’infection des voies respiratoires inférieures
Apparition ou augmentation de la production d’expectorations, avec signes thoraciques (auscultatoires, percutoires) ou radiologiques non attribuables à une embolie pulmonaire, une décompensation cardiaque ou une aspiration.
3) – Critères d’une infection urinaire
Un des signes suivants doit être présent : fièvre (>38°), ou miction fréquente, douloureuse ou pressante, ou douleur supra-pubienne, ET une culture d’urine positive (au moins 105 colonies/ml)
OU
– deux des signes suivants : fièvre (>38°), ou miction douloureuse ou pressante, ou douleur supra-pubienne ET pyurie ou urine purulente
OU
– un test par stick urinaire positif aux leucocytes ou aux nitrites.
OU
– antibiothérapie à visée urologique
OU
– diagnostic posé par un médecin
* Une bactériurie asymptomatique doit satisfaire aux critères suivants :
avec une sonde à demeure : pendant les 7 jours qui précèdent le prélèvement d’urine pour culture, le/la patient(e) ne montre aucun signe clinique d’infection urinaire, mais la culture d’urine est positive (pas plus de 2 microorganismes différents).
sans sonde à demeure : sur une période de 7 jours, 2 cultures d’urine positives aux mêmes microorganismes (maximum 2) sans autre signe clinique d’infection urinaire.
4) – Critères d’infection de la peau et/ou des tissus mous :
Diagnostic clinique des affections renseignées par le médecin LE GROUPE « AUTRES » NE REPREND QUE LES DERMATITES INFECTIEUSES NOTEES QUI NE PEUVENT ÊTRE REPRISES NULLE PART AILLEURS. (donc pas : acné, eczéma, psoriasis,…)
5) – Autres :
– Critères d’une gastro-entérite ou diarrhée :
Apparition soudaine d’une diarrhée (= selles liquides depuis plus de 12 heures), avec ou sans vomissements ou fièvre ET de toute vraisemblance d’origine infectieuse (donc par exemple non consécutive à un test diagnostique ou à un traitement ou à un stress).
– Critères d’une hépatite B ou C :
Deux des signes suivants : fièvre (>38°C), nausées, anorexie, vomissements, douleur abdominale, ictère, ou une transfusion sanguine au maximum 3 mois auparavant ET une sérologie positive.
On entend par porteurs chroniques les patients qui ont été contaminés un jour et qui, en ce qui concerne l’hépatite B, n’ont PAS été vaccinés.
– Critères d’ostéomyélite et d’infections génitales
Ce diagnostic doit être posé par un médecin.
– Critères d’une conjonctivite :
Rougeur de la conjonctive ET sécrétion purulente.
– Question 2 : Si l’escarre apparait dans l’établissement, il est indiqué « intra-muros », sinon c’est « extra-muros ». Il convient de préciser également la gravité de la lésion. Si le patient présente plusieurs escarres, décrivez la plus grave.
– Question 3 : Notez le nom de l’antibiotique administré au patient. Soit on note le nom commercial, soit l’appellation générique du produit. .
Un très grand merci pour votre collaboration.
Références bibliographiques
1) Haley RW, Culver DH, White JW, et al. The efficacy of infection surveillance and control programs in the prevention of nosocomial infections in US hospitals. Am J Epidemiol1985; 121: 182-205.
2) Haenen R, Moens G, Vandenbroeck S, et al. Effect of a prevention campaign on the prevalence of infections among Belgian psychiatric patients. Research Report 2012
3) Costers M, Viseur N, Catry B, Simon a. Four multifaced countrywide campaigns to promote hand hygiene in Belgian hospitals between 2005 and 2011: impact on compliance to hand hygiene. Euro Surveill 2012;17(18):pii=20161.
4) Garner JS, Jan WR, Emori TG, Horan TC, Hughes JM. CDC definitions for nosocomial infections, 1988. J Infect Control 1988; 128-140
5) McGeer A, Campbell B, Emori TG, et al. (1991) Definitions of infection for surveillance in long-term care facilities. Am J Infect Control 1991;19:1-7.
6) Haenen R, Moens G, Jacques P. Voorkomen en kenmerken van infecties in rust- en verzorgingstehuizen in België. Tijdschr Geneesk 1998;54:1254-1262.
7) The French Prevalence Survey Study Group. Prevalence of nosocomial infections in France: results of the nationwide survey in 1996. J Hosp Infect 2000;46:186-93.
8) Latour K, Jans B and the HALT management team. Healthcare associated infections in long-term care facilities (HALT study): results of the pilot point prevalence survey November 2009. Brussels: Institute of Public Health, 2011.
9) Jans B, Latour K, Broex E, Goossens H and the the European Surveillance of Antimicrobial Consumption (ESAC) management team. Report on point prevalence survey of antimicrobial prescription in European nursing homes 2009 (first ESAC-project). Brussels: Institute of Public Health, 2010.
10) Organisation mondiale de la santé (OMS) Recommandations de l’OMS pour l’hygiène des mains au cours des soins Premier Défi Mondial pour la Sécurité des Patients Un soin propre est un soin plus sûr. Genève : OMS, 2009. Disponible sur : http://apps.who.int/iris/bitstream/10665/70469/1/WHO_IER_PSP_2009.07_fre.pdf
11) Pittet D, Hugonnet S, Harbarth S, Mourouga P, Sauvan V, Touveneau S, et al. Effectiveness of a hospital-wide programme to improve compliance with hand hygiene. Infection Control Programme. Lancet 2000;356(9238):1307-12.
12) Naikoba S, Hayward A. The effectiveness of interventions aimed at increasing handwashing in healthcare workers – a systematic review. J Hosp Infect. 2001;47(3):173-80.
13) Gould DJ, Chudleigh JH, Moralejo D, Drey N. Interventions to improve hand hygiene compliance in patient care. Cochrane Database Syst Rev. 2007;(2):CD005186.
14) Chen YC, Sheng WH, Wang JT, Chang SC, Lin HC, Tien KL, Hsu LY, TsaI KS. Effectiveness and limitations of hand hygiene promotion on decreasing healthcare-associated infections. PLOS One: 2011;6:e27163: 1-9.
15) Allegranzi B, Pittet D. Roleof hand hygiene in healthcare associated infection prevention. J Hosp Infect 2009;73:305-15.
16) Ebner W, Schlachetzki J, Schneider C, Dettenkofer M, Langosch JM. Hand hygiene seems to be sufficient for prevention of MRSA transmission on a closed psychiatric ward?. J Hosp Infec 2010;75:334-5.
17) Gilbride SJ, Lee BE, Taylor GD, Forgie SE. Successful containment of a norovirus outbreak in an adult psychiatric area. Infect Control Hosp Epidemiol 2009;30:289-91.
18) Cheng VC, Wu AK, Cheung CH, Lau SK, Woo PC, Chan KH, Li KS, Ip IK, Dunn EL, Lee RA, Yam LY, Yuen KY. Outbreak of human metapneuvirus infection in psychiatric patients : implications for directly observed use of alcohol hand rub in prevention of nosocomial outbreaks. J Hosp Infect 2007;67:336-43.