 Introduction
Introduction
Depuis 2 ans, une foule de projets portant sur la refonte de la classification des fonctions cliniques et managériales du département infirmier ont été organisés. Les différentes fonctions sont passées sous la loupe afin de définir leurs rôle et le futur statut dans tous les établissements possibles, hôpitaux, structures de soins ainsi que dans les soins à domicile. Le lieu d’affectation, les domaines de résultat, les compétences requises et la rémunération vont de pair à ces fonctions. Dans le cadre de cette classification et différenciation de fonctions au sein du département infirmier, l’Institut de Classification de fonctions (IFIC en abrégé) a soumis fin 2016 une proposition au cabinet Affaires Sociales et Santé Publique et à son administration. Cette proposition n’a pas été retenue en raison d’une coupole d’hôpitaux flamands, arguant notamment e.a. que les données utilisées par l’IFIC pour lier la fonction à une échelle barémique ne correspondaient pas à la réalité de travail actuelle des infirmiers. La proposition a donc été provisoirement mise en attente, mais en dépit d’un avis négatif de la coupole, la nouvelle classification IFIC a tout de même été implémentée début 2018 dans les hôpitaux privés.
L’IFIC sous-évalue la fonction d’infirmier en hygiène hospitalière (IHH) et ne répond pas, en termes de statut, aux recommandations reprises dans la circulaire de Christiaan Decoster (ancien directeur général Soins de santé) du 19/07/2007, qui stipule que chaque IHH doit faire partie du cadre intermédiaire infirmier. Selon l’IFIC, l’IHH se situe dans les hôpitaux au même niveau qu’un infirmier en chef, à savoir le niveau 17. La fonction n’est pas reconnue dans les autres secteurs. Fin 2016, la Plateforme Fédérale Hygiène hospitalière (partenaire privilégié dans la reconnaissance de la fonction de l’IHH) a également réagi vis-à-vis de l’IFIC, notamment sur demande des plateformes régionales en hygiène hospitalière, de l’ABIHH et du WIN.
Vu que les actions entreprises par la coupole et la Plateforme fédérale hygiène hospitalière n’ont eu aucun impact sur l’implémentation de la classification IFIC fin 2017-début 2018, la Plateforme Fédérale Hygiène Hospitalière, l’ABIHH et le WIN ont réuni leurs forces pour entreprendre plusieurs actions contre ce déploiement futur de la classification de fonction d’IHH. Le premier objectif commun consiste à adapter le contenu et le statut de l’IHH, tels que décrits dans la carte de fonction IFIC, et ce conformément aux dispositions légales, au profil de compétences professionnelles et à la pratique. Le deuxième objectif commun consiste à consolider la position de chaque IHH et d’en rendre la rémunération proportionnelle. Étant donné que pour plusieurs actions, il a été fait appel à la collaboration de tous les IHH de Belgique, il nous a semblé opportun d’informer, par cette voie, nos collègues et les équipes opérationnelles en hygiène hospitalière à propos de l’état d’avancement de ce dossier.
IFIC : Valorisation ou dévalorisation ?
Depuis deux ans, nos autorités et les partenaires sociaux ne jurent plus qu’au travers de la nouvelle classification de fonctions de l’IFIC pour le secteur des soins de santé. En 2018, cette classification a été mise en œuvre dans les hôpitaux privés. Cette année, ce sera au tour des hôpitaux publics.
La carte de fonction IFIC de l’IHH (code 6162) réduit le contenu de la fonction à l’introduction de mesures et à la formulation de conseils, dont les domaines de résultat sont les suivants :
• Détecter et résoudre les problèmes d’hygiène
• Superviser les méthodes de travail en matière d’hygiène
• Effectuer les prélèvements et assurer le suivi des infections
• Effectuer des recherches sur le matériel et les produits
En d’autres termes, l’IHH est privé de son rôle de participant à la coordination de la politique de prévention des infections de l’hôpital, la motivation et le coaching de collaborateurs par rapport à la prévention des infections ne font plus partie de ses tâches (il doit uniquement informer et donner des conseils), il n’établit plus de directives générales concernant la prévention des infections (uniquement mettre en œuvre des mesures et remettre des avis), sa participation à des groupes de travail et plateformes externes n’est pas attendue, etc. Une telle description réduit fortement sa fonction réelle exercée sur le terrain . Il est évident que la carte de fonction a été établie par des personnes qui ne connaissent pas la fonction et qui ne se sont certainement pas concertées avec les titulaires de fonction, à savoir l’IHH. Nos organisations ont ensuite demandé à l’IFIC d’adapter cette carte de fonction et ont proposé leur aide/soutien. En guise de travail préparatoire, une description de fonction adaptée avait déjà été remise à l’IFIC, celle-ci étant conforme à la législation, au profil de compétences professionnelles et à la pratique, et aussi validée par la Plateforme Fédérale en Hygiène Hospitalière, l’ABIHH et le WIN.
Une autre modification dévalorisante concerne la position de la fonction qui, selon la circulaire de Christiaan Decoster, doit se trouver « au niveau du cadre intermédiaire ». Malheureusement, l’IHH n’est dans la pratique pas toujours reconnu ni rémunéré comme un cadre intermédiaire. Depuis lors, le terme a été abandonné et remplacé par infirmier chef de service . La nouvelle classification de fonctions de l’IFIC n’en tient cependant pas compte et positionne l’IHH dans la catégorie de fonction 17, soit au même niveau que l’infirmier en chef. Et ce alors que la circulaire positionne l’IHH dans la catégorie de fonction 19, à savoir la même que celle de l’infirmier chef de service. La Plateforme Fédérale en Hygiène Hospitalière a également récemment interpellé M. L. Verboven, président de la commission paritaire 330, par rapport à la classification de l’IHH dans une échelle barémique trop basse.
Selon le rapport sur les indicateurs de qualité en l’hygiène hospitalière rassemblés en 2017, on retrouve dans 95 % des hôpitaux au moins un IHH qui est membre du cadre intermédiaire infirmier. En d’autres termes, seul 1 IHH est reconnu comme cadre intermédiaire ou infirmier chef de service de l’équipe infirmière hygiène hospitalière…et donc pas tous les IHH qui font partie de l’équipe. On assiste également à une tendance, dans laquelle des gestionnaires de projets en hygiène hospitalière sont intégrés dans l’équipe en remplacement de l’IHH et sont ensuite ajoutés à injuste titre dans le nombre d’équivalents temps plein (ETP) IHH. Un revirement se remarque au niveau de cet indicateur : en 2013 et 2015, la question était différente, à savoir « IHH faisant partie de l’encadrement minimal requis ( financement) est/sont membre(s) du cadre intermédiaire infirmier ». Cette évolution est selon nous plutôt préoccupante, étant donné que dans les hôpitaux dénombrant plus de 1 IHH, 2 types d’IHH sont ainsi créés. À savoir un qui fait partie du cadre intermédiaire, mais pas les autres. Cette approche est financièrement avantageuse pour l’employeur mais n’est pas propice à une collaboration mutuelle et à une professionnalisation de la profession. Selon nous, une possibilité de création d’une troisième sorte d’IHH se crée également, à savoir celui du gestionnaire de projet prévention des infections, qui selon certaines sources, est compté par certains employeurs dans le nombre d’ETP IHH. Cet indicateur est également décrit différemment dans le rapport de 2017 par rapport à ceux de 2013 et 2015, à savoir respectivement « Nombre effectif d’IHH ≥ 90 % du nombre théorique » et « Nombre effectif d’IHH ≥ nombre théorique ». Les changements au niveau de la description de ces indicateurs compliquent l’interprétation des résultats et les évolutions.
Législation et profil de compétences – sont-ils clairs ou obscurs ?
En ce qui concerne le contenu de la fonction, l’AR du 26 avril 2007 décrit clairement les tâches de l’équipe d’hygiène hospitalière, et par conséquent de l’IHH :
1° le développement, la mise en œuvre et le suivi, à travers l’hôpital, d’une stratégie relative :
a) aux mesures de protection standard ayant pour objet de
prévenir la transmission de germes infectieux ;
b) à l’isolement des patients infectés afin d’endiguer la
transmission des maladies infectieuses ;
c) à la surveillance des infections nosocomiales à l’aide
d’indicateurs permettant d’en suivre et d’en corriger
l’incidence au sein de l’établissement ;
2° la mise sur pied d’une stratégie de lutte contre les épidémies ;
3° le suivi des aspects ayant trait à l’hygiène dans le cadre d’activités hospitalières telles que :
a) la construction ou la transformation ;
b) les activités au quartier opératoire ou en salle d’accouchements ;
c) l’achat de matériels ;
4° la mise en œuvre des directives et recommandations rédigées par des organismes officiels tels que le Conseil supérieur de la Santé ;
5° l’échange avec d’autres établissements d’informations et de l’expérience acquise, dans le cadre d’une plate-forme de collaboration en matière d’hygiène hospitalière.
L’AR stipule également clairement que l’IHH doit avoir suivi une formation appropriée de niveau universitaire et être titulaire d’un diplôme de bachelier en soins infirmiers complété par un master en art infirmier ou un master en santé publique. L’IHH doit en plus faire la preuve d’avoir suivi avec succès une formation spécifique en prévention des infections. Ces exigences de formation justifient en d’autres termes la position de l’IHH en tant que cadre intermédiaire/ Infirmer chef de service
L’AR du 26 avril 2007 ne spécifie cependant pas l’échelle salariale, mais seulement la formation nécessaire. Dans l’avis concernant l’organisation de l’hygiène hospitalière du 10 novembre 2005, Monsieur Decoster indique par contre que la Plateforme fédérale Hygiène hospitalière souhaite un salaire compétitif pour l’IHH (niveau cadre intermédiaire/ infirmier chef de service). Le Conseil National des Etablissements Hospitaliers souligne également que la rénumération de l’IHH doit être suffisante, au vu de la responsabilité de cette fonction intellectuelle et que donc une rémunération en tant que cadre intermédiaire est justifiée. Le budget des moyens financiers prévoit également une rémunération de l’IHH en tant que cadre intermédiaire. Dans la circulaire du 19 juillet 2007 concernant les normes d’agrément et le financement de l’hygiène hospitalière, M. Decoster recommande également l’insertion de l’IHH dans le cadre intermédiaire infirmier.
Le 21 août 2009, le Sénat a formulé une réponse à une question écrite n° 4-4161 relative à la rémunération de l’IHH. Il a été donné comme réponse que la rémunération de l’infirmier hygiéniste hospitalier est une matière qui appartient bien entendu à l’appréciation de l’hôpital, compte tenu de la position qui lui est accordée dans la structure hiérarchique selon laquelle l’infirmier à sa place au niveau du cadre intermédiaire compte tenu de sa formation et son expertise étendues. Par ailleurs, cette position donnerait également à l’IHH du « poids » dans ses contacts avec les infirmiers (en chef) et avec les médecins de l’hôpital.
En marge de ces dispositions légales, qui définissent clairement le contenu et la position de l’IHH, le profil belge de compétences professionnelles pour l’IHH a été établi et validé en 2012 par le SFP Santé publique, l’Union Générale des Infirmiers de Belgique (AUVB-UGIB-AKVB), l’ABIHH et le WIN. Le profil a été établi conformément à l’AR du 26 avril 2007 et au European Core Curriculum for training of Infection Control Practitioners (2008), en collaboration avec tous les infirmiers hygiénistes hospitaliers, le médecin hygiéniste hospitalier, le président du comité d’hygiène hospitalière, le directeur infirmier et le directeur médical en Belgique (N=623). Le profil de compétences professionnelles mentionne clairement l’objectif de la fonction, sa position dans l’organisation, les domaines de résultat, les compétences et les exigences liées à la fonction. Étant donné qu’un profil de compétences professionnelles est quelque chose de dynamique, le profil a été dans le courant de 2017 révisé par l’ABIHH et le WIN, conformément aux évolutions actuelles et au document technique de l’ECDC, « Core competencies for infection control and hospital hygiene professionals in the European Union » (2013). Le profil révisé est disponible auprès des deux organisations.
En dépit des informations claires concernant le contenu et les exigences de la fonction d’IHH fournies par le législateur et le profil de compétences professionnelles, l’on constate qu’il n’en a guère été tenu compte lors de l’établissement de la classification de fonction de l’IHH. La carte de fonction n’a pas non plus été validée par les titulaires de fonction, une harmonisation par rapport à la pratique faisant dès lors défaut.
Réalité du terrain
À l’automne 2017, l’ABIHH et le WIN ont organisé une enquête nationale sur le statut d’IHH. Dans ce cadre, un courrier a été adressé à tous les IHH du pays, les invitant à compléter un questionnaire sur leur rôle et leur position actuels dans l’hôpital. Au total, 125 IHH ont participé à l’enquête, ce qui correspond à un taux de représentation de 55,8 %. Au niveau des hôpitaux, 84 des 117 hôpitaux généraux (HG) étaient représentés (72,0%), et 11 des 60 hôpitaux psychiatriques (HP) l’étaient (18,3%).
Graphique 1 : Nombre de participants par province (Abs. Freq.)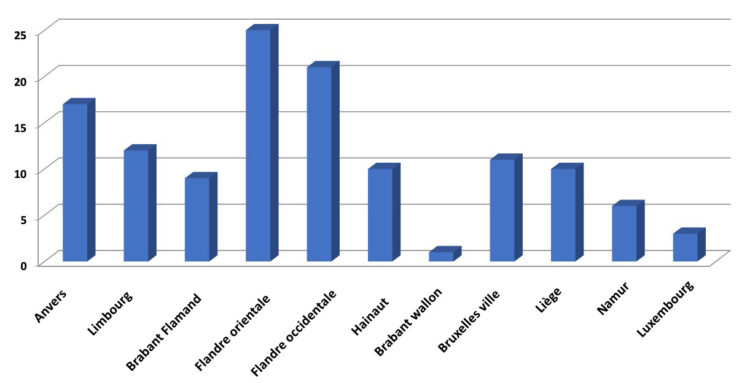
Graphique 2 : Subdivision en termes de pourcentage des participants selon le type d’hôpital (%)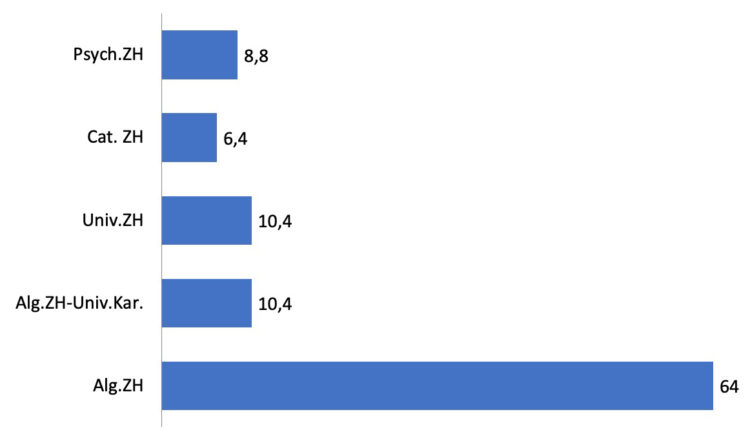
Cette constatation correspond parfaitement à la conclusion du « Mission Report – ECDC Country visit to Belgium to discuss antimicrobial resitance issues » du Centre européen de prévention et de contrôle des maladies (ECDC). Il est clairement indiqué en page 17 du rapport que le nombre d’ETP IHH est bien trop faible en comparaison à la norme. Le nombre d’ETP doit être revu et étendu, afin que toutes les tâches nécessaires (voir ECDC technical document ‘Core competencies for infection control and hospital hygiene professionals in the European Union’ (2013)) puissent être exécutées.
Sur le plan légal, le nombre d’ETP IHH est calculé en Belgique conformément à l’AR 19/06/2007, selon la formule suivante : Li x C/1.000 (où Li = « nombre de lits justifiés déterminés conformément à l’annexe 3 du présent arrêté pour le service concerné au 1er juillet de l’exercice » et c = coefficient par service) avec un minimum de 1 ETP par 150 lits (voir p. 7 Circulaire C. Decoster 19/07/2007) soit 0,66 ETP par 100 lits. L’on constate cependant dans la pratique que la norme de 1 ETP IHH par 250 lits est toujours utilisée. Cette norme repose sur l’étude SENIC des années 70 et n’est plus conforme au contexte actuel. Sur la base de la publication de Van den Broek PJ et al. (2007) et s’inspirant des Pays-Bas, l’ABIHH et le WIN ont proposé d’appliquer la norme d’1 ETP IHH par 5 000 admissions (hospitalisations + hospitalisations de jour). Elle devrait permettre à l’IHH d’être plus en phase avec le terrain et d’organiser et de suivre davantage de projets concernant l’hygiène hospitalière et la prévention des infections.
En ce qui concerne l’appartenance ou non au cadre intermédiaire infirmier, l’on constate que 73 % des IHH des hôpitaux généraux (HG) en font partie. Contre 64 % dans les hôpitaux psychiatriques (HP). Dans les HG, on observe une différence minime dans le pourcentage qui fait partie du cadre intermédiaire entre hôpitaux avec 1 IHH et hôpitaux avec > 1 IHH, à savoir respectivement 76,9 % et 71 %. Dans les HG et HP, l’IHH travaille dans respectivement 43 % et 100 % des cas à temps plein. Parmi les IHH travaillant à temps partiel dans tous les hôpitaux généraux, 65,22 % combinent leur fonction d’IHH (en moyenne 0,49 ETP) à une autre fonction (en moyenne 0,47 ETP – 41 % Infirmier chef de service/ manager de soins, 17 % infirmier, 10 % collaborateur). Sur les IHH travaillant à temps plein dans les hôpitaux généraux, 32,26 % combinent leur fonction d’IHH (en moyenne 0,99 ETP) à une autre fonction (en moyenne 0,27 ETP – 65 % infirmier chef de service/ manager de soins, 15 % infirmier en soin de plaies, 10 % collaborateur). Dans les HG avec 1 HH, 74,36 % travaillent à temps plein, dont 48,28 % combinent la fonction d’IHH à une autre fonction.
Dans les HP, 91 % des IHH combinent leur fonction d’IHH (en moyenne 0,5 ETP) à une autre fonction (en moyenne 0,85 ETP – 40 % infirmier, 20 % infirmier chef de service/manager de soins, 20 % infirmier en chef).
Sur l’ensemble des IHH, 38 % dans les HG et 18 % dans les HP assurent une permanence de garde téléphonique pour l’hygiène hospitalière.
Les activités ou domaines de résultat de l’IHH correspondent dans la pratique en large mesure à ceux formulés dans le profil belge de compétences professionnelles. Cette correspondance est plus importante dans les HG que dans les HP, où l’étroite collaboration avec le cadre intermédiaire infirmier, la coordination journalière de l’équipe de prévention des infections (PI), le point de contact concernant la politique de prévention des infections et la direction des référents en prévention des infections affichent un score nettement moins élevé.
Sur l’ensemble des IHH, dans seulement 78,15 % des cas, la direction des soins infirmiers en est le supérieur hiérarchique, et ce, contrairement à la loi. Dans les 21,85 % restants, il s’agit d’un infirmier chef de service/ manager de soins (9,24 %), d’un autre (Directeur qualité & sécurité des patients, Directeur médical, biologiste clinique, Directeur Nursing adjoint) (8,40 %) et du médecin hygiéniste hospitalier (4,20 %).
En ce qui concerne la rémunération, 53,16 % des IHH actifs dans un hôpital privé sont rémunérés selon le barème 1.80. Pour les 46,84% restants : 15,19 % sont rémunérés à un barème plus élevé et 31,65 % à un barème inférieur. Pour les IHH actifs dans un hôpital public, 35,71 % sont rémunérés au barème B6 et 32,15 % au barème A1. Pour les 32,14 % restants : 7,14 % sont rémunérés à un barème plus élevé et 25,00 % à un barème inférieur. La rémunération à un barème supérieur n’est pas liée à une combinaison avec la fonction d’ infirmier chef de service/manager de soins.
En ce qui concerne les primes mensuelles, 41,74 % de tous les IHH perçoivent un supplément de fonction, 33,91 % un complément de fonction et 13,04 % une autre prime. Ces primes ne sont pas liées à la combinaison de la fonction d’ infirmier chef de service/manager de soins.
On distingue de nettes disparités entre HG et HP, la rémunération d’un IHH dans un HP étant nettement inférieure à celle accordée dans un HG. Par contre, dans les HP, les IHH sont plus nombreux à recevoir une prime mensuelle que leurs collègues dans un HG.
Sur l’ensemble des IHH, 75,63 % ont suivi une formation de base Bachelier (Ba) + Master (Ma). Les 24,37 % restants ont un diplôme Ba (14,29 %) ou un diplôme Ba + Bachelor après Bachelor (BaNaBa) en gestion de soins (10,08 %). Une formation spécialisée supplémentaire en hygiène hospitalière a été suivie par 96,61 % des IHH, dont 65,25 % dans le cadre d’une formation distincte de minimum 1 an Université de Liège (ULG) / Université Catholique de Louvain (UCL) / Université Libre de Bruxelles (ULB), NVKVV,…, 15,25 % dans un choix d’option après un master (Katholieke Universiteit Leuven – KUL), 16,10 % dans un choix d’option pendant un master (KUL).
On distingue ici également de nettes disparités entre HG et HP, le niveau de formation d’un IHH dans un HG étant plus élevé que celui d’un IHH dans un HP.
Sur les IHH d’HG, on constate que 45,05 % n’ont pas de collègue IHH, tandis que dans les HP, aucun IHH n’a de collègue. Ceux qui ont un collègue IHH se concertent minimum 1x par jour. La majorité des IHH dans un HG se concertent chaque semaine avec le médecin hygiéniste hospitalier (54,33 %), contre une fois par trimestre dans les HP (45,45 %). Les collaborateurs/gestionnaires de projet hygiène hospitalière sont plus nombreux dans les HP (54,55 %) que dans les HG (21,10 %). Un statisticien, un informaticien, un gestionnaire de données, un épidémiologiste et un collaborateur administratif ne font qu’exceptionnellement partie de l’équipe hygiène hospitalière. Dans 21,52 % des HG, un laborantin fait partie de l’équipe opérationnelle en hygiène hospitalière, et dans 27,85 %, un infectiologue fait partie de l’équipe opérationnelle en hygiène hospitalière. Contre 0 % dans les HP.
En ce qui concerne la participation de l’IHH aux réunions, on constate que dans 92,52 % des HG et 90,91 % des HP, ils participent toujours aux réunions de l’équipe opérationnelle en hygiène hospitalière. Le taux de participation aux réunions du cadre intermédiaire, des infirmiers en chef, des infirmiers référents en hygiène hospitalière, des groupes de travail (HACCP, linge, déchets, construction, etc.) et du Comité matériel médical varie entre HP et HG, le plus élevé étant enregistré du côté des HG. Dans les HP, le taux de participation de l’IHH aux réunions du groupe de la gestion des antibiotiques est plus élevé en comparaison aux IHH actifs dans des HG (respectivement 27,27 % vs. 20,56 %). La participation active de l’IHH d’HG à des réunions externes avec des maisons de repos et de soins est assez limitée, à savoir 11,22 %. En ce qui concerne les réunions externes avec des établissements psychiatriques, la participation active des IHH d’HP est de 63,63 %. Pour les IHH d’HG, elle est de 8,41 %. La concertation externe d’IHH d’HG avec des services de soins à domicile est actuellement encore limitée, à savoir 2,8%. Le nombre d’IHH d’HG qui participent à la Plateforme Régionale en Hygiène hospitalière est de 79,44 %, contre 63,64 % dans les HP. De plus, 42,99 % des IHH d’HG et 8,18 % d’HP participent activement aux réunions des organisations professionnelles ABIHH et WIN, et 14,95 % des IHH d’HG et 9,09 % d’HP sont impliqués dans l’établissement des recommandations du Conseil Supérieur de la Santé.
Dans les HG, on retrouve en moyenne 6,65 infirmiers référents et 1,14 référent par 100 lits. Ces personnes de référence sont en moyenne libérées 2,05 heures par mois pour leur rôle de personne de référence (1,37 h + 0,68h de concertation par mois). Dans les HP, on retrouve en moyenne 1,96 infirmier référent et 0,48 référent par 100 lits. Ces personnes de référence dans les HP sont en moyenne libérées 1,80 heure par mois pour leur rôle de personne de référence (1,36 h + 0,44h de concertation par mois). En d’autres termes, le temps de travail libéré pour leur rôle de référent au sein du service est équivalent dans les HP et HG, mais dans les HG, la fréquence de réunion est plus élevée par rapport aux HP (respectivement 4,37 versus 3,27).
Sur la base des résultats de cette enquête, l’on peut en conclure que la carte de fonction IFIC actuelle de l’IHH n’est pas conforme à la réalité actuelle du monde du travail. En d’autres termes, la Plateforme Fédérale Hygiène Hospitalière, l’ABIHH et le WIN ont toutes les raisons de réagir et de marquer leur désaccord avec la carte de fonction IFIC actuelle de l’IHH.
Actions entreprises
En notre qualité d’organisations intéressées, nous avons examiné et abordé le nouvel éventail de fonction et la nouvelle description de fonction de l’IHH (code 6162) rédigés par l’IFIC. Ils ont ensuite été comparés aux documents légaux et officiels susmentionnés, et aux données du questionnaire. Sur la base de ces éléments, un courrier a été établi et transmis à l’IFIC et à notre ministre de la Santé publique, Mme Maggie De Block, mentionnant clairement notre désaccord avec le contenu de la description de fonction actuelle de l’IFIC et le positionnement de l’IHH dans la catégorie de fonction « 17 », cela sur la base des arguments susmentionnés concernant le statut juridique, le domaine d’action et le contenu de la fonction d’IHH. Une proposition d’adaptation de l’objectif global, des activités, des tâches, des critères et de la classification en catégorie « 19 » a été ajoutée. En dépit de toutes les étapes entreprises, l’IFIC a répondu le 15 mai 2018 de manière courtoise mais insuffisante. La classification dépend de la commission paritaire et non de la position dans l’organigramme, ni du financement, mais du contenu de la fonction. L’UGIB a également réagi à cette classification de fonctions IFIC, qui ne concerne bien évidemment pas seulement l’IHH, et a donné lieu aux interpellations nécessaires à la Chambre le 05/06/2018.
Mme Maggie De Block a réagi en expliquant que la classification de fonctions IFIC n’était pas une donnée fixe mais évolutive. À l’automne 2018, elle promettait une phase de maintien intensif, dans le cadre de laquelle les fonctions manquantes allaient être ajoutées et les profils actuels actualisés. Une attention particulière allait dans ce cadre être accordée à l’apport de personnes du terrain, par le biais des partenaires sociaux et de l’asbl IFIC. Les remarques transmises au SPF Santé Publique allaient également être transmises à l’IFIC. En d’autres termes, nous attendons avec impatience une invitation pour l’adaptation du profil actuel d’IHH, mais Mme Maggie De Block a également ajouté ceci : « Nous ne pouvons pas imposer aux partenaires sociaux les participants à la concertation. Je ne peux que jouer un rôle d’intermédiaire, et c’est ce que je fais, en rassemblant autour de la table organisations professionnelles et l’asbl IFIC. Les organisations professionnelles des infirmiers veulent clairement aller plus loin et faire partie de la concertation sociale, mais je ne peux rien y faire, c’est à eux de plaider pour leur cause. » Espérons que notre demande d’invitation sera acceptée.
Dans l’intervalle, l’AR du 17/08/2018 rendant obligatoire la convention collective de travail du 11 décembre 2017, conclue au sein de la Commission paritaire des établissements et des services de santé, relative à l’introduction d’un nouveau modèle salarial pour les services de santé fédéraux a été publié le 07/09/2018.
L’ABIHH et le WIN ont de leur côté remis un dossier d’information à chaque IHH, comportant toutes les informations et la documentation nécessaires. Il a été transmis avec un modèle de lettre pour la signification de recours interne et externe à chaque IHH de Flandre, de la région bruxelloise et de Wallonie. Chaque IHH a ainsi été informé de la situation actuelle et a reçu toute la documentation et tous les arguments pour la signification d’un recours interne et externe contre la description de fonction actuelle de l’IFIC. C’est bien entendu à chaque IHH que revient le choix et la responsabilité de marquer son accord ou non avec la description de fonction et rémunération actuelles de l’IFIC. Le but est de réagir massivement contre la description de fonction actuelle afin que notre voix, unie, soit entendue et que la probabilité d’une concertation avec l’IFIC augmente. L’avenir et la professionnalisation de la profession de l’IHH résident donc entre les mains de chaque IHH individuel.
Conclusion
Les dés sont-ils jetés ? … Ne rien faire n’est pas une solution. C’est la raison pour laquelle nos organisations professionnelles ont réuni leurs forces et informé nos membres à propos des solutions (internes-externes) existantes, vu que la nouvelle description de fonction actuelle de l’IFIC ne correspond pas à la réalité du monde du travail. Nos futurs collègues IHH devront étudier pendant 4 ans pour obtenir leur diplôme de Bachelier, 2 à 3 ans pour obtenir leur diplôme de Master et 1 an pour décrocher leur certificat en hygiène hospitalière. Le nouveau modèle de fonction pour les soins infirmiers de demain du SPF Santé publique positionne déjà le IHH au niveau d’Advanced Practice Nursing (Niveau 7).
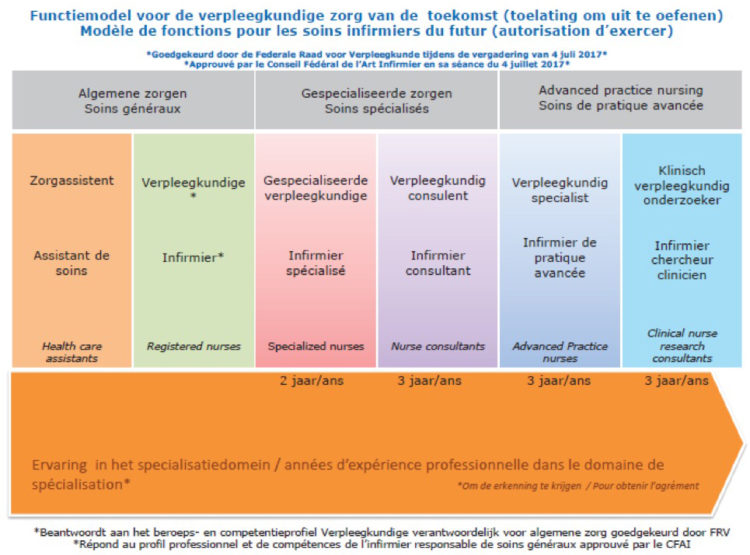
Notre plus grande crainte dans ce dossier est que rien ne change au niveau de la description de fonction actuelle de l’IHH de l’IFIC. Le statut IFIC proposé actuellement pour la fonction d’IHH et le niveau de formation et de responsabilités requis donneront lieu à une pénurie en IHH à l’avenir. Ce sera alors un jeu d’offre et de demande… Ou, pour l’éviter, abaissera-t-on le niveau d’IHH au niveau 6, suite à quoi, par adaptation de la loi, un master ne sera plus nécessaire ? En notre qualité d’organisations professionnelles pour IHH, nous ne pouvons l’accepter et nous y opposerons. Mais….nous ne pouvons le faire sans vous. Nous avons besoin de vous tous, de chaque équipe en hygiène hospitalière, des IHH et médecins hygiénistes, pour y arriver. Et ce, dans l’intérêt de la professionnalisation du métier d’IHH et de soins sûrs et qualitatifs à chaque patient pris en charge dans nos établissements de soins belges. En d’autres termes, c’est à chaque équipe opérationnelle d’hygiène hospitalière de Belgique qu’il revient de se positionner et de convaincre sa direction
Dernière minute
En février 19, l’IFIC nous informe que nos associations, tout comme e.a le président de la Plateforme Fédérale en Hygiène Hospitalière, seront auditionnés dans les semaines à venir afin de présenter nos argumentations pour la classification de la fonction d’IHH au niveau 19.
Wait and see ….
References
• Braekeveld P. & Barbier C. (2014). Het project ‘Belgisch Beroepscompetentieprofiel voor de Verpleegkundige-Ziekenhuishygiënist. Noso-Info, vol . XVIII, nr 2 , 2-5.
• Braekeveld P., Claeys K. & Demey G. (2014). Referentieverpleegkundige Ziekenhuishygiëne: Van actuele tendens binnen het werkveld tot innovatieve opleiding. Noso-Info, vol . XVIII, nr 2 , 6-10.
• European Centre for Disease Prevention and Control (2018). Mission Report – ECDC country visit to Belgium to discuss antimicrobial resistance issues. Stockholm: ECDC.
• European Centre for Disease Prevention and Control (2013). Technical Document – Core competencies for infection control and hospital hygiene professionals in the European Union. Stockholm: ECDC.
• Service public fédéral Santé publique, Sécurité de la Chaîne alimentaire et Environnement(2007). Arrêté royal du 26 avril 2007 modifiant l’arrêté royal du 23 octobre 1964 portant fixation des normes auxquelles les hôpitaux et leurs services doivent répondre. Moniteur Belge, 07/06/2007, 30947-30950.
• Service public fédéral Santé publique, Sécurité de la Chaîne alimentaire et Environnement(2007). Arrêté royal du 19 juin 2007 modifiant l’arrêté royal du 25 avril 2002 relatif à la fixation et à la liquidation du budget des moyens financiers des hôpitaux. Moniteur Belge, 28/06/2007, 35435-35450.
• Service public fédéral Santé publique, Sécurité de la Chaîne alimentaire et Environnement(2007). Note du 19 juillet 2007 de Christiaan Decoster concernant l’arrêté royal du 26 avril 2007 et l’arrêté royal du 19 juin 2007. Consulté le 18/02/2019 via https://overlegorganen.gezondheid.belgie.be/sites/default/files/documents/belgische_commissie_voor_de_coordinatie_van_het_antibioticabeleid/15174562.pdf
• Service public fédéral Santé publique, Sécurité de la Chaîne alimentaire et Environnement: Comptabilité des Hôpitaux. (2017). Vue d’ensemble données générales hôpitaux 2016. Bruxelles: SPF.
• Improving Patient Safety in Europe (2008). European Core Curriculum for training for Infection Control Practitioners. Lyon: IPSE.
• Morrison J. (2004). Development of a resource model for infection prevention and control programs in acute, long term, and home care settings: conference proceedings of the Infection Prevention and Control Alliance. American Journal of Infection Control, February, 32(1):2-6.
• O’Boyle C, Jackson M. & .Henly S.J. (2002). Staffing requirements for infection control programs in US health care facilities: Delphi project. American Journal of Infection Control, Volume 30, Issue 6, October, 321-333.
• van den Broek P.J., Kluytmans J.A.J.W., Ummels L.C., Voss A. & Vandenbroucke-Grauls C.M.J.E. (2007). How many infection control staff do we need in hospitals? Journal of Hospital Infection, Volume 65, Issue 2, February, Pages 108-111.
• Velghe Y. (2014). La formation des référents en hygiène hospitalière au CHU Brugmann – Mise en place d’une démarche ou d’un levier de changement ? Noso-Info, vol . XVIII, nr 2 , 11-17.
• WIN, ABIHH, AUVB, SPF Santé publique et Okc (2017). Profil Belge de compétences professionnelles pour l’infirmier en hygiène hospitalière – Révision version 2012. Bruxelles.
• Institut Scientifique de Santé Publique (2018). INDICATEURS DE QUALITE EN HYGIENE HOSPITALIERE – Rapport annuel 2017- Données 2016. Bruxelles: WIV-ISP.











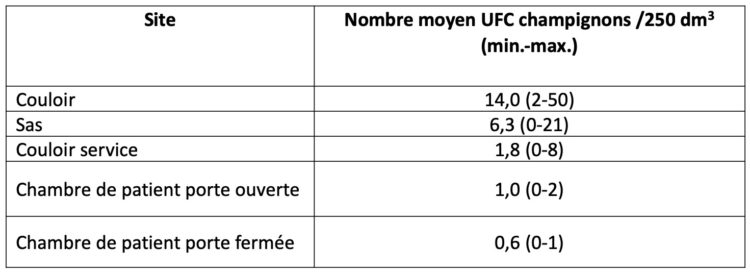
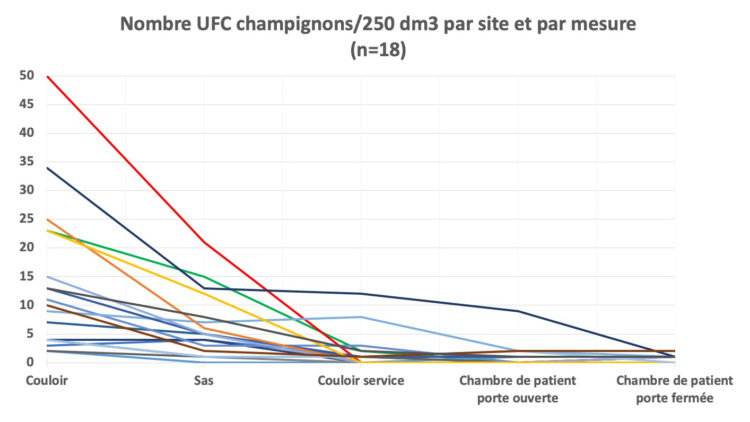
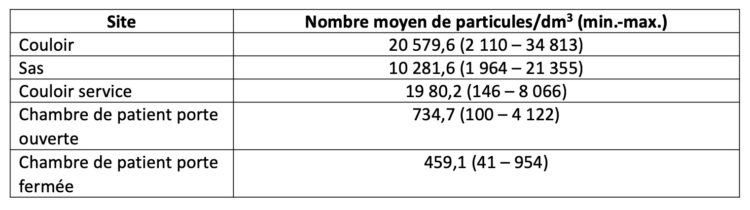
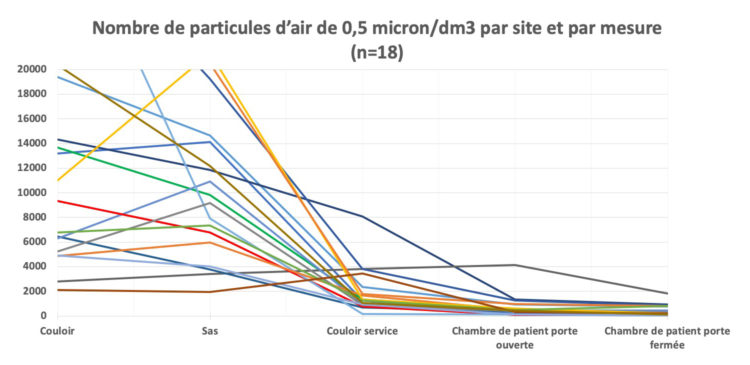
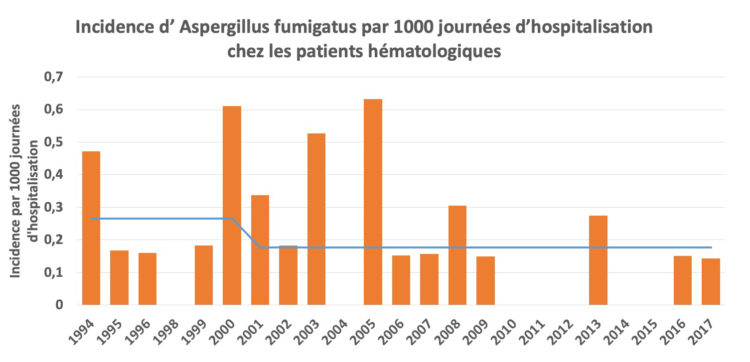
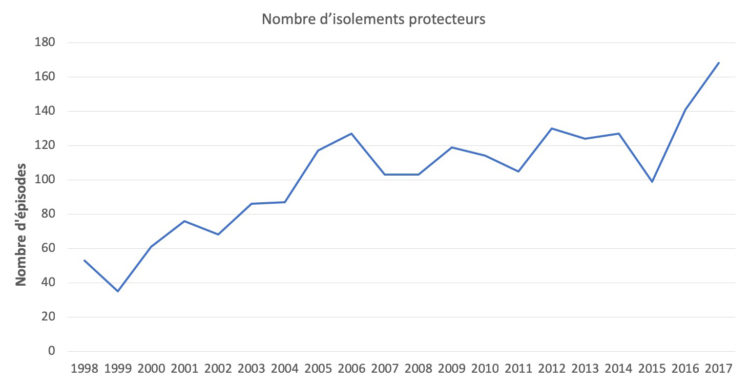
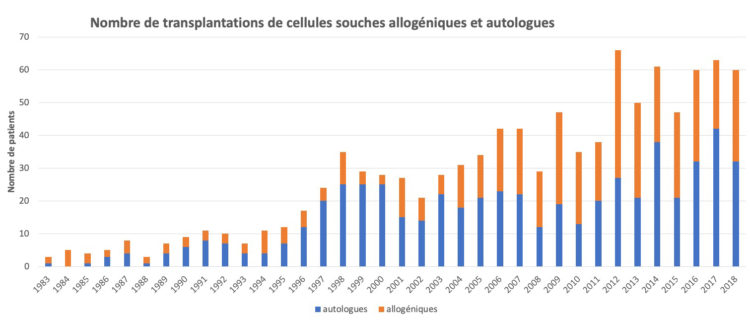



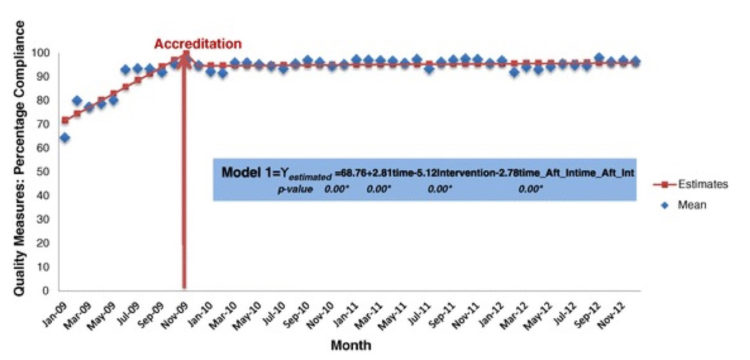
 Les hôpitaux flamands ont volontairement opté massivement pour l’accréditation par une organisation externe indépendante (JCI ou NIAZ). Au moyen de traceurs, les auditeurs examinent la façon dont les professionnels font leur travail en mettant notamment l’accent sur l’hygiène et la prévention des infections. Quiconque fournit à ces organismes une qualité démontrable n’a pas besoin que le gouvernement lui impose des contraintes administratives et réglementaires. L’accréditation n’est un but en soi pour aucun hôpital flamand. C’est juste un outil, un instrument pour fournir de bons soins.
Les hôpitaux flamands ont volontairement opté massivement pour l’accréditation par une organisation externe indépendante (JCI ou NIAZ). Au moyen de traceurs, les auditeurs examinent la façon dont les professionnels font leur travail en mettant notamment l’accent sur l’hygiène et la prévention des infections. Quiconque fournit à ces organismes une qualité démontrable n’a pas besoin que le gouvernement lui impose des contraintes administratives et réglementaires. L’accréditation n’est un but en soi pour aucun hôpital flamand. C’est juste un outil, un instrument pour fournir de bons soins.