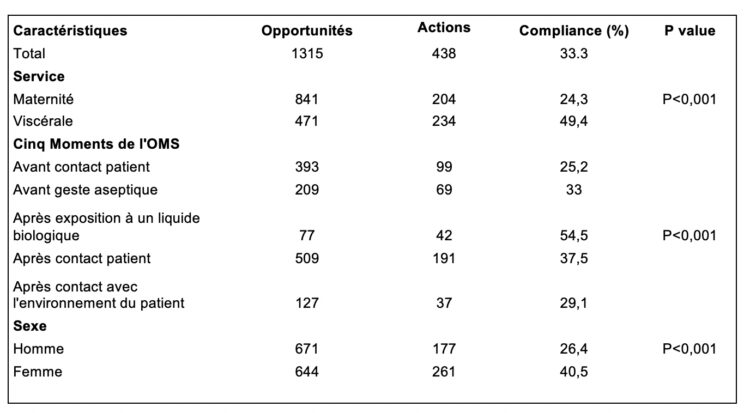
L’étude de F. Van Laer et coll. rapportée dans ce numéro de NOSO-Info est originale et innovante (assurément une première en Belgique !). Elle a en premier lieu le mérite de mettre en avant un bel exemple de collaboration pluridisciplinaire entre le laboratoire de microbiologie, les hygiénistes hospitaliers et les équipes soignantes de terrain.
L’évaluation porte sur une période de plusieurs années et les résultats suggèrent un impact très favorable de la toilette quotidienne à base de gants imprégnés de chlorhexidine à 2% sur l’incidence de certaines infections nosocomiales ainsi que sur l’écologie des résistances microbiennes chez les patients en soins intensifs (SI). Les diminutions observées de 50% des taux d’incidence des septicémies associées aux cathéters veineux centraux (CLABSI) et des germes multirésistants (MDRO) après intervention par rapport à la situation de base constituent un résultat spectaculaire. Cependant, comme les auteurs eux-mêmes le soulignent, ces résultats ne permettent pas de conclure à l’existence d’un lien direct de causalité entre l’instauration de la toilette à la chlorhexidine et l’amélioration des deux indicateurs précités.
Malgré les nombreuses études publiées dans la littérature internationale depuis plus de 10 ans, la toilette sans eau reste encore très peu appliquée compte tenu du doute qui subsiste quant aux bénéfices apportés par son utilisation. Force est de constater aussi que cette pratique n’a pas encore atteint un niveau élevé d’acceptation et que pour bon nombre de soignants la toilette des patients au bassin avec de l’eau et du savon reste encore la référence. Par ailleurs, on ne sait toujours que très peu de choses sur les risques d’effets indésirables liés à l’utilisation à large échelle de la chlorhexidine (développement de réactions cutanées, modifications de la composition du microbiote de la peau et des muqueuses, développement de résistances bactériennes aux antiseptiques mais également aux antibiotiques…).
Bien que la chlorhexidine soit un produit antiseptique et désinfectant largement utilisé, peu coûteux et globalement bien toléré, le surcoût engendré par son utilisation sous forme de gants de toilette imprégnés à usage unique, la nécessité d’acquisition de matériel supplémentaire pour cette pratique (p.ex: armoire de préchauffage), l’existence de formes commerciales multiples disponibles en conditionnements pré-emballées devraient également être pris en considération dans la décision de leur introduction dans les protocoles de soins et doivent aussi faire l’objet d’évaluations approfondies au niveau local.
Ci-après quelques considérations qui mettent en lumière les lacunes et les nombreuses zones d’incertitudes qui doivent encore être levées avant une éventuelle généralisation de la recommandation de cette pratique de soins.
Les études publiées différent fortement les unes des autres et il est dès lors difficile de les comparer et de tirer des conclusions univoques en termes d’efficacité et de rapport coût/bénéfice. Ces différences concernent à la fois les contextes cliniques (étude locale vs multicentrique), les unités et services (médicaux, chirurgicaux, unités mixtes, etc.…), les profils (case-mix) des patients, ou encore les paramètres d’intérêt ciblés (p.ex: septicémies nosocomiales de toute origine (HA-BSI), septicémies associées aux cathéters veineux centraux (CLABSI), pneumonies associées à la ventilation mécanique chez les patients intubés (VAP), infections des voies urinaires associées aux cathéters (C-AUTI), ,… ).
Les taux d’infections de base (c’est à dire avant l’introduction de la chlorhexidine), la durée des études (de quelques semaines à plusieurs années) et donc les nombres d’événements d’intérêt rencontrés divergent aussi très fortement. Les nombres de journées d’hospitalisation à risque d’infection sont très souvent manquantes. Enfin, l’évaluation de l’impact de la toilette à la chlorhexidine sur la durée du séjour aux SI, la durée totale du séjour à l’hôpital ou sur la mortalité des patients en cours d’hospitalisation ne sont que très rarement mesurés et rapportés.
Le design des études publiées diverge aussi très fortement et les biais de publication (ou de non publication) sont nombreux. Les méta-analyses ne reprennent que les essais cliniques comparatifs randomisés et contrôlés (randomized controlled trials) ou encore les essais cliniques randomisés croisés en grappe (cross-over, cluster randomized trials). Par contre, les études observationnelles sans groupe contrôle ne sont pas retenues car elle sont trop hétérogènes et sujettes à de nombreuses variations. Le plus souvent ce sont cependant des études de type ‘avant-après’ comme celle de l’UZA qui montrent un effet favorable de l’utilisation des gants de toilette à la chlorhexidine sur la réduction des taux de certaines infections nosocomiales (HA-BSI, CLABSI). Par contre, les essais cliniques randomisés susmentionnés ne montrent aucun effet significatif lorsque considérés isolément car ils n’atteignent généralement pas la taille et la puissance statistique suffisante.
En ce qui concerne les germes multi-résistants, ce sont en priorité les MRSA, les VRE et les entérobactéries productrices de BLSE (parfois Clostridium difficile) qui ont fait l’objet d’investigations. Par contre, les CPE (Entérobactéries productrices de carbapénémases) ainsi que d’autres bactéries à Gram-négatif multi-résistantes comme Pseudomonas aeruginosa ou Acinetobacter spp. ne sont quasiment jamais ciblées. Ce manque de prise en compte est étonnant compte tenu de leur implication fréquente dans les infections nosocomiales contractées en soins intensifs et des nombreuses sources et réservoirs (notamment hydriques) qui leur sont associées.
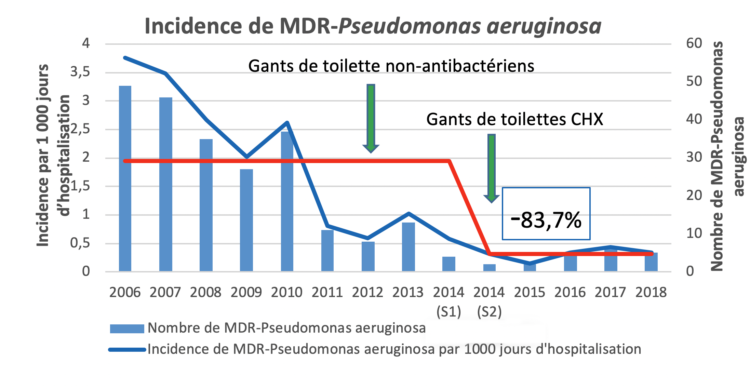
La diminution importante de l’incidence des P. aeruginosa multi-résistants observée dans l’étude de l’UZA pourrait accréditer l’hypothèse que la toilette sans eau à l’aide de gants de toilettes imprégnés de chlorhexidine diminuerait les risques d’acquisition de ces bactéries en réduisant la fréquence des contacts des patients avec l’eau du réseau de distribution dans le cadre des procédures de soins journaliers. Cependant il est très vraisemblable que des modifications d’autres variables (non évaluées dans l’étude) aient aussi pu être introduites au fil du temps (p.ex : systématisation du dépistage à l’admission dans l’unité et isolement précoce des patients porteurs de bactéries multi-résistantes, meilleure maitrise des risques microbiologiques de l’environnement, amélioration de la qualité de la prescription des antibiotiques chez les patients hospitalisés suite à la mise en œuvre des groupes de gestion de l’antibiothérapie,….) et que celles-ci puissent aussi avoir contribué à cet impact favorable sur l’écologie des Pseudomonas aeruginosa multi-résistants au sein des unités de SI.
Trois méta-analyses récentes (Alonso et al., 2016; Frost er al. 2018; Lewis et al. 2019) ont apportées des informations intéressantes. La revue d’Alonso qui incluait quatre études randomisées croisées (près de 23,000 patients dans 25 unités de SI dans plusieurs pays en Europe) avait un degré d’hétérogénéité acceptable (pour les études retenues) et montrait une réduction d’incidence de 26% des septicémies nosocomiales (HA-BSI). Une sous-analyse a identifié que c’était surtout le taux d’incidence des septicémies sur cathéter central (CLABSI) qui était diminué (-50%) mais que cette réduction n’était observée que pour les seules bactéries à Gram-positif (-55%) sans modification aucune du taux d’incidence des septicémies causées par des bactéries à Gram-négatif, suggérant ainsi un effet bénéfique de la chlorhexidine sur la prévention des HA-BSI et des CLABSI par l’intermédiaire d’une réduction des bactéries à Gram-positif de la flore commensale. Les résultats montraient également une variation importante selon les centres en fonction de la qualité de “l’hygiène de base”, les différences d’impact étant significativement moindres dans les unités de SI lorsque les taux de base des HA-BSI et de CLABSI étaient déjà bas avant introduction de la chlorhexidine dans la toilette quotidienne des patients.
La méta-analyse rapportée par Frost et al. incluait cinq essais cliniques randomisés (trois essais randomisés contrôlés et deux études randomisées croisées en grappe). Elle portait sur plus de 17,000 patients hospitalisés en unité de SI (>50 unités, dans une dizaine de pays) et elle excluait les populations non-adultes (SI pédiatriques) ne tenant compte par ailleurs que des nombres de journées à risque d’infection. Etaient également exclues toutes les études où des interventions autres que l’introduction de chlorhexidine étaient réalisées.
Les principaux résultats d’intérêt analysés étaient:
1) les septicémies (HA et non-HA BSI);
2) les septicémies associées aux cathéters centraux (CLABSI);
3) les taux de colonisation/infection par MDRO (essentiellement MRSA, VRE, +/-Clostridium difficile avec peu/pas de données renseignées concernant les MDRO à gram-négatif);
4) les pneumonies associées à la ventilation artificielle (VAP);
5) les infections des voies urinaires associées aux cathéters (CAUTI).
Pour les BSI et CLABSI, les réductions d’incidence après introduction de la chlorhexidine étaient respectivement de 29% et de 40% , avec une incidence de base durant la période contrôle de 6 BSI/1000 jours et de 3 CLABSI/1000 jours de séjour en SI. Pour les MDRO une diminution globale d’incidence de 18% était observée dans la période chlorhexidine (avec une incidence de base de 6 MDRO/1000 jours de SI). Aucune réduction n’était par contre observée pour les VAP ni pour les C-AUTI. Globalement, les auteurs concluaient à l’incertitude du bénéfice de la chlorhexidine par rapport à une toilette standard et à l’impossibilité de généraliser les recommandations de son utilisation sur base des données existantes.
L’accent était mis en particulier sur la nécessité de réaliser des études complémentaires de taille et de puissance suffisante afin d’éviter des erreurs de type I (non détection d’une différence réelle), et sur la nécessité d’inclure des groupes plus homogènes (SI médicaux chirurgicaux ou trauma) et d’étudier des facteurs de risque individuels permettant d’identifier d’éventuels groupes/types de patients qui pourraient particulièrement bénéficier de la toilette à la chlorhexidine. Enfin le degré du taux d’observance, la fréquence de la toilette (quotidienne vs tous les deux jours), les effets éventuels liés à la concentration de chlorhexidine utilisée (2% vs 4%) et à la formulation (gants pré-imprégnés commerciaux prêts à l’emploi vs préparation extemporanée de la dilution de la solution par le personnel soignant au lit du patient) étaient quelques uns des multiples facteurs non adressés par les études dans cette revue.
La méta-analyse la plus récente de la Cochrane systematic review (Lewis et coll. 2019) incluait quant à elle huit études (quatre essais contrôlés randomisés sur plus de 1,500 patients et quatre études randomisés croisées en grappe comprenant 23 unités de SI randomisées avec un total de plus de 23,000 patients. Ces séries comparaient l’utilisation de gants de toilette imprégnés de chlorhexidine à 2 % ou de solutions diluées de chlorhexidine à 4 % par rapport aux bains à l’eau savonneuse ou aux bains avec des gants de toilette non antimicrobiens. A l’aide d’une approche du niveau d’évidence (GRADE), la méta-analyse a montré un niveau de certitude faible ou très faible d’évidence selon les indicateurs et qui ne permettait aucune conclusion de l’effet de la chlorhexidine sur la réduction du taux d’infections nosocomiales, de la durée de séjour et de la mortalité des patients en SI. Bien que des réactions cutanées aient été rapportées comme possible effet indésirable dans cinq des huit études, le rapportage était le plus souvent insuffisamment précis et ne permettait pas d’attribuer la responsabilité de celles-ci à la chlorhexidine.
En conclusion, il est important que d’autres études soient réalisées afin de tenter de reproduire ces résultats dans des contextes locaux différents. La démarche de l’équipe de l’UZA ouvre la voie et devrait inciter d’autres équipes de soins à évaluer et préciser les bénéfices cliniques et économiques de la toilette à la chlorhexidine dans les hôpitaux belges. A terme, cette pratique de soins pourrait s’imposer comme un pilier majeur dans les stratégies de prévention des infections associées aux soins chez les patients à haut risque hospitalisés en unité de soins intensifs voire également dans des groupes de populations à risque hospitalisés dans d’autres types d’unités.
Références
– Alonso E, Blot K, Blot S. Prevention of hospital-acquired bloodstream infections through chlorhexidine gluconate-impregnated washcloth bathing in intensive care units: a systematic review and meta-analysis of randomised crossover trials. Eurosurveillance 2016 ; 21(46) : pii=30400. DOI: http://dx.doi.org/10.2807/1560-7917.
– Frost SA, Hou YC, Lombardo L, Metcalfe L, Lynch JM, Hunt L, Alexandrou E, Brennan K, Saxnchez D, Aneman A, Christensen M. Evidence for the effectiveness of chlorhexidine bathing and health care-associated infections among adult intensive care patients: a trial sequential meta-analysis.BMC Infectious Diseases, 2018, 18 : 679-89.
– Lewis SR, Schofield-Robinson OJ, Rhodes S, Smith AF. Chlorhexidine bathing of the critically ill for the prvention of hospital-acquired infection. Cochrane Systematic Review – Intervention Version published: 30 August 2019
– https://doi.org/10.1002/14651858.CD012248.pub2





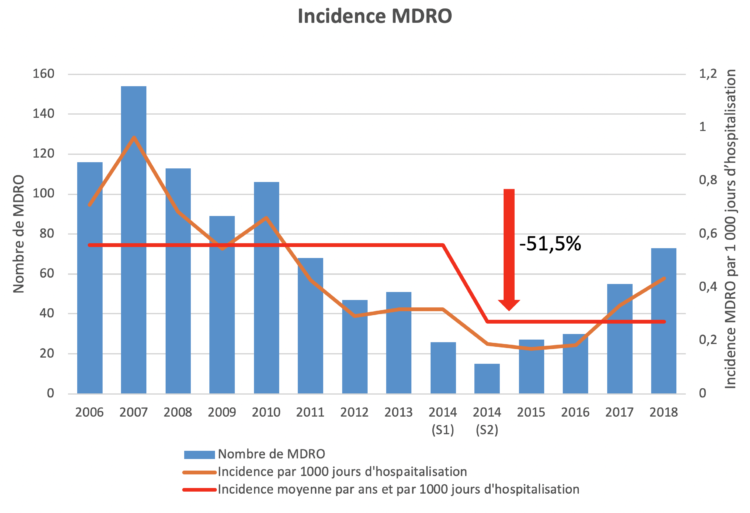
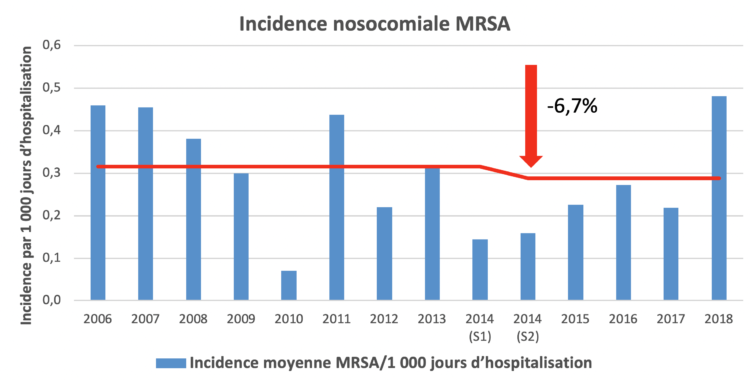 (S1) = premier semestre ; (S2) = deuxième semestre
(S1) = premier semestre ; (S2) = deuxième semestre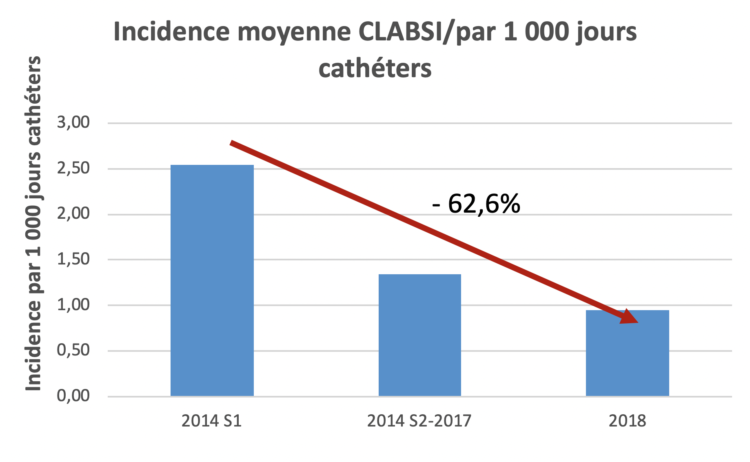 TXT(S1) = premier semestre ; (S2) = deuxième semestre
TXT(S1) = premier semestre ; (S2) = deuxième semestre