CET ARTICLE EST PUBLIÉ AVEC L’AUTORISATION DE L’AUTEUR ET DU RÉDACTEUR EN CHEF DE LA REVUE HYGIÈNES

Le risque d’infection du site opératoire (ISO) dépend de la quantité de bactéries contaminantes (inoculum), de la virulence du germe impliqué, des défenses du patient, de la présence au site opératoire d’antibiotiques donnés en prophylaxie, et de l’importance des dégâts tissulaires liés à l’intervention. Le risque de contamination peropératoire est majeur en chirurgie propre, principalement dû à la stérilité du site abordé, à la large incision cutanée, ainsi qu’à l’implantation de maté-riel (réduisant de près de 1 000 fois l’inoculum nécessaire à l’infection). Les micro-organismes proviennent soit de la flore du patient : c’est l’origine endogène (flore cutanée ou digestive), soit de l’environnement chirurgical (personnel, matériel, etc.) pour l’origine exogène. Cette dernière source est importante à considérer en chirurgie « propre » avec incision cutanée, comme la chirurgie orthopédique prothétique.
En dehors de toute activité (debout ou assis), l’homme émet près de 100 000 particules par minute dans l’air, ce nombre pouvant monter jusqu’à 30 000 000 de particules lors d’exercice physique. L’étude de l’air en salle d’intervention durant des gestes de chirurgie cardiaque et orthopédique a permis d’établir une corrélation significative entre les comptes particulaires et l’aérobiocontamination [1]. En d’autres termes, les particules émises dans l’air par l’homme sont pour partie des micro-organismes vivants. La desquamation de la peau du personnel représente une quantité importante de cellules porteuses de micro-organismes diffusées dans l’air et qui sont autant de sources de contamination de la plaie [2-5]. Une série d’études, menée par Tammelin et al., recherchait l’origine des bactéries retrouvées dans la plaie opératoire à partir de prélèvements réalisés chez le personnel chirurgical, le patient, et l’air de la salle en chirurgie cardiaque [6,7]. L’épidémiologie moléculaire montrait une similarité entre les souches de Staphylococcus aureus isolées de l’air et celles de la plaie chirurgicale dans 2/19 plaies positives à S. aureus. Les auteurs émettaient l’hypothèse d’une transmission aéroportée pour ces deux patients. Malgré l’absence d’évidence formelle, la voie aéroportée pourrait constituer une voie non négligeable de colonisation de la plaie opératoire.
Polémique américaine sur la coiffe chirurgicale : une histoire à rebondissements
La tenue du personnel est un sujet récurrent de maîtrise de l’environnement au bloc opératoire. Ce domaine n’a pas généré de réel intérêt scientifique pendant de nombreuses années. Malgré cela, des débats passionnés existent autour du type de coiffe chirurgicale, de sa forme, de sa couleur, de sa composition, basés principalement sur des critères esthétiques. De nombreuses coiffes sont disponibles à l’heure actuelle (charlotte, coiffe, cagoule), de matériaux différents et de couleurs ou motifs différents (Figure 1).
En 2016, l’Association américaine des infirmiers(e)s de bloc opératoire (AORN, Association of periOperative Registered Nurses) a publié des recommandations sur la tenue au bloc opératoire [8]. Dans ce document, le personnel de bloc opératoire devait porter : une veste à manches longues recouvrant les bras, et une coiffe ou « couvre-chef » couvrant la tête, les cheveux, et les oreilles. De la même manière, il était recommandé de couvrir les poils du visage (la barbe) et la nuque. Ces mesures, notamment la coiffe recouvrant les cheveux et les oreilles, ont généré une large controverse, par l’interprétation (implicite à la lecture de la recommandation) de la nécessité du port de charlotte par le personnel sur le champ opératoire, abolissant le port du rituel calot par les chirurgiens. Le réservoir important de contamination représenté par les oreilles, qui comportent plus de bactéries que le front, était l’argument évoqué.
Ces recommandations de l’AORN ont été utilisées lors d’inspections d’hôpitaux américains. Des commentaires, voire des réprimandes, ont alors été émis sur le port inadapté de la coiffe par les chirurgiens, qui ne couvrait pas l’intégralité des cheveux autour des oreilles et de la barbe pendant l’opération. Il s’est ensuivi un débat passionné du collège des chirurgiens américains contre les recommandations de l’AORN, allant jusqu’à la médiatisation du sujet [9]. L’American College of Surgeons (ACS) a alors rédigé et publié ses propres recommandations sur le sujet, basées sur « le professionnalisme, le bon sens, et les preuves disponibles », laissant le choix du port du calot par les chirurgiens [10]. La coiffe constituait pour eux un symbole de la profession chirurgicale. La chaleur, l’inconfort procuré, ainsi que des irritations au contact de l’élastique étaient des arguments complémentaires contre la charlotte. L’AORN a alors riposté par une campagne de communication réfutant point par point les recommandations de l’ACS. Il était notamment dit que : « Porter une coiffe en raison de son symbolisme n’était pas fondé sur des preuves et ne devrait pas servir de base à une recommandation de pratique à l’échelle nationale ». Un responsable fédéral déclarait alors que l’agence Medicare (système d’assurance santé géré par le gouvernement fédéral des États-Unis) ne validerait les recommandations de l’AORN qu’après une analyse rigoureuse de l’évidence disponible sur le sujet. Force est de constater que, jusqu’en 2017, les revues de littérature dans le domaine montraient peu ou pas d’évidence sur l’impact de la coiffe pour la prévention des ISO. Cet épisode a alors déclenché la réalisation d’une série d’études aux États-Unis sur les types de coiffes (principalement calot versus charlotte) et leur impact sur le risque infectieux, dont nous décrivons les résultats ci-après.

Retombées de la controverse : de l’absence de données à une série d’études
Les recommandations 2016 de l’AORN portant sur la cou-verture intégrale des cheveux, des oreilles et de la barbe se basaient principalement sur deux études [8]. L’une datant de 1965, étude rétrospective, comparant des bactéries isolées des narines et des cheveux de membres du personnel hospitalier et de patients. Cette étude a identifié les cheveux comme un réservoir de staphylocoques, sans identification d’un lien de causalité avec l’ISO [11]. Une seconde étude, monocentrique et datant de 1973, incluait une série de 11 patients et décrivait une épidémie d’ISO dont l’origine semblait être les cheveux d’un seul chirurgien, dans lesquels une bactérie identique était retrouvée [12]. Ces études ne discutaient pas la coiffe portée par l’opérateur et les professionnels de manière générale.
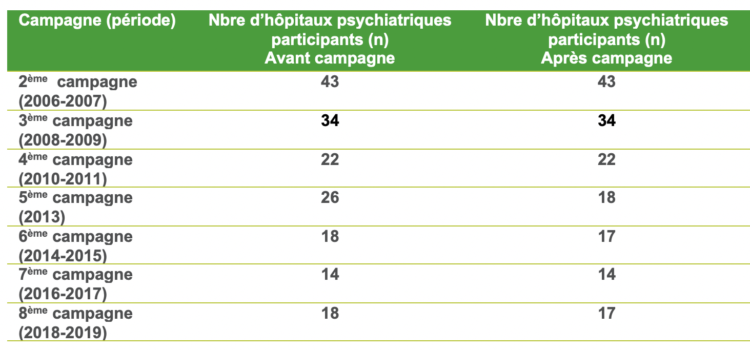
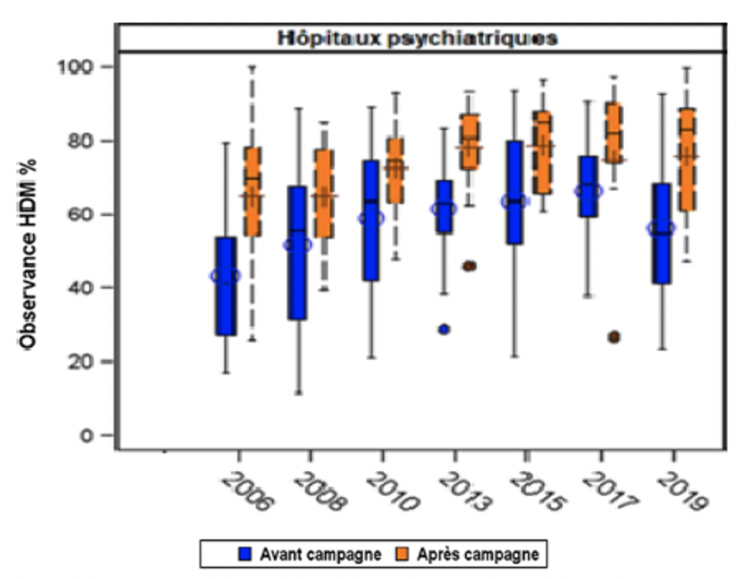
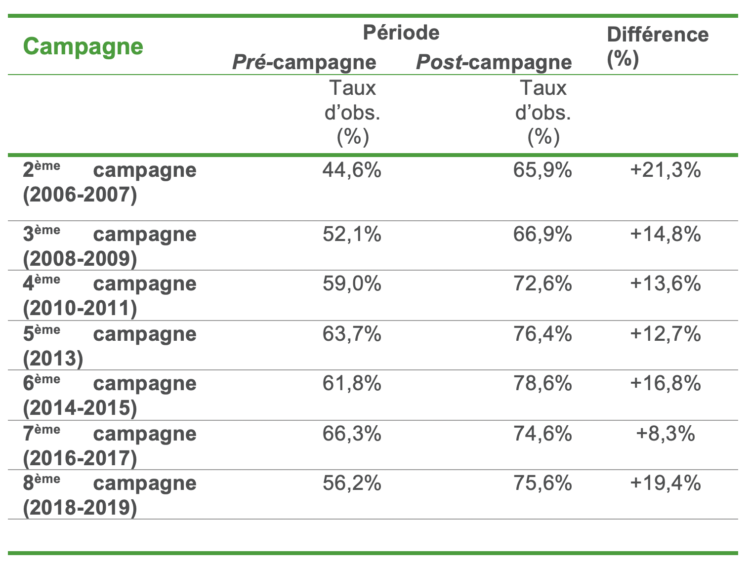
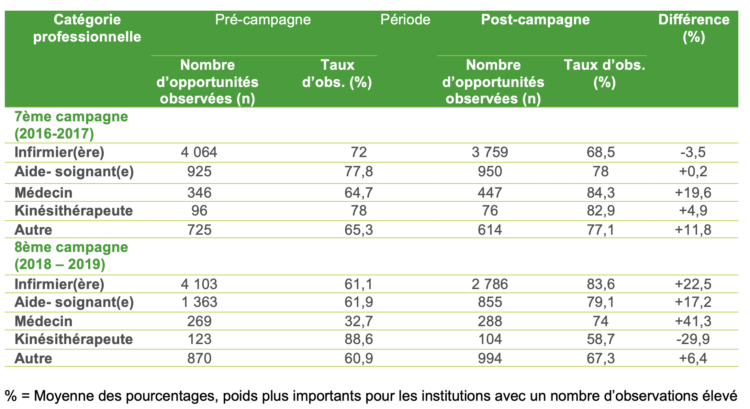
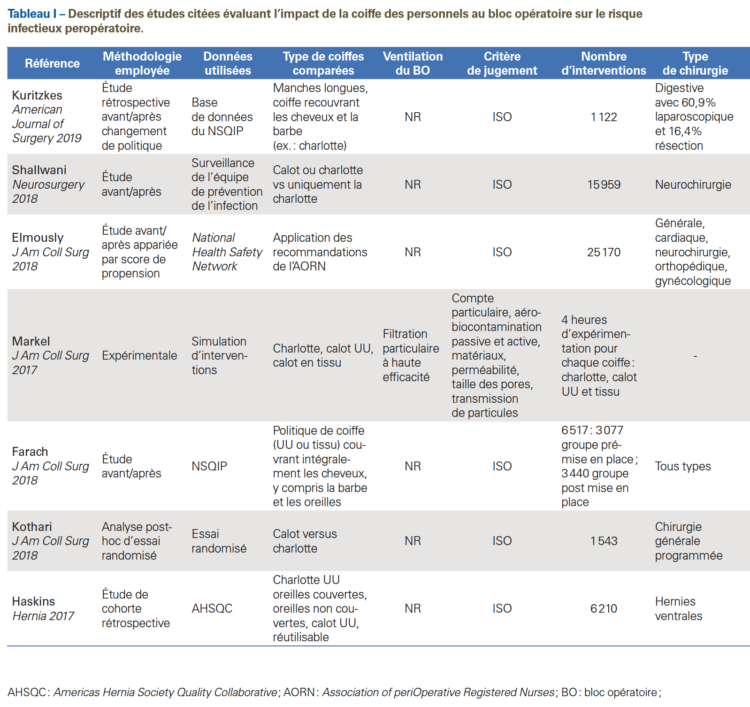
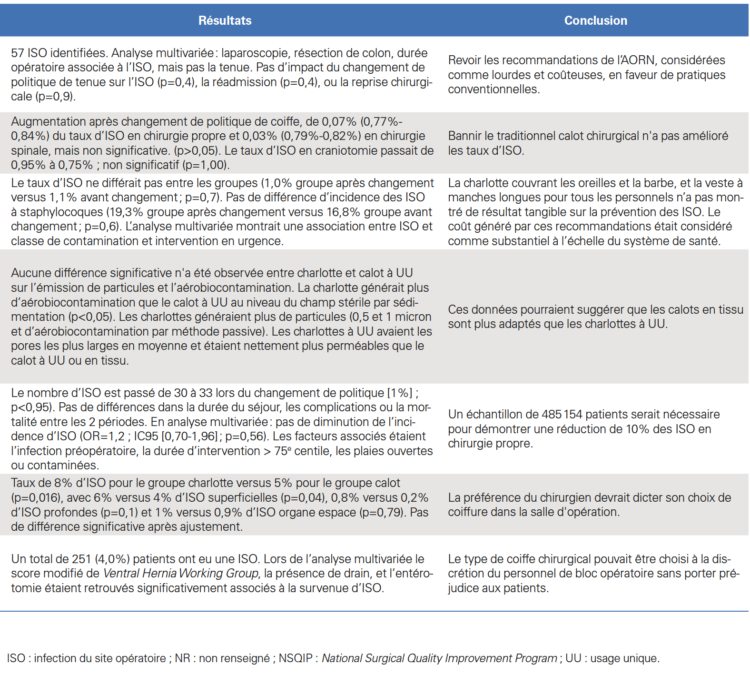
Suite à la controverse entre les infirmiers et les chirurgiens aux États-Unis, plusieurs études ont alors été menées, principalement rétrospectives ou quasi expérimentales, de manière à établir une évidence dans ce domaine (Tableau I). Une première étude avant/après a été menée de 2014 à 2016 en neurochirurgie, sur des gestes de classe I d’Althemeier dans un hôpital newyorkais. Elle consistait en la comparaison des taux d’ISO obtenus entre deux périodes de 13 mois : l’une permettant le port de calot ou de charlotte, et la seconde avec port uniquement de la charlotte (port du calot interdit). Près de 16 000 interventions étaient incluses dans l’analyse, avec des taux d’ISO respectivement de 0,77% durant la période permettant le port du calot versus 0,84% durant la période « uniquement charlotte » avec une différence non significative (p=0,63). Le design quasi expérimental (avant/après) était une limite majeure de cette étude, du fait de l’absence d’ajustement sur les potentiels facteurs confondants [13].
Une seconde étude a investigué le degré de contamina-tion aérienne lors du port des différents types de coiffes. La charlotte était comparée au calot en nontissé et au calot en tissu. Cinq personnes (dont des chirurgiens et des infirmiers de bloc opératoire diplômés d’État [Ibode]), dans des salles avec filtration particulaire de haut niveau, ont simulé une intervention pendant une heure avec éva-luation de la contamination particulaire et microbienne. Des tests de perméabilité, pénétration, porosité, épaisseur et microscopie des fibres étaient également réalisés. La seule différence de contamination particulaire de l’air de la salle était observée pour le port de la charlotte, significativement supérieure par rapport au calot en tissu. La contamination microbiologique était systématiquement inférieure pour les deux types de calot en comparaison avec la charlotte. Ces résultats étaient confortés par des tests de pénétration et de perméabilité défavorables pour la charlotte. Nous pondérons l’interprétation des données par le fait qu’il s’agit d’une étude in vitro dont la méthodologie est discutable [14].
Par la suite, deux études ont analysé de manière rétros-pective les données collectées de manière routinière par des sociétés de chirurgie. La première, réalisée dans deux hôpitaux américains, a évalué la régulation stricte de la tenue, en incluant la couverture intégrale des cheveux, barbe, oreille et bijoux. L’un des deux hôpitaux a mené des formations associées à des affichages, et mis en place une check-list
« go/no go » portant sur la coiffe. Le second hôpital, quant à lui, a effectué des formations et des affichages seuls. La mise en œuvre de la stratégie renforcée sur le port de la coiffe n’était pas associée à une baisse du taux d’ISO superficielles (OR : 1,2 ; IC95 [0,7-1,96] ; p=0,56) [15]. Cette régression logistique multivariée incluait près de 6 000 patients. La seconde étude reposait sur les données de l’Americas Hernia Society Quality Collaborative (AHSQC), registre national d’amélioration continue de la qualité des soins de hernie [16]. Ce registre intègre les données pré, per et postopératoires jusqu’à 30 jours. Les pratiques de 170 chirurgiens exerçant dans des contextes variables ont été collectées. Une enquête sur la longueur des cheveux, le port de la barbe et le port de la coiffe (six options différentes, Figure 1) a été envoyée à 86 de ces chirurgiens, parmi lesquels 68 (79,1%) ont répondu. Trente et un chirurgiens (45,6%) ont déclaré porter un calot à usage unique, six (8,9%) ont déclaré porter un calot en tissu, 20 (29,4%) une charlotte à usage unique avec leurs oreilles non couvertes, et onze (16,1%) ont déclaré porter une charlotte à usage unique avec les oreilles couvertes. Un total de 6 210 hernies ventrales opérées par les 68 chirurgiens participants ont été incluses dans l’analyse, et 251 (4,0%) ISO ont été identifiées. Lors de l’analyse multivariée, le score modifié VHWG (Ventral Hernia Working Group), la présence de drain et l’entérotomie étaient retrouvés comme significativement associés à la survenue d’ISO. Plusieurs comparaisons ont été faites entre les différents types de coiffes et leur impact sur le taux d’ISO, et aucune association significative n’a été observée. Les auteurs concluaient au fait que le type de coiffe chirurgical pouvait être choisi à la discrétion du personnel de bloc opératoire sans porter préjudice aux patients.
En 2016, un hôpital américain a mis en œuvre les recom-mandations de l’AORN dans ses blocs opératoires [17]. La politique instituée reposait sur la couverture de l’ensemble des cheveux et poils par la coiffe, les bras devant être recouverts par une veste à manches longues. Après analyse des données du National Health Safety Network (NHSN), les taux d’ISO avant et après le changement de politique ont été calculés pour 30 493 interventions de neurochirurgie et de chirurgies générale, cardiaque, orthopédique et gynécologique. La comparaison avant/après a été réalisée par appariement 1:1 sur un score de propension. 12 585 paires d’interventions appariées ont été incluses, représentant un total de 25 170 patients. Les taux d’ISO ne différaient pas entre les deux groupes (1,0% groupe politique AORN versus 1,1% avant chan-gement ; p=0,7). Il n’y avait pas de différence dans l’inci-dence des ISO à staphylocoques (19,3% groupe politique AORN versus 16,8% avant changement ; p=0,6). L’analyse multivariée retrouvait la classe de contamination de la plaie et les interventions en urgence comme facteurs prédictifs d’ISO. Le coût de la tenue vestimentaire pour une personne entrant dans la salle d’opération était compris entre 0,07$ et 0,12$ avant le changement de politique, et 1,11$ à 1,38$ après le changement de politique. Les vestes à manches longues obligatoires en salle d’opération étaient associées à un coût supplémentaire de 1 128 078$ par an, ce qui représentait environ 540 millions de dollars par an pour tous les hôpitaux américains combinés. Des représentants de l’AORN ont alors écrit à l’éditeur pour préciser certains points évoqués dans l’article d’Elmously et al. [18]. Selon Spruce, l’AORN ne spécifie pas dans ses recommandations le type ou le style de coiffe qui devrait être porté : « Une coiffe ou une cagoule propre qui limite tous les cheveux et couvre complètement les oreilles, la peau du cuir chevelu, les favoris, et la nuque devrait être portée. » Par ailleurs, il était précisé que les recommandations avaient été rédigées sans la collaboration des chirurgiens et des différentes sociétés savantes américaines du domaine, sur la base d’une revue systématique de la littérature. Enfin, le port d’une coiffe à usage unique pour recouvrir les coiffes réutilisables en tissu n’a pas été recommandé par l’AORN. Basée sur la même méthodologie, une étude monocentrique a analysé l’effet de la nouvelle réglementation vestimentaire de l’Agency for Healthcare Research and Quality (AHRQ), sur l’incidence des ISO en chirurgie abdominale [19]. 1 122 patients (dont 60,9% de procédures de laparoscopie et 16,4% de résection de l’intestin) ont été inclus, dont 515 avant et 607 après la mise en œuvre des recommandations ; les cohortes étaient similaires en matière de facteurs de risque d’ISO. Cinquante sept patients en ont développé une. L’analyse multivariée retrouvait la laparoscopie, la résection intestinale et la durée d’intervention comme variables associées à l’ISO, mais pas la tenue vestimentaire. La tenue n’était pas significativement associée à l’ISO (p=0,4), à la réadmission (p=0,4) ou à la reprise chirurgicale (p=0,9).
Enfin, les données d’un essai randomisé prospectif, pré-cédemment publié, sur l’impact de la dépilation sur les ISO ont été analysées [20]. Les patients ont été regroupés, selon le choix de coiffe des chirurgiens, en groupes charlotte ou calot. Un total de 1 543 patients a été inclus dans l’analyse. Les chirurgiens présents portaient une charlotte dans 39% des interventions et un calot dans 61%. Le taux d’ISO global était de 8% dans le groupe charlotte versus 5% dans le groupe calot (p=0,016), avec respectivement 6% des ISO contre 4% classées comme superficielles (p=0,041), 0,8% des ISO contre 0,2% classées comme profondes (p=0,12), et 1% des ISO contre 0,9% classées comme infection d’organe ou de cavité (p=0,79). Lors de l’ajustement sur le type d’intervention, aucune différence entre les groupes charlotte versus calot n’était observée concernant les taux d’ISO. Des critiques ont été émises par Fujita et al. sur cette analyse posthoc manquant d’ajustement, notamment sur le score ASA (American Society of Anesthesiologists) ou sur la durée d’intervention [21]. En réponse, Kothari et al. ont fait tourner le modèle en incluant cette dernière variable, sans modification des résultats toujours non significatifs. À la suite des études récentes sur le sujet, l’ACS, l’ASA, l’AORN, l’Association for Professionals in Infection Control and Epidemiology (Apic), l’Association of Surgical Technologists (AST), le Council on Surgical and Perioperative Safety (CSPS) et le Joint action se sont réunis en février 2018 et, après avoir examiné l’évidence scienti-fique disponible, ont publié une déclaration selon laquelle « L’obligation de couvrir les oreilles n’était pas étayée par des preuves » et que « le domaine de la tenue chirurgicale nécessitait une évaluation plus poussée » [22,23].
Les recommandations françaises actuelles
La plupart des recommandations actuellement disponibles en France sur le sujet n’ont pas fait l’objet d’une gradation du niveau de preuve. Sans être opposables, les normes de la série EN 13 795 constituent un guide important pour l’évaluation de la performance des textiles utilisés en bloc opératoire et donc pour leur choix [24]. La tenue de bloc est définie par la norme comme : « Tenue destinée et ayant démontré son efficacité à réduire la contamination de la plaie opératoire par les squames porteuses d’agents infectieux provenant de la personne habillée de cette tenue via l’air de la salle d’opération, réduisant ainsi les risques d’infection de la plaie. » Selon les recommandations de la Société française d’hygiène hospitalière (SF2H) de 2005, la tenue du person-nel en salle d’opération doit être adaptée de manière à limiter la production et la diffusion de particules [25]. La nature des textiles et des non-tissés utilisés en bloc opératoire a un rôle dans l’aérobiocontamination (accord très fort). Enfin, il était recommandé de limiter la production et la dissémination de particules donnant naissance à des colonies par le port permanent d’une tenue spécifique du bloc opératoire, du calot couvrant la totalité des cheveux et d’un masque recouvrant le nez et la bouche (accord fort). En 2008, un guide, publié par le centre de coordination de la lutte contre les infections nosocomiales (CClin) Sud-Ouest, conseillait que la coiffe soit la plus couvrante possible, de type cagoule chirurgicale en non- tissé ou charlotte, les cheveux devant être complètement recouverts [26]. Enfin, en 2015, la SF2H recommandait de recouvrir complètement la chevelure et la barbe, à l’aide d’une cagoule ou d’une coiffe, à usage unique de préférence, pour éviter la contamination aérienne du fait de la desquamation [27]. L’évidence, cotée selon la méthode Grading of Recommendations Assessment, Development and Evaluation (Grade), était classée en B 2 (présomption scientifique), avec accord total du groupe d’experts. En définitive, la coiffe était assimilée aux résultats obtenus lors d’une étude comparant les tenues à usage unique et des tenues réutilisables. Les résultats de la seule étude (financée par un industriel) étaient à l’avantage des tenues à usage unique.
Le point de vue des auteurs
La série d’études publiées présente une avancée des connaissances dans le domaine. Elles concluent toutes à l’absence d’impact du changement de politique sur la coiffe au bloc opératoire. Il est cependant nécessaire de pondérer les résultats et les conclusions des auteurs. Tout d’abord, d’un point de vue méthodologique, les études présentées ci-avant pour l’évaluation de la coiffe au bloc opératoire sont discutables, tout comme les informations mises à disposition par les auteurs. Les travaux portent pour partie sur de la chirurgie digestive, dont l’origine des ISO est principalement endogène. Les analyses ne prennent pas en compte le type de ventilation des salles ; l’intégration du traitement d’air dans l’analyse est cependant cruciale dans l’évaluation du risque exogène d’ISO. La causalité entre le port de la coiffe et la survenue d’ISO est difficile à établir. Les études observationnelles, même prospectives, ne peuvent pas être adaptées à traiter cette question par manque de prise en compte des facteurs de confusion. Les études avant-après ne précisent pas toujours les pratiques dans le groupe « avant ». Ces études ont, pour la plupart, été menées par des chirurgiens en réaction aux recommandations de l’AORN, dans un climat de conflit interprofessionnel. Malgré l’intégrité scientifique indiscutable des auteurs, nous pouvons imaginer qu’un parti pris existe dans la manière de réaliser les études et d’en interpréter les résultats. Pour éviter ces potentiels biais, l’essai randomisé en grappe (cluster et ses variantes « cluster-cross-over », « stepped wedge ») représente le gold standard. Il convient également d’inclure suffisamment d’évènements (ISO) pour obtenir des statistiques significatives. La sélection des chirurgies et des interventions à inclure est un autre sujet. La coiffe est censée éviter une contamination peropératoire. La chirurgie propre avec incision cutanée est la plus perti-nente pour mener ce genre d’étude.
Mais a-t-on besoin d’une évidence scientifique dans le domaine ? La prévention des ISO est multimodale par essence, intégrant un ensemble de mesures de la manière la plus cohérente possible. Certaines ont fait l’objet de nombreuses études et méta-analyses, démontrant l’évidence de leur impact (ex. : antibioprophylaxie) ; d’autres, comme la tenue, ont été moins étudiées. Pour ce genre de mesures, dont l’impact peut théoriquement être considéré comme inférieur à d’autres (ex. : antibio-prophylaxie, normothermie et préparation cutanée de l’opéré), il est nécessaire de faire preuve de pragmatisme. Si des efforts sont à privilégier, ceux-ci doivent être portés sur l’observance des mesures à fort impact, tout en maintenant de la rigueur sur celles qui en ont moins. De manière pragmatique, nous pouvons penser, sans en avoir la preuve scientifique, qu’une coiffe recouvrant l’ensemble des cheveux des personnes en salle d’intervention sera plus efficace pour limiter l’émission de particules. Mais, dans l’état actuel des connaissances, aucun type de coiffe ne peut être privilégié. Concernant la matière composant les coiffes réutilisables, elle pourrait suivre les mêmes règles que celle des tuniques réutilisables, à savoir : être composée d’un mélange de polyester et coton (65% – 35%). Comme les tuniques réutilisables, les coiffes réutilisables pourraient être changées quotidiennement et chaque fois que nécessaire, et passer en lingerie quotidiennement (circuit de linge interne à la structure). Par ailleurs, le tissu se détériore au lavage, générant de la perméabilité et des émissions particulaires. Il convient donc de les renouveler régulièrement. L’usage unique requiert moins de contraintes que l’usage multiple et pourrait être privilégié pour cette raison.
Conclusion
La tenue au bloc opératoire touche à l’image des individus ainsi qu’à leur identité personnelle et professionnelle. Des aspects sociologiques sous-jacents sont importants à considérer. L’image de la fonction est influencée par des séries télévisées. Les signes de professionnalisme sont autant de facteurs psychosociologiques sous-jacents importants à considérer dans l’approche de ce domaine. Ils sont probablement également la cause de tant de discussions et de controverses. De la même façon d’ailleurs, la tenue professionnelle laissant découverts les avant-bras a fait aussi l’objet de débats aux États-Unis, où le port de chemises ou de blouses à manches longues (et même de la cravate) fait partie de l’image que souhaitent donner d’eux-mêmes une partie des membres du corps médical. La tenue au bloc opératoire nécessite de la rigueur, de la discipline et du pragmatisme. Son impact sur la prévention des ISO est probablement inférieur à d’autres mesures faisant l’objet d’une large évidence scientifique, dont l’observance reste trop faible à l’heure actuelle en chirurgie.
Références
1- Birgand G, Toupet G, Rukly S, et al. Air contamination for predicting wound contamination in clean surgery: A large multicenter study. Am J Infect Control 2015;43(5):516-521.
2- Mackintosh CA, Lidwell OM, Towers AG, et al. The dimensions of skin fragments dispersed into the air during activity. J Hyg (Lond) 1978;81(3):471-479.
3- Hambraeus A. Aerobiology in the operating room-a review. J Hosp Infect 1988;11 Suppl A:68-76.
4- Noble WC, Lidwell OM, Kingston D. The size distribution of air-borne particles carrying micro-organisms. J Hyg (Lond) 1963;61:385-391.
5- Verkkala K, Eklund A, Ojajärvi J, et al. The conventionally ventilated operating theatre and air contamination control during cardiac surgery-Bacteriological and particulate matter control garment options for low level contamination. Eur J Cardio-Thorac Surg Off J Eur Assoc Cardio-Thorac Surg 1998;14(2):206-210.
6- Tammelin A, Hambraeus A, Ståhle E. Routes and sources of Sta-phylococcus aureus transmitted to the surgical wound during cardio-thoracic surgery: possibility of preventing wound contamination by use of special scrub suits. Infect Control Hosp Epidemiol Off J Soc Hosp Epidemiol Am 2001;22(6):338-346.
7- Tammelin A, Hambraeus A, Ståhle E. Source and route of methi-cillin-resistant Staphylococcus epidermidis transmitted to the surgical wound during cardio-thoracic surgery. Possibility of preventing wound contamination by use of special scrub suits. J Hosp Infect 2001;47(4):266-276.
8- Association of periOperative Registered Nurses. AORN Guide-line for Surgical Attire [Internet]. 2017. Accessible à : https://www. aorn.org/about-aorn/aorn-newsroom/health-policy-news/2017-health-policy-news/aorn-guideline-for-surgical-attire (Consulté le 31-10-2019).
9- Liz Kowalczyk. No more caps for surgeons? [Internet]. Boston Accessible à : https://www.bostonglobe.com/business/2016/08/31/hat-wars-flaring/abr7FuB9EZna1FRtECDR1K/story.html (Consulté le 31-10-2019).
10- American College of Surgeons (ACS). Statement on Operating Room Attire [Internet]. 2016. Accessible à : https://www.facs.org/about-acs/statements/87-surgical-attire (Consulté le 31-10-2019).
11- Summers MM, Lynch PF, Black T. Hair as a reservoir of staphylo-cocci. J Clin Pathol 1965;18:13-15.
12- Dineen P, Drusin L. Epidemics of postoperative wound infec-tions associated with hair carriers. Lancet 1973;2(7839):115761159.
13- Shallwani H, Shakir HJ, Aldridge AM, et al. Mandatory change from surgical skull caps to bouffant caps among operating room personnel does not reduce surgical site infections in class I Surgical cases: a single-center experience with more than 15 000 patients. Neurosurgery 2018;82(4):548-554.
14- Markel TA, Gormley T, Greeley D, et al. Hats off: a study of dif-ferent operating room headgear assessed by environmental quality indicators. J Am Coll Surg 2017;225(5):573-581.
15- Farach SM, Kelly KN, Farkas RL, et al. Have recent modifications of operating room attire policies decreased surgical site infections? an american college of surgeons NSQIP review of 6,517 patients. J Am Coll Surg 2018;226(5):804-813.
16- Haskins IN, Prabhu AS, Krpata DM, et al. Is there an association between surgeon hat type and 30-day wound events following ven-tral hernia repair? Hernia J Hernias Abdom Wall Surg 2017;21(4):495-503.
17- Elmously A, Gray KD, Michelassi F, et al. Operating room attire policy and healthcare cost: favoring evidence over action for preven-tion of surgical site infections. J Am Coll Surg 2019;228(1):98-106.
18- Spruce L. Association of periOperative Registered Nurses clarifies position on surgical attire. J Am Coll Surg 2019;228(2):207-208.
19- Kuritzkes BA, Cao Y, Baser O, et al. New barrier attire regulations in the operating room: A mandate without basis? Am J Surg 2019;218(3):447-451.
20- Kothari SN, Anderson MJ, Borgert AJ, et al. Bouffant vs skull cap and impact on surgical site infection: does operating room headwear really matter? J Am Coll Surg 2018;227(2):198-202.
21- Fujita T. Evidence-based surgical attire. J Am Coll Surg 2018;227(4):475-476.
22- A statement from the Meeting of ACS, AORN, ASA, APIC, AST, and TJC. [Internet]. Accessible à : https://www.facs.org/about-acs/consensus-statements/or-attire (Consulté le 31-10-2019).
23- Moalem J, Markel TA, Plagenhoef J, et al. Proceedings and recommendations from the OR attire summit: A collaborative model for guideline development [Internet]. American College of Surgeons; 2019. Accessible à : http://bulletin.facs.org/2019/05/proceedings-and-recommendations-from-the-or-attire-summit-a-collaborative-model-for-guideline-development/ (Consulté le 31-10-2019).
24- Afnor. Vêtements et champs chirurgicaux – Exigences et méthodes d’essai – Partie 1 : champs et casaques chirurgicaux – Vêtements et champs chirurgicaux – Exigences et méthodes d’essai -Partie 1 : Champs et casaques chirurgicaux [Internet]. 2019. Accessible à : https://www.boutique.afnor.org/norme/pr-nf-en-13795-1/vetements-et-champs-chirurgicaux-exigences-et-methodes-d-essai-partie-1-champs-et-casaques-chirurgicaux/article/902403/fa177177 (Consulté le 31-10-2019).
25- Société francaise d’hygiène hospitalière. Groupe recommandations GR-AIR : l’air au bloc – Partiellement actualisé en 2015 [Internet]. 2005. Accessible à : https://sf2h.net/publications/groupe-recomman-dations-gr-air-lair-bloc-operatoire (Consulté le 31-10-2019).
26- Cclin Sud Ouest. Recommandations pour une tenue vestimentaire des personnels soignants adaptée à la maîtrise du risque infectieux [Internet]. 2008. Accessible à : http://nosobase.chu-lyon. fr/recommandations/cclin_arlin/cclinSudOuest/2008_personnel_ CCLIN.pdf (Consulté le 31-10-2019).
27- Société francaise d’hygiène hospitalière. Qualité de l’air au bloc opératoire et autres secteurs interventionnels [Internet]. 2015. Hygiènes 2015;(23)2:1-60. Accessible à : https://sf2h.net/wp-content/uploads/2015/05/SF2H_recommandations_qualite-de-l-air-au-bloc-operatoire-et-autres-secteurs-interventionnels-2015.pdf (Consulté le 31-10-2019).
Citation
Birgand G, Lucet JC, Beloeil H, Astruc K, Aho-Glélé LS. La coiffe au bloc opératoire : outil de prévention ou accessoire de mode ? Hygiènes 2019;27(5):269-276.
Historique
Reçu 24 octobre 2019 – Accepté 25 octobre 2019 – Publié 7 novembre 2019.
Financement : aucun déclaré.
Conflit potentiel d’intérêts : aucun déclaré.