Introduction
La gale est une dermatose contagieuse causée par l’acarien de la gale (Sarcoptes scabiei var hominis). Elle est connue comme l’une des affections dermatologiques les plus courantes dans les pays en voie de développement depuis plus de 100 ans et est endémique dans les pays tropicaux où les soins de santé sont peu accessibles. Ces dernières années, une augmentation de l’incidence a été observée dans la population générale en Europe, et donc également en Belgique (1-5).
On ne dispose pas de chiffres récents sur l’incidence de la gale en Belgique, car les cas individuels de gale ne doivent plus être déclarés depuis 2009. En raison de l’approche coordonnée qu’elle nécessite, la gale collective doit quant à elle être notifiée et se manifeste régulièrement dans les hôpitaux et les collectivités résidentielles telles que les centres de soins résidentiels, les institutions pour personnes handicapées, les foyers pour sans-abri, les prisons… (4).
La gale n’est pas une pathologie grave, mais en raison de la complexité de la maladie, elle peut avoir un impact négatif sur la qualité de vie, le travail et le sommeil. Elle peut également entrainer des problèmes psychosociaux chez les personnes infectées et chez les membres de leur famille. C’est pourquoi il est très important que des efforts soient faits dans les différents milieux concernés pour coordonner rapidement la prise en charge des cas individuels et des cas groupés
de gale (5).
Cet article décrit une épidémie de gale, occasionnée à partir d’un cas index de gale norvégienne (également connue sous le nom de gale croûteuse), dans deux services de gériatrie de l’hôpital général Vesalius (AZV) à Tongres. Les mesures de contrôle et de prévention prises sont également détaillées dans cet article.
Description de l’épidémie
Historique
L’AZV est un hôpital général de 326 lits agréés, dont 25 en Gériatrie B0 et 24 en Gériatrie C0. Avant l’épidémie décrite ci-après, seulement un cas isolé, sporadique de la variante classique de la gale avait été rapporté à l’AZV.
En novembre 2021, le service d’hygiène hospitalière a été informé du diagnostic de gale chez plusieurs infirmières à domicile qui s’occupaient d’un patient admis à l’hôpital. Ce patient de 86 ans avait été admis dans deux services gériatriques (B0 et C0) en octobre 2021 et était décédé après 24 jours d’hospitalisation. Ce patient présentait une pathologie oncologique et avait été diagnostiqué comme souffrant d’un syndrome paranéoplasique en raison de la présence de démangeaisons nocturnes, de desquamations et d’une hyperkératose cutanée (augmentation de la couche cornée de l’épiderme). Suite à la visite effectuée par le service d’hygiène hospitalière dans les deux services, ce diagnostic fut remis en question, car un cas de gale avait été diagnostiqué chez une infirmière quelques jours auparavant et plusieurs membres du personnel présentaient des symptômes de démangeaisons.
Après une brève revue de la littérature et prise de contact avec le gériatre traitant et l’Agentschap Zorg & Gezondheid, il a été conclu qu’il s’agissait d’un cas de gale norvégienne.
Évolution de l’épidémie et mesures prises
L’épidémie de gale a été identifiée du fait de l’augmentation rapide et inattendue du nombre de cas confirmés et du nombre de personnes symptomatiques ayant eu des contacts de soins avec le patient index. Afin d’avoir une approche systématique et coordonnée dans la gestion de cette épidémie, nous avons suivi le cheminement des recommandations du Centre de contrôle des maladies (CDC) et de l’Organisation mondiale de la santé (OMS) (6,7).
Étape 1 : confirmer l’existence d’une épidémie et identifier les personnes à risque
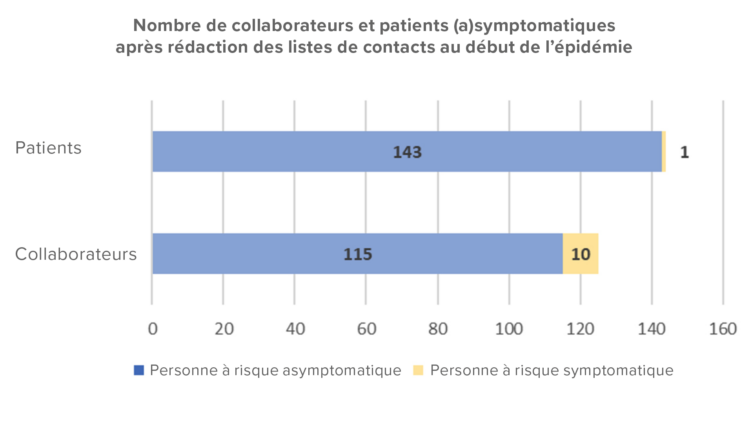
L’épidémie a été confirmée par le service d’hygiène hospitalière et la première étape a consisté à envoyer une communication écrite à la direction et aux chefs des services concernés. L’ensemble des membres du personnel travaillant dans les services infirmiers de gériatrie B0 et C0, incluant également le personnel paramédical, le personnel technique, les étudiants et le personnel des services d’urgence et d’imagerie médicale ayant été en contact avec le patient ont été identifiés comme personnes à risque (n=115). Toutes ces personnes ont été informées par écrit de la situation et ont été invitées à faire preuve d’une vigilance accrue. Une fois la liste des contacts dressée, 10 collaborateurs se sont révélés symptomatiques.
Les patients hospitalisés dans le service C0 ou B0 depuis l’admission du patient index (n=144) ont également été identifiés comme personnes à risque, étant donné que plusieurs membres du personnel étaient symptomatiques et qu’une transmission vers d’autres patients dans l’unité aurait pu avoir lieu par l’intermédiaire des vêtements de travail contaminés lors d’un contact direct avec le patient index qui avait nécessité beaucoup de soins. Un patient, transféré entre-temps dans un service de revalidation, présentait déjà des symptômes et a été soigné en isolement jusqu’à ce qu’il consulte un dermatologue.
Étape 2 : former une équipe de soutien aux épidémies
En raison de l’ampleur de l’épidémie et de la nécessité de faire intervenir des acteurs internes et externes avec des rôles et des responsabilités différents, une équipe de gestion de crise a été immédiatement constituée, composée du service d’hygiène de l’hôpital, de membres de la direction, des chefs de service et des gériatres des deux services, ainsi que du responsable des soins et de l’agence flamande pour les soins et la santé (Agentschap Zorg & Gezondheid).
Étape 3 : établir une définition de cas
Une définition de cas permet de classer les individus dans un contexte d’épidémie sur la base de critères cliniques, du temps, du lieu et de la personne. La plupart des définitions de cas tiennent compte d’une certaine incertitude en créant différentes catégories (6).
Tous les collaborateurs et patients ayant eu un contact fugace, prolongé ou fréquent avec le patient index ou avec son linge et tous les collaborateurs et patients ayant eu un contact prolongé ou fréquent avec un travailleur ayant présenté des symptômes de gale ont été classés comme cas possibles.
Tous les membres du personnel ainsi que les patients qui présentaient des symptômes de gale, mais n’avaient pas encore subi d’examen dermatologique ont été classés comme cas probables.
Un cas de gale était confirmé lorsque un diagnostic clinique était posé chez un membre du personnel ou chez un patient par un médecin généraliste, un dermatologue ou par tout autre médecin.
Étape 4 : recherche passive et active de cas
Afin d’identifier l’étendue de la propagation et de prendre les mesures nécessaires, des recherches passives et actives de cas doivent être effectuées (6,7).
Le service d’hygiène hospitalière a informé oralement et par écrit les infirmières, les médecins, le personnel paramédical, les lingères, logisticiens et agents d’entretien des deux services de gériatrie, aux urgences et au service d’imagerie médicale en les invitant à être vigilant sur l’apparition des symptômes de la gale. Un renforcement de la vigilance leur était également demandé en cas d’apparition de symptômes chez des patients nouvellement admis.
L’épidémie a également été notifiée auprès des partenaires extérieurs tels les centres de soins résidentiels et les hôpitaux de la région.
Étape 5 : description de l’épidémie et mise en application des premières mesures
Une bonne épidémiologie descriptive constitue un élément important de la gestion des épidémies pour identifier les tendances, la propagation et les acteurs impliqués, ce qui permet de coordonner systématiquement les mesures préventives et curatives (6).
Le service d’hygiène hospitalière de l’AZV a enregistré en continu les membres du personnel et les patients infectés, le type de contact à risque, les personnes qui présentaient des symptômes et celles chez qui le diagnostic était confirmé. Toujours en chiffres absolus et en pourcentages, éventuellement accompagnés d’explications visuelles (voir figure 1).
Figure 1 : Histogramme du nombre de cas (possible, probable ou confirmé) de gale chez le personnel et chez les patients symptomatiques/asymptomatiques au début de l’épidémie (hors patient index).
Les premières mesures ont été instaurées dans les 24 heures à compter de l’apparition de l’épidémie. Celles-ci comprenaient notamment : le port d’une blouse et de gants d’isolement par les collaborateurs ayant eu un contact à risque, une consultation chez un dermatologue pour les collaborateurs présentant des symptômes, la prise en charge de tous les patients des services de gériatrie B0 et C0 avec une blouse et des gants d’isolement, l’isolement des patients symptomatiques et la demande d’ avis d’un dermatologue pour confirmer ou exclure le diagnostic de gale. Le service d’hygiène hospitalière s’est occupé des commandes en quantité importante de crème à la perméthrine, le traitement privilégié à l’époque, afin d’assurer l’organisation et le bon déroulement des traitements préventifs.
Étape 6 : émettre une hypothèse
Après avoir constaté que le patient index présentait de fortes démangeaisons nocturnes, une hyperkératose de l’épiderme avec nombreuses lésions de grattage et desquamation de la peau, le diagnostic initial de syndrome paranéoplasique a pu être écarté et celui de gale norvégienne a été posé. La gale norvégienne est une forme de gale très contagieuse qui survient chez certains groupes de patients (immunodéprimés, patients souffrant de neuropathie, personnes très âgées dans des établissements de soins…) et pour laquelle un contact, même bref, suffit pour contaminer d’autres personnes.
Il est fort probable que les collaborateurs symptomatiques ou ceux chez qui la gale a été diagnostiquée ont été infectés par contact fugace ou étroit avec le patient index. De même, il est très probable que les patients symptomatiques hospitalisés dans les unités affectées par l’épidémie aient été infectés par contact avec des collaborateurs atteints de gale ou par les vêtements de travail de collaborateurs ayant été en contact avec le patient index.
Étape 7 : Tester l’hypothèse
Un diagnostic clinique ou microbiologique n’a pu être posé chez le patient index, ce dernier étant décédé rapidement. Cependant, compte tenu de l’ampleur et de la rapidité de la propagation (infirmières à domicile, autres patients et personnel hospitalier) ainsi que la nature des symptômes présentés par le patient index, le diagnostic de gale norvégienne a été retenu.
Étape 8 : Communication
Une communication correcte avec les différents acteurs doit être effectuée rapidement et efficacement.
Pendant la période aiguë de l’épidémie de gale à l’AZV, une communication écrite avec mise à jour de la situation était envoyée quotidiennement à la direction et autres parties concernées en interne. Des mises à jour écrites et/ou téléphoniques régulières ont également été communiquées à l’ensemble du personnel hospitalier, aux étudiants, aux responsables des écoles d’infirmiers, aux centres de soins résidentiels, à la blanchisserie externe, à l’entreprise de pompes funèbres qui s’était occupée du patient index et au service de santé au travail.
Étape 9 : mise en œuvre des mesures de contrôle et de prévention
Dans le cadre d’une investigation d’épidémie, l’objectif principal est de maîtriser le foyer afin d’éviter qu’il ne se propage. Pour éviter l’expansion, il est préférable de prendre des mesures initiales dès le début de l’épidémie, puis des mesures globales après une investigation plus approfondie.
Après avoir pris les mesures initiales concernant les équipements de protection individuelle, l’isolement et les consultations dermatologiques le cas échéant, les premiers traitements curatifs ont été effectués sur le personnel présentant des symptômes, ainsi que sur un patient symptomatique dans le service de revalidation. Les personnes susmentionnées ont été traitées par de la perméthrine en crème les jours 1 et 7, en tenant compte des mesures d’hygiène décrites dans la brochure de l’agence flamande pour les soins et la santé (8). Les familles des employés et des patients présentant des symptômes se sont vu remettre une lettre d’information concernant le traitement préventif à suivre ou la nécessité de consulter un médecin en cas de symptômes.
Tous les membres du personnel asymptomatiques ont reçu un traitement préventif 5 à 7 jours après le traitement initial des personnes symptomatiques.
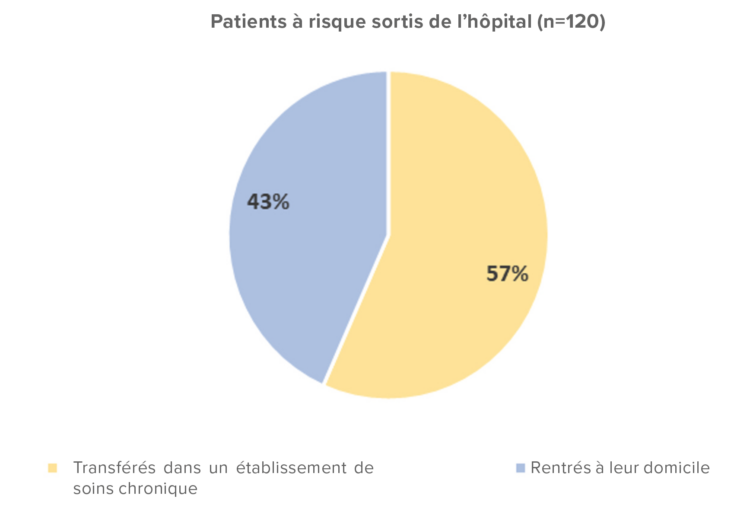
Tous les patients encore hospitalisés en gériatrie B0 et C0 (n=23) lors de l’instauration des traitements ont reçu leur traitement préventif dans le service, ainsi qu’une lettre d’information sur les mesures à prendre pour leur linge personnel. Le patient symptomatique qui était toujours hospitalisé a été traité de manière curative. Les patients déjà sortis (n=120) ont reçu une lettre d’information les invitant à la vigilance, des explications sur le traitement qu’ils devaient recevoir et sur la délivrance de la crème à la perméthrine (voir Figure 2). Plus de la moitié des patients sortis (n=68) séjournaient dans 25 établissements de soins chroniques différents (voir Figure 3). Ces établissements ont été contactés par le service d’hygiène hospitalière pour les informer, trouver d’autres arrangements et éventuellement donner des conseils. Ces contacts téléphoniques ont permis de constater que 4 contacts à risque présentaient déjà des symptômes de gale dans les différents établissements. Il a été conseillé d’isoler les résidents présentant des symptômes et de contacter un médecin pour poser le diagnostic.
Figure 2 : Histogramme des patients ayant eu un contact à risque.
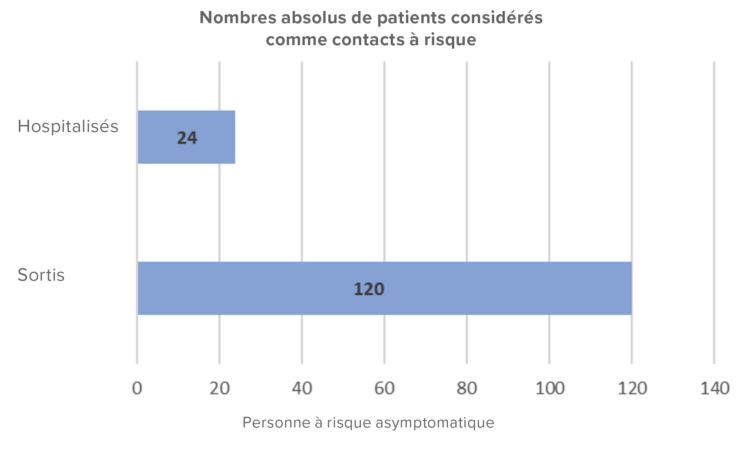
Figure 3 : Diagramme circulaire relatif aux patients à haut risque ayant quitté l’hôpital et à leur destination après sortie.
D’autres mesures ont été prises, notamment la mise en quarantaine de tous les rideaux et chaises de bureau en tissu du service pendant 7 jours, l’instauration du changement quotidien des vêtements de travail du personnel et l’intervention du Fonds des maladies professionnelles.
En cas de récidive de gale chez des collaborateurs ou chez les patients, deux traitements de trois jours à base de benzoate de benzyle ou un traitement à base d’ivermectine ont été administrés, à une semaine d’intervalle.
Comme le décrit la littérature, la gale a un impact sur la qualité de vie en raison des symptômes et des sentiments associés à l’infection et des effets sur les relations, le sommeil, le travail et les études (5, 9, 10). Pour réduire la charge psychologique, l’AZV a mis l’accent sur une communication claire et transparente avec toutes les parties concernées à des moments appropriés. En outre, un accompagnement psychologique a été proposé aux membres du personnel et aux patients encore hospitalisés.
Étape 10 : surveillance et suivi en continu
Après la mise en œuvre des mesures de contrôle et de prévention, un suivi doit être assuré pendant une période convenue au préalable (6).
Après la mise en application de l’ensemble des mesures visant à contenir l’épidémie de gale, des efforts ont été déployés pour suivre la survenue de récidives et de nouveaux cas pendant 6 semaines après le diagnostic de gale du dernier membre du personnel ou du dernier patient hospitalisé. Cette surveillance active et continue a été assurée conjointement par le service d’hygiène hospitalière et par le médecin du travail. Les patients admis en gériatrie B0 et C0 ont également été examinés quotidiennement pour détecter les symptômes de démangeaisons et des mesures supplémentaires d’isolement et de traitement ont été appliquées lorsque nécessaire.
Plusieurs récidives ont encore été observées chez le personnel et chez des patients sur une période de 12 semaines. De même, des cas de gale ont été objectivés chez des patients et chez des membres du personnel en dépit de l’application d’un traitement préventif. Après une période plus stable, de petits foyers épidémiques sont encore apparus à plusieurs reprises en 2022 en raison de récidive chez des membres du personnel ou chez des patients. La vigilance à l’égard des symptômes chez le personnel et les patients a été maintenue, avec notamment une investigation supplémentaire des plaintes lors de l’admission de patients gériatriques au service des urgences et le développement de formations en ligne sur la gale à l’intention du personnel.
Discussion et conclusion
L’épidémie de gale à l’AZV a été causée par un patient index atteint de la gale norvégienne, et la propagation au personnel et aux patients s’est faite par contact fugace avec le patient index ou par contact avec des membres du personnel infectés. La rapidité de propagation a probablement été influencée négativement par le fait que le patient index souffrait d’un problème oncologique, qu’il avait été hospitalisé pendant une longue période, qu’il avait grand besoin de soins et que le diagnostic de gale n’a été posé qu’après son décès.
Comme on l’a également constaté à l’AZV, le diagnostic complexe chez les contacts à risque présentant des symptômes empêche une approche rapide et efficace. Depuis 2022, l’examen microscopique des squames et la PCR (polymerase chain reaction) pour la gale sont davantage utilisés en Belgique. Une étude du RIVM aux Pays-Bas (2017) montre qu’en présence d’un tableau clinique suspect, le diagnostic ne peut être confirmé par microscopie/PCR dans 76 % des cas. Par conséquent, poser strictement le diagnostic à partir du tableau clinique induit de nombreux diagnostics faussement positifs. Néanmoins, le degré de suspicion clinique en présence de symptômes très suspects s’avère fortement associé à la probabilité d’un résultat PCR positif (69 %). La PCR pour la gale détecte l’ADN non seulement des acariens vivants, mais aussi des acariens morts et des fèces d’acariens. Par conséquent, la PCR n’est pas une bonne technique pour contrôler l’effet d’un traitement. Des recherches supplémentaires sont nécessaires sur la durée de la présence de l’ADN de la gale dans les squames de la peau après le traitement (11). Depuis la mi-2022, le personnel ou les patients hospitalisés de l’AZV sont régulièrement soumis à des tests PCR. Et ce, si la gale ne peut être exclue sur base de signes cliniques ou d’un diagnostic par microscopie.
La deuxième pierre d’achoppement dans la lutte contre cette épidémie de gale s’est avérée être l’angoisse. La gale n’étant pas encore un problème courant en 2021 et donc peu connu à l’AZV, cela a provoqué beaucoup de tristesse, d’angoisse et de panique au sein du personnel des services concernés. Malgré l’engagement en faveur d’une communication ouverte et claire, la disponibilité du service d’hygiène hospitalière et le déploiement de psychologues, l’aspect psychologique a continué à peser. Il a été noté, par exemple, que le personnel était extrêmement anxieux à l’idée de contracter la gale et de la transmettre à des membres de sa famille ou à des patients. C’est ainsi que certains membres du personnel asymptomatiques, qui devaient recevoir un traitement préventif le 7e jour après le premier traitement du personnel symptomatique, se traitaient déjà au 5e jour.
En raison de l’ampleur de l’épidémie, les traitements préventifs et curatifs des patients à risque qui avaient déjà quitté l’hôpital n’ont guère pu être contrôlés. Les tubes de crème à la perméthrine commandés n’avaient pas tous été récupérés par les patients ou par les membres de leur famille contactés. Lors de la réadmission de ces personnes à risque, on leur demandait toujours si elles avaient suivi le traitement, mais leur réponse s’est régulièrement avérée négative. De manière sporadique, un contact à risque a été réadmis avec des symptômes après un certain temps, qu’il se soit traité préventivement ou non. Le service d’hygiène hospitalière n’a pas pu assurer un suivi des contacts externes, mais à l’avenir, l’équipe HOST du Limbourg Sud-ouest ou l’agence flamande pour les soins et la santé pourraient jouer un rôle à cet égard.
Un tube de crème à la perméthrine a été commandé pour chaque contact à risque. Le personnel interne qui n’avait pas assez d’un tube de crème pouvait contacter le Service d’hygiène hospitalière pour obtenir un deuxième tube, comme l’indique également la notice jointe (12). Pour les patients déjà sortis de l’hôpital, il était impossible de vérifier si le traitement avait avait été correctement appliqué. Depuis l’épidémie de 2021, la règle veut que les personnes de grande taille et de forte corpulence reçoivent toujours deux tubes de crème à la perméthrine par traitement.
En cas de récidive chez un collaborateur ou chez un patient pendant et après l’épidémie, un traitement à base de benzoate de benzyle ou d’ivermectine était prescrit. Le benzoate de benzyle était utilisé de manière sporadique, chez le personnel et les patients pour lesquels il n’était pas considéré comme contraignant de suivre ce traitement de 2 à 3 jours. L’ivermectine était obtenue à l’étranger pour les personnes présentant une résistance ou des contre-indications à la perméthrine et au benzylbenzoate. Depuis novembre 2022, l’ivermectine est également disponible en Belgique. Le traitement privilégié de la gale selon l’agence flamande pour les soins et la santé a été mis à jour en juillet 2022. En l’espèce, la perméthrine est indiquée comme traitement de premier choix, mais le traitement au benzoate de benzyle peut également être mis en œuvre immédiatement. En cas d’échec thérapeutique ou de contre-indication aux traitements de premier choix, un traitement à l’ivermectine peut être initié(13).
Compte tenu de l’augmentation présumée de la prévalence de la gale dans la population tongroise, la gale a été incluse dans le programme de formation du personnel hospitalier au travers d’un apprentissage en ligne et d’un écolage en présentiel. La diffusion d’informations sur la gale reste importante au sein de l’AZV et du réseau hospitalier andreaz grâce à l’équipe HOST du Limbourg du Sud-ouest. Cela passe par des formations en ligne pour le personnel des établissements de soins chroniques, pour les médecins généralistes et les autres parties prenantes, des formations en présentiel, des mises à jour sur le nombre de foyers de gale, l’élaboration de plans de traitement (14).
L’épidémie décrite dans cet article montre qu’une action rapide, mais structurée représente le point le plus important dans la gestion d’une épidémie.
Références
1) Centers for Disease Control and Prevention (2010). Parasites — Scabies. Consulté le 17 février 2023, sur CDC — Scabies
2) Organisation mondiale de la santé (2020) : Gale, consulté le 17 février 2023, sur https://www.who.int/fr/news-room/fact-sheets/detail/scabies.
3) Rijksinstituut voor Volksgezondheid en Milieu (2022). Scabiës richtlijn. Consulté le 17 février 2023, sur https://lci.rivm.nl/richtlijnen/scabies
4) Agentschap Zorg & Gezondheid (z.d.). Scabiës (schurft), collectieve infectie. Consulté le 17 février 2023, sur https://www.zorg-en-gezondheid.be/scabies
5) Aždajic, M., Bešlic, I., Gašic, A., Ferara, N., Pedic, L., Lugovic-Mihic, L. Increased scabies incidence at the beginning of the 21st century: What do reports from Europe and the world show. Life (2022), doi: https://doi.org/10.3390/life12101598
6) Centers for Disease Control and Prevention (2016). Lesson 6: Investigating an Outbreak. Consulté le 17 février 2023, sur Principles of Epidemiology : Lesson 6, Section 2|Self-Study Course SS1978|CDC
7) Organisation mondiale de la santé (2022) : Principles and steps of an outbreak investigation. Consulté le 17 février 2023, sur Principles and steps of an outbreak investigation (who.int)
8) Agentschap Zorg & Gezondheid (2018). Folder Schurft (of scabiës). Consulté le 17 février 2023, sur Folder Schurft (of scabiës) | Zorg en Gezondheid (zorg-en-gezondheid.be)
9) Jin-gang, A. et al. Quality of life of patients with scabies. J Eur Acad Dermatol Venereol (2010)., doi: 10.1111/j.1468-3083.2010.03618.x.
10) Trettin, B., Lassen, J., Andersen, F, Agerskov, H. The journey of having scabies – a qualitative study. Journal of Nursing Education and Practice (2019)9:2.
11) Rijksinstituut voor Volksgezondheid en Milieu (2017). Scabiës – PCR bij uitbraken binnen zorgorganisaties. Consulté le 18 février 2023, sur Scabiës-PCR bij uitbraken binnen zorgorganisaties/IB 12-2017 | RIVM
12) Pharma (2020). Zalvor. Consulté le 18 février 2023, sur E-Compendium
13) Agentschap Zorg & Gezondheid (2022). Aanpassing behandelingsrichtlijn scabiës – brief huisartsen en dermatologen. Consulté le 18 février 2023, sur Scabiës (schurftmijt) (zorg-en-gezondheid.be)
14) Hospital Outbreak Support Team Zuidwest Limburg (2022). Tools en procedures — Scabiës. Consulté le 18 février 2023, sur Tools en procedures — HOST Zuid-West Limburg (hostzwl.be)
Note de la rédaction
Y. Glupczynski
Dans l’article relatif à une épidémie de gale norvégienne, à l’AZ Vesalius, E. Coeman rapporte son expérience positive de l’utilisation d’un test PCR pour la confirmation du diagnostic de gale chez des personnes contacts à risque (patients ou personnel de soin) et souligne la supériorité de cette technique par rapport au diagnostic clinique conventionnel souvent entaché de résultats faussement positifs.
Depuis l’épidémie de COVID-19, les tests moléculaires basés sur la technique PCR sont de plus en plus largement utilisés pour le diagnostic de nombreuses maladies infectieuses. Ces tests offrent souvent l’avantage combiné d’une excellente sensibilité et spécificité et ils permettent un diagnostic rapide lorsqu’ils sont largement disponibles et faciles à utiliser (kits commerciaux). La meilleure sensibilité de la PCR rapportée dans l’article apparaît certes intéressante mais on manque encore de recul quant à la performance réelle du test PCR, peu d’études ayant été réalisées à ce jour sur des larges séries de patients atteints de gale (différentes présentations cliniques, différentes populations dont patients âgés avec présentations cliniques atypiques,…etc.).
Le diagnostic par PCR, bien que prometteur, ne remplace pas l’examen clinique et ce dernier couplé à la visualisation des sarcoptes ou des œufs par microscopie optique ou par dermoscopie reste essentiel en première intention pour le diagnostic de cas de gale.1 Enfin, les tests PCR ayant à ce jour fait l’objet d’une évaluation ne sont pas standardisés et plusieurs formats (avec différentes cibles d’ADN de Sarcoptes Scabei) ont été proposés.2 Compte tenu de ce qu’il n’existe aucun test commercial et qu’il n’y a pas de remboursement en Belgique prévu, le test PCR pour le diagnostic de la gale n’est pas disponible dans la grande majorité des laboratoires.
Les lecteurs intéressés par le sujet trouveront des informations complémentaires dans deux articles de synthèse récents sur le diagnostic de la gale et la place des différentes techniques de laboratoires dont la PCR.
1. Engelman D, Yoshizumi J, Hay RJ et al. The 2020 International Alliance for the Control of Scabies Consensus Criteria for the Diagnosis of Scabies. Br J Dermatol. 2020 Nov;183(5):808-820.
2. Siddig EE, Hay R. Laboratory-based diagnosis of scabies : a review o f the current status. Trans R Soc Trop Med Hyg. 2022 Jan 19; 116(1): 4-9.