Introduction
L’impétigo est une infection cutanée superficielle qui apparaît surtout chez les enfants. Cette infection est fréquemment induite par le Staphylococcus aureus, mais les streptocoques béta-hémolytiques du groupe A ou le Streptococcus pyogenes peuvent également provoquer cette infection. [10, 11] Les épidémies d’impétigo par le Staphylococcus aureus dans des services de maternité et de soins intensifs néonataux sont décrites dans la littérature. [1-9] Pour ces épidémies, le matériel de soin et le portage (asymptomatique) du Staphylococcus aureus chez les mères ou les professionnels de la santé sont cités comme sources ou vecteurs éventuels.
Cet article décrit 3 épidémies d’impétigo à Staphylococcus aureus dans un service de maternité au cours de la période juin 2012 – mars 2013.
Méthode
Enquête épidémiologique, analyse rétrospective des dossiers et revue de la littérature. Le génotypage des souches a été effectué lors de l’épidémie 1 avec Diversilab (BioMérieux). Pour les épidémies 2 et 3, un typage Spa a été utilisé.
Description des épidémies
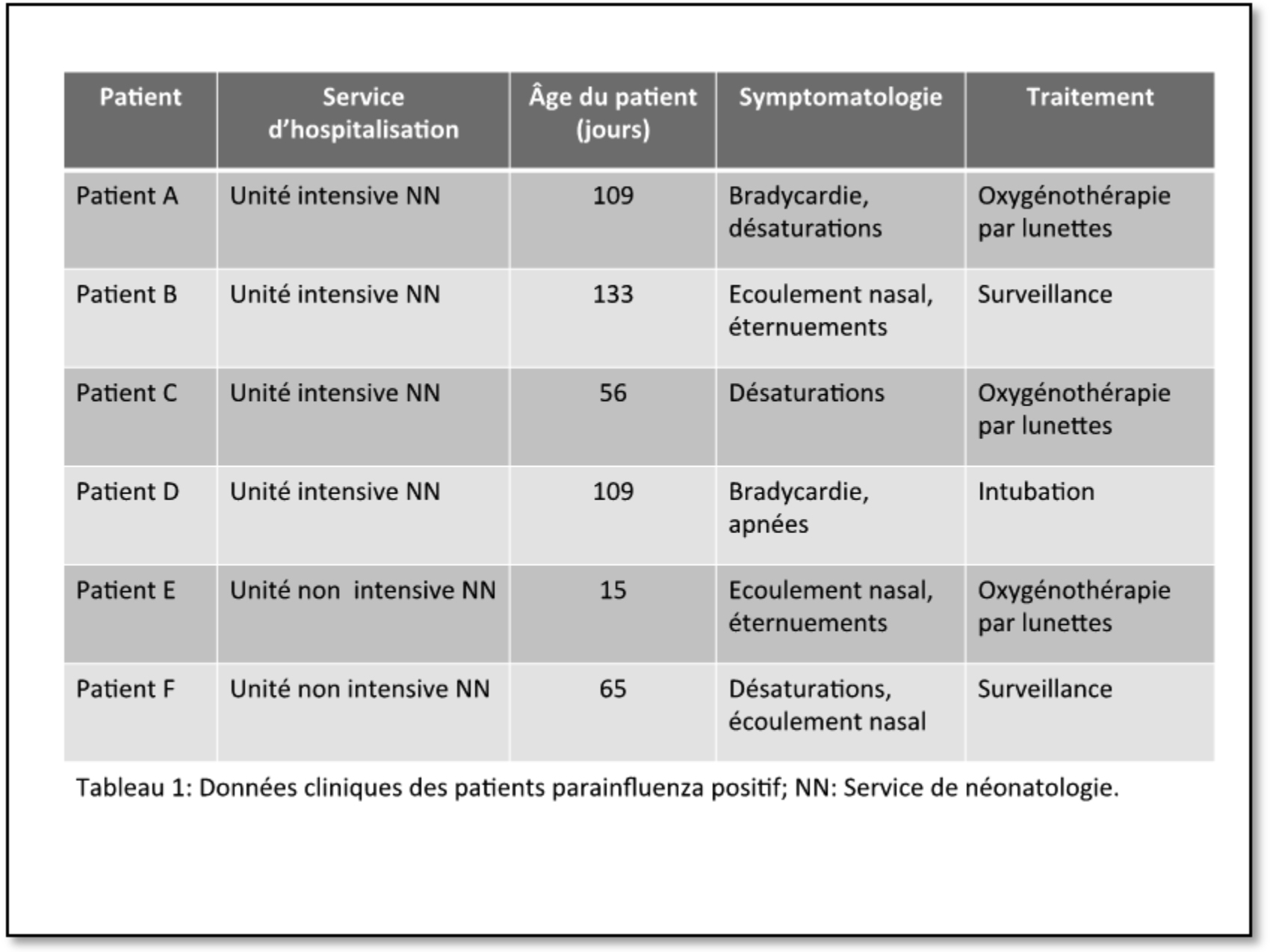
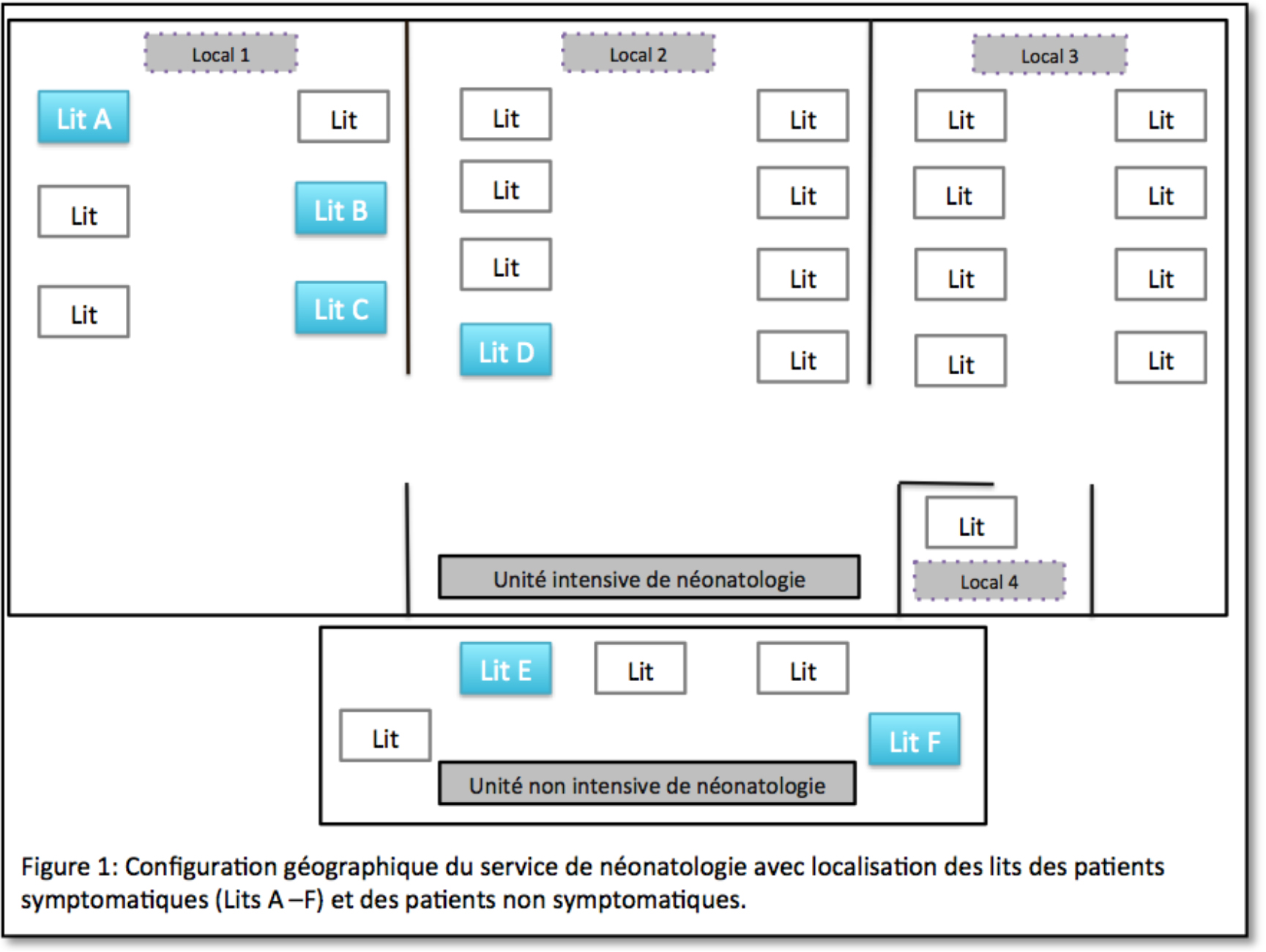
Au cours de la période juin 2012 – mars 2013, 3 épidémies d’impétigo ont eu lieu dans le service de maternité d’un des campus de l’Onze-Lieve-Vrouw Ziekenhuis. Quatorze nouveau-nés ont été infectés avec le Staphylococcus aureus sensible à la méticilline (MSSA), dont 13 nouveau-nés ont développé une infection ; les autres étaient colonisés. Les lésions se situaient principalement dans la région de l’aine, le visage, l’aisselle et le nombril. Le délai médian d’acquisition du germe à dater de la naissance était de 5 jours. Dans la plupart des cas, un traitement local a suffi ; 3 nouveau-nés ont nécessité un traitement systémique aux antibiotiques. Aucun des nouveau-nés n’a eu de complications infectieuses sévères.
Épidémie 1 : 01/06-12/07/2012
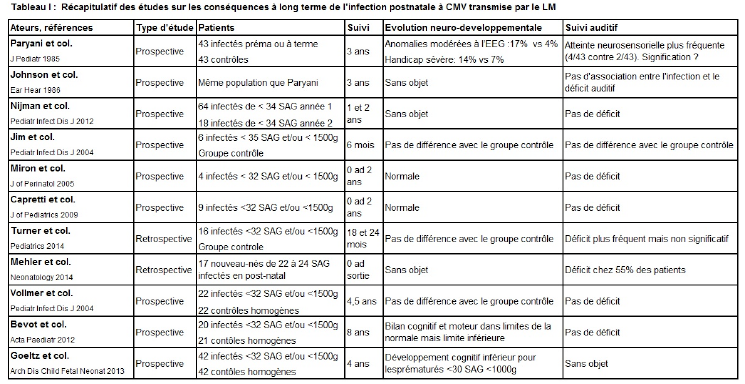
Lors de cette épidémie, 7 nouveau-nés ont été diagnostiqués avec de l’impétigo par S. aureus (tableau 1). La suspicion d’épidémie a été suspectée lorsque l’impétigo a été diagnostiqué chez le bébé 3.
Les mesures suivantes ont été prises par l’Équipe d’hygiène hospitalière et d’épidémiologie (EHH) :
- Il a été communiqué aux médecins et aux infirmiers du service à quel point une bonne hygiène des mains, ainsi que le nettoyage et la désinfection du matériel réutilisable sont importants. Il a également été demandé si les professionnels de la santé présentaient des lésions cutanées.
- Analyse de dossier de tous les nouveau-nés, comprenant des données sur la date et l’heure de la naissance, le type d’accouchement (vaginal ou par césarienne), la salle d’accouchement utilisée, le nom du gynécologue, le nom de la sage-femme, le nom du pédiatre éventuellement présent, l’utilisation d’une table de réanimation, l’utilisation de matériel pendant (vacuum,…) et directement après la naissance (sonde d’aspiration, ballon,…), un éventuel séjour dans l’unité néonatale, le numéro de chambre à la maternité, le type d’alimentation (alimentation au sein ou au biberon), les sages-femmes et puéricultrices présentes, la date d’apparition des lésions d’impétigo et le site des lésions.
- Vu qu’il ressort de l’analyse de dossier qu’à la naissance de tous les nouveau-nés avec impétigo la table de réanimation a été utilisée, des échantillons d’environnement de la table et des dispositifs médicaux ont été prélevés. Ensuite, la table de réanimation et ses accessoires ont été soigneusement nettoyés et puis désinfectés avec de l’alcool à 70%. L’on a retrouvé sur le saturomètre un S. aureus sensible à la méticilline (MSSA), aussi bien dans l’échantillon de l’écran/le bouton de commande que dans l’échantillon du capteur digital. Suite à cette constatation, il a été décidé de ne plus reutiliser les capteurs digitals, mais d’utiliser pour chaque nouveau-né un nouveau capteur, vu que le matériel dont le capteur digital est fabriquée ne permet pas d’être nettoyé et désinfecté correctement. Il a également été mis fin aux mesures de la saturation lors du test de Guthrie (test néonatal du buvard) effectué le quatrième jour.
- Les isolats de 4 nouveau-nés (du bébé 2 au bébé 5 inclus) ont été envoyés dans un laboratoire externe pour génotypage. La souche du bébé 1 n’avait pas été conservée au laboratoire et ne pouvait donc pas être envoyée. Vu que dans le laboratoire externe des analyses allaient être effectuées sous peu, il n’était pas possible, en raison du manque de temps, d’inclure également les isolats des autres nouveau-nés (bébés 6 et 7).
Le typage des échantillons a montré que les souches issues des 4 nouveau-nés présentaient des empreintes digitales identiques (> 98% de similarité) et qu’elles appartenaient donc au même clone. Vu qu’aucun nouveau cas d’impétigo n’a été signalé après le 12/07/2012, il a été présumé que la réutilisation du capteur digital de saturation a probablement joué un rôle dans la transmission. La souche MSSA retrouvée sur le capteur digital n’a cependant pas été conservée au laboratoire, de sorte qu’il n’a pas été possible d’effectuer un génotypage. La souche retrouvée sur l’écran/le bouton de commande n’a pas été envoyée pour génotypage lors de l’épidémie 1 en raison du manque de temps.
Tableau I : Aperçu du nombre de contaminations lors de l’épidémie 1 (1/06-12/07/2012)
Épidémie 2 : 29/10-18/11/2012
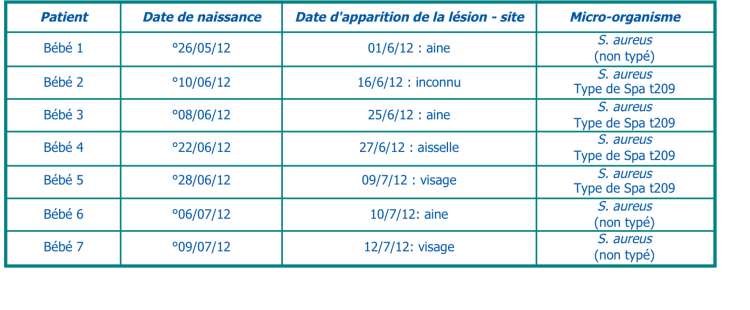
Lors de cette épidémie, 4 nouveau-nés ont été contaminés avec le S. aureus, dont 3 nouveau-nés ont développé l’impétigo. Chez l’autre nouveau-né (bébé 9), le MSSA a été retrouvé dans une culture de surveillance prélevée après la naissance en raison de l’apparition de fièvre, mais ce bébé n’a pas développé de lésions cutanées (voir tableau II).
Les mesures suivantes ont été prises par l’EHH :
- Analyse de dossier, cependant aucun facteur commun n’a pu être dévoilé.
- Concertation avec les pédiatres et la sage-femme en chef : l’importance de l’hygiène des mains et de la désinfection du matériel à usage commun (p.ex. stéthoscope) a été à nouveau soulignée.
- Observation de la conformité de l’hygiène des mains et du respect des exigences de base de l’hygiène des mains.
- Envoi des isolats des 4 nouveaux-nés de l’épidémie 2 pour typage Spa au laboratoire de référence national pour le aureus, ensemble avec l’isolat du saturomètre et les 4 isolats déjà typés des nouveau-nés de l’épidémie 1.
Le 17/12/2012, il a été constaté que les souches des nouveaux-nés de l’épidémie 2 appartenaient au type de Spa t209 avec présence du gène ETA (exfoliatine A) et qu’elles étaient génétiquement identiques aux souches des nouveaux-nés de l’épidémie 1. L’isolat du saturomètre appartenait à une autre souche et n’était donc pas génétiquement identique aux souches des nouveau-nés. Dès lors, l’hypothèse que la transmission s’effectuait via le saturomètre a été abandonnée.
Afin de dépister un portage (asymptomatique) chez les professionnels de la santé, il a été procédé à un dépistage de MSSA au niveau du nez chez tous les médecins, sages-femmes, puéricultrices et paramédicaux du service de maternité (période 19/12/2012 – 18/01/2013). Des 36 professionnels de la santé contrôlés, 14 se sont avérés positifs au MSSA et ces souches ont été envoyées pour génotypage au laboratoire de référence national pour S. aureus. Le 13/02/2013, il a été constaté que la souche d’un professionnel de la santé appartenait au type de Spa t209 avec présence du gène ETA (exfoliatine A) et qu’elle était donc génétiquement identique aux souches des nouveau-nés avec impétigo.
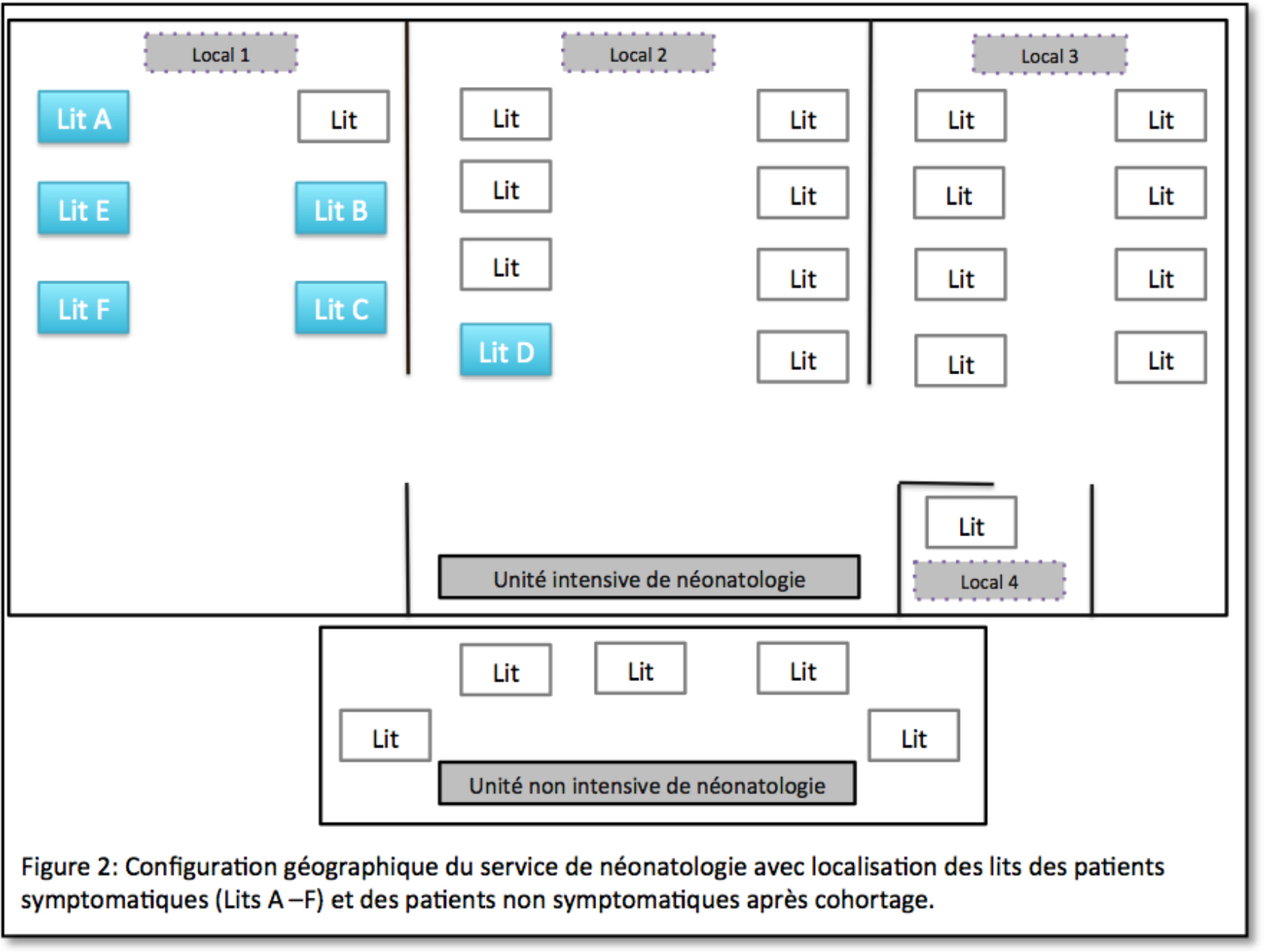
Le professionnel de la santé était une sage-femme présente à la naissance de 4 nouveau-nés avec impétigo (3 nouveau-nés de l’épidémie 1 et 1 nouveau-né de l’épidémie 2). Par ailleurs, elle travaillait au service de maternité pendant le séjour hospitalier de 5 autres nouveau-nés avec impétigo (3 nouveau-nés de l’épidémie 1 et 2 nouveau-nés de l’épidémie 2), au cours duquel il est possible qu’elle ait eu des contacts physiques avec les nouveau-nés.
La sage-femme a été soumise à un traitement de décontamination de 5 jours consistant en un nettoyage de la peau et des cheveux avec un savon désinfectant (à base de chlorhexidine), l’utilisation d’une crème nasale antimicrobienne (à base de mupirocine) et une solution désinfectante pour la gorge (à base de chlorhexidine). Lorsqu’au contrôle, le dépistage de MSSA était encore positif, le traitement de décontamination a été renouvelé. Depuis le deuxième traitement, les dépistages de contrôle se sont avérés négatifs.
Tableau II : Aperçu du nombre de contaminations lors de l’épidémie 2 (29/10-18/11/2012)
Épidémie 3: 14/01-28/03/2013
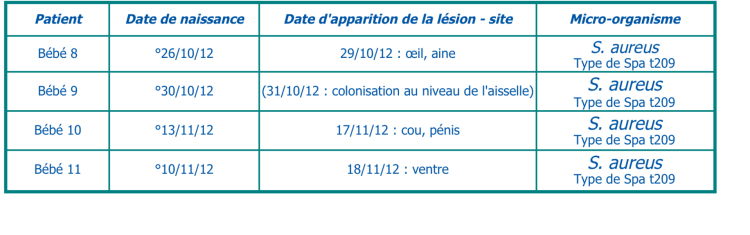
Lors de cette épidémie, 3 nouveau-nés ont été diagnostiqués, de manière étalée dans le temps, avec de l’impétigo par S. aureus (voir tableau III).
Lorsque l’impétigo a été diagnostiqué chez le bébé 12, le dépistage des professionnels de la santé était encore en cours (voir épidémie 2). Vu qu’il s’agissait d’un cas isolé et dans l’attente des résultats de génotypage des souches issues des professionnels de la santé, aucune mesure supplémentaire n’a été prise.
Les isolats des nouveau-nés de l’épidémie 3 ont été envoyés pour génotypage au laboratoire de référence national pour le S. aureus. Seul l’isolat du 14/01/2014 (bébé 12) appartenait à la même souche que les isolats des nouveau-nés de l’épidémie 1 et 2, notamment le type de Spa t209 avec présence du gène ETA (exfoliatine A). Les isolats des 2 autres nouveau-nés appartenaient chacun à une autre souche (Spa t012 et Spa t2778).
Tableau III : Aperçu du nombre de contaminations lors de l’épidémie 3 (14/01-28/03/2012)
Discussion
Des 14 nouveau-nés impliqués dans les 3 épidémies d’impétigo avec S. aureus, 9 souches appartenaient au même type, notamment le type de Spa t209 avec présence du gène ETA (exfoliatine A). Cette souche a également été retrouvée dans le dépistage nasal d’un des professionnels de la santé.
Le portage chez les professionnels de la santé comme source éventuelle d’une épidémie d’impétigo avec S. aureus est décrit dans la littérature. [1, 2, 5, 6, 8] Concernant les épidémies au sein de notre hôpital, il s’agit d’une sage-femme qui était présente à la naissance d’un des nouveau-nés avec une contamination par MSSA du type de Spa t209 (bébé 10). Par ailleurs, elle travaillait au service de maternité pendant le séjour hospitalier de 6 autres nouveau-nés avec impétigo avec une contamination par MSSA du type de Spa t209 (bébés 2, 4, 5, 8, 9 et 12), au cours duquel il est possible qu’elle ait eu des contacts physiques avec les nouveau-nés. Maximum 7 des 9 contaminations confirmées avec MSSA du type de Spa t 209 sont, par conséquent, liées au portage asymptomatique de cette professionnelle de la santé. Pour au moins 2 des contaminations (bébé 3 et bébé 11), il était donc question d’une autre source ou d’un autre vecteur. Il est possible qu’une contamination horizontale ait eu lieu entre les nouveau-nés, et ce par les mains des professionnels de la santé ou par du matériel contaminé.
Bien que le portage de S. aureus chez les professionnels de la santé soit décrit dans la littérature comme source éventuelle d’une épidémie d’impétigo, il régnait au sein de l’OLV ziekenhuis une certaine réticence par rapport au dépistage des professionnels de la santé. Seulement lorsqu’il s’est avéré du typage Spa de l’épidémie 2 que les souches des nouveau-nés des épidémies 1 et 2 appartenaient au même type, on a commencé à dépister le portage de S. aureus chez tous les prestataires de soins du service. Le dépistage des professionnels de la santé lors d’une épidémie est encore trop souvent ressenti comme la recherche d’un ‘coupable’ au lieu de d’être considéré comme une recherche d’explication à l’épidémie. Une compréhension du mode de transmission permet de prendre des mesures ciblées afin de mettre fin à l’épidémie.
Les épidémies avec des souches S. aureus testées positives à l’ETA sont décrites dans la littérature par Jursa-Kulesza et al. (2009) [2] et Piechowicz et al. (2012) [8]. La toxine exfoliative (ET-A) fait en sorte que la desmogléine, une protéine importante de la peau humaine, soit éliminée, ce qui cause des cloques qui sont caractéristiques pour l’impétigo. Des épidémies avec ce type de S. aureus sont le plus souvent symptomatiques, ce qui favorise leur détection.
Il n’y a pas eu de dépistage systématique auprès de tous les nouveau-nés présents dans le service de maternité pendant les épidémies. Il se peut donc que le nombre total de nouveaux-nés contaminés soit supérieur à 14. Vu que l’épidémie a toutefois été causée par une souche de S. aureus testée positive à l’ETA, il persistait un risque élevé que des nouveaux-nés contaminés présentent des lésions d’impétigo. Cependant, la souche de type Spa t209 avec présence du gène ETA (exfoliatine A) a également été retrouvée dans une culture de surveillance de l’aisselle chez un nouveau-né qui a développé une fièvre postnatale (bébé 9). Ce nouveau-né n’a toutefois pas présenté de lésions d’impétigo. Il est donc possible que d’autres nouveaux-nés asymptomatiques soient concernés par les épidémies.
Afin de tracer une éventuelle source lors d’une épidémie, il est utile d’effectuer un génotypage. L’on a initialement pensé que le saturomètre était lié à l’épidémie, car on avait retrouvé le S. aureus dans le prélèvement de l’appareil et de la sonde. Le génotypage de la souche retrouvée sur l’écran/le bouton de commande pouvait cependant démontrer qu’il s’agissait d’une autre souche. Comme la souche retrouvée sur la sonde de saturation (après enrichissement au laboratoire) n’a pas été conservée, elle n’a pas pu être typée. Il est probable qu’il s’agissait ici également d’une autre souche. Bien qu’il n’est pas démontrable que le saturomètre ait joué un rôle dans les épidémies, les souches MSSA retrouvées sur l’écran/le bouton de commande et la sonde soulignent toutefois l’importance 1) de nettoyer et désinfecter le matériel réutilisable après utilisation chez un nouveau-né, 2) de ne pas réutiliser du matériel qui ne peut pas être bien nettoyé, ni bien désinfecté et 3) d’une bonne hygiène des mains chez les professionnels de la santé.
Une transmission peut être démontrée au moyen du génotypage. Cependant, le désavantage est que le génotypage reste encore assez cher. Par ailleurs, cette méthode d’analyse n’est actuellement effectuée que dans des centres spécialisés et cela peut prendre des jours, voire des semaines avant de connaître les résultats. Cela limite l’utilité du génotypage en cas d’épidémie aiguë.
Conclusion
Dépister les professionnels de la santé pour le S. aureus et décontaminer le professionnel de la santé qui était porteur de la même souche que celle retrouvée chez les nouveau-nés s’est avéré efficace pour mettre fin aux épidémies d’impétigo.
Nous remercions le laboratoire de microbiologie du Heilig-Hartenziekenhuis Roeselare-Menen et le laboratoire de référence nationale pour le S. aureus (Cliniques Universitaires de Bruxelles (ULB) – Hôpital Erasme) pour le typage.
Bibliographie
- Conceição T, Aires de Sousa M, Miragaia M et al. Staphylococcus aureus reservoirs and transmission routes in a Portuguese Neonatal Intensive Care Unit: a 30-month surveillance study. Microb Drug Resist 2012; 18(2):116-24
- Jursa-Kulesza J, Kordek A, Kopron K, Wojciuk B, Giedrys-Kalemba S. Molecular studies of an impetigo bullosa epidemic in full-term infants. Neonatology 2009; 96(1):61-8
- Koningstein M, Groen L, Geraats-Peters K et al. The use of typing methods and infection prevention measures to control a bullous impetigo outbreak on a neonatal ward. Antimicrob Resist Infect Control 2012;1:37
- Kurlenda J, Grinholc M, Krzysztoń-Russjan J, Wiśniewska K. Epidemiological investigation of nosocomial outbreak of staphylococcal skin diseases in neonatal ward. Antonie Van Leeuwenhoek 2009; 95(4):387-94
- Nakashima AK, Allen JR, Martone WJ et al. Epidemic bullous impetigo in a nursery due to a nasal carrier of Staphylococcus aureus: role of epidemiology and control measures. Infect Control 1984; 5(7):326-31.
- Occelli P, Blanie M, Sanchez R et al. Outbreak of staphylococcal bullous impetigo in a maternity ward linked to an asymptomatic healthcare worker. J Hosp Infect 2007; 67(3):264-70
- Pawun V, Jiraphongsa C, Puttamasute S et al. An outbreak of hospital-acquired Staphylococcus aureus skin infection among newborns, Province de Nan, Thaïlande, janvier 2008. Euro Surveill 2009; 14(43):pii=19372
- Piechowicz L, Garbacz K, Budzyńska A, Dąbrowska-Szponar M. Outbreak of bullous impetigo caused by Staphylococcus aureus strains of phage type 3C/71 in a maternity ward linked to nasal carriage of a healthcare worker. Eur J Dermatol 2012; 22(2):252-5
- Wilcox MH, Fitzgerald P, Freeman J et al. A five year outbreak of methicillin-susceptible Staphylococcus aureus phage type 53,85 in a regional neonatal unit. Epidemiol Infect 2000; 124(1):37-45
- http://www.kindengezin.be/gezondheid-en-vaccineren/ziek/impetigo/ consulté le 4/8/2014
- http://www.gezondheid.be/index.cfm?fuseaction=art&art_id=8777 consulté le 4/8/2014
- https://mrsa.rivm.nl/verspreiding-typen-mrsa-nederland/ consulté le 11/08/2014
- http://www.biomerieux-usa.com/servlet/srt/bio/usa/dynPage?open=USA_PRD_LST&doc=USA_PRD_LST_G_PRD_USA_9&lang=en consulté le 11/8/2014