
N’oubliez pas de vous inscrire à la prochaine campagne d’hygiène des mains avant le 31 juillet via le lien suivant
http://www.health.belgium.be/fr/
Merci déjà pour votre participation



N’oubliez pas de vous inscrire à la prochaine campagne d’hygiène des mains avant le 31 juillet via le lien suivant
http://www.health.belgium.be/fr/
Merci déjà pour votre participation

Mattner F., Guyot A., Henke-Gendo C.
J. Hosp. Infect 2015 Dec ; 91 (4) : 332-7
Les épidémies à norovirus dans les hôpitaux restent une menace importante malgré les nombreuses recommandations de prévention publiées récemment. L’objectif de l’étude est d’analyser les facteurs qui contribuent à l’émergence d’une épidémie à norovirus pour identifier les nouvelles options de prévention. Nous avons analysé les données de 71 épidémies à norovirus survenues dans 5 hôpitaux allemands entre 2002 et 2012 en nous concentrant sur les conditions de départ : le jour de la semaine de l’épidémie, l’écart de temps entre les premiers cas symptomatiques et la date de l’émergence de l’épidémie, le moment du résultat positif du test à norovirus dans une épidémie et la présence d’infections concomitantes à Clostridium difficile. Dans 68 épidémies (96 %), les cas index sont identifiables. Dans 33 des 44 (68 %) épidémies, le patient cas index a contracté l’infection à norovirus à l’hôpital. Dans 20 % de toutes les épidémies, le cas index est un membre du personnel. Neuf épidémies sont causées par des patients non isolés pendant le temps d’incubation après leur exposition à un cas symptomatique. Le nombre de cas dans les épidémies à norovirus est plus faible quand les résultats des tests pour norovirus sont disponibles avant l’émergence de l’épidémie (P=0,028). Dans 30 des 46 épidémies à norovirus (64 %), les tests à la toxine de C. difficile sont positifs chez 10 patients. Une co infection ou une infection subséquente à norovirus et à C. difficile chez un même patient est observée dans 9 épidémies (20 %).
Nous concluons que les futures stratégies de prévention devraient se focaliser non seulement sur les patients mais aussi sur le personnel. Une surveillance constante des nouveaux cas de diarrhée et de vomissements et une adhésion rapide aux précautions de contact pour toutes les personnes exposées sont cruciales pour un contrôle de l’épidémie ainsi que la nécessité de tests microbiologiques étendus.
Gaspard P., Ambert-Balay K., Mosnier A., Aho-Glélé S., Roth C., Larocca S., Simon L., Talon D., Rabaud C., Pothier P.
J. Hosp. Infect 2015 Sep ; 91 (1) : 19-27
Dans les institutions soignant des personnes dépendantes, la gastro entérite virale survient fréquemment et est très contagieuse. Chez les personnes âgées, ces épisodes peuvent conduire à une hospitalisation et parfois à la mort. Le but de l’étude est d’étudier l’impact des épidémies de gastro entérite (Gos) dans les institutions soignant des personnes dépendantes. L’étude a été menée sur 18 sites comprenant 35 unités émargeant de 4 disciplines différentes (médecine gériatrique et de revalidation, psychogériatrie, maison de soins gériatrique et centres de soins spécialisés pour adultes avec handicap physique et mental).Une analyse spatio temporelle des Gos a été réalisée pendant 6 saisons hivernales et nous avons analysé les données cliniques et virales en regard aux paramètres structuraux (taille des sites et organisation du réfectoire), épidémiologie des virus et chronologie des épidémies et le type d’activités. Nous avons recensé 98 épidémies dans les 35 unités. Le risque de Gos était élevé même en dehors des périodes épidémiques nationales. Nous avons recherché les virus dans 86 épidémies et les avons identifiés dans 96,5 % (83/83) des épidémies : norovirus génotype G II.4 (59,0 %, 49/83), autres virus (41 %, 34/83). Il y a des variations entre les périodes de surveillance en termes de fréquence de GO et du taux d’attaque et du type de virus. L’organisation du réfectoire pourrait être un facteur d’infection croisée dans le site.
Nous concluons qu’une surveillance spécifique qui prend en compte l’épidémiologie précise devrait être développée dans les institutions soignant des personnes dépendantes pour augmenter le contrôle de l’infection et l’information du personnel de soins.
Acherman Y., Seidl K., Leimer N., Durisch N., Ajder-Schäffler E.,Karrer S., Senn G., Holzmann-Bürgel A., Wolfensberger A., Leone A., Arlettaz R., Zinkernagel A.S., Sax H.
Infect Control Hosp Epidemiol 2015 Nov ; 36 (11) : 1305-12.
La transmission intra hospitalière de Staphylococcus aureus sensible à la méticilline (MSSA) chez les nouveau-nés reste une énigme. Nous décrivons l’épidémiologie de la colonisation et de l’infection par MSSA dans une unité néonatale de 30 lits par une étude multimodale de l’épidémie. Nous réalisons cette étude dans un hôpital universitaire en Suisse. Les investigations ont lieu en 2012-2013, déclenchées par un cluster d’infection à MSSA incluant la surveillance prospective de l’infection à MSSA, la détection microbiologique des nouveau-nés et de l’environnement, les observations in situ et une étude prospective de cohorte. Les isolats de MSSA sont caractérisés par électrophorèse sur gel pulsé (PFGE) et les isolats sélectionnés sont examinés pour le type de séquence multilocus et les facteurs de virulence. Parmi les 726 en 2012, 30 (4,1 %) des patients souffraient d’une infection à MSSA incluant 8 (1,1 %) avec bactériémie. Parmi 655 admissions en 2013, 13 (2,0 %)souffraient d’infection à MSSA dont 2 (0,3 %) avec bactériémie. Parmi 177 nouveau-nés testés pour portage de S. aureus, un total de 77 (44 %) ont été testés positifs. La souche PFGE-1-ST30 a été identifiées comme prédominante dans 3 des 30 nouveau-nés infectés (20 %) et chez 30 des 77 nouveau-nés colonisés (39 %). Ce clone persistant est pvl-négatif, tst-positif et émarge au groupe agr III. Nous n’avons pas trouvé de source environnementale. Le portage de MSSA est associé à l’utilisation de cathéter veineux central mais pas avec une sage-femme particulière ni infirmière ni médecin ou de box d’isolement. L’observation de l’attitude des soignants peut avoir propagé la transmission par les mains ou les vomissements. Malgré les interventions multimodales, la transmission et la colonisation par le clone a continué et un autre clone, PFGE-6-STS est devenu prédominant.
Nous concluons que les clones MSSA acquis à l’hôpital représentent une grande proportion de la colonisation par MSSA mais pas les infections par MSSA chez les nouveau-nés. Par opposition à la persistance de MSSA, le taux de transmission de l’infection baisse avec les interventions concomitantes. Il reste à établir si l’éradication des souches de MSSA acquises à l’hôpital peuvent encore réduire les taux d’infection.
Stapelton P. J., Murphy M., Mc Callion N., Brennan M., Cunney R., Drew R. J.
Arch Dis Child Fetal Neonatal Ed 2015 Sep 14
L’objectif de l’étude est d établir le nombre d’épidémies à micro organismes secrétant des bêta-lactamases à large spectre (ESBL) dans les unités de soins intensifs néonatals (NICUs), pour en déterminer les causes, le taux de mortalité, la proportion d’enfants colonisés et infectés et les interventions qui ont mis fin à l’épidémie. Nous avons réalisé une revue de la littérature anglaise, française et espagnole dans quatre banques de données. La recherche a été menée selon les recommandations PRISMA et l’extraction des données est réalisée selon les critères ORION pour l’étude des infections nosocomiales. 75 études rencontrent les critères d’inclusion. Il y a 1185 cas de colonisation, 860 infections et 139 morts. La durée moyenne de l’épidémie est de 6,2 mois (IRQ 2,0-7,5 mois). Le pathogène le plus souvent impliqué est la Klebsiella pneumoniae. Un staff trop peu nombreux est le facteur de risque le plus fréquent d’épidémie. La source la plus commune identifiée est l’admission d’un enfant colonisé par un ESBL avec une dissémination horizontale consécutive. Les grandes interventions décrites sont les procédures accrues de contrôle de l’infection et le screening du staff te de l’environnement. 26 études ont été incluses dans l’analyse quantitative. La meta analyse des effets indique un taux de mortalité accru chez les enfants qui ont développé une infection (31 %, 95 % CI 20 % à 43 %).
Nous concluons que les épidémies dans les NICUs sont associées à une mortalité significative et à une interruption prolongée. Le manque de personnel est le facteur de risque majeur mais n’est pas toujours visé dans les interventions. Des procédures de contrôle de l’infection a minima sont souvent impliquées comme contributrices de la dissémination des ESBL. Un meilleur rapport des épidémies peut aider à clarifier le rôle du screening de routine pour ESBL dans les NICUs.
Fabrizzi F., Messa P
Int J Artif Organs 2015 Oct 19 ; 38:471-480.
Les épidémies dues au virus de l’hépatite C (HCV) chez des patients en hémodialyse sont encore un problème important au niveau mondial. Nous avons réalisé une étude systématique des rapports concernant HCV dans les unités d’hémodialyse des pays développés et émergents (entre 1992 et 2015) pour évaluer les facteurs de risque et les pratiques associées à la transmission de HCV de patient à patient dans ce genre d’unité. Nous avons réalisé la recherche en utilisant les données de PubMed et des données de « Outbreak Database » ; les études ont été sélectionnées selon l’algorithme PRISMA. Les critères d’inclusion ont été établis avant d’extraire les données pour éviter les biais de sélection.
36 articles ont rapporté 45 épidémies qui englobent 335 patients différents sous hémodialyse ; aucun cas mortel n’a été détecté. La transmission nosocomiale de HCV est confirmée par analyse phylogénétique dans beaucoup d’études (n = 31 ; 69 %). Le partage de machines d’hémodialyse contaminées et des flacons multidoses (héparine ou solution saline) sont suggérées comme responsables de la transmission de HCV dans respectivement 8 (18 %) et 6 (13 %) des épidémies. Des brèches dans le nettoyage et la désinfection de l’environnement et des manquements dans la préparation des médicaments et dans les pratiques d’administration sont considérées dans 29 (65 %) des épidémies ; cependant, le mécanisme exact de transmission de HCV ne peut pas être déterminé dans chacune des unités où une épidémie a eu lieu.
Nous concluons que notre revue systématique des rapports sur les épidémies à hépatite C montre que, même si l’étendue totale de transmission de HCV dans les unités d’hémodialyse est inconnu, les épidémies continuent à survenir. Les respect total des procédures de contrôle de l’infection standard et spécifiques et un screening sérologique de routine pour anticorps anti HCV jouent un rôle central pour prévenir la transmission de HCV dans les unités d’hémodialyse.
Wong H., Eso K., Ip A., Jones J., KwonY., Powelson S., de Grood J., Geransar R., Santana M., Joffe A.M., Tatlor G., Missaghi J.
Syst Rev. 2015 Nov 7; 4:152
Une idée souvent utilisée pour contrôler les épidémies, l’efficacité de la fermeture de l’unité de soins n’est pas claire. Cette revue systématique cherche à identifier les études définissant et décrivant la fermeture de l’unité de soins dans un but de contrôle de l’infection et de déterminer l’impact de la fermeture de l’unité de soins comme intervention pour contenir l’épidémie. Nous avons recherché dans ces bases de données ans restriction de mots : Medline 1946 au 07 juillet 2014 ; Embase 1974 au 07 juillet 2014 ; Cinahl 1937 au 08 juillet 2014 et la base de données Cochrane pour les revues systématiques 2005 à mai 2014. Nous avons aussi recherché dans Inmed ; Lilacs ; les listes des références des articles retenus ; les comptes-rendus de conférences et les sites web du CDCP, ICID et WHO. Nous avons inclus les études concernant les patients hospitalisés dans les unités de soins aigus, la fermeture de l’unit » de soins en tant que mesure de contrôle, l’utilisation d’autres mesures de contrôle et les discussions au sujet du contrôle des épidémies sous investigation. Une approche par parties est utilisée pour évaluer la qualité de l’étude.
Nous avons inclus 97 études observationnelles anglaises et non anglaises. Aucune n’inclut une comparaison contrôlée entre la fermeture de l’unité de soins et une autre intervention. Nous avons trouvé que la fermeture de l’unité de soins était souvent utilisée comme partie du « bundle » des interventions mais ne pouvait pas déterminer son impact direct spécifique par rapport à toutes les autres interventions quand elle est utilisée en parallèle ou en séquence avec d’autres interventions. Nous n’avons pas trouvé de définition universelle de la fermeture de l’unité de soins qui soit largement acceptée. Sans aucune étude identifiée contrôlée publiée, la fermeture de l’unité de soins pour le contrôle de l’épidémie reste une intervention qui n’est pas « evidence based » et le personnel de soins devra nécessairement continuer à évaluer les risques associée à cet usage, prenant en considération la nature de l’épidémie, le type de pathogène et sa virulence, le mode de transmission et l’unité dans laquelle l’épidémie survient. Notre étude a révélé un manque majeur dans ce domaine.
Makuda O.,Odia O.
J Med Ethics 2015 Nov;4 (11) : 917-9.
Répondre efficacement à une épidémie requiert souvent que des processus de routine soient mis à l’écart en faveur d’approches non conventionnelles. Conséquemment, une réponse en situation d’urgence génère usuellement des dilemmes éthiques. L’émergence du virus Ebola dans les villes densément peuplées de Lagos et Port Harcourt au Nigéria apportèrent des avertissements peu encourageants sur l’épidémie à expansion rapide. Cependant, ces peurs ne se sont pas matérialisées surtout grâce à la réaction rapide de la réponse en urgence et aux organisations gérant les incidents et le WHO a maintenant déclaré le Nigéria exempt d’Ebola. Cependant, de nombreuses questions éthiques surgissent en relation avec la réponse à l’épidémie. Cet article discute certaines de ces questions éthiques et les leçons vitales tirées. Les questions éthiques relatives à la confidentialité, à la dignité des personnes, la non nuisance, la stigmatisation et les obligations éthiques des personnels de santé sont passées en revue. Les interventions mises en place pour assurer que la confidentialité et la dignité des personnes soient augmentées et que la stigmatisation soit réduite, incluant des rassemblements de la communauté la communication des connaissances et la formation du personnel de communication dans le cadre de la communication des résultats de l’Ebola.De plus, la formation en prévention et contrôle de l’infection ont aidé à apaiser les peurs des personnels de santé. Une catastrophe potentielle a ainsi été évitée lors de la remise en cause de l’utilisation de médicaments expérimentaux. D’autres pays actuellement confrontés à l’épidémie peuvent apprendre de l’expérience nigériane.
Deshpande A., Curran E. T., Jamdar S., Inkster T., Jones B. L.
J Hosp Infect. 2015 Oct; 91 (2) : 171-5
L’article rapporte une épidémie historique à Slamonella hadar dans une maternité. L’épidémie est survenue suite à l’admission d’un cas index infecté avec transmission à 11 autres individus sur une période de trois mois dans une unité de maternité et de néonatologie. Malgré une évaluation rigoureuse des pratiques cliniques, le screening des patients et du personnel et la révision des politiques de désinfection et de stérilisation, l’épidémie fut difficile à contrôler. Ceci montre probablement la capacité de S. hadar de survivre malgré tout dans l’environnement et de causer un portage asymptomatique avec des poussées intermittentes. Il est probable que le cas index soit une mère qui a contracté l’infection après avoir ingurgité de la nourriture suspecte. De plus, l’infection a pu se propager par l’utilisation partagée de tubes de paraffine jaune tendre utilisée pour la lubrification des thermomètres rectaux digitaux. Cette étude montre les difficultés à contrôler les épidémies à S. hadar dans les unités de maternité/néonatologie et montre ainsi l’importance de prélever très tôt des selles chez tout patient présentant ds symptômes diarrhéiques.
Hocine M. N., Temime L.
Am J Infect Control 2015 Jul 13
Dans les maisons de soins, le risque infectieux est élevé ce qui transforme en problème majeur les approches de contrôle de l’infection comme l’hygiène des mains (HH). Cependant, l’efficacité de HH dans ces milieux de soins n’est pas bien documentée et la compliance à l’HH est basse. Nous avons réalisé une revue systématique dans PubMed, Scopus, le Web des Sciences et dans les revues cliniques de Cochrane pour des études réalisées dans les maisons de soins qui décrivent soit une intervention liée à l’HH ou évaluent la compliance à HH et qui incluent des résultats infectieux mesurés. Deux révisions rencontrent de façon indépendante la sélection de l’étude. 56 études rencontrent les critères d’inclusion et sont revues. La plupart sont des rapports d’épidémies (39 %), suivies par les études observationnelles (23 %), les études contrôlées (23 %) et les études avant-après (14 %). 35 études (63 %) rapportent des résultats en faveur de HH sur au moins un de leurs résultats ; de plus, le taux de succès de contrôle de l’infection est plus élevé lorsque au moins une des interventions liée à HH (par exemple éducation du personnel à HH, accessibilité plus grande à la solution hydro alcoolique)était incluse (70 % versus 30 % en cas de non intervention). Cependant, seulement 25 % des études randomisées concluent que les interventions liées à HH conduisent à une réduction du risque infectieux. Les résultats de cette revue systématique suggèrent qu’il est nécessaire de disposer de plus d’évidence au sujet de HH dans les maisons de soins. Les études interventionnelles futures devraient augmenter leur rigueur méthodologique par l’utilisation de mesure de résultats clairement définis, des rapports ou trouvailles standardisés et un outil d’observation de HH applicable.
Lister D.M., Kotsanas D., Ballard S.A., Howden B.P., Carse E., Tan K., Scott C., Gillespie E. E., Mahony A. A., Doherty R., Korman T. M., Johnson P.D., Stuart R. L.
Am J Infect Control 2015 Oct 1;43 (10) : 1061-5
L’objectif de l’étude est de décrire la fin d’une épidémie à Enterococcus faecium résistant à la vancomycine (VREfm) dans un service de néonatologie. L’étude est réalisée dans une unité de soins intensifs néonatals et des nurseries pour soins particuliers dans un même service de santé. Nous avons relevé 44 cas de colonisation à VREfm de patients hospitalisés en néonatologie incluant 2 isolats cliniques (prélèvement oculaire et d’urines) et 42 isolats venant du screening. Les interventions menées sont une surveillance active par cultures, l’isolement des patients, les précautions de contact, un nettoyage poussé de l’environnement et l’éducation du personnel et des parents. Pour caractériser l’épidémie et affiner les procédures de contrôle de l’infection, nous avons utilisé le séquençage total du génome et la séquence multilocus. La prévalence maximale de la colonisation par VREfm sur tous les sites est de 31 % à la découverte de l’épidémie. Après l’intervention, la transmission s’est tarie dans les 8 semaines et nous n’avons pas retrouvé d’isolats de la souche de l’épidémie pendant les 12 mois qui ont suivi l’épidémie. Les écouvillons de l’environnement révèlent une colonisation par VREfm des pèse-bébé, des bains pour bébé et d’un frigo à médicaments à l’intérieur de l’unité de soins intensifs. Tous les isolats se rapportent à un seul type de séquence multilocus (type de séquence 796) et très clonées au niveau du coeur du génome.
Nous concluons que les interventions concertées de contrôle de l’infection sont efficaces pour terminer rapidement une épidémie de colonisation à VREfm type 796 dans une unité d’hospitalisation néonatale. Le typage de souche et une surveillance active des cultures sont critiques dans l’orientation de la gestion de cette épidémie. L’environnement confiné d’une unité de soins néonatals a probablement facilité l’éradication des réservoirs de VREfm chez les patients et dans l’environnement.
Clarivete B., Pantel A., Morvan M., Jean Pierre H., Parer S., Jumas-Bilak E., Lotthé A.
J Hosp Infect. Sep 28 S0195-6701
L’émergence et la propagation des Entérobactéries productrices de carbapenemase (CPE) sont devenues un problème majeur de santé publique. La prévention et le contrôle des infections à CPE dépendent des précautions d’isolement pour les porteurs et d’un screening actif et du suivi des contacts. L’objectif de l’étude est de mettre en place un registre ouvert des cas et des contacts pour une gestion rapide d’une épidémie, la collection de données à long terme et l’investigation épidémiologique. Tous les cas , définis comme des patients (infectés ou colonisés) présentant une culture positive à CPE pendant leur hospitalisation et les contacts (les patients soignés par la même équipe soignante et considérés comme cas) sont enregistrés dans une base de données progressive. Les séjours hospitaliers sont doublement référencés pour chaque nouvelle entrée et les liens épidémiologiques sont investigués (par exemple les contacts partagés). Tous les cas et contacts non négativés par un screening complet sont enregistrés dans une liste active. Entre octobre 2012 et novembre 2014, nous avons enregistré 30 cas et 1268 contacts parmi lesquels 24 sont liés à 2 ou 3 cas séparés. Seulement 6,5 % des contacts présentent un screening complet avec 3 prélèvements rectaux et 1145 contacts sont encore enregistrés dans la liste de surveillance active. 2 épidémies (12 et 9 cas) survinrent à 9 mois d’écart. Le référencement croisé des données d’hospitalisation par l’utilisation du registre montre des liens épidémiologiques entre des cas de patients positifs à CPE qui semblent non liés et suggèrent une source de transmission environnementale ce qui fut démontré par la suite. Nous avons mis en place un outil simple et à plusieurs fonctions pour gérer les épisodes à CPE et investiguer les liens épidémiologiques. Des efforts sont nécessaires pour développer le screening des contacts patients qui peuvent occulter les sources de transmission. Un registre régional peut être d’une grande aide.

1. Introduction
Le rotavirus est longtemps resté la principale cause de gastroentérite virale de l’enfant de moins de 5 ans en Belgique, donnant parfois lieu à des épidémies nosocomiales. Le tableau clinique est classiquement dominé par des diarrhées aqueuses d’une durée de 3 à 7 jours, associées à un risque de déshydratation, de déséquilibre ionique et d’acidose métabolique particulièrement important chez l’enfant de moins de 2 ans. En néonatologie, la symptomatologie est plus variable et atypique (selles plutôt glaireuses et hémorragiques, ballonnement abdominal, instabilité hémodynamique, bradycardie, apnées…) et une possible association avec l’entérocolite nécrosante reste suspectée, bien que controversée.1-3 Un portage asymptomatique est également possible à tout âge.
Le virus se transmet par voie féco-orale ou via les vomissures du patient, de façon directe ou indirecte. La contagiosité est maximale en période symptomatique, mais peut persister, à moindre échelle, jusqu’à 10 jours après la fin des diarrhées. La période d’incubation est classiquement inférieure à 48h.
En 2006, la commercialisation européenne par GSK du Rotarix®, vaccin vivant atténué oral monovalent, a considérablement modifié l’épidémiologie de ce virus. Ce premier vaccin fut suivi en 2007 d’un second vaccin oral, pentavalent, le RotaTeq® (Sanofi Pasteur MSD). La Belgique, accompagnée de l’Autriche, du Luxembourg et de la Finlande, fut l’un des premiers pays d’Europe de l’Ouest à l’introduire dans son calendrier de vaccination. La première dose peut être administrée dès 6 semaines, et l’intervalle minimal entre deux doses est de 4 semaines. Le Rotarix® nécessite deux doses, contre trois pour le RotaTeq®.
L’impact de cette vaccination a récemment été évalué en se basant sur les données collectées entre 2005 et 2013 dans 11 hôpitaux belges.4 Une réduction de 70 à 80% du nombre absolu de tests diagnostiques positifs a ainsi été objectivée entre 2006 et 2012. La diminution d’incidence de cette pathologie dans la population générale permet de protéger indirectement les nourrissons de moins de 2 mois qui n’ont pas encore pu être vaccinés. Dans cette tranche d’âge, la diminution du nombre de cas depuis l’introduction de la vaccination a été estimée à 50%.
Le diagnostic de l’infection à rotavirus repose essentiellement sur la détection directe des constituants viraux sur un prélèvement de selles. La recherche dans d’autres prélèvements biologiques (sang, LCR) peut également se faire mais reste du domaine de la recherche.
Cette détection se fait le plus souvent à l’aide de tests immunochromatographiques utilisant des anticorps ciblant la protéine virale VP6. Cette technique simple et rapide offre des performances analytiques théoriques excellentes (sensibilité 80% et spécificité 100% par rapport à la PCR) et offre l’avantage de permettre une détection simultanée de plusieurs virus entériques (rotavirus, adénovirus, plus rarement norovirus).
Le diagnostic peut également se faire par technique immuno-enzymatique (ELISA), dont les performances sont similaires à l’immunochromatographie. Cette technique est plus adaptée aux grandes séries d’analyse qu’à la routine d’un laboratoire périphérique.
Une détection du génome viral par RT-PCR est enfin possible. Elle offre des performances supérieures aux deux autres techniques mais reste encore trop coûteuse pour être effectuée en routine.
Un résultat positif signe la présence de rotavirus dans les selles, mais n’élimine pas la possibilité d’une co-infection par un autre entéropathogène (10% des cas). En l’absence de symptomatologie digestive, un test positif signera un simple portage asymptomatique.
Le rotavirus, fort contagieux, est transmis par contact direct ou indirect via les selles et vomissures du patient. Il convient donc de renforcer les mesures de précautions générales et d’y ajouter les précautions additionnelles s’appliquant aux germes transmis par contact.
Ceci implique donc une hygiène des mains rigoureuse avec présence de solution hydro-alcoolique en chambre, le port de gants et d’une blouse à usage unique, un hébergement en chambre seule ou cohorté avec d’autres patients symptomatiques, un nettoyage quotidien de la chambre à l’aide d’un détergent-désinfectant type Incidin ® (désinfectant sans aldéhyde, à base de 1-propanol et 2-propanol), et la présence en chambre d’un matériel de soin dédicacé au patient (tensiomètre, pèse-personne, porte-perfusion, stéthoscope, …) qui sera convenablement lavé et désinfecté à l’Incidin ® avant sa réutilisation pour un patient tiers. Notons que le virus est également sensible à l’éthanol 95%, au formol 2%, à l’hypochlorite de sodium 2% ainsi qu’à une combinaison d’ammonium quaternaire et d’alcool, mais il nécessite toujours une exposition prolongée.
Ces mesures devront être maintenues durant toute la durée de la symptomatologie du patient soit environ 7 jours.
Au départ du patient, le personnel d’entretien devra nettoyer la chambre avec un détergent suivi d’eau de javel à 1000 ppm ou 2%.
L’unité de néonatologie des Cliniques universitaires Saint-Luc comprend 28 lits répartis en 5 salles, et accueille 300-350 enfants chaque année. Ce service a connu une importante épidémie à K. pneumoniae OXA-48 en septembre 2014, événement qui a fortement sensibilisé le personnel aux règles de prévention de la transmission des infections.
En février 2015, l’équipe d’hygiène hospitalière fut contactée par le service suite au retour d’un test rotavirus positif, prescrit pour bilan de fébricules. Ce cas index ne présentant pas de diarrhée, son isolement ne fut pas recommandé. Un renforcement des mesures d’hygiène des mains et le port de gants lors des manipulations fut préconisé. Les autres patients de l’unité furent tous testés négatifs.
Douze jours plus tard, l’équipe d’hygiène fut recontactée à propos d’un deuxième cas positif. Il s’agissait d’une jeune fille de 5 jours, transférée d’une autre institution dans laquelle elle avait déjà été testée positive pour le rotavirus. Son isolement fut décidé suite à la présence de symptômes digestifs, bien que frustres.
Trois jours plus tard, un troisième patient, asymptomatique et préalablement testé négatif, fut testé positif. La clinique ayant motivé la prescription de ce test ne put être clarifiée. S’agissant ici d’une acquisition documentée dans l’unité, le patient fut isolé avec précautions additionnelles de type contact (gants, blouse). Il fut alors décidé de dépister l’ensemble des patients non-documentés positifs de l’unité (15). Aucun ne présentait de symptomatologie, mais la fragilité des patients présents et la documentation de cas d’entérocolite nécrosante associée au rotavirus poussèrent l’équipe à une prise de mesure de protection maximale. Le seuil épidémique fut fixé à 2 acquisitions.
Dix selles purent être envoyées au laboratoire le jour-même, trois d’entre elles furent testées rotavirus positives. La cellule de crise fut activée, les patients positifs furent tous isolés, les enfants et le personnel infirmier furent cohortés.
Malgré ces mesures sévères, de nouveaux cas de portage asymptomatique furent mis en évidence. Certains patients positifs furent ultérieurement testés négatifs, puis à nouveau positifs quelques jours plus tard.
Suite à ce manque de reproductibilité des résultats et à la non-compréhension des causes de la progression de l’épidémie, la fiabilité du test diagnostic utilisé fut remise en question. Le laboratoire utilisait depuis plusieurs années le test immuno-enzymatique (Elisa) Premier Rotaclone® commercialisé par la firme Meridian Bioscience Inc et dont les performances analytiques rapportées tant par la firme que dans la littérature apparaissaient tout à fait satisfaisantes (Sensibilité = 81-100%, spécificité = 92-100%).8-10 Ce test est d’ailleurs utilisé par le Centre National de Référence (CNR) belge du rotavirus situé à l’UZ Leuven. Ce test était réalisé tous les jours par une équipe de technologues bien formée et expérimentée. Le kit était conservé dans un frigo dont la température est monitorée, comme recommandé dans la procédure, et la date de péremption en était vérifiée à chaque nouvelle série d’analyse. Les résultats étaient rendus par détermination visuelle comme conseillé par la firme : les puits présentant une coloration bleue plus marquée que le contrôle négatif étaient considérés positifs. Jusqu’alors aucun problème n’avait été posé sur les échantillons provenant de l’unité de néonatologie (+/- 35-40 échantillons testés par an).
Les selles positives (1/patient), conservées à 4°C, furent alors envoyées au CNR (UZ Leuven) pour recherche de rotavirus par RT-PCR. Toutes revinrent négatives. Il s’agissait donc d’une pseudo-épidémie, qui aura finalement duré près d’un mois.
Le rotavirus est une étiologie bien décrite d’épidémies nosocomiales de gastroentérite. Si l’incidence de telles épidémies a nettement reculé depuis l’instauration de la vaccination, les nourrissons, non vaccinés, restent encore une population à risque. Ils constituent une population difficile à diagnostiquer ; leur symptomatologie peut être absente ou très atypique et le taux d’excrétion de particules virales dans les selles peut être nettement plus modeste que dans le reste de la population. Néanmoins, les associations décrites par certains auteurs entre le rotavirus et des affections menaçant le pronostic vital de ces nouveau-nés (entérocolites nécrosantes, bactériémies secondaires, …) rendent les pédiatres sensibles à ce pathogène.
Le test immuno-enzymatique (Elisa) Premier Rotaclone® est utilisé au laboratoire depuis plusieurs années sans qu’aucun incident n’ait été jusqu’ici à déplorer. Si la firme signale la possibilité de faux négatifs sur échantillons néonatals, le taux d’excrétion virale dans les selles des nouveau-nés pouvant être très faible, elle ne rapporte pas de faux positifs dans cette tranche d’âge. 8
En relisant la procédure à suivre, il s’est avéré que deux étapes analytiques pouvaient être améliorées :
• D’une part, il est apparu que l’équipe technique diluait trop peu les selles des patients avant analyse. Les selles étaient en effet diluées à 1/10 dans du PBS (tampon phosphate salin sans conservateur) plutôt qu’à 1/30 dans le diluant fourni par la firme (solution saline tamponnée avec 0.02% de thimérosal). Cette erreur de dilution a aujourd’hui été corrigée.
• D’autre part, les modifications de couleurs étaient lues à l’œil nu et non par un spectrophotomètre, ce qui apporte une part de subjectivité au test. Ceci était néanmoins en accord avec les recommandations de la firme, qui ne favorisait pas l’une ou l’autre alternative. La lecture des tests positifs de cette pseudo-épidémie au spectrophotomètre a rapporté des résultats douteux (Absorbance à 450 nm proche du seuil de positivité, fixé par la firme à 0.150) rapportés « positifs faibles ».
La lecture oculaire n’a depuis plus été autorisée sur les échantillons douteux ou provenant de l’unité de néonatologie.
Suite à ces changements, les selles « positives faibles » se sont fortement raréfiées sans totalement disparaître dans les jours suivant l’identification de la pseudo-épidémie. Plus aucun cas douteux ou positif faible n’a été rapporté par la suite.
Une unité de néonatologie de Taiwan a rapporté en 2014 une expérience similaire.11 En 2011, 7 jeunes patients présentant une symptomatologie abdominale furent testés positifs sur une période de 2 mois, résultats ultérieurement infirmés par RT-PCR. Le laboratoire utilisait alors un kit de détection immuno-enzymatique différent de celui utilisé aux Cliniques Universitaires Saint-Luc (RIDASCREEN Rotavirus, R-Biopharm AG, Darmstadt, Germany). L’équipe n’avait pu expliquer ces faux-positifs, mais un changement de version du kit avait permis une résolution de la situation.
D’autres faux-positifs et d’autres pseudo-épidémies de ce type ont également été décrites en néonatologie pour d’autres virus pathogènes du système digestif (tableau 1).12-16 L’histoire des pseudo-épidémies est toujours identique : un test immunoenzymatique ou immunochromatographique sur selles est prescrit pour documenter une symptomatologie atypique et revient positif. L’unité est dans un second temps dépistée, que les patients soient symptomatiques ou non. Face à l’incohérence des résultats ou de l’évolution, les selles sont envoyées pour confirmation par PCR et reviennent négatives. Les tests utilisés varient, et ne sont pas commercialisés par la même firme.
L’origine de ces faux-positifs propres aux nouveau-nés n’est pas encore élucidée. Si l’on peut raisonnablement suspecter l’existence d’interférences entre certains éléments présents dans les selles des nouveau-nés et les tests immunologiques commercialisés, le ou les facteurs à l’origine de ces interférences restent indéterminés. Ces éléments pourraient n’être présents que de façon épisodique voire épidémique, ce qui expliquerait l’existence de « clusters » de faux-positifs. Ainsi par exemple, la présence de grande quantité de protéine A de Staphylococcus aureus dans l’échantillon a été rapportée par la firme Fisher Scientific comme cause possible de faux positif sur les tests immunochromatographiques de détection d’adénovirus. Il n’est pas précisé sur quel type de prélèvement cette interférence a été observée. 17
Dans notre situation, si une partie du problème peut être attribuée à l’erreur de dilution de la selle, le fait que malgré des années d’utilisation aucun problème de ce type n’ait été déploré auparavant plaide en faveur de l’existence d’un facteur surajouté, microbiologique, médicamenteux ou autre, qui interférerait avec le test. La dilution supplémentaire de la selle entraînerait une dilution supplémentaire de ce facteur qui ne serait alors plus présent en quantité suffisante pour que l’interférence soit visible.
Tableau 1 : Caractéristiques de différentes pseudo-épidémies à virus entéropathogènes rapportées au sein de services de néonatologie.
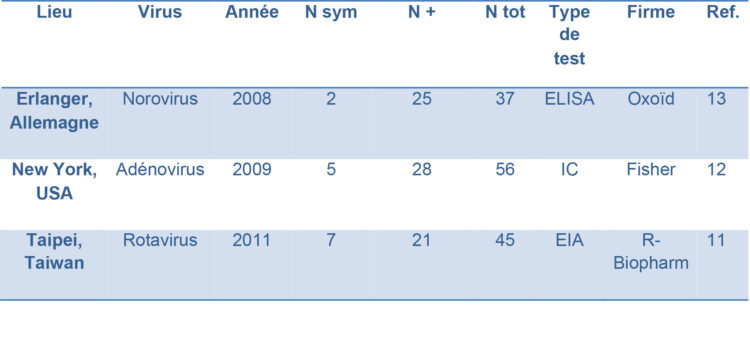
N sym = Nombre de patients présentant des symptômes digestifs, frustres ou francs.
N + = Nombre de patients testés positifs
N tot = Nombre total de patients testés.
IC = Immunochromatographie.
Une pseudo-épidémie peut être définie comme un faux cluster de vraies infections ou un vrai cluster de fausses infections. 18-19
Dans la première situation, des patients réellement infectés sont erronément reliés comme cas d’une épidémie. Ceci peut être par exemple le cas lorsqu’un laboratoire change de méthode diagnostique pour une pathologie : si le nouveau test utilisé offre une sensibilité supérieure au test précédent, une fausse augmentation de l’incidence de la pathologie peut être objectivée et erronément interprétée comme une épidémie.
Dans le deuxième cas, il s’agit d’une erreur de diagnostic touchant une population par ailleurs reliée, que ce soit par la localisation des patients, leur groupe d’âge, ou autre. Ceci peut survenir lorsqu’un test est prescrit de façon inappropriée et/ou suite à un problème au laboratoire (erreur de manipulation, contaminations, réactifs périmés,…).
Ces pseudo-épidémies sont coûteuses tant sur le plan humain que financier, particulièrement lorsqu’elles sont liées à une erreur diagnostique. Elles peuvent engendrer une charge de travail supplémentaire pour l’équipe soignante, un traitement inapproprié des patients, un stress inutile pour tous, ainsi qu’une perte de confiance dans le laboratoire quand celui-ci joue un rôle dans leur genèse.20 Leur identification est donc primordiale. Il est, pour ce faire, capital d’envisager cette possibilité face à toute situation épidémique, en particulier lorsqu’il existe des points nébuleux (résultats contradictoires, germes atypiques, discordances clinico-biologiques, …) et d’engager alors une discussion pluridisciplinaire.
Les pseudo-épidémies sont des événements indésirables coûteux, qui peuvent impacter négativement la bonne prise en charge des patients et la confiance entre les différents acteurs du secteur médical. En situation épidémique, toute incohérence devra donc faire envisager cette possibilité, qui devra faire l’objet d’une discussion entre l’équipe soignante, l’équipe d’hygiène hospitalière et le laboratoire.
Il semble exister des interférences non élucidées lorsque les tests immunochromatographiques ou immunoenzymatiques sont utilisés sur les selles de patients hospitalisés en néonatologie. Ces interférences peuvent être responsables de faux-positifs et donc de pseudo-épidémies. Afin d’éviter leur survenue, il est important de connaître les tests réalisés par le laboratoire et de veiller à ce que ceux-ci soient prescrits avec parcimonie, dans un cadre symptomatologique bien délimité.
1. Haffejee IE. Neonatal rotavirus infection. Rev Infect Dis 1991 ; 13 :957-62
2. Sharma R et al. Clinical manifestations of rotavirus infection in the neonatal intensive care unit. Pediatr Infect Dis J 2002 Dec;21(12):1099-105.
3. Tai IC et al. Clinical manifestations of a cluster of rotavirus infection in young infants hospitalized in neonatal care units. J Microbiol Immunol Infect. 2012 Feb;45(1):15-21
4. Standaert B. et al Medium to long-term impact of rotavirus vaccination on hospital care in Belgium : a 7-yeat follow-up of the Rotavirus Belgium Impact Study (RotaBIS) Infect Dis Ther 2015 Dec 31 (epub)
5. Avis du Conseil Supérieur de la Santé n°9295 et 8883 :
Analyse du risque bénéfice de la vaccination contre le rotavirus en Belgique (réaction suite à une prise de position française récente). Juillet 2015.
6. REMIC Référentiel en microbiologie médicale 5ème édition 2015 (SFM, SFP, SFMM)
7. The Sanford Guide to Antimicrobial Therapy 2012-2013: 23ème edition Belgique/Luxembourg.
8. Meridian Bioscience, Inc. Premier® Rotaclone® product insert. Cincinnati, Ohia, USA. Révision: 01/2015.
9. Gautam R. et al. Comparison of Premier™ Rotaclone®, ProSpecT ™, and RIDASCREEN ® rotavirus enzyme immunoassay kits for detection of rotavirus antigen in stool specimens. J Clin Virol. 2013 Sep ; 58 (1) : 292-294
10. Evaluation of seven commercial assays for detecting group A rotavirus antigen. PHLS East Virology Advisory Committee, internal document.
11. Tan BF et al. Pseudo-outbreak of rotavirus infection in a neonatal intensive care unit. J Microbiol Immunol Infect. 2014 Nov 22.
12. Faden H et al. Pseudo-outbreak of adenovirus infection in a neonatal intensive care unit due to a false –positive antigen detection test. J Clin Microbiol. 2010 Nov;48(11):4251-2
13. Köhler H, Jüngert J and Korn K : Norovirus pseudo-outbreak in a neonatal intensive care unit. J Pediatr Gastroenterol Nutr 2008 Apr ; 46(4) :471-2
14. Terashita Gastelum D et al. Pseudo-outbreak of respiratory syncytial virus infection in a neonatal intensive care unit due to cross-reactivity of surfactant and a rapid immunoassay. Infect Control Hosp Epidemiol. 2009 Sep;30(9):890-2.
15. Rand KH, Houck HJ, Swingle HM. Rotazyme assay in neonates without diarrhea. Results of screening survey and preliminary analysis of false positive specimens. Am J Clin Pathol 1985 Dec; 84(6):748-51.
16. Niizuma T et al. False positive of an immunochromatography kit for detection of norovirus in neonatal feces. J Infect Chemother 2013 Feb ; 19(1) : 171-3.
17. Fischer Scientific Company. Sure-Vue™ Adeno Test Kit product insert. Pittsburgh, Pennsylvania, USA. Révision : 2002.
18. Curran ET. Outbreak Column 7: Pseudo-outbreaks part 1. Journal of infection prevention 2013 March ; 14(2) : 69-74
19. Curran ET. Outbreak Column 7: Pseudo-outbreaks part 2. Journal of infection prevention 2013 May ; 14(3) : 108-113
20. Shears P. Pseudo-Outbreaks. Lancet 1996 Jan ;347:138

L’offre en blouses d’isolation est actuellement considérable. Vu que les fabricants n’utilisent pas tous les mêmes méthodes de test pour déterminer le niveau de protection, il n’est guère évident pour l’utilisateur de procéder à une comparaison objective de ces blouses. Des méthodes de test ont dès lors été conçues afin d’objectiver de manière spécifique les performances des vêtements d’isolation (EPI ou équipements de protection individuelle). Il peut y avoir une confusion avec les exigences auxquelles les blouses d’isolation doivent répondre dans la pratique. Certains fabricants/fournisseurs de blouses d’isolation appliquent parfois des normes utilisées pour les tenues d’opération afin de clarifier les capacités de protection des blouses d’isolation.
Dans un contexte de prévention contre les infections, il est dans tous les cas nécessaire que l’utilisateur dispose de données objectives concernant les capacités de protection.
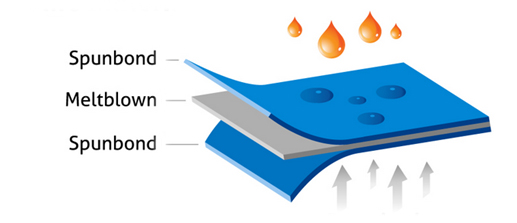
La composition la plus usitée pour les blouses d’isolation est SMS (Spunbond + Meltblown + Spunbond). Il s’agit d’une blouse non tissée constituée de trois couches, une couche de meltblown formant la couche du milieu. La couche du milieu peut également se composer de deux ou trois couches (respectivement SMMS ou SMMMS).
Dans le processus de fabrication de tissus spunbond, des polymères fondus (polypropylène (PP) ou combinaison entre PP et polyéthylène (PE)) sont transformés en filaments continus transformés en rouleaux de non-tissé. On utilise également l’abréviation PPSB lorsqu’une base PP a été utilisée (Spunbond polypropylène). Des blouses d’isolation peuvent également se composer uniquement de PP tissé, avec par exemple un revêtement supplémentaire en PE.
La technologie metlblown permet de produire des fils ultrafins à l’aide d’air chaud soufflé sur le flux de polymères fondus. Les meltblowns sont surtout utilisés pour la production de tissus absorbants et de matériel d’incontinence (1).
Si le fabricant/fournisseur des blouses d’isolation fait référence à la directive 93/42/CEE, cela signifie uniquement que la blouse en question est considérée comme un dispositif médical au sens large du terme. Un dispositif médical est tout instrument, appareil, équipement, matière ou autre article destiné par le fabricant à être utilisé chez l’homme à des fins de diagnostic, de traitement ou d’atténuation d’une maladie, d’atténuation ou de compensation d’une blessure ou d’un handicap. Les accessoires et logiciels nécessaires à un bon fonctionnement de ces produits relèvent également de la directive. Les dispositifs sont subdivisés en quatre classes. Les règles de classification se fondent sur la vulnérabilité du corps humain. Les procédures d’évaluation de conformité pour les blouses d’isolation de la classe I peuvent être effectuées, en règle générale, sous la seule responsabilité des fabricants, vu le faible degré de vulnérabilité de ces produits (2).
Les directives américaines AAMI (AAMI : Association for the Advancement of Medical Instrumentation) pour vêtements de protection stipulent des normes de performance minimales dans le domaine de la solidité, des performances de protection et de résistance à l’humidité. Les vêtements doivent répondre à un niveau de qualité (AQL) de 4 %. Chaque vêtement doit offrir une protection totale à l’avant, à l’arrière et le long des coutures.
Les vêtements portent une étiquette mentionnant le niveau de protection : le niveau AAMI 1 est le plus bas, le 4 étant le plus élevé.
AATCC= American Association of Textile Chemists and Colorists.
AATCC-42 (résistance à la pénétration) : mesure la résistance de tissus contre la pénétration de liquides lorsqu’ils entrent en contact avec de l’eau.
AATCC-127 (pression hydrostatique) : mesure la résistance de tissus contre la pénétration de liquides lorsqu’ils entrent en contact avec de l’eau sous pression constante et croissante.
ASTM = American Society of the International Association for Testing and Materials.
ASTM F1670 : test de pénétration de sang synthétique.
ASTM F1671 : test de pénétration d’un micro-organisme de substitution (bactériophage Phi-X174) qui est utilisé comme modèle du virus de l’hépatite C (plus petit pathogène viral transmissible par le sang connu) et simule tant l’hépatite B que le VIH.
La directive européenne 89/686/CEE fait référence à des organismes notifiés pour déterminer le niveau de protection des vêtements de protection contre des agents microbiologiques.
La norme européenne EN 14126 détermine les exigences auxquelles les vêtements de protection doivent répondre pour offrir une protection contre ces agents. La norme vise de manière spécifique les combinaisons devant offrir une protection contre les liquides, aérosols et poussières. Les méthodes de test utilisées sont ISO 16603 et ISO 16604 pour déterminer le niveau de protection ; six classes de protection existent. À cet égard, les méthodes de test américaines (ASTM F 1670 et ASTM F1671) peuvent également être utilisées. Vous trouverez de plus amples détails à ce propos dans l’article de Noso-info intitulé « Degré d’efficacité des combinaisons de protection contre les agents biologiques» (5).
Cette norme européenne décrit des méthodes de test s’appliquant de manière spécifique aux vêtements d’opération et champs de protection.
Méthodes de test :
a) Protection contre la pénétration d’eau (ISO 20811) : mesure l’étanchéité de la blouse ; chevauche partiellement la barrière bactérienne humide. Le matériau est soumis à une pression de l’eau qui augmente de 10 cm/min. Le test prend fin lorsque des gouttes traversent le matériau. Le résultat s’exprime en cm H2O.
b) Protection contre la pénétration de bactéries (humide) (ISO 22610) : le test mesure la résistance d’un matériau à la pénétration de bactéries dans un liquide (par ex. sang) lorsque ce matériau est soumis à un frottement mécanique. Le test est effectué à l’aide de S. aureus. Le résultat s’exprime en BI (barrier index, avec une valeur maximale de 6).
c) Protection contre la pénétration de bactéries (sèche) (ISO 22612) : spécifie une méthode d’essai pour évaluer la résistance de matériaux de protection à la pénétration de particules porteuses de bactéries dans un environnement sec (par ex. dans de la poussière, cellules épithéliales). Du talc contaminé avec B. subtilis est appliqué par vibration sur le matériau (108 CFU/g talc et 30 min. de temps de vibration). Le résultat s’exprime en log10 CFU.
Les exigences auxquelles une blouse d’isolation doit répondre sont déterminées par une analyse de risque. Une combinaison destinée à être portée en présence de patients souffrant de fièvre hémorragique devra par conséquent satisfaire à d’autres exigences que dans le cas d’une blouse d’isolation utilisée avec des patients colonisés par le MRSA et où aucun contact avec des liquides corporels n’est attendu.
Le niveau de protection d’une blouse d’isolation peut déjà être évalué sur la base de quelques spécifications techniques limitées comme la composition, le poids par m² (par ex. 20 g/m2, 35 g/m2,…) et le niveau de la colonne d’eau auquel les blouses peuvent résister. Lorsque, dans les caractéristiques d’une colonne d’eau, ≥ 28 cm apparaît, il est alors évident que les propriétés de protection de ce type de blouse sont supérieures au type mentionnant une colonne d’eau de ≥ 18 cm. Même si les deux blouses sont perméables à l’eau, des liquides corporels traverseront cependant les deux types de blouse en cas de pression élevée. C’est par exemple le cas lorsqu’on se penche sur le lit d’un patient souillé de liquides.
Dans la pratique, une blouse d’isolation doit cependant offrir un niveau de protection suffisant contre la pénétration de micro-organismes à l’état sec. Le résultat de la méthode de test EN ISO 22612 sera dès lors déterminant dans ce cas. Si seules les méthodes de test américaines sont à disposition, il est possible d’utiliser le niveau de protection AAMI 1 car le contact liquide attendu est ici faible.
Le choix pour une blouse d’isolation conforme à EN ISO 22612 mais offrant une faible résistance aux liquides (<20 cm H2O) a également des retombées financières pour l’hôpital : ces blouses peuvent être jusqu’à 1/3 moins chères que des blouses comparables offrant un niveau de protection contre des liquides légèrement supérieur.
Si une protection supplémentaire s’avère cependant nécessaire en cas de risque de contact avec des liquides corporels, il est possible d’opter pour une blouse d’isolation combinée à une blouse en plastique jetable (7) offrant une protection optimale à l’avant du corps, évitant de souiller les vêtements de travail. Vu qu’une blouse en plastique de ce type n’est pas toujours nécessaire, le coût de cette protection supplémentaire est négligeable.
1. Lim H. A review of spun bond process. Journal of Textile and Apparel, Technology and Management, 2010,6 (3):1-13.
2. Directive 93/42/CEE du Conseil, du 14 juin 1993, relative aux dispositifs médicaux. Journal officiel n° L 169 du 12/07/1993 p. 0001 – 0043.
3. Association for the Advancement of Medical Instrumentation, American National Standards Institute. Liquid barrier performance and classification of protective apparel and drapes intended for use in health care facilities, ANSI/AAMI PB70:2003.
4. Centers for Disease Control and Prevention. Considerations for selecting protective clothing used in healthcare for protecting against microorganisms in blood and body fluids. Last updated: February 10, 2015. http://www.cdc.gov/niosh/npptl/topics/protectiveclothing/
5. Van Laer F. Degré d’efficacité des combinaisons de protection contre les agents biologiques Noso-info, 2014, 18 (4):5-6.
6. Dupont. EN 13795. Understanding the European Standard. Surgical gowns, drapes and clean air suits. http://www2.dupont.com/Medical_Fabrics/en_US/assets/downloads/EN13795_Understanding%20the%20European%20Standard.pdf.
7. Candlin J, Stark S. Plastic apron wear during direct patient care. Nursing Standard, 2005, 20 (2): 41-46.


L’assistance et l’expertise d’une outbreak support team (OST) offrent une plus-value absolue pour endiguer une épidémie au sein d’un hôpital. Les problèmes sont analysés avec davantage de sens critique et les solutions proposées sont plus rapidement mises en œuvre. Nous pouvons en témoigner ici à l’hôpital général AZ Nikolaas et nous en savons toujours gré. Je vais tenter de souligner les aspects les plus importants de cette collaboration.
A l’AZ Nikolaas, les premiers cas d’entérobactéries productrices de carbapénémases (CPE) ont été découverts au cours du premier trimestre de 2011. Durant l’été 2011, 4 nouveaux patients ont été détectés et nous avons lancé une concertation de crise et mis en place des mesures. En janvier 2012, nous avons mis en œuvre la nouvelle directive du Conseil supérieur de la Santé (CSS). Il s’en est suivi davantage de dépistages, et la transmission entre patients d’un même service ne fit plus de doute. L’environnement et les matériaux jouaient un rôle important dans cette transmission. La surveillance stricte au niveau national a permis de préciser notre problème auprès du service de surveillance de santé publique du gouvernement flamand (Toezicht Volksgezondheid) et de l’Institut scientifique pour la santé publique (ISP). Il s’en est suivi une première réunion avec les personnes suivantes :
– Toezicht Volksgezondheid : M. Wim Flipse, Dr. Pia Cox
– ISP : Dr. Boudewijn Catry, Mme Bea Jans,
– Dr. Toon Braye – AZ Nikolaas : Prof P.Duyck, Dr. AM Verbruggen
Durant les concertations successives, cette équipe a été rejointe par l’équipe d’hygiène hospitalière, les membres de la direction et les infirmiers et professionnels paramédicaux directement impliqués.
Lors de la première réunion, il était clair que toutes les mesures ne devaient pas êtes mises directement en œuvre. Les experts externes ont proposé de poser des priorités :
– Améliorer l’hygiène des mains
– Améliorer l’hygiène en général
– Créer des cohortes de patients CPE pour les soigner
Ensuite, l’attention s’est focalisée sur ces 3 aspects ; toutes les ressources matérielles et humaines ont été employées pour atteindre cet objectif.
La présence d’experts externes a renforcé l’implication de la direction face à cette problématique. Le feed-back qui fut demandé lors des concertations a également permis de mettre immédiatement en œuvre les mesures proposées.
Ces réunions avec des experts externes ont motivé les troupes à enregistrer des résultats et à introduire des mesures malgré le coût que cela engendre.
Les avis difficiles à prendre, surtout lors de situations conflictuelles entre prestations de soins et isolements, ont été traités au cours des réunions avec l’OST. Il en a résulté un échange utile, où les experts ont été confrontés aux problèmes quotidiens qui n’étaient pas abordés dans la directive générale. Ainsi, les soins aux personnes porteuses de CPE dans les maisons de repos et de soins requièrent des mesures de précaution adaptées. Généralement, cela donne lieu à un avis personnalisé pour le patient concerné.
En outre, l’avis des experts a été demandé à maintes reprises pour savoir comment interpréter la directive 8791[1] du CSS. En effet, il s’est avéré que différentes interprétations étaient possibles lors de la mise en œuvre de cette directive sur le lieu de travail.
Certains avis des experts ont été abordés, mais pas mis en force. Cela a toujours été correctement rapporté à l’OST. Le screening des infirmiers en est un exemple.
Ces mesures ont été placées plus tard dans le cadre du grand ensemble visant à endiguer l’épidémie. le coût que cela engendre.
Confier l’observation du lieu de travail à des infirmiers externes permet d’avoir une indication plus objective du respect de l’hygiène des mains. Cela demande toutefois une grande expertise dans le chef des observateurs externes. Une expérience en la matière est souhaitable pour interpréter correctement toutes les indications d’hygiène des mains durant une prestation de soins.
D’un coup, tous les membres de la direction ont été impliqués dans la mise en œuvre des conditions élémentaires et le respect de l’hygiène des mains. La fonction d’exemple des membres de la hiérarchie a fait office de catalyseur. L’hygiène des mains n’était plus un sujet d’hygiène hospitalière mais une priorité à l’échelle de l’hôpital tout entier.
La crise inhérente à l’épidémie a permis d’entreprendre des actions positives et de libérer des ressources financières. Au moins 2 infirmiers par service ont reçu une formation d’infirmier de référence en hygiène hospitalière.
La collaboration avec l’OST a permis d’obtenir un point de vue général au sein de l’hôpital, soutenu par les différentes directions (Conseil d’administration, Directeur Général, Médecin-chef, Directeur des soins infirmiers, Responsable de l’entretien et du nettoyage) et appuyé par l’expertise de l’OST. En outre, des moyens financiers et du temps ont été dégagés pour réaliser ces objectifs communs.
1. Conseil 8791 du Conseil Supérieur de la Santé : http/:www.health.belgium.be


Introduction
Alors qu’on attend toujours la publication des « Recommandations nationales pour la maîtrise de l’ensemble des bactéries multirésistantes (Multi-drug resistant organisms, MDRO) » par le Conseil Supérieur de la Santé, une alerte entérocoques résistants à la vancomycine (ERV) donnée en octobre 2014 par l’Institut Scientifique pour la Santé publique (ISP) et l’Agence Soins et Santé a souligné la problématique accrue des entérocoques résistants à la vancomycine (ERV) au sein des hôpitaux belges. Au cours du premier trimestre de 2015, le Centre de référence national (CRN) a reçu un nombre croissant d’isolats provenant de plusieurs hôpitaux, dont certains en situation d’épidémie (1). Le présent article se penche sur le cas d’un foyer d’ERV apparu au service d’hématologie de l’UZA et sur les mesures qui y ont été prises afin de maîtriser ce foyer (2).
La surveillance des microorganismes multirésistants (MRMO), parmi lesquels l’ERV, par l’équipe d’hygiène hospitalière s’effectue de manière permanente. Chaque échantillon positif à un MRMO est directement notifié par mail au service d’hygiène hospitalière par le laboratoire de microbiologie.
En octobre 2014, un ERV avait été isolé dans des échantillons cliniques provenant de trois patients différents d’un service d’hématologie. Suite à cela, il a été décidé de procéder au dépistage de l’ERV par écouvillonnage ou par analyse de selles de tous les patients admis dans ce service. Tous les nouveaux patients admis ont également été soumis à ce dépistage. Dépistage qui fut répété toutes les semaines chez tous les patients négatifs.
Au total, 16 patients positifs à l’ERV furent identifiés entre octobre 2014 et mars 2015 inclus (graphique 1). Six patients ont été déclarés positifs à l’ERV suite à un prélèvement clinique pour examen (dont 4 par prélèvement sanguin), les 10 autres au moment du dépistage.
Dans les deux semaines qui ont suivi l’identification de trois patients de référence, 9 patients ont été identifiés positifs à l’ERV (1 par échantillon clinique et 8 par dépistage).
Deux autres patients ont été identifiés positifs à l’ERV au service des soins intensifs (SI) : 1 patient ERV a été transféré du service hématologie aux urgences, où une transmission supplémentaire d’ERV s’est produite.
Un mois et deux mois après l’apparition de ce foyer, deux autres patients ont été dépistés positifs à l’ERV au service hématologie grâce au dépistage hebdomadaire.
Les isolats d’ERV furent identifiés comme étant Enterococcus faecium vanA. Une analyse moléculaire a démontré que tous les isolats avaient le même modèle d’électrophorèse en champ pulsé (ECP).
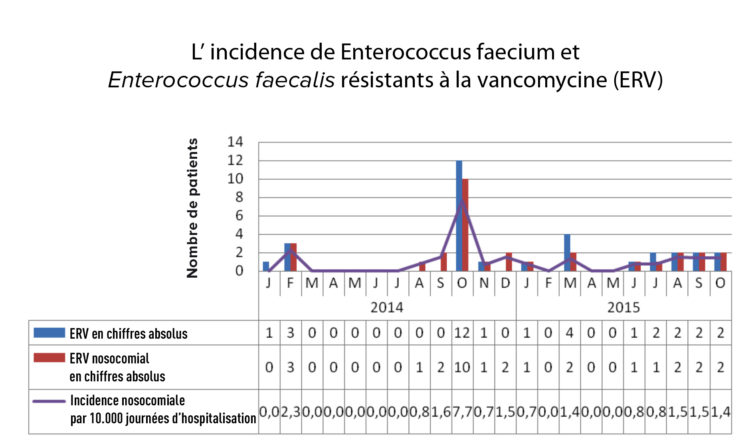
Graphique 1 : incidence de l’ERV dans l’UZA entre 2014 et 2015.
Parallèlement au dépistage des patients au service hématologie, on est également passé à la mise en œuvre de plusieurs mesures d’hygiène visant à maîtriser le foyer.
a) Politique d’isolement
Tous les patients positifs à l’ERV ont été isolés dans une chambre individuelle et des mesures de précautions (comme le port d’un tablier de protection) ont été appliquées lors des contacts. L’isolement n’était indiqué que pour les cas d’ERV vanA ou d’ERV vanB. Les patients présentant par exemple un Enterococcus gallinarum vanC résistant à la vancomycine n’ont dès lors pas été placés en isolement. L’organisation n’a pas permis de séparer des groupes de patients et/ou de membres du personnel en deux zones dans le service hématologie. Deux chambres individuelles étaient toutefois à disposition pour faire office si nécessaire de chambres d’isolement.
Des patients positifs à l’ERV sont restés en isolement durant toute la durée de leur hospitalisation. La politique d’isolement indique que l’isolement du patient peut être levé si plus aucun antibiotique n’est administré et que le patient a été déclaré négatif à trois dépistages successifs (effectués à une semaine d’intervalle). Dans la pratique, comme les patients en hématologie bénéficiaient d’une antibiothérapie de longue durée ou d’une prophylaxie médicale, l’arrêt de l’isolement n’était pas à l’ordre du jour. Cela n’avait donc pas de sens de procéder à un dépistage hebdomadaire de ces patients, puisque le résultat du dépistage d’ERV n’influençait pas la politique d’isolement. Les patients connus pour être positifs à l’ERV étaient directement isolés lors de leur réadmission à l’hôpital. Même si les patients étaient sortis après 3 dépistages négatifs, la consigné était de les mettre en isolement s’ils devaient être à nouveau hospitalisés ; chez ces patients, l’isolement peut être levé si un dépistage de contrôle s’avère négatif pour l’ERV et si le patient ne reçoit pas d’antibiothérapie dans le même temps.
Les chambres d’isolement étaient nettoyées et désinfectées tous les jours avec une solution à base d’acide peracétique à 0,5%. Après sortie du patient, les rideaux étaient retirés et lavés en interne à 80°C. Le reste du papier toilette et le goupillon du WC étaient évacués de la chambre en tant que déchets
Le nettoyage était évalué en contrôlant les points à risque (comme le bouton d’appel, le perroquet, la poignée d’appui de fauteuil…) à l’aide de prélèvements d’ATP (adénosine triphosphate) (CleanTrace®).
b) Mesures supplémentaires
Pour éviter la transmission de l’ERV par le biais des pannes, une pochette plastique (CareBag®) est utilisée en combinaison avec la panne, ainsi qu’une serviette absorbante étendue par-dessus la panne de manière à pouvoir évacuer les selles en tant que déchets. Cela permet également d’éviter d’utiliser un lave-panne et de traverser le couloir du service avec des pannes souillées.
Les patients positifs à l’ERV ont été lavés quotidiennement avec des gants de toilette antimicrobiens à usage unique.
En outre les hygiénistes hospitaliers ont demandé une attention particulière au personnel du service pour une hygiène correcte des mains et la désinfection du matériel ; le personnel d’autres disciplines médicales s’étant rendu au chevet des patients en hématologie y a également été invité.
Lorsqu’un patient positif à l’ERV devait subir un examen médico technique (un examen radiologique, par exemple) ou un traitement (kinésithérapie, par exemple), il était inscrit en dernier dans l’agenda de la journée.
Il semble difficile de déterminer sans équivoque quelles sont les mesures les plus efficaces pour maîtriser les foyers d’ERV. Dans une étude des CDC (Centres pour le contrôle et la prévention des maladies), les mesures indiquées dans 39 études sont décrites (entre1982 et 2005). Il en ressort par exemple qu’un nettoyage et une désinfection supplémentaires et le recours à des chambres individuelles ne sont repris respectivement que dans 51% et 27% des études (3).
En tout cas, des mesures visant à réduire la charge microbienne de l’environnement et du patient se sont apparemment avérées efficaces pour garder le foyer sous contrôle au service hématologie de l’UZA. Les mêmes mesures sont appliquées également lorsque des patients sont identifiés positifs à l’ERV dans d’autres services, comme aux soins intensifs.
La combinaison des mesures décrites au service hématologie s’est avérée efficace pour maîtriser le foyer d’ERV. Il convient toutefois de rester sur ses gardes. En effet, des patients positifs à l’ERV sont encore hospitalisés au service hématologie dans la mesure où, d’une part, il est impossible de décoloniser ces patients et, d’autre part, parce qu’ils sont fréquemment réadmis à l’hôpital pour leur thérapie de longue durée. En septembre 2015, deux patients ont en outre été à nouveau dépistés positifs à l’ERV au service hématologie ; ces patients présentaient toutefois un profil ECP différent. La décision de ne pas isoler des patients présentant un E. gallinarum résistant à la vancomycine risque également d’être remise en question à terme ; ainsi, un E. gallinarum résistant tant à la vanC qu’à la vanB a été identifié en octobre 2015.
1 Agence Soins et Santé, Institut scientifique de la Santé Publique. Augmentation du nombre de foyers d’entérocoques résistants à la vancomycine (ERV) dans les hôpitaux de Belgique. Alerte à l’ERV d’octobre 2015/21.10.2015.
2 Jansens H, Van Laer F, Goovaerts E, Loens K. Successful control of vancomycine-resistant enterococci outbreak in a hematology unit. Antimicrobial Resistance and Infection Control, 2015, 4(Suppl 1). P199.
3 Siegel JD, Rhinehart E, Jackson M, Chiarello L, the Healthcare Infection Control Practices Advisory Committee. Management of Multidrug-Resistant Organisms In Healthcare Settings, CDC,2006. http://www.cdc.gov/hicpac/mdro/mdro_0.html