



Fram D, Okuno MF, Taminato M, Ponzio V, Manfredi SR, Grothe C, Belasco A, Sesso R, Barbosa D
BMC Infect. Di., 15 :158, mars 2015
L’infection est une des premières causes de morbidité et de mortalité chez les patients en traitement de substitution rénale. Les taux de septicémie chez les patients hémodialysés varient selon le type d’accès veineux utilisé. Les bactéries Gram-positif sont les plus fréquemment isolées dans les hémocultures des patients hémodialysés. Cette étude évalue les facteurs de risque de développer une septicémie chez ces patients.
Les facteurs de risque associés à la septicémie chez les patients hémodialysés sont investigués en utilisant une étude cas-contrôle se déroulant entre janvier 2010 et juin 2013. Les patients souffrant de maladie rénale chronique en hémodialyse qui ont présenté des hémocultures positives pendant l’étude sont considérés comme cas. Les contrôles sont des patients hémodialysés de la même institution qui n’ont pas présenté d’hémoculture positive pendant la période de l’étude. Les données ont été collectées à partir des dossiers médicaux. Nous avons utilisé la régression logistique pour l’analyse statistique. 162 patients ont été inclus dans l’étude (81 cas et 81 contrôles). Les bactéries Gram-positif ont été isolées avec la plus grande fréquence (72 %). Dans la première analyse de régression logistique ; les variables étaient l’hypertension, la dialyse péritonéale avec traitement antérieur, le type et la durée de l’accès veineux actuel, le type d’accès veineux précédent, l’utilisation antérieure d’antibiotiques et l’hospitalisation antérieure à cause d’une septicémie. L’analyse de régression multiple a montré que les patients qui avaient un cathéter veineux central avaient 11,2 fois (CI 95 %: 5,17-24,29) plus de risques de développer une septicémie comparativement aux patients qui présentaient une fistule artério-veineuse comme accès vasculaire. Une hospitalisation antérieure augmente de 6,6 fois (CI 95 %: 1,9-23,09) les risques de développer une septicémie.
Nous concluons que les mesures de prévention des septicémies liées à l’utilisation du cathéter veineux central devraient être intensifiées ainsi qu’à l’utilisation judicieuse de cette voie d’accès vasculaire dans le cadre de l’hémodialyse. La réduction de l’exposition à l’environnement hospitalier par une admission séparée pourrait contribuer à réduire les septicémies dans cette population.
Marsh N, Webster J, Mihala G, Rickard CM
Cochrane Database Systematic Review, 6, June 2015.
Le cathéter veineux périphérique (PVC) est typiquement utilisé pour administrer pendant un temps court des fluides et des médicaments par voie vasculaire. C’est un élément essentiel de la médecine moderne et la procédure invasive la plus fréquemment réalisée en hôpital. Cependant, les PVCs font défaut avant que le traitement ne soit terminé : ceci peut survenir parce que le dispositif n’est pas bien attaché à la peau, permettant au cathéter de tomber, ou être cause de complications comme la phlébite (irritation ou inflammation de la paroi veineuse), infiltration (fuite de liquide dans les tissus environnants) ou occlusion (blocage). Un PVC insuffisamment sécurisé augmente ainsi le risque de septicémie liée au cathéter (CRBSI), comme l’action de piston (mouvements d’aller et retour dans la veine) du cathéter peut permettre la migration d’organismes le long du cathéter et dans la circulation. Malgré le nombre important de pansements et d’outils de sécurisation disponibles, l’impact des différentes techniques de sécurisation pour augmenter le temps de cathétérisation reste peu clair ; il y a nécessité de proposer une recommandation aux cliniciens en réexaminant systématiquement les études récentes.
L’objectif est d’évaluer les effets des pansements des PVCs et des systèmes de sécurisation sur l’incidence de défaut du cathéter.
Nous avons cherché, pour identifier les rapports pertinents des études randomisées contrôlées (RCTs), dans les bases de données électroniques suivantes : Le registre Cochrane du groupe plaies (recherche du 08 avril 2015) : Le registre Cochrane central des études contrôlées ‘Central 2015 N°3), Le Medline Ovid (1946 au 7 mars 2015) : Medline Ovid (citations en cours de traitement et autres non-indexées 7 mars 2015 : Embase Ovid (1974 au 7 mars2015) ; et EBSCO Cinahl (1982 au 8 mars 2015).
Deux auteurs ont revu les études sélectionnées indépendamment, ils ont évalué la qualité des études et extrait les données. Nous avons contacté les auteurs des études pour complément d’information. Nous avons utilisé les procédures méthodologiques standard attendues par Cochrane.
Résultats principaux : nous avons inclus dans cette revue 6 RCTs (1539 participants). La taille des études s’échelonne de 50 à 703 participants. Ces 6 études font 4 comparaisons : pansement transparent versus gaze ; pansement transparent avec bord versus dispositif de sécurisation ; pansement transparent avec bord versus sparadrap et pansement transparent versus emplâtre collant. Il n’y a pas de franche évidence de quelques délogements ou d’enlèvement accidentel avec les pansements transparents versus gaze (2 études, 278 participants, RR0;40 : 95% CI 0, 17 à 0,92 P= 0,03 % ). Les effets relatifs des pansements transparents et de la gaze sur la phlébite (RR 0,89 ; 95 % CI 0,47 à 1,68) et sur l’extravasation (RR 0,80 ; 95 % CI 0,48 à1,33) ne sont pas clairs. Les effets relatifs sur le défaut de cathéter des pansements transparents avec bord et un outil de sécurisation ont été évalués dans seulement une petite étude et ils ne sont pas clairs. Il y a une évidence de faible qualité dans une seule étude d’une fréquence plus petite de changement de position ou d’enlèvement accidentel de cathéter avec les pansements transparents possédant un bord qu’avec des outils de sécurisation (RR 0,14, 95 % CI 0,03 à 0,63) mais il y a plus de phlébites avec les pansements avec bord (RR 8,11, 95 % CI 1,03 à 64,02) (évidence de très peu de qualité). Une petite étude a comparé les pansements transparents possédant un bord avec le sparadrap et a montré une évidence de très peu de qualité de plus de défaut de cathéter avec le pansement muni d’un bord (RR 1,84, 95% CI 1,08 à 3,11) mais les effets relatifs sur le maintien en place ne sont pas clairs (évidence de très peu de qualité). Les effets relatifs des des pansements transparents et du sparadrap ont été comparés dans une petite étude et ne sont pas clairs. Il est nécessaire de disposer de plus de RCTs de haute qualité pour déterminer les effets relatifs des pansements PVC et des outils de sécurisation.
Nous concluons qu’il n’est pas clair qu’un pansement ou un outil de sécurisation soit meilleur qu ‘un autre pour la sécurisation des cathéters veineux périphériques. Il y a nécessité de disposer de nouvelles études indépendantes de haute qualité pour évaluer les produits largement utilisés tant les traditionnels que les nouveaux. Etant donné les grandes différences de coût entre certains pansements et les produits de sécurisation, les futures études devraient comprendre une robuste analyse coût-efficience.
Hermon A, Pain T, Beckett P, Jerrett H, Llewellyn N, Lauwrence P, Szakmany T
Nurs. Crit. Care, may13 2015
Les infections associées aux soins sont un aspect majeur des mauvaises expériences faites par les patients dans les unités de soins modernes. De récents rapports suggèrent que des checklists électroniques pour la documentation du care bundle pour la voie centrale peuvent accroître significativement la compliance au processus documenté et aider à réduire le taux des septicémies liées au cathéter. Cet article décrit l’utilisation de notre outil électronique pour suivre et donner un feed-back de la compliance au processus, en conjonction avec l’introduction de sets sur mesure d’insertion de la voie centrale pour s’attaquer aux septicémies liées au cathéter dans notre unité de soins intensifs dans un hôpital général d’un district moyen. Nous avons mis en place un plan continu d’amélioration de la qualité avec les cycles « Plan-Do-Study-Act ». Le care bundle d’insertion et de maintenance du cathéter veineux central a été publié en 2007. Pour suivre la compliance avec les éléments du bundle, un outil informatique a été crée en tant que partie de notre système d’information clinique au lit du patient. Depuis 2009, un feed-back trimestriel régulier est fourni sur le nombre de cathéters veineux centraux insérés, la compliance avec le bundle d’insertion et de maintenance et le taux de septicémies liées au cathéter ceci en utilisant les données collectées par le système d’information clinique. Nous avons aussi introduit des chariots dédiés à l’insertion des cathéters et des sets d’insertion réalisés par l’industrie. Nous avons utilisé une analyse de régression segmentée pour évaluer les changements dans le taux de septicémies liées au cathéter avant et après l’implémentation du bundle pour le cathéter veineux central.
La compliance au bundle a augmenté pendant la période d’implémentation et a dépassé les 95 % dans les 6 mois. Nous avons observé une diminution significative au niveau du taux des septicémies liées au cathéter de 15,6/1000jours à 0,4/1000 jours. L’analyse de régression montre que seule la compliance a un effet significatif sur le nombre et la prévalence des septicémies liées au cathéter.
L’implémentation de care-bundles evidence-based renforcés par des feed-back en temps réel sur la performance des prestataires de soins peut réduire significativement le taux des septicémies liées au cathéter dans l’unité de soins intensifs. S’assurer que le processus de changement est intégré continuellement dans le travail, avec une charge administrative minimale est crucial pour l’implantation du processus.
Curto-Garcia N, Garcia-Suarez J, Callejas Chavarria vM, Gil Fernadez JJ, Martin Guerrero Y, Magro Mazo E, Marcellini Antonio S, Juarez LM, Guttierez I, Arranz JJ , Montalvo I, Elvira C, Dominguez P, Diaz MT, Burgaleta C
Support Care Cancer, may 3 2015
L’utilisation de cathéters centraux insérés en périphérie (PICCs) a fortement augmenté durant la dernière décade. Cependant, il existe peu d’études sur l’utilisation des PICCs chez des patients présentant des pathologies hématologiques (HM) recevant une chimiothérapie intensive. Les données préliminaires suggèrent un haut taux de complications liées au PICC chez ces patients à haut risque. Cette étude prospective observationnelle sur un seul centre a pour but d’investiguer les complications liées au PICC après l’implémentation d’une approche multidisciplinaire aux soins aux PICC et de le comparer à la littérature antérieure.
Nous prenons en compte 36 patients pour un total de 44 PICCs insérés (27,3 %, thrombocytopénie <50 x 109 /L à l’insertion) sur 5045 jours PICC (durée médiane : 114,5 jours).
Nous n’avons pas observé de complications supplémentaires au nombre liées à l’insertion. Les complications tardives majeures sont l’obstruction dans 13,6 % (1,19 / 1000 jour PICC) des patients, les septicémies liées au cathéter dans 6,8 % (0,59 / 1000 jours PICC) et la thrombose liée au cathéter dans 4,5 % (0,39 / 1000 jours PICC). L’enlèvement prématuré du PICC est survenu dans 34 % des cas (2,97 / 1000 jours PICC). Le taux global de complications majeures potentiellement dangereuses est particulièrement bas (11,36 %; 0,99 / 100 jours PICC) comparé aux études précédentes.
Cette étude fait ressortir l’utilité d’une approche multidisciplinaire pour les soins au PICC chez les adultes présentant une HM et recevant une chimiothérapie intensive. Nous fournissons des données pour aider à l’utilisation des PICC chez de tels patients.
Lorente L, Lecuona M, Jimenez A, Lorenzo L, Santacreu R, Ramos S, Hurtado E, Buitrago M, Mora ML
American Journal of Infection Control,April 29 2015
Les analyses coût-efficacité montrent que les cathéters imprégnés de sulfadiazine chlorhexidine-argent (CHSS) réduisent les septicémies liées aux cathéters (CRBSI) et les coûts liés aux cathéters veineux centraux (CVC). Cependant, aucune étude n’a montré l’efficacité des cathéters imprégnés CHSS pour les accès veineux quand le risque de CRBSI est faible ; par exemple au niveau du site sous-clavier. Cette étude détermine le coût d’une CVC, du diagnostic de CRBSI et des agents antimicrobiens pour traiter les CRBSI ; nous ne prenons pas en compte le coût de l’allongement de l’hospitalisation.
Cette étude rétrospective comprend les patients ,admis dans l’unité des soins intensifs à l’hôpital universitaire des Canaries (Tenerife),qui ont eu un cathéter sous-clavier
Les patients qui ont un cathéter CHSS (n = 353) ont une densité d’incidence moindre de CRBSI (2,12 vs 0 sur 1000 jours cathéter ; P = 0,02) et un coût lié au cathéter moindre par jour cathéter (3,35 ± 3,75 vs 3,94 ± 9,95, P = 0,002) que les patients avec un cathéter standard (n = 518). Les cathéters imprégnés de CHSS sont associés à un risque plus faible de CRBSI (régression logistique exacte) (odds ratio 0,102 ; intervalle de confiance à 95 % -∞ à 0,667 ; P = 0,008) que les cathéters standard quand on tient compte de la durée du cathéter. Les cathéters imprégnés de CHSS sont aussi associés à un moindre coût lié à la CVC par jour cathéter que les cathéters standard (régression de Poisson) (odds ratio 0,85 ; intervalle de confiance à 95 % 0,001-0,873 ; P < 0,001).
Nous concluons que les cathéters imprégnés de CHSS peuvent être efficaces pour la prévention de CRBSI chez des patients avec un accès veineux sous-clavier.
Entesari-Tatafi D, Orford N, Bailet MJ, Chonghaile MN, Lamb-Jenkins J, Athan E
Med. J Aust., Mar 16 2015
L’objectif de l’étude est de déterminer l’efficience d’un « care bundle », avec une nouvelle procédure de surveillance de la voie IV afin de r réduire le taux de septicémies liées au cathéter de voie centrale (CLABSI) dans une unité de soins intensifs (ICU). Nous avons réalisé une étude avant et après en utilisant les données des CLABSI rapportées au système de surveillance de l’association des professionnels en prévention de l’infection de l’hôpital de Victoria (VICNISS) chez des patients adultes admis dans l’unité de soins intensifs d’un hôpital universitaire de la région de Victoria entre le 01 juillet 2006 et le 30 juin 2014. Les cas de CLABSI rapportés par VICNISS ont été revus pour vérification. Une intervention a été réalisée en 2009. Cette intervention est constituée d’un care bundle. Il prévoyait une procédure d’insertion de la voie vasculaire déjà définie auparavant et une nouvelle procédure de maintien comprenant un biopatch, un bain quotidien à la chlorhexidine 2 %, une vérification quotidienne de la voie centrale et une infirmière de liaison gérant le follow-up des voies centrales.
Nous avons pu déterminer le taux de CLABSI (cas pour 1000 jours cathéter). Le taux moyen de CLABSI est tombé de 2,2 / 1000 jours cathéter de voie centrale (pic de 5,2 / 1000 jours cathéter dans le quatrième trimestre de 2008) pendant la période de pré intervention à 0,5 par 1000 jours cathéter de voie centrale (0 / 1000 jours de cathéter de voie centrale de juillet 2012 à juillet 2014) pendant la période post intervention.
Notre étude suggère que ce « care bundle » utilisant une nouvelle procédure de suivi peut effectivement réduire le taux de CLABSI et le maintenir à zéro pendant deux ans.
Paglilonga F, Consolo S, Biasuzzi A, Assoumou J, Gattarello E, Patricelli MG, Giannini A, Chidini G, Napolitano L, Edefonti A.
Hemodial Int.,Suppl 1:S13-8, October 18 2015
Peu d’études ont investigué la gestion optimale du site de sortie des cathéters veineux centraux tunnellisés (CVCs) chez des patients pédiatriques en hémodialyse (HD). L’objectif de cette étude est d’évaluer l’efficacité des solutions de chlorhexidine et de la solution de povidone-iodée à 5 % sur l’incidence des infections liées au cathéter CVC chez des enfants hospitalisés en HD. L’incidence de l’infection du site de sortie (ESI), l’infection du tunnel (TI) et la septicémie (BSI) est évaluée dans deux groupes de CVCs tunnellisés. Le groupe povidone est constitué de 14 CVCs utilisés entre le 1 janvier 2011 et le 30 juin 2012 chez 10 enfants dont la moyenne d’âge au moment du placement du cathéter est de 11,8 ans (1,2 à 19 ,2) : la povidone iodée à 5 % est utilisée pour le soin de la sortie du cathéter. Du 01 août 2012 au 31 janvier 2013, nous avons utilisé une solution de 0,5 % de gluconate de chlorhexidine dans l’alcool isopropylique à 70 % pour le site de sortie et 2 % de gluconate de chlorhexidine dans l’alcool isopropylique à 70 % en spray pour 13 CVCs chez 10 patients (groupe chlorhexidine) dont la moyenne d’âge au moment du placement du cathéter est de 10 ans (1,2 à 19,2). Nous avons diagnostiqué 10 épisodes ESI dans le groupe povidone (incidence 3,4/ 1000jours CVC) et seulement un dans le groupe chlorhexidine (incidence 0,36/1000 jours CVC P = 0,008). Nous avons observé un TI dans le groupe povidone (0,34/1000 jours CVC) et aucun dans le groupe chlorhexidine. L’incidence des BSI a diminué de 1,7 / 1000jours CVC (5 cas) à 0,36 /1000 jours CVC (1 cas P=0,06) après le passage à la chlorhexidine. Nous avons perdu 2 cathéters à cause des infections liées à CVC dans le groupe povidone alors que nous n’en avons déploré aucun dans le groupe chlorhexidine. En comparaison à la povidone-iodée à 5 %, l’utilisation du gluconate de chlorhexidine est associé à une réduction de l’incidence de ESI, TI et BSI chez les enfants en HD.
McAlearny AS, Hefner JL
American Journal of Infection Control, 42(10 Suppl) : S216-222, October 2015
Les professionnels du contrôle de l’infection (ICPs) jouent un rôle crucial dans la mise en place et la gestion des interventions de réduction de l’infection associée aux soins alors que le personnel de terrain est responsable de la délivrance de soins directs et continus au patient. L’objectif de notre étude est de déterminer si les ICPs et le personnel de terrain ont des vues différentes à propos des facilitateurs et des défis concernant les programmes de prévention des septicémies associées au cathéter central (CLABSI). Nous avons réalisé des interviews dirigées dans 8 hôpitaux qui ont participé à l’initiative de l’Agence pour la Recherche en Santé et Qualité pour la prévention des CLBASI et intitulée : « On the CUSP : Stop BSI ». Nous avons analysé les données d’interviews de 50 infirmières de terrain et 26 ICPs pour identifier les thèmes communs en lien avec les facilitateurs et les défis du programme. Nous avons identifié 4 facilitateurs du programme CLBSI ; éducation, leadership, données et contenu.. Nous avons aussi identifié 3 défis communs : manque de ressources, priorités en compétition et résistance médicale. Cependant, les vues des ICPs et du personnel de terrain diffèrent. Alors que les ICPs tendent à se focaliser sur des descriptions générales, le personnel de terrain relève les spécificités du programme et discute souvent d’exemples concrets.
Nos résultats suggèrent que les ICPs devraient prendre en compte les points de vues du personnel de terrain lors de la mise en place d’un programme de contrôle de l’infection et d’initiatives plus larges augmentant la qualité. Bien plus, l’inclusion du personnel de terrain dans l’implémentation de ce type de programme peut être vitale pour sa réussite.
Zakarioudakis IM, Zervou FN, Avanitis M, Ziakas PD, Mermel LA, Mylonakis E.
Clin Infect Dis., 15 ; 59 (12) : 1741-9, December 2014
Les solutions antimicrobiennes lors des locks IV momentanées des cathéters peuvent être une stratégie efficace pour prévenir les septicémies liées au cathéter. Cependant, il reste beaucoup d’incertitude quant à leur efficacité et sécurité. Pour investiguer l’efficacité de la thérapie antimicrobienne pour la prévention des septicémies associées au cathéter central (CLABSIs), nous avons réalisé une recherche systématique dans PubMed, Embase, le registre central Cochrane des études contrôlées et dans clinicalTrials.gov et ce, depuis le début jusqu’au 31 décembre 2013. Les études sont éligibles si ce sont des études randomisées contrôlées comparant des solutions antimicrobiennes à l’héparine et si elles donnent une définition appropriée de l’infection.
Les 23 études incluses rapportent des données de 2896 patients qui sont majoritairement des adultes sous hémodialyse (16 études /23) mais aussi des patients oncologiques adultes et pédiatriques, des nouveau-nés gravement atteints et des patients recevant une nutrition parentérale totale. L’utilisation d’une solution antimicrobienne conduit à une réduction de 69 % du taux de CLABSI (risque relatif [RR], 0,31 ; intervalle de confiance à 95 % [CI] 0,24-0,40) et à une réduction de 32 % du taux d’infection du site de sortie (RR 0,68 ; 95 % CI 0,49-0,95) comparé à l’héparine sans affecter significativement la perte du cathéter due à des complications non infectieuses (RR 0 ,83 ; 95 % CI 0,65-1,06). La cause de mortalité n’est pas différente dans les deux groupes (RR 0,84 ; 95 % CI 0,64-1,12). Ni le type de solution antimicrobienne ni la population étudiée n’affectent la réduction relative des CLABSI qui reste significative parmi les études rapportant des taux d’infection de base <1,5/1000 jours cathéter et les études qui produisent des données pour les septicémies liées au cathéter. La publication et les biais sélectifs de rapportage sont un problème dans notre étude et doivent être reconnus.
Nous concluons que les solutions antimicrobiennes pour les locks IV momentanés des cathéters sont efficaces dans la réduction du risque de CLABSI et cet effet apparaît être un plus aux mesures de prévention traditionnelles.
Dumyati G, Concannon C, van Wijngaarden E , Love TM, Graman P, Pettis AM, Greene L, El-Daher N, farnworth D, Quinlan G, Karr G, Ward L, Knab R, Shelly M.
Am J Infect Control, 42 (7) : 723-30, July 2014
L’utilisation du cathéter veineux central hors les unités de soins intensifs (ICUs) est banale mais la prévention dans cet environnement n’est pas étudiée. Nous avons démarré une surveillance des septicémies liées au cathéter central (CLABSI) hors l’unité de soins intensifs et étudié l’impact d’une intervention multimodale sur l’incidence des CLABSI à travers plusieurs hôpitaux .
Le projet a été construit comme une étude pré et post intervention. Le projet comprend trois phases (pré intervention [ligne de base], intervention et post intervention) sur une période de 4;5 ans (2008-2012) et implémenté dans 37 unités adultes non intensives dans 6 hôpitaux dans la région de Rochester NY. L’intervention s’est focalisée sur le personnel de soins et le leadership, le maintien des connaissances de soins on line, l’évaluation de la compétence, des audits de soins hors voie IV et des feed-back réguliers sur les taux de CLABSI. Les taux trimestriels sont comparés dans le temps en relation avec l’implémentation de l’intervention.
Le taux global de CLABSI pour toutes les unités participantes a diminué de 2,6/1000 jours perfusion en pré intervention à 2,1/1000 jours perfusion pendant l’intervention et 1,3 /1000 jours perfusion en post intervention ; une réduction de 50 % (intervalle de confiance 95 % 0,40-0,59) comparé à la période pré intervention (P 0,0179).
Nous concluons qu’une approche prolongée mêlant les aspects d’adaptation et technique des soins incluant un engagement du personnel de terrain et l’évaluation des deux procédures et des résultats peuvent être une stratégie efficace pour réduire le taux de CLABSI hors les ICU.
Cartier V, Haenny A, Inan C, Walder B, Zingg W.
La guidance par ultra sons pour l’insertion des cathéters veineux centraux (CVCs) réduit les complications mécaniques et diminue le temps de pose mais ses effets sur les septicémies liées au cathéter CVC (CLABSI) demeurent controversés. Le but de l’étude est de tester l’effet de l’insertion des CVC par ultra sons sur les CABSI dans une unité de soins hospitaliers. Nous avons conduit une étude de cohorte prospective de 4 ans dans un hôpital de soins tertiaire affilié à une université. Tous les patients qui ont reçu un cathéter CVC non tunnellisé placé par un anesthésiste ont été enrôlés. La surveillance des cathéters a été réalisée par des infirmières en contrôle de l’infection expérimentées et contrôlées par un médecin en contrôle de l’infection (EOH) Le principal résultat a été la CLABSI tel que définie par les Centers for Disease Control and Prevention.. Le résultat secondaire est la cause de mortalité jusqu’à 28 jours après l’enlèvement. Nous avons inclus et analysé les données de 2312 patients avec 2483 cathéters. La guidance par ultra sons a été utilisée pour 844 insertions de CVC (34;0 %) avec une augmentation significative pendant la période de l’étude (taux d’incidence 1,13 intervalle de confiance à 95 % [CI]01,11-1,15 ; P<0,001). Nous avons identifié 47 CLABSI représentant une incidence générale de 2,1 épisode / 1000 jours cathéter. Nous n’avons pas détecté d’association entre la guidance par ultra sons et CABSI (ratio de hasard 0,69, 95 % CI 0,36-1,30 ; P = 0,252).La cause globale de mortalité est de 11,0 % (253/2312) sans trend significatif, ni association avec la guidance par ultra sons.
Nous concluons que la guidance par ultra sons n’a pas d’effet sur les CLABSI ni sur la mortalité. Dans un hôpital avec une ligne de base de taux de CLABSI au niveau standard communément trouvé dans les pays industrialisés, l’utilisation des ultrasons n’a pas d’effet bénéfique ajouté pour la prévention des CLABSI.
Sandora TJ, Graham DA, Conway M, Dodson B, Potter-Bynoe G, Margossian SP.
Am J Infect Control, 42(5) ; 485-9, May 2014
La septicémie est l’infection associée aux soins la plus commune en pédiatrie et est fortement associée à l’utilisation de cathéters. Cette infection augmente fortement les coûts d’hospitalisation. Pour évaluer l’association entre la fréquence de change des connecteurs sans aiguille (NC) et le taux des septicémies liées au cathéter central (CLABSI), nous avons modélisé le taux mensuel de CLABSI du service de transplantation de moelle (SCT) pédiatrique en 3 périodes : la période de ligne de base durant laquelle les NC sont changés toutes les 96 heures sans tenir compte de l’infusat (période 1), la période d’étude durant laquelle les NC sont changés toutes les 24 heures avec les perfusions de lipides ou de sang (période 2) et un retour au change de NC toutes les 96 heures sans tenir compte de l’infusat (période 3). Des données sur les éléments confondants ont été collectées rétrospectivement. Les modèles de régression segmentés auto corrélés sont utilisés pour comparer les taux de CLABSI SCT dans chaque période avec ajustement pour élément confondant potentiel. Les taux de CLABSI sont aussi évalués pour un groupe de contrôle non équivalent (unité d’oncologie ) dans laquelle les NC sont changés toutes les 24 heures avec perfusion de lipides ou de sang pendant les périodes 2 et 3. Les taux de CLABSI SCT sont respectivement de 0,41, 3,56 et 0,03/ 1000 jours de ligne centrale pendant les périodes 1,2 et 3. En analyse multivariée, le taux de CLABSI est significativement plus élevé en période 2 comparé à la période 1 (P = 0,01) et la période 3 (P = 0,003). A contrario, le taux de CLABSI dans l’unité d’oncologie n’était pas significativement différent durant les périodes 1, 2 et 3.
Nous concluons que chez des patients pédiatriques SCT, changer les connecteurs sans aiguille toutes les 24 heures lors de l’infusion de lipides ou de sang est associé avec une augmentation du taux de CLABSI. Les recommandations nationales concernant la fréquence de change de NC devraient être clarifiées.

Compte rendu des exposés : Taminiau P.
Cette XIV Rencontre nous a permis à nouveau de nous rencontrer, d’échanger nos expériences et de partager nos solutions dans une ambiance conviviale.
Que de chemins parcourus depuis 28 ans, mais ce qui ne change pas c’est la qualité des exposés et le dynamisme des infirmiers hygiénistes, bref leur PASSION pour leur profession.
Il me revient le privilège de vous présenter un aperçu des exposés. L’ensemble des exposés est consultable sur le site www.abihh.be .
JEUDI
La session a débuté par un mot des présidents : Mme Aggoune / France – M.Louis / Luxembourg – M. Barbier/ Belgique qui ont envisagé l’évolution de l’HH dans leur pays respectif, ainsi que les innovations attendues et les projets pour le futur.
Après cette introduction ont débuté les exposés:
Le Profil des Infirmiers hygiénistes
Braeckveld – NVKVV – Belgique
Un exposé sur le développement du profil de compétence des IHH, conduisant vers une professionnalisation du métier. L’aboutissement est un profil de compétence européen en passant par les accords de Bologne menant à une harmonisation des exigences de formation et de niveau éducationnel en Europe.
En 2013, le profil terminé a été présenté et publié avec pour objectif de réduire les infections associées aux soins par la promotion de la qualité et la sécurité des soins qui s’appuie sur un niveau de formation de type master associé à des compétences spécifiques.
Evolution et identification des défis futurs
Houdart – C.H. Jolimont – Belgique
Définition de l’avenir en HH par :
L’éducation à la santé se focalisant sur la surveillance locale et internationale, la diminution de la consommation d’AB et une meilleure répartition des ressources pourraient être la solution aux problèmes de demain ainsi qu’une augmentation des formations en gériatrie et le choix de la chirurgie élective.
Hygiéniste et gestionnaire de risque dans un établissement de santé
A.C. Guille des Buttes – Nantes – France
Théorie du chaos appliquée aux germes et associées à de graves conséquences.
Bilan à 1 an de la démarche en gestion des risques par un renforcement de la position transversale faisant partie de la coordination générale des soins.
Perspectives :
Comment sortir 180 étudiants infirmiers des sentiers battus pour réactualiser leurs connaissances en HH ?
Crelot et F. Zanini – Helmo – Belgique
Après une première initiative en 2004, organisation d’une journée complète permettant de réactualiser les connaissances des étudiants en HH dont les défis principaux étaient de :
Cette journée a permis d’amener les étudiants en posture réflective, en confrontant leurs concepts à ceux de leurs collègues et à leurs expériences. Cette journée a aussi généré un conflit socio-cognitif induisant une régulation des conflits.
La simulation en santé : application en hygiène
Zaro–Goni – Bordeaux – France
Principe fondateur : « Jamais la première fois sur le patient »
Avant : apprentissage en salle de cours et dans les services.
Depuis 2000, les concepts de simulation en Europe vont naître dans les CHU qui permettent de reproduire des situations ou environnements de soins pour enseigner des procédures diagnostiques ou thérapeutiques par des professionnels ou des équipes. Les avantages sont, notamment :
Démarche en 5 étapes (briefing, pré-briefing, pratique similaire, débriefing et conclusions)
La simulation en santé appliquée à la gestion du risque infectieux fait partie de ces nouveaux outils. A nous de les inclure dans nos pratiques.
Le triangle des Bermudes en HH
Velghe – CHU Brugmann – Belgique
Deux réflexions constituent le fil rouge de cet exposé :
Une définition des rôles et des responsabilités de chacun, l’analyse des dysfonctionnements et des causes de non-respect des règles d’hygiène hospitalière, l’identification et l’analyse des besoins de formation, l’élaboration d’un profil de fonction et d’un plan de formation pour des référents en HH s’avèrent indispensables. Le cadre infirmier en HH devient alors un acteur du changement d’une organisation « taylorienne » (savoir-faire) vers une organisation « métier complet » ( savoir agir et inter-agir )…. Avec pour conséquence l’apparition d’une zone d’ombre au niveau de la relation triangulaire entre l’infirmier en chef, le référent et le cadre ressource. Bienvenue alors dans ce « triangle des Bermudes » de l’HH.
Mise en place d’un programme d’hygiène des mains et production locale de SHA en Afrique subsaharienne
Fouveau – Rennes – France
Voici une expérience réalisée au Burundi qui décrit tout le challenge que constitue l’implémentation de la fabrication de SHA, l’achat du matériel, la mise au point de la technique, le contrôle de qualité du produit fini, les péripéties du parcours et les perspectives dans un pays où l’hygiène hospitalière en est encore à ses balbutiements et ou la devise est : « Vous avez l’heure, nous avons le temps ».
In fine c’est aussi la preuve, que même en Afrique quand on veut, on peut.
Révision du fonctionnement et des procédures de la banque de lait dans le cadre d’un programme assurance qualité
Gylbert – Hôpital Erasme-ULB – Belgique
Concerne : les dons de lait personnalisés et anonymes
Problèmes : existence de procédures remises à jour mais non validées. Pas de traçabilité, pas de contrôle qualité et du matériel vétuste. Nécessité de gérer le dysfonctionnement et les évènements indésirables par l’application du modèle de Reasus avec un plan d’action en 5 étapes qui a permis d’améliorer l’hygiène, l’environnement, le matériel tout en impliquant les équipes par des transmissions d’informations tant aux médecins qu’au personnel soignant, par la réalisation d’un cahier de liaison et l’implémentation de réunions régulières.
La communication soignant – soigné sur l’hygiène des mains : pour une implication du patient et un engagement des soignants
M.A. Ertzscheid – Rennes – France
Concerne l’aboutissement des changements induits depuis 2012 par une semaine sécurité patients et par la campagne française « Patients – soignants : tous concernés » qui implique le patient comme étant acteur de sa sécurité.
Ce projet comprend une mise en place progressive de protocoles et de formations, sous la responsabilisation de l’EOHH (Equipe Operationnelle en Hygiène Hospitalière).
En conclusion :
– L’HDM est au cœur de la qualité des soins.
– Chaque personne est engagée dans une attitude positive.
– Infos patients ciblées et pratiques.
– Mise en confiance du patient
Réflexions sur la rénovation d’un service de stérilisation
Gobert – CHDN – Luxembourg
Démonstration de la faisabilité de l’installation d’un nouveau service de stérilisation suite à la découverte de certains défauts associé au choix de la production en interne en respectant les normes du ministère Allemand (RKI).
L’expérience se déroule de 2007 à 2013 avec la démolition des locaux existants, l’enlèvement du matériel obsolète et l’installation d’une stérilisation moderne, impliquant une amélioration des conditions de travail du personnel (ex : utilisation de tapis en silicone quadrillé qui diminue le bruit et permet de mesurer les instruments).
Histoire particulière du MRSA en institutions de soins de long séjour
Elis – Institut Pacheco – Belgique
Si dans les hôpitaux aigus, le MRSA est bien contrôlé, dans les longs séjours :
Mais :
La prévalence du MRSA en long séjour est de 19%. Le projet consiste à obtenir une réduction de la charge endémique.
Pour ce faire un dépistage systématique est instauré pour les patients admis, plus un dépistage semestriel afin de suivre l’évolution des taux de MRSA in situ.
Cette prise en charge acharnée du MRSA doit correspondre à une vie satisfaisante pour le résident.
Les mesures appliquées sont :
Conclusions :
Des règles d’hygiène strictes pour le personnel, des formations ciblées par équipe et la qualité de l’hébergement font que cette prise en charge a été rendue plus humaine pour les patients.
Les nouvelles recommandations – Maîtrise des BHRe- l’Expérience des hôpitaux de l’AP – HP
Nion Huang – Paris – France
Concerne : Les entérobactéries productrices de carbapanémase ou d’enteroccocus faecium résistant aux glycopeptides (ERG)
La situation des hôpitaux de Paris a nécessité la mise en place d’un protocole drastique pour la prise en charge de ce problème. Une vigilance importante a été associée lors de l’hospitalisation de patients venant de pays bien connus pour leur taux élevé et pour les patients ayant été hospitalisé dans l’année précédente.
Mesures drastiques prises en urgence pour diminuer le risque au maximum des cas secondaires, comme séparer totalement le personnel prenant en charge ces patients (2 salles de soins – 2 salles de repos)
Recommandations généralisées au niveau national :
Epidémiologie des bactéries résistantes émergentes en Belgique
Jans – ISP – Belgique
Un historique de l’émergence de la résistance aux antibiotiques ainsi que la relation avec l’augmentation de la consommation est exposée et conclut à une histoire sans fin. Le tableau épidémiologique des bactéries résistantes (MRSA, BLSE, CPE, …) est dressé. L’oratrice présente un résumé des actions de lutte contre l’antibiorésistance en Belgique depuis 1993 et expose les stratégies de prévention et de contrôle des bactéries multi-résistantes en milieu hospitalier et en maison de repos.
Epidémie de Burkholderia cepacia, un réservoir inattendu
Alfagem-Gonzales – CHU Liège – Belgique
Relation d’une épidémie qui a touché 16 patients et nécessité une investigation énergique pour trouver le responsable, une bactérie gram -. Cette dernière aime l’eau, est peu exigeante au niveau nutritif mais elle est responsable d’infections respiratoires, urinaires et possède un tropisme particulier pour les patients atteints de mucoviscidose chez qui elle est responsable de pneumonie nécrosante.
De nombreux prélèvements d’environnement finissent par mettre en évidence la présence de Burkholderia cepacia dans le SAVON pour lequel 12 échantillons sont contaminés.
Perspectives :
VENDREDI
D’une alerte en établissement de santé à un outil de la gestion des risques et plus…
Laprugne Garcia – Lyon – France
Définition : prévention de l’apparition d’évènements indésirables en évitant qu’ils se produisent ou se reproduisent.
A partir d’un incident au niveau de la pose d’un cathéter sous-cutané, application d’une gestion des risques. Ceci a permis d’analyser la cause et de réaliser un audit en 6 étapes permettant d’avoir un regard et une écoute sur l’ensemble du système et l’élaboration d’une fiche » retour d’expérience ».
La mise en pratique permet de prévoir les accidents possibles avec leur solution afin que cela ne se reproduise plus :
– Formation en ligne
– Outils téléchargeables
– Enquêtes d’évaluation des pratiques
Hygiène et qualité, une démarche intégrée
Dehon – Clin. de l’Europe – Belgique
En 2013, mise en route du processus d’accréditation pour les Cliniques de l’Europe à la Joint Comission International (JCI). On note alors une émergence rapide de liens entre projets qualité et HH tout en gardant le patient au centre des préoccupations (ex : sécurité du patient opéré)
Ceci a permis un entraînement automatique des équipes qui s’autogèrent et analysent les problèmes et trouvent des solutions = STAND UP.
On entre ainsi dans un système d’amélioration continue et de culture participative.
Mettons notre grain de sel dans le dossier informatisé
Laurent – CHIREC – Belgique
Description de la mise en place d’un nouveau dossier infirmier informatisé extrêmement complet dont l’implémentation a été commencée par les cadres en 2009.
L’accès au programme se fait par badge. Le paramétrage des écrans se fait régulièrement avec le consensus de tous.
Des tableaux récapitulatifs par patients sont disponibles et très complets et permettent l’extraction de statistiques. Description de l’apport des IHH dans ce processus d’amélioration continue du dossier.
Enquête nationale belge sur les pratiques concernant les chambres implantables
Magnette – CHR Huy – Belgique
Revue des pratiques concernant les chambres implantables existant dans les hôpitaux francophones.
Des procédures existent : placement d’aiguille, réfection de pansement, utilisation d’antiseptique ou de SP ou d’héparine, mais il y a beaucoup de divergences qui nécessiteraient une uniformisation des pratiques par des recommandations du CSS.
Workshop pour les référents en HH
Mme Haesebroeck (pour K. Rottey) – NVKVV – Belgique
La législation ne fait jamais référence aux référents sauf au niveau du projet pilote fédéral. La situation est identique dans toute l’Europe.
Idéalement il faudrait un référent HH par unité de soins – est ce payable ?
Les rôles et les tâches ont évolués tant verticalement que horizontalement de par la pénurie d’infirmières.
En Belgique il existe une formation qui donne les informations de base, mais il semble difficile pour les hôpitaux d’y faire participer leur personnel et donc il existe un projet pour uniformiser cette formation sous forme de workshop.
3 points importants émergent :
Ce workshop permettrait de l’élargir à toute l’Europe et d’avoir ainsi un profil de fonction et des exigences identiques partout.
Quels sont les facteurs influençant l’adhésion du personnel infirmier aux bonnes pratiques d’hygiène
Arai – Casablanca – Maroc
Au Maroc, le taux des IAS (Infections associées aux soins) est de 28% et l’observance de l’hygiène des mains de 20%. Le personnel ne sait pas, ne veut pas, ne connaît pas…..il y a donc un gros travail à réaliser, mais :
Investigation d’une épidémie à ERG
Cauchy – Lille – France
Description d’une épidémie à ERG dans un service de gériatrie dont les patients ont plus de 75 ans, souffrent de polypathologies, de démence, déambulateurs-dépendants et en long séjour.
4 cas pratiques sont présentés et dans chacun des cas, on a utilisé des équipes dédiées et cohorté les patients.
Le cadre de la gestion des risques appliqué à la gestion des épidémies. Une application de la méthode Alarm
Landriu – Paris – France
Démonstration de la méthode ALARM sur des cas pratiques, ce qui permet d’agir sur les individus, les tâches, les équipes et l’organisation.
Dans un premier temps le personnel se sentait peu concerné et la solitude de l’IHH importante.
En partant de l’analyse, différents points ont été envisagés au niveau du personnel:
Stratégie de dépistage du staphylocoque doré en chirurgie orthopédique
Marechal – Clin. Sud Luxembourg – Belgique
Explication de la mise en route d’une stratégie de dépistage du staphylocoque doré en chirurgie orthopédique dans un hôpital belge. La contamination à lieu au quartier opératoire durant l’intervention.
D’où l’intérêt de décoloniser les patients la veille et le matin de l’intervention.
Dépistage par PCR en orthopédie et/ou en ambulatoire avec décontamination durant les 5 jours précédents + fiche de décolonisation. Dépistage nez-gorge-oreilles et plis inguinaux.
Toutes ces mesures ont été bien accueillies tant par le personnel que par le patient.
Endoscopie souple et thermosensible, analyse des pratiques en 2014
Mutsers – CHU Liège – Belgique
En 2010, le CSS dans les recommandations (8355) défini le processus de désinfection et insiste sur la sécurité du personnel et des patients.
Suite à cela des procédures sont écrites et on opte pour l’automatisation de l’entretien par des laveurs désinfecteurs et par l’instauration d’une traçabilité.
Une enquête est réalisée sur 46 services dans 20 hôpitaux belges :
Conclusions :
29% lavage/désinfection à la main
71% en machine automatique
La glutaraldéhyde est la solution la plus employée
¼ pas de traçabilité
½ pas de contrôle des endoscopes
Quelques conseils :
Une marche en avant s’impose avec des certifications, de la traçabilité, de l’ergonomie, un calcul des coûts d’exploitation, d’acquisition et l’évaluation du coût de cette prise en charge.
Epidémie de gastroentérite à Norovirus dans le secteur des personnes âgées. Quelle stratégie mettre en place pour prévenir ?
Schmit – CHNP – Luxembourg
Une épidémie de gastro- entérite à Norovirus a touché tant les patients que le personnel dans un secteur pour personne âgée et nécessité une prise en charge qui a porté sur :
Prévention de la transmission des BHRe : comment mobiliser une région
Bagdhadi – Lille – France
De nombreuses épidémies impliquant des bactéries hautement résistantes dans la région ont attiré l’attention et mis le doigt sur la gestion des excrétas et l’utilisation adéquate des laves-bassins
L’objectif a été de travailler sur :
Expérience d’un hôpital dans la prise en charge d’un patient atteint d’une maladie hautement contagieuse.
I .Van Wynsberghe – CHU St Pierre – Belgique
Les maladies hautement contagieuses émergentes concernent des germes en biosécurité 3 (MHCe) à savoir SARS-H1N1-MERS. Les fièvres hémorragiques sont du niveau 4.
La convention établie avec le ministère a permis d’établir entre autres :
En février 2014 la crise « EBOLA » a nécessité la prise de mesures de biosécurité 4 dont :
Ces mesures sont parties d’un manuel et ont été adaptées en insistant sur le rôle de l’accompagnant lors du retrait des EPI et en tenant compte, pour la prise en charge du patient, des 14 besoins fondamentaux de V. Anderson.
Les prochaines rencontres auront lieu à Lille en France dans le courant du mois d’octobre 2016 avec, à nouveau, la participation des Suisses et des Canadiens.
Introduction
Les septicémies sont une des premières causes de morbidité et de mortalité. Le diagnostic et l’enregistrement de cette infection sont établis par une hémoculture positive. En Belgique, nous ne disposons pas de taux d’incidence fiables pour toutes les septicémies, mais en 2013, l’incidence moyenne des septicémies survenues en milieu hospitalier était de 5,9 pour 1000 admissions [http://www.nsih.be/]. Les septicémies peuvent être subdivisées sur la base de l’environnement (de soins) dans lequel elles se manifestent. Plusieurs paramètres, dont le vieillissement progressif de la population, l’évolution des soins de santé et la globalisation de plus en plus poussée rendent la subdivision épidémiologique entre septicémie « community onset » et septicémie « hospital onset » de moins en moins pertinente. Dans la catégorie des infections « community onset », on retrouve en effet une importante partie de patients se trouvant dans des environnements de soins chroniques comme les soins à domicile, le séjour dans une maison de repos et de soins ou un centre de jour. Ces infections portent également le nom de « healthcare associated ».[1]
Les septicémies peuvent aussi être subdivisées sur la base du foyer infectieux où elles prennent naissance. Dans le cas des septicémies qui se sont déclarées à l’hôpital, après un précédent foyer infectieux, les infections pulmonaires et urinaires sont les plus fréquentes, suivies par les infections des plaies postopératoires. L’origine de certaines septicémies demeure inconnue. Une partie d’entre elles peut certainement être imputée à une transmission de bactéries dans le sang par le biais de muqueuses endommagées (MBI-LCBSI). Cette situation touche les patients dont l’immunité est compromise, comme les patients ayant subi une transplantation et les patients traités par chimiothérapie ou radiothérapie. [2] Les nouvelles définitions sont résumées dans le Tableau 1. Elles permettent de procéder à une classification plus précise des septicémies et d’ainsi plus facilement identifier la partie des infections qui pourrait être évitée.
Les septicémies se déclarant dans nos hôpitaux font partie des infections associées aux soins qui sont influençables par notre pratique des soins et notre attitude. La réduction de l’incidence des septicémies pouvant être réalisée par la prévention des infections est notable, d’autant plus que le risque de mortalité de ces infections est élevé. La prévention des septicémies provoquées par des cathéters veineux centraux incombe à cette entité et mérite dès lors toute l’attention de chaque établissement de soins et chaque professionnel de la santé.
Cet article relate notre expérience en tant que participant à une étude européenne ayant pour but d’éviter les septicémies provoquées par des cathéters veineux centraux en utilisant des « bundles ». Dans la description, nous mettons l’accent sur le changement de comportement nécessaire à la réussite de ce projet. Nous esquissons les obstacles et opportunités mis au jour lors de l’étude.
L’étude PROHIBIT (PRevention Of Hospital Infections By Intervention and Training) a été mise en place au sein de l’Union européenne (UE). Le projet fait partie du Framework 7 Specific Targeted Research Projects (STReP) de l’UE. (http://ec.europa.eu/research/fp7). Les centres de coordination nationaux européens supervisant également le réseau EARS (en Belgique, il s’agit du WIV-ISP), ont porté ce projet européen à la connaissance de tous les hôpitaux aigus en 2010. Ceux qui étaient intéressés pouvaient introduire un dossier de candidature auprès du coordinateur européen national.
Lors du lancement de l’étude PROHIBIT, en 2010, le taux d’incidence moyen des septicémies déclarées en milieu hospitalier était de 7,5/10.000 jours patients en Belgique. Avec un taux d’incidence moyen de 3,5/10.000 jours patients, la proportion de septicémies secondaires dont le foyer se trouve dans un organe est la plus élevée. La proportion d’infections liées à un cathéter veineux central est moins élevée et présente de plus grandes disparités d’un hôpital à l’autre et s’élève en moyenne à 1,4/10.000 jours patients [http://www.nsih.be/]. L’AZ Sint-Lucas Gand est un hôpital secondaire de 805 lits et d’une durée d’admission moyenne de 6,1 jours. La durée d’admission moyenne en soins intensifs est de 4,1 jours. L’incidence des infections liées à un cathéter veineux central en hôpital était de 1,8/10.000 jours patients au début de l’étude.
PROHIBIT est une étude en six parties. Deux parties, l’étude d’intervention et le module « in depth », ont dû être menées au sein des départements soins intensifs de 15 hôpitaux répartis dans l’UE. Dans l’étude d’intervention, l’efficacité des stratégies reprises dans le bundle sur le taux d’incidence des infections liées à un cathéter veineux central a été mesurée. Cette partie prévoyait également des modules « train the trainer » consacrés à l’hygiène des mains et à la pose d’un cathéter veineux central. (www.carepractice.net). Dans le module « in depth », les facteurs de succès et obstacles à l’implémentation du bundle de pratiques pour la prévention des infections liées à un cathéter veineux central ont été mesurés auprès d’un échantillon représentatif de centres d’études.
La méthodologie « stepped wedge cluster randomisation » a été utilisée dans le cadre de l’étude. Cette dernière est une forme spéciale d’essais randomisés dans lesquels une intervention au niveau du groupe est introduite progressivement. Le concept peut s’utiliser lorsque la randomisation au niveau individuel n’est pas possible. Une période de contrôle est également intégrée dans ce concept : il s’agit du moment avant que l’intervention expérimentale soit introduite dans un cluster. Ce type d’essai est de meilleure qualité que les études avant/après ou des études de prévalence ponctuelles mais nécessite également de considérables investissements en termes de temps, d’argent et de personnel. L’étude PROHIBIT a comparé l’efficacité de 3 tactiques : hygiène des mains, bundle sur les cathéters ou les deux. L’étude a été déployée de manière séquentielle dans l’unité de soins intensifs de 14 hôpitaux aigus européens. Le coup d’envoi a été donné en janvier 2011 sous la forme d’une période de contrôle de 6 mois lors de laquelle, en marge de la mesure de l’observance de l’hygiène des mains au travers d’un système randomisé, intensif d’observations, les infections liées à un cathéter veineux central ont également été enregistrées. Ces observations et mesures se sont poursuivies tout au long du trajet. En juillet 2011, notre hôpital a été sélectionné au hasard pour appliquer le bundle lié à la pose de cathéters veineux jusqu’à la fin de l’étude, en juin 2013. Au rythme de 3 nouveaux participants par trimestre, une intervention avait été attribuée à tous les hôpitaux en juillet 2012. Nous n’avons pas participé au volet « in depth » mais avons tenu à jour un journal (implementation log) dans lequel nous avons documenté la mise en œuvre du bundle. Nous partagions régulièrement ce journal avec les coordinateurs de l’étude.
L’étude a duré 36 mois. Au final, 14 hôpitaux provenant de 11 pays européens (Belgique, Grèce, Irlande, Italie, Hongrie, Lettonie, Autriche, Pologne, Roumanie, Slovénie et Espagne) ont pris part à l’étude. Au total, 25.377 patients ont été inclus, avec 35.894 cathéters, 263.093 jours cathéter et 384 infections liées à un cathéter veineux central. Un ratio d’infection moyen déjà faible avant l’étude, de 2,4 infections liées à un cathéter veineux central par 1000 jours cathéter, a encore reculé pour atteindre 0,9 infection par 1000 jours cathéter. [Figure 1] Les hôpitaux établis dans les pays aux dépenses en matière de soins de santé les moins élevées étaient également ceux affichant le taux d’infection de base le plus élevé. La compliance à l’hygiène des mains et la pratique d’insertion des cathéters se sont améliorées dans pratiquement chaque centre. La compliance à l’hygiène des mains moyenne était de 49 % au début de l’étude. L’amélioration de l’application de l’hygiène des mains la plus notable a été enregistrée dans les hôpitaux qui avaient été sélectionnés au hasard pour uniquement appliquer cette intervention. Dans plusieurs hôpitaux, dont celui à Gand, auxquels le bundle sur les cathéters a été attribué, on a également enregistré une amélioration notable de l’application de l’hygiène des mains. L’amélioration de l’application du bundle sur les cathéters la plus notable a été enregistrée dans les centres auxquels ce bundle a été attribué, éventuellement en combinaison avec l’hygiène des mains. Quelques centres devant uniquement faire la promotion de l’hygiène des mains ont également enregistré une légère hausse de l’application du bundle lié à la pose de cathéters. Les différents volets de l’étude PROHIBIT ont été présentés lors de congrès et dans des publications. [3] Un résumé des résultats complets de l’étude a été publié sur le site web CORDIS (Community Research and Development Information Service) de la Commission européenne. [ http://cordis.europa.eu/result/rcn/158223_en.html]
Il avait auparavant déjà été démontré que les interventions multimodales lors de la pose de cathéters et de soins liés aux cathéters avaient une influence évidente sur le taux d’incidence des infections liées à un cathéter veineux central au sein du département soins intensifs [4]. Un bundle pour la prévention des infections liées à un cathéter veineux central contient tout au moins les paramètres suivants : barrière stérile maximale lors de la pose d’un cathéter, l’évitement de la pose de cathéters fémoraux, l’hygiène des mains lors des soins liés à la pose d’un cathéter et de la manipulation de cathéters et un questionnaire quotidien de l’indication pour le maintien du cathéter.
Un examen et une analyse méta systématiques récents de 2014 ont étudié les interventions les plus efficaces pour éviter les infections liées à un cathéter veineux central. Il en a été conclu que de telles interventions existaient et que les bundles de soins et les check-lists enregistraient les meilleurs scores.[5] Le principal objectif de l’étude PROHIBIT n’était pas de confirmer ces résultats, mais d’en évaluer l’efficacité dans la pratique.
Nous avons été confrontés à quelques obstacles avant même que l’étude ne débute. Le premier obstacle était la loi vie privée belge qui, dans le cadre d’une recherche interventionnelle, impose l’accord écrit de chaque patient intégré dans l’étude. [http://www.fagg-afmps.be/fr/]. Cette obligation est entièrement justifiée dans le cas de véritables recherches interventionnelles. L’étude PROHIBIT mène également des interventions, mais il s’agit d’actes qui devraient faire partie des GMP (Good Medical Practice) au sein de chaque établissement. Il s’agit ici de processus validés intégrés dans des directives (inter)nationales. Il s’agit également d’une exigence pour l’étude, attribuant la même qualité de soins/le même bundle de soins à autant de patients que possible au sein du département. L’obtention de ces autorisations écrites n’était une obligation légale qu’en Belgique et a induit une pression administrative importante sur l’étude et a parfois été source d’ambiguïtés auprès du patient. Nous préconisons donc que les comités d’éthique médicale examinent à l’avenir minutieusement les aspects éthiques des essais stepped-wedge, informant largement les patients et leur entourage, mais ne nécessitant plus d’accord écrit au niveau individuel. Chaque patient conserve bien évidemment le droit de choisir individuellement de ne pas participer à l’étude (opting out). Un deuxième obstacle de la méthodologie appliquée était que l’hôpital individuel pouvait tôt ou (très) tard être sélectionné au hasard de sorte que l’intervention ne pouvait être exécutée que pour une période limitée. En cas de randomisation tardive, vous disposez de nettement moins de temps pour mettre l’intervention en œuvre et, le cas échéant, l’ancrer au sein de l’établissement.
Il semble logique, dans le cadre de la prévention des infections liées aux cathéters veineux centraux, de se concentrer sur les départements où les cathéters veineux centraux sont présents en nombre comme les soins intensifs, l’hémato-oncologie, l’hémodialyse. Cependant, les départements au sein desquels le nombre de cathéters est nettement inférieur constituent également un risque réel vu que l’expertise des collaborateurs y est nettement moins élevée. Sur la base de l’enregistrement continu des septicémies nosocomiales dans le NSIH (national surveillance of healthcare associated infections and antimicrobial resistance in Belgian hospitals, WIV-ISP), nous avons obtenu un aperçu du taux d’incidence des infections liées à un cathéter veineux central dans notre établissement. Il en est ressorti que le taux d’incidence de base pour l’hôpital dans son ensemble était faible à moyen et qu’une importante partie des infections liées à un cathéter veineux central concernait le département des soins intensifs. A l’issue d’une concertation avec la direction (des soins) et l’équipe en charge de la prévention des infections, il a été décidé de directement mettre ce projet en œuvre au sein du service soins intensifs afin d’également permettre un meilleur enregistrement et une amélioration des soins liés aux cathéters au sein de tous les autres départements.[6] L’étude nous a permis de revoir en profondeur les procédures et d’élaborer des fiches d’instruction. Il s’agit d’une condition fondamentale pour l’amélioration de la qualité, mais il faut aller plus loin. La création d’une culture d’engagement et de responsabilité auprès de chaque collaborateur importe davantage. Chaque collaborateur doit être convaincu que les infections liées à un cathéter veineux central sont problématiques et qu’elles peuvent en partie être évitées. Il est possible de faire dans ce cadre appel à une communication directe et continue sur la prévalence et l’incidence des infections liées à un cathéter veineux central, en élaborant des procédures écrites et fiches d’instruction. Il est cependant également possible de faire mieux, de manière plus efficace et plus durable en impliquant dans ce processus chaque collaborateur sur son lieu de travail. [7] Cette approche permet de créer un réseau de pairs qui, en agissant correctement, exercent une pression normative sur ceux ne le faisant pas encore. L’amélioration de la qualité nécessite également un leadership, comme l’a illustrée la comparaison de la compliance au sein des deux départements utilisant des cathéters veineux centraux.
Le département soins intensifs s’est mué, avec le soutien de médecins intensivistes et infirmiers en chef, en une véritable équipe mettant expertise et habileté au service de la pose des cathéters et des soins liés à ces derniers. Le même résultat a été obtenu pendant une certaine période au sein du département en charge des opérations, sous l’impulsion de l’infirmier de l’étude, mais son impact s’est ensuite rapidement érodé.
Les interventions multimodales ne s’assortissent pas de points d’évaluation majeurs. Les résultats de l’étude ont démontré que les hôpitaux, en marge de l’intervention obligatoire, améliorent également la qualité des processus inhérents. Les coordinateurs de l’étude en avaient conscience et ont, également pour des raisons d’éthique, toujours ouvert la porte à des améliorations locales, parallèles. Le module « in depth » et les journaux ont permis de mieux comprendre la dynamique des stratégies multimodales et de confirmer que cette approche était réalisable en Europe.[8] Dans tous les hôpitaux, il est toujours apparu qu’une combinaison de facteurs conduisait à une amélioration de la qualité. Des personnes expérimentées, occupant une position respectée ou en mesure de créer des liens, restent indispensables à un processus d’amélioration. A côté de cela, un soutien financier semble indispensable à l’installation d’un coordinateur de projets. Le soutien par une équipe expérimentée en charge de la prévention des infections semble également jouer un rôle de facilitation majeur.
Il est possible d’extraire une vision et une mission pour les formateurs d’opinions et décideurs politiques. Nous avons, en notre qualité de participant à PROHIBIT, déjà commencé à le faire au sein de notre établissement.
1. Laupland K, Church D. Population based epidemiology and microbiology of community onset bloodstream infections. Clin Microbiol Rev 2014; 27(4):647-664.
2. Steinberg J, Coffin S. Improving the Central Line–Associated Bloodstream Infection Surveillance Definition: A Work in Progress. Infection Control Hospital Epidemiol 2013; 34(8):769-776.
3. van der Kooi T, Wolkewitz M, van Benthem B et al. Prohibit (preventing hospital-acquired infections by intervention and training): preliminary results of a European multi-center study on the effectiveness of a hand hygiene campaign and a central venous catheter bundle. Antimicrob Resist Infect Control 2013; 2(Suppl 1):O83.
4. Pronovost P, Needham D, Berenholtz S et al. An Intervention to Decrease Catheter-Related Bloodstream Infections in the ICU. N Engl J Med 2006; 355:2725-2732.
5. Blot K, Bergs J, Vogelaers D et al. Prevention of central line-associated bloodstream infections through quality improvement interventions: a systematic review and meta-analysis. Clin Infect Dis 2014; 59(1):96-105.
6. Zingg W, Huttner B, Sax H. Assessing the Burden of Healthcare-Associated Infections through Prevalence Studies: What Is the Best Method? Infection Control Hospital Epidemiol 2014; 35 (6):674-684
7. Zingg W, Walder B, Pittet D. Prevention of catheter-related infection: toward zero risk? Curr Opin Infect Dis 2011; 24:377-384
8. Sax H, Clack L, Touveneau S et al. Implementation of infection control best practice in intensive care units throughout Europe: a mixed-method evaluation study. Implement Sci 2013; 8(24):8:24
Tableau 1 : Définitions utilisées dans l’étude européenne PROHIBIT sur l’efficacité d’une ‘bundle care’ pour la prévention des septicémie dans des hôpitaux aigus.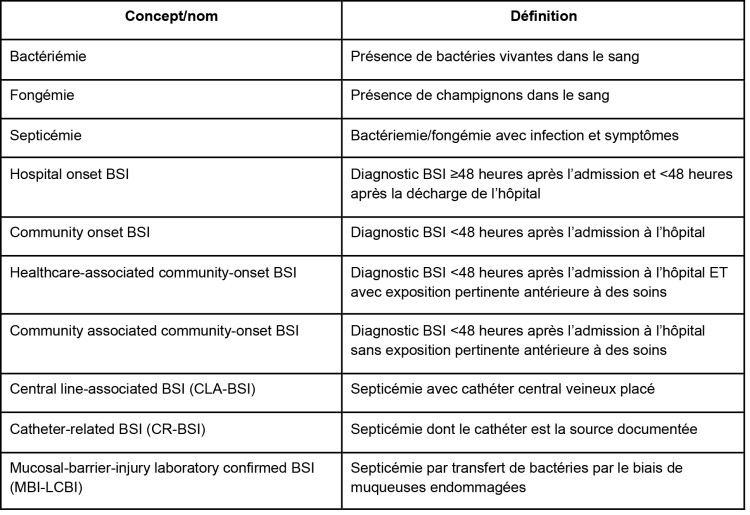
Figure 1 : Incidence des septicémies liées aux cathéters (CR-BSI) par 1000 journées cathéter avant et après une intervention ‘bundle care’, de l’étude PROHIBIT (14 hôpitaux dans 11 pays européens)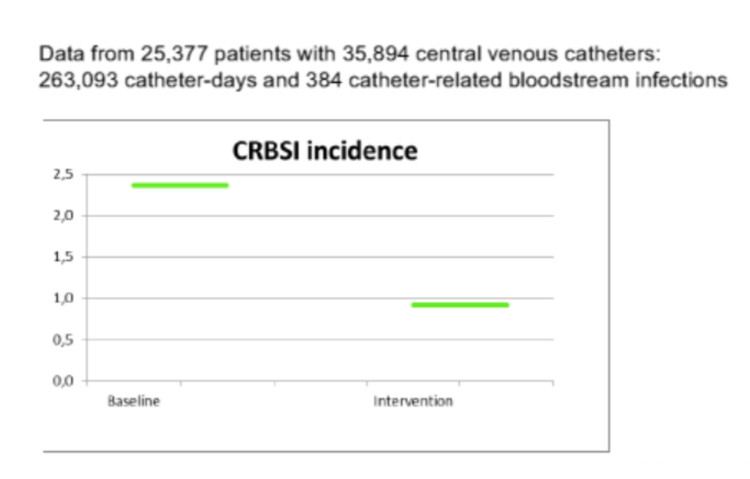
Nous allons nous baser sur les « Recommandations en matière de stérilisation, CSH n°7848 »1 pour la stérilisation. Dans ce cas, la stérilité des instruments à l’issue d’un nettoyage validé, à savoir une désinfection thermique de haut niveau (valeur Ao2 de minimum 3000) et une stérilisation, ne peut être garantie lorsque l’empaquetage des instruments s’est effectué à mains nues. Des preuves sont apportées dans le présent document à l’aide d’un système formel et logique. Si nous voulons conférer une garantie de stérilité aux instruments stérilisés, nous devrons adapter notre processus ou notre point de vue.
Extraits CSH n° 7848: [1]
« Stérilisation : mise en œuvre d’un processus visant à rendre stérile la charge introduite dans un stérilisateur (EN 285-8). Ce processus s’inscrit lui-même dans une suite de processus qui concourent à détruire ou à éliminer tous les micro-organismes vivants de quelque nature et sous quelque forme que ce soit, portés par des objets parfaitement nettoyés. (définitions) »…
« La stérilisation fait partie des procédés spéciaux dont les résultats, et plus particulièrement la stérilité du matériel traité, ne peuvent être certifiés par un contrôle du produit fini.
La maîtrise du processus de stérilisation est la base même du résultat que le patient est en droit d’attendre. Cette maîtrise passe par le contrôle du processus de stérilisation conjugué à un nombre important d’actions de contrôles en amont et en aval de la stérilisation proprement dite. La biocharge doit être maintenue aussi basse que possible.
Une maîtrise efficace de la biocharge ne peut être obtenue que par des méthodes de nettoyage et de désinfection préalablement validées mais aussi par une maîtrise de l’environnement (locaux, air ambiant, personnel…) »…
« Un nettoyage et/ou une désinfection insuffisants peuvent offrir aux germes une protection contre l’agent de stérilisation et entraîner des contaminations chez les patients. »…
« Pour le matériel médical critique, la valeur de A0 (niveau de désinfection)² doit être d’au moins 3.000. »
« Les normes ont été établies pour des charges à stériliser dont la contamination initiale est bien maîtrisée. A lui seul, un paramètre correct ne peut garantir la stérilité d’une charge. Par contre, à lui seul, un paramètre incorrect met en évidence une défaillance ; la charge ne peut être libérée. »
Le pharmacien hospitalier a notamment pour mission de contrôler les différentes étapes précédant la stérilisation : nettoyage, désinfection, emballage du matériel à stériliser.
Lors de l’établissement de recommandations concernant les techniques de stérilisation, il convient de tenir compte du respect des mesures de précaution requises pour réduire la charge microbienne (biocharge).
Les exigences en matière de stérilisation peuvent se résumer comme suit :
« Tous les matériaux de parachèvement et les surfaces de travail sont lisses et lavables (CSH n° 7848). »
L’on oublie ou occulte souvent que la zone « propre » du CS (Centre de stérilisation)[2] où il est procédé au contrôle des instruments, à leur emballage et à leur stérilisation constitue la zone la plus critique du CS. Dans cette zone, les instruments « parfaitement » nettoyés et ayant fait l’objet d’une désinfection de « haut niveau » (et ce contrairement à la zone « stérile » où les instruments sont stockés en attendant d’être utilisés) ne sont pas protégés contre des contaminations organiques ni contre des transmissions de composants microbiens (microbiota).
Dans le manuel intitulé « Ziekenhuishygiëne »3 (hygiène hospitalière), on apprend dans le chapitre « Microbiologisch onderzoek van oppervlakken » (Examen microbiologique des surfaces) que « pour être validées, les surfaces normales ne peuvent comporter plus de 5 colonies par plaque (25 cm2). »
La zone d’empaquetage d’un CS est donc une zone propre. La contamination microbienne de tous les matériaux de finition et surfaces de travail doit être minime (< 5 unités formant une colonie (UFC)/25 cm²). Ces surfaces n’ont pas de microbiota commensaux propres (flore). La biocharge éventuellement présente sur ces surfaces doit toujours être considérée comme une contamination.
Chaque surface de chaque organisme pluricellulaire complexe entrant en contact avec l’environnement extérieur développe des microbiota commensaux propres, comme c’est le cas sur la peau de nos mains. A la suite du contact avec des matières vivantes et non vivantes, la peau absorbe également des micro-organismes transitoires et transmet des microbiota commensaux mais aussi transitoires.
De la même manière, nous transmettons des substances organiques et inorganiques par le contact. Ces échanges sont très intenses. Ils permettent à certaines races d’animaux de dépister des individus.
Les recommandations de l’OMS (« Recommandations OMS pour l’hygiène des mains au cours des soins)4 stipulent que (traduction) : « La peau humaine normale est colonisée par des bactéries. Le nombre total de bactéries aérobies varie de plus de 1 x 106 UFC/cm2 sur le front, 5 x 104 UFC/cm2 sur l’abdomen à 1 x 104 KVE/cm2 (KVE/cm² ou UFC/cm2)sur l’avant-bras. Le nombre total de bactéries sur les mains des professionnels de la santé oscille entre 3,9 x 104 et 4,6 x 106 UFC/cm2. Lors de l’utilisation de la méthode « Fingertip press », la contamination oscille entre 0 et 300 UFC ».
Dans une autre référence, Pessoa-Silva C.L. et al.5 démontrent à l’aide de la méthode « Fingertip press » que 360 des 398 cultures prélevées auprès de professionnels de la santé se sont avérées positives aux bactéries.
Lucet J.C., et al.6 démontrent quant à eux ce qui suit à l’aide de la méthode « Fingertip press » : sur un total de 516 cultures (258 avant l’hygiène des mains (HM) et 258 après HM), 383 se sont révélées positives. Dans ce cadre, il est crucial de noter que le nombre d’UFC avant HM ne présente PAS de divergence notable.
Hoffman P.N., et al.7 démontrent à l’aide de la méthode « Swab » qu’un swab (tampon à prélèvements) réalisé sur la peau sous une bague contient en moyenne 1600 UFC/swab et qu’un swab de la peau sur un lieu de contrôle dénombre en moyenne 180 UFC/swab. Salisbury DM, et al. 8 démontrent à l’aide d’une méthode « timed-friction rinse » que sur 915 échantillons de mains sans bague et avant leur nettoyage, on obtient en moyenne 3303 UFC et que sur 245 échantillons de mains sans bague et après leur nettoyage, on obtient en moyenne 1775 UFC.
Annette Schuermans, et al.9 démontrent à l’aide de la méthode « Fingertip press » que 51,8 % des 1643 personnes examinées dénombraient plus de 50 UFC sur les 5 empreintes digitales de leur main dominante avant l’exécution d’un acte pour lequel les mains sont supposées avoir été récemment lavées ou désinfectées.
En juin 2013, la Vlaams Agentschap Zorg en Gezondheid (Agence flamande soins et santé) a évalué l’hygiène des mains au sein de l’AZ Nikolaas. A cet effet, des tampons à prélèvements (swabs) ont été utilisés entre les doigts des collaborateurs. Les valeurs cibles de ces types de prélèvement ne sont pas mentionnées dans les ouvrages, mais la limite a été fixée à 500 UFC/swab en concertation avec le WIV-ISP (Dr Nadine Botteldoorn).
En guise de premier petit échantillonnage, l’auteur a, en mars 2014, à l’aide de la méthode « Fingertip press », étudié au hasard les doigts de la main dominante de 13 collaborateurs du CS en zone « propre ». Cinq boîtes (38 %) dénombraient des UFC supérieures à 100. Sept (54 %) en dénombraient plus de 50 (à comparer à l’étude susmentionnée du Prof. A. Schuermans9).
Toujours en mars 2014 est paru « Contamination of Stethoscopes and Physicians’ Hands After a Physical Examination »10. Le tableau suivant indique les résultats de la contamination bactérienne (exprimée en UFC/25 cm²) provoquée par un contact cutané avec des objets stériles : stéthoscope stérile, gants stériles (comparable au contact manuel avec des instruments stériles).
Tableau 1. Contamination des mains et du stéthoscope des médecins après un examen médical (Yves Longtin, et al., 2014 11)
UFC : unités formant colonies ; Min: minimum; Max: maximum.
Il convient également de tenir compte du fait qu’il a été démontré que l’observance pour l’hygiène des mains était trop faible, que l’exécution technique de l’hygiène des mains était souvent incorrecte et qu’il y avait une relation linéaire entre la transmission bactérienne et le niveau de contamination des mains11.
En résumé, on peut avancer que la biocharge de nos mains est élevée (surtout en rapport avec des surfaces normales propres) et que le contact avec les mains donne lieu à une importante transmission de bactéries (UFC). Le contact avec les mains conduit également à la transmission de substances organiques et inorganiques (lipides, particules cutanées, métaux, sels, etc.). En d’autres termes, le contact avec les mains accroît la biocharge et pollue.
Un nettoyage et/ou une désinfection insuffisants peuvent offrir aux germes une protection contre l’agent de stérilisation et entraîner des contaminations chez les patients. (CSH n° 7848).
Les instruments utilisés en chirurgie propre sont en principe exempts de bactéries.
A l’issue d’un nettoyage validé et d’une désinfection thermique de haut niveau validée (valeur Ao ≥ 3000, en pratique souvent 6000 12-13), l’instrument est en principe parfaitement propre et exempt de germes. Si, à l’issue du nettoyage et de la désinfection adéquats, il est procédé au contrôle et à l’emballage des instruments à mains nues, la pollution des instruments augmente et la biocharge n’est plus aussi faible que possible. La biocharge de gants jetables propres (surfaces normales) est en principe très réduite (surtout en comparaison à la biocharge de nos mains) et comparable à celle du matériau d’emballage.
Littérature scientifique et syllogistique14-20, le système formel logique d’Aristote.
Après manipulation à mains nues, la stérilité des instruments à l’issue d’une stérilisation validée ne peut plus être garantie. Pour les variables scientifiques, veuillez voir ci-dessus.
Une preuve est un raisonnement valable aux prémisses vraies. Un raisonnement n’est valable que si les prémisses sont vraies. La conclusion est alors vraie également (Aristote).
Major (Aam) : après stérilisation validée, des instruments garantis stériles (a) sont des instruments parfaitement propres affichant une biocharge aussi basse que possible (m) -> point de départ, CSH n° 7848.
Minor (Ebm) : après manipulation à mains nues, les instruments (b) ne sont pas des instruments parfaitement propres affichant une biocharge aussi basse que possible (m) -> littérature scientifique, preuves (voir ci-dessus).
Conclusion (Eba) : après manipulation à mains nues, les instruments (b) ne sont pas des instruments garantis stériles après stérilisation validée (a)
(Aam
Ebm
Eba -> est un Camestres, un syllogisme valide de la 2e figure avec AEE, qui devait être prouvé.)
Si nous voulons conserver les « Recommandations pour stérilisation » du Conseil supérieur de l’hygiène (CSH n° 7848) et offrir une garantie de stérilité, le port de gants lors du contrôle et de l’emballage (donc à l’issue du nettoyage et de la désinfection validés) en constitue la suite logique (un discours tel que, certaines choses étant posées, quelque autre chose en résulte nécessairement par cela seul que les premières sont posées (Aristote)).
Avec le temps, nos possibilités techniques en matière de prévention et de contrôle des infections dans le secteur des soins sont également de plus en plus nombreuses. En comparaison au nettoyage et à la désinfection manuels, l’utilisation de méthodes de nettoyage et de désinfection validées constitue un avancement qualitatif majeur. La plus-value de ces processus partiels ne peut s’éroder dans la suite du processus, au risque de voir la facture s’alourdir à la fin du processus. La plus-value du nettoyage et de la désinfection validés est liée à l’utilisation de gants pendant la phase d’emballage. Nos capacités cognitives évoluent souvent moins rapidement que nos capacités techniques, et nous ne tenons pas assez compte de nos microbiota commensaux. L’on considère trop souvent l’homme comme un être complexe et à part entière et oublie qu’il coexiste avec une multitude de micro-organismes. L’homme est le fruit de l’évolution de la planète terre.
« A » est défini comme le temps nécessaire, exprimé en secondes, à une température de 80°C, pour atteindre un certain effet désinfectant.
Lorsque la température est de 80°C et que la valeur Z est équivalente à 10, le terme « A0 » est utilisé.
1 unité Ao = 1 seconde à 80°C.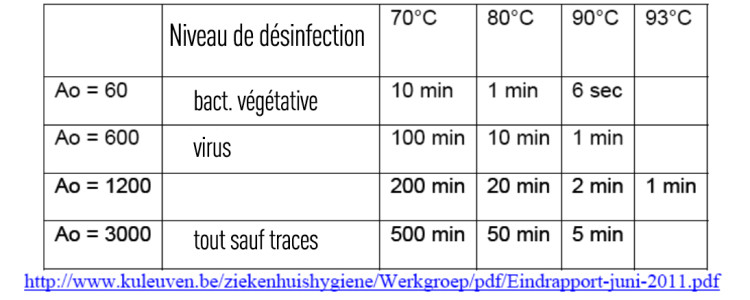
La syllogistique est un système formel logique. La forme ou la structure du raisonnement en détermine la validité. On distingue 256 modes syllogiques. Camestres est un syllogisme valable.
Un syllogisme (raisonnement valable) se compose d’énoncés catégoriques, 2 faisant office de prémisses et 1 de conclusion. Un prédicat (a) est affirmatif ou négatif par rapport à un sujet (b). Le moyen terme (m) n’apparaît que dans les prémisses. Il existe 4 sortes d’énoncés S- P :
Aba: universel affirmatif
Iba: particulier affirmatif
Eba: universel négatif
Oba: particulier négatif.
1. Conseil supérieur de l’hygiène (CSH) n° 7848, Recommandations en matière de stérilisation
2. Thermal Disinfection – The Ao Concept and the Biological Background, Urs Rosenberg, Borer Chemie AG, Switzerland
3. Reybrouck G., Schuermans A., Van de Putte M. Ziekenhuishygiëne. Acco Leuven / Leusden, uitgave 2000
4. World Health Organization Patient Safety: WHO Guidelines on Hand Hygiene in Health Care: First Global Patient Safety Challenge, Clean Care is Safer Care. Geneva Switzerland: World Health Organization; 2009
5. Pessoa-Silva C.L. et al.: Dynamics of bacterial hand contamination during routine neonatal care. Infect Control Hosp Epiemiol 25:192-197, Mar. 2004
6. Lucet J.C., et al.: Hand contamination before and after different hand hygiene techniques: a randomized clinical trial. J Hosp Infect 50:276-280, Apr. 2002.
7. Hoffman P.N., et al.: Micro-organisms isolated from skin under rings worn by hospital staff. BMJ290(6463):206-207. Jan. 1985.
8. Salisbury DM, et al.: The effect of rings on microbial load of health care workers’ hands. Am J Infect Control, 1997;25:24-27
9. Schuermans, A. et al.: Sensibilisatiecampagne handhygiëne door de Regionale Werkgroep voor Ziekenhuishygiëne Vlaams-Brabant en Limburg. NOSO-info, vol. VIII nr. 4, 2004
10. Longtin, Y. et al., Contamination of Stethoscopes and Physicians’ Hands After a Physical Examination. Mayo Clin Proc. March 2014:89(3):291-299.van der Velden L.B., Nabuurs-Franssen M.H., van Leeuwen A., Isken M., Voss A.
11. Pittet D., et al Evidence-based model for hand transmission during patient care and the role of improved practices. . The Lancet Infectious Diseases 1/2006; 6(10):641-52.
12. Van der Velden L.B. et al., Thermal disinfection of bedpans: European ISO 15883-3 guideline requirements are insufficient to ensure elimination of ARE and OXA-48 outbreak-strains. Antimicrobial Resistance and Infection Control: Abstracts from the 2nd International Conference on Prevention and Infection Control (ICPIC 2013), Antimicrobial Resistance and Infection Control 2013, 2(Suppl 1):O66 doi:10.1186/2047-2994-2-S1-O66
13. Bories, Y. Bedpanspoelers, centrale vaatwassers in ziekenhuizen en woon- en zorgcentra en de verspreiding van multiresistente darmcommensalen, Yvo Bories, NOSO-info, vol. XVII nr 4, 2013
14. Van Riel G., Fundamentele wijsbegeerte, , Acco 2010
15. Cloots A., Fundamentele wijsbegeerte, , Acco 2012
16. De Pater W.A., Vergauwen R.M.A., Logica: formeel en informeel, Universitaire Pers Leuven 2005
17. Werkgroep ziekenhuishygiëne, Eindrapport-juni-2011 KULeuven
18. Wenzel R.P., Prevention and Control of Nosocomial Infections, fourth edition, Lippincott Williams & Wilkins 2007
19. Wenzel R.P. Minimizing Surgical-Site Infections. Editorial. New Engl J. Med 362;1:75-77, 2010
20. Sintubin, M. De wetenschap van de aarde – over een levende planeet, Acco 2012
Tout patient d’hémodialyse chronique est confronté au risque d’une bactériémie associée aux cathéters (BAC). Le risque de développer cette complication dépend de la voie d’accès choisie : un cathéter de dialyse temporaire ou permanent induit un risque d’infection supérieur à une fistule artério-veineuse [1,2,3]. Selon certaines sources, les taux d’hospitalisation et de mortalité liés à des infections sont 2 à 3 fois plus élevés dans le cas de patients d’hémodialyse sur cathéter[4,5]. La pathogénèse des BAC est claire. Les bactéries pénètrent dans les vaisseaux sanguins à partir de la peau, par le biais du site d’insertion du cathéter, ou des bactéries formant un biofilm pénètrent directement dans le cathéter à la suite d’une manipulation non aseptique [6].
Au vu des potentielles conséquences lourdes des BAC sur les patients d’hémodialyse, la surveillance des BAC auprès des patients d’hémodialyse chronique s’avère particulièrement judicieuse. Cet article est un compte rendu d’un projet d’amélioration de la qualité suivant la méthode en 7 étapes. [7] Ce projet a été élaboré de manière autonome par l’unité de dialyse. La méthode appliquée est celle du Netwerk Klinische Paden de la KU Leuven dont le but est de soutenir les équipes multidisciplinaires dans l’élaboration, la mise en place, l’évaluation et le suivi continu de l’organisation d’un processus de soins.
Approche selon le cycle PDCA (Plan-Do-Check-Act/Adjust)
Fig.1. Méthode en 7 étapes pour mettre en place un itinéraire de soins
Phase 1 : screening
Toutes les hémocultures de patients en dialyse chronique prélevées lors d’une même année civile ont été étudiées pour identifier la présence de pathogènes (hémocultures positives). Les définitions du protocole sepsis de l’Institut Scientifique de Santé Publique (WIV-ISP) ont été appliquées. Les patients dialysés aigus temporaires et les patients sous dialyse péritonéale nécessitant une hémodialyse temporaire n’ont pas été inclus. Dans le cadre de l’analyse, tout patient d’hémodialyse chronique présentant une hémoculture positive non secondaire à une autre infection a été considéré comme un patient présentant un sepsis associé à un cathéter, identifié dans cet article par l’abréviation BAC. D’après ce screening, les infections liées à des cathéters en 2008 et 2009 ont augmenté de 1,03 à 1,17 par 1000 jours-cathéter. Le centre de dialyse a perçu la nécessité d’élaborer un projet d’amélioration multidisciplinaire.
Phase 2 : approche par projets
Un néphrologue et 2 infirmiers de dialyse ont été désignés chefs de projet. Lors des moments de concertation d’équipe, il a été procédé à un brainstorming multidisciplinaire concernant des possibles actions d’amélioration visant à réduire le risque de BAC auprès de patients d’hémodialyse chronique. L’équipe de dialyse était clairement prête à changer et à innover. Un groupe de travail sur les soins impliquant l’utilisation d’un cathéter a été mis en place sur une base volontaire. Les soins au site de sortie et les manipulations du cathéter de dialyse sont considérés comme cruciaux dans la prévention des BAC. La procédure existante pour les soins liés à l’utilisation d’un cathéter a été passée sous la loupe et comparée aux directives Kidney Disease Outcomes Quality Initiative (directives KDOQI) [8].
Phase 3 : diagnostic & objectivation
C’est sous la devise « mesurer c’est savoir » que des données ont été rassemblées et traitées. Les chiffres BAC obtenus ont été comparés avec les critères de performance internationaux objectifs suivants.
Fig. 2. Critères d’évaluation du taux de BAC auprès des patients d’hémodialyse chronique
BAC : bactériémie associée aux cathéters
Un objectif de < 1 BAC/1000 jours-cathéter – dans le but d’offrir des soins excellents – a été formulé. Il est évalué chaque année si cette norme est atteinte.
Phase 4 : développement
Différentes actions ont été mises en place pendant la phase de développement.
Le groupe de travail sur les soins liés à l’utilisation d’un cathéter a révisé la procédure de soins liés à l’utilisation d’un cathéter en intégrant les directives KDOQI. Des seringues stériles pré-remplies de 20 ml de sérum physiologique ont été utilisées pour le rinçage du cathéter. Le contenu des sets de raccordement et de fermeture a été adapté. Le nombre de matériaux emballés séparément à utiliser a été revu à la baisse, réduisant la probabilité d’actes non stériles. La préparation du set de fermeture, les soins au site d’insertion du cathéter et le procédé lors du raccordement ont été rédigés. Il a été fait la promotion de l’hygiène des mains et de la désinfection de l’écran de l’appareil de dialyse (surface souvent touchée).
Vu que le dialysé endosse souvent également une responsabilité propre et doit participer à la prévention des BAC, une brochure destinée aux patients a été élaborée et des investissements dans une éducation des patients supplémentaire concernant la prévention d’infections dues à un cathéter ont été consentis.
Fig. 3 exemples de quelques nouveautés dans la procédure de soins liés à l’utilisation de cathéters lors de dialyses
Nouveaux sets de raccordement et de fermeture
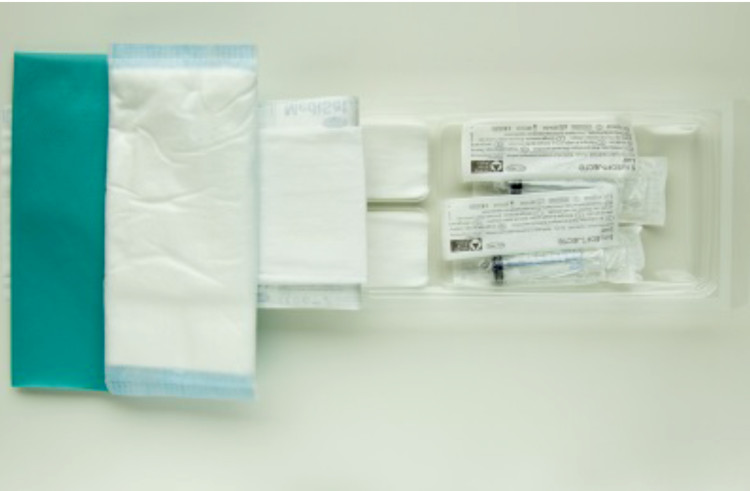
Désinfection des connexions à l’aide de compresses imprégnées de chlorhexidine alcoolique (« scrub the hub »)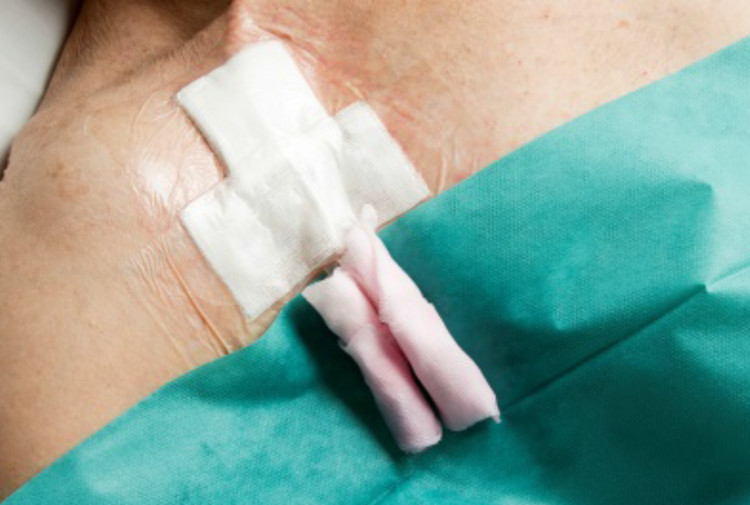
Bouchons obturateurs dans chlorhexidine alcoolique Utilisation d’acide fusidique en pommade uniquement dans des indications bien précises (en cas de cathéter temporaire ; en cas de cathéter définitif si cuff visible ou pendant une courte période en cas de rougeurs au niveau du site d’insertion du cathéter après prélèvement de culture))
Phases 5 & 6 : mise en place et évaluation
Le nouveau procédé a été expliqué à tous les infirmiers de dialyse à l’occasion d’une réunion d’équipe. A l’issue d’une phase d’information poussée, toutes les mesures (dont l’information des patients) ont immédiatement été appliquées à large échelle en 2012. La nouvelle procédure concernant les soins liés à l’utilisation de cathéters est disponible dans le livre de procédures électronique et évaluée lors des moments de concertation en équipe. Les indications pour l’utilisation de pommade antibiotique (acide fusidique Fucidin®) ont été clairement établies. Les résultats du processus d’amélioration de la qualité se sont avérés positifs. Le taux de BAC s’élevait en 2012 à 0,75/1000 jours-cathéter.
Phase 7 : suivi continu
Chaque année, il est procédé à une évaluation objective formelle de l’indicateur de résultat et de l’organisation du processus de soins. Après l’introduction d’actions d’amélioration dans le processus de soins, le taux de BAC a diminué pour ensuite rester à un faible niveau (moins de 1 BAC par 1000 jours-cathéter).
Fig. 4 Evolution des BAC/1000 jours-cathéter (de dialyse) auprès des patients d’hémodialyse chronique, avant et après intervention dans un hôpital aigu.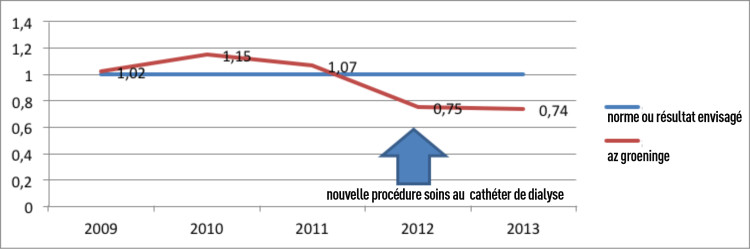
Des procédures claires et des soins uniformes liés à l’utilisation de cathéters ont permis d’améliorer les la qualité des soins, donnant lieu à une réduction effective du nombre de BAC. Mesurer une qualité, comparer des chiffres avec une norme acceptée à l’échelle internationale et mettre en place un projet de qualité PDCA sont autant d’actions suscitant une implication et rapprochant différents membres d’équipe/disciplines. La surveillance actuelle des BAC devrait pouvoir être étendue au contrôle de l’utilisation des antibiotiques, de la durée de vie des cathéters de dialyse et du nombre d’hospitalisations liées à l’utilisation d’un cathéter.
L’étude NOTICE (National Opportunity To Improve Infection Control in End-stage renal disease) a récemment démontré la présence de grandes disparités concernant les mesures de prévention des infections sur les unités de dialyse aux États-Unis ; les meilleures pratiques ne sont pas partout traduites dans la pratique quotidienne [9]. Les choses ne sont peut-être pas différentes dans notre pays. Notre expérience nous a appris que le meilleur moyen d’y remédier était de faire appel à un projet d’amélioration de la qualité locale à l’aide d’une équipe motivée de néphrologues et infirmiers de dialyse.
[1] Inrig JK, Reed SD, Szczech LA, et al. Relationship between clinical outcomes and vascular access type among hemodialysis patients with Staphylococcus aureus bacteremia. Clin J Am Soc Nephrol 2006; 1:518.
[2] Fan PY, Schwab SJ. Vascular access: concepts for the 1990s. Clin J Am Soc Nephrol 1992; 3:1.
[3] Patel PR, Kallen AJ, Ardujo MJ, Epidemiology, surveillance and prevention of bloodstream infections in hemodialysis patients, Am J Kidney Dis, 2010, 56(3), 566-577.
[4] Pastan S, Soucie JM, McClellan WM. Vascular access and increased risk of death among hemodialysis patients. Kidney Int 2002; 62:620.
[5] Allon M, Daugirdas J, Depner TA, et al. Effect of change in vascular access on patient mortality in hemodialysis patients. Am J Kidney Dis 2006; 47:469.
[6] Allon M. Dialysis catheter-related bacteremia: treatment and prophylaxis. Am J Kidney Dis 2004; 44:779.
[7] 7 fasenmodel voor de ontwikkeling, implementatie, evaluatie en continue opvolging van zorgpaden, Netwerk Klinische Paden, Centrum voor Ziekenhuis-en Verplegingswetenschap KU Leuven https://nkp.be/zorgpaden/methodologie
[8] Clinical Practice Guidelines and Clinical Practice Recommendations for vascular access, 2006 updates NKF DOQI.
[9] Chenoweth CE et al., Variation in infection prevention practices in dialysis facilities: results from the National Opportunity to improve Infection Control in ESRD (End-Stage Renal Disease) Project, Inf Control and Hosp Epidem, 2015, 36(7), 802-806.


D’après le REMIC 1
Un prélèvement d’hémoculture doit être réalisé chez tout patient présentant de la fièvre surtout s’il présente des signes cliniques évocateurs d’infection.
L’objectif de ce prélèvement est de détecter la présence de bactéries ou de champignons dans le sang et d’en déterminer la sensibilité pour aider le clinicien dans le choix de l’antibiotique ou de l’antifongique. Le type de micro-organisme identifié est un élément important dans le diagnostic de l’origine du foyer infectieux: endocardite ou autre foyer profond.
Seule la ponction veineuse est une technique valable pour le prélèvement d’hémoculture.
Les prélèvements par des dispositifs intra-vasculaires augmentent significativement le risque de contamination. Quand on suspecte une infection de voie centrale, on peut prélever une hémoculture par le cathéter central et une autre hémoculture par voie périphérique, pour autant que le laboratoire réalise des cultures quantitatives. La meilleure façon de faire le diagnostic d’une septicémie liée au cathéter (CRBSI) est de mettre le cathéter en culture.
Les autres facteurs de risque de contamination du prélèvement sont : le site de prélèvement mal préparé, des mains mal ou pas désinfectées, une mauvaise technique de prélèvement, les prélèvements via des dispositifs invasifs, la multiplication des prélèvements, une mauvaise asepsie des bouchons des flacons d’hémocultures, …
Dans le cadre des précautions générales, tout prélèvement sera réalisé avec des gants après désinfection des mains à la solution hydro-alcoolique.
Pour diminuer ce risque de contamination, la séquence idéale des actions :
La chance de cultiver un germe est directement corrélée au volume de sang prélevé. Chez l’adulte, ce volume, par ponction veineuse, est de minimum 20 ml à distribuer dans 2 flacons d’hémoculture (aérobie et anaérobie).
Chez le jeune enfant, la concentration de germes/ml est beaucoup plus importante et de ce fait un volume plus faible peut être prélevé pour un même rendement pour autant qu’on utilise un flacon pédiatrique.
Prélèvement d’hémoculture chez l’adulte :
Chez l’adulte, le volume minimum de sang est de 20 ml. Le volume optimal est variable suivant les publications mais une étude de 2007 a déterminé la sensibilité cumulée de une, deux, trois et quatre paires d’hémocultures prélevées sur 24h. 2
Sur 629 épisodes de septicémies, 73.1% ont été détectés après 1 paire, 89.07% détectés après 2 paires, 98.2% après 3 paires et 99.8% détectés après quatre paires prélevées sur une période de 24h.
L’intervalle entre les prélèvements de flacons n’a aucune importance sur le diagnostic. Il est recommandé de les prélever le plus près possible du pic fébrile. Les flacons sont généralement prélevés en plusieurs fois (prélèvements multiples) mais une alternative est donc de les prélever tous en même temps (prélèvement unique) ce qui diminue le risque de contamination. Ces contaminations ont comme conséquences potentielles un doute sur le diagnostic, une antibiothérapie inappropriée, le retrait inutile d’un cathéter et l’augmentation de la durée de séjour et des dépenses.
Prélèvement d’hémoculture chez l’enfant: les recommandations aux Cliniques Universitaires Saint-Luc
Eviter tout prélèvement dit de routine (ex : au retrait des voies centrales si l’enfant n’est pas septique), ce qui augmente la charge de travail du laboratoire et présente le risque d’avoir une contamination. De plus cela ne comporte pas de bénéfice pour le patient.
Eviter également les hémocultures dites de routine, celles prélevées dans un contexte d’infection virale démontrée ou suspectée 2-3 jours auparavant, celles faites en postop immédiat d’une intervention sans risque connu d’infection secondaire.
Voici un tableau qui reprend les quantités idéales requises en fonction du poids ou de l’âge de l’enfant, tableau utilisé aux Cliniques universitaires Saint-Luc
Dans la 5ème édition du référentiel en microbiologie médicale de la Société française de microbiologie (REMIC) tout récemment paru (2015) existe un tableau quelque peu différent reprenant les volumes de sang à prélever en fonction du poids de l’enfant repris ci-dessous :
Transport des flacons d’hémoculture :
Les flacons doivent être acheminés le plus rapidement possible et à température ambiante au laboratoire. En cas de délai d’acheminement au laboratoire (à éviter) les flacons sont conservés à température ambiante et surtout pas au frigo.
L’introduction différée des flacons dans l’automate n’est pas du tout recommandée car dans ce cas de figure, que ce soit avec ou sans pré-incubation, le risque de retard de croissance ou de faux négatifs est avéré.
Les flacons doivent donc être incubés le plus rapidement possible dans l’automate. Il existe d’ailleurs actuellement des automates de petite dimension pour l’incubation délocalisée des flacons garantissant le délai le plus court possible entre le prélèvement et le début de l’analyse.
Durée d’incubation des flacons :
5 à 7 jours en fonction des systèmes et en dehors de toute suspicion d’endocardite
Le cas particulier de l’endocardite :
Idéalement avant toute antibiothérapie, il est recommandé de prélever trois paires d’hémoculture dont l’incubation sera prolongée de 5 à 7 jours à 21 jours minimum.
Il n’y a pas de pic de température en général donc les prélèvements peuvent s’échelonner sur la journée en prélevant à distance des injections d’antibiotiques et si possible dans les flacons contenant des inhibiteurs. Si les trois premiers prélèvements sont négatifs, il est conseillé de prélever à nouveau deux à trois jours plus tard selon les mêmes modalités.
1 REMIC Référentiel en microbiologie médicale 5ème édition 2015 (SFM, SFP, SFMM)
2 Detection of bloodstream infections in adults: how many blood cultures are needed? Lee A, Mirrett S, Reller LB, Weinstein MP. J Clin Microbiol. 2007 Nov;45(11):3546-8.