Introduction
Les quelques épidémies recensées ces dernières années en Belgique (oreillons en 2013, rougeole en 2011 et 2017), ont montré qu’une proportion de la population des jeunes adultes belges n’était pas suffisamment protégée contre ces deux affections. Elles ont également mis en évidence l’importance de la vaccination du personnel soignant appelé à intervenir en première ligne. Si le cadre des vaccinations obligatoires est bien posé et suivi par le Conseiller en prévention-Médecin du travail, celui des vaccinations recommandées reste moins structuré. Après un bref rappel des obligations légales, cet article a pour objet de donner des recommandations de bonnes pratiques en matière de politique vaccinale dans ce secteur.
I. Vaccinations en milieu de travail. Que prévoit la législation du travail ?
La vaccination en milieu de soins doit s’inscrire dans une démarche globale de prévention des risques infectieux, élaborée par l’employeur, en collaboration avec le Conseiller en prévention-Médecin du travail, l’hygiène hospitalière et tout autre intervenant utile.
D’un point de vue légal, la démarche s’inscrit dans le cadre de l’Arrêté Royal du 4 aout 1996 concernant la protection des travailleurs contre les risques liés à l’exposition à des agents biologiques [1] et notamment via les articles suivants :
Art VII 1-5 à 1-8 : « l’employeur réalise l’évaluation des risques en collaboration avec le Conseiller en prévention-Médecin du travail, détermine les mesures préventives, assure l’information des travailleurs exposés et leur surveillance de santé ; cette évaluation doit être renouvelée régulièrement et en tout cas lors de tout changement des conditions de travail ou s’il s’avère qu’un travailleur est atteint d’une infection ou d’une maladie qui résulterait d’une telle exposition. Les éléments ayant contribué à l’évaluation, les résultats de l’évaluation et les mesures générales à prendre sont consignés dans un document écrit qui est soumis à l’avis du CPPT. »
Art VII 1-51 à 1-58 : si l’analyse des risques révèle que les travailleurs sont ou peuvent être exposés à des agents biologiques, l’employeur doit offrir la possibilité aux travailleurs qui ne sont pas suffisamment immunisés de se faire vacciner s’il s’agit d’un agent biologique pour lequel un vaccin efficace est disponible et il doit les faire vacciner s’il s’agit d’un vaccin obligatoire (hépatite B, tétanos, test tuberculinique). Les vaccinations sont effectuées par le Conseiller en Prévention-Médecin du travail ou si le travailleur le souhaite par un médecin de son choix.
Par ailleurs, le Conseiller en prévention-Médecin du travail a également pour mission de prendre les mesures nécessaires vis-à-vis d’un travailleur atteint d’une maladie contagieuse grave, afin de préserver la santé de ses collègues.
II. Objectifs de la vaccination du personnel de santé
La vaccination du personnel de soin présente un double objectif :
– Prémunir les travailleurs d’un risque de contamination en leur assurant par cet acte de prévention primaire, une protection individuelle ; c’est le rôle de prévention requis par la législation du travail ; cette vaccination préventive permet également de prémunir la travailleuse en âge de procréer contre des affections qui peuvent être graves pour la femme enceinte et l’enfant à naître et rejoint donc la protection de la maternité.
– Eviter de transmettre aux patients fragilisés hospitalisés une maladie potentiellement sévère chez eux ; il s’agit, dès lors, d’une action de protection collective qui relève plus de l’hygiène hospitalière.
Ces deux objectifs sont, bien sûr, liés et complémentaires.
III. Les vaccinations et le test tuberculinique de dépistage obligatoires en milieu de soins
Les vaccinations rendues obligatoires par l’AR du 4 août 1996
[1 : Art 1-64 et 1-74] sont les suivantes :
– La vaccination contre l’hépatite B ;
– La vaccination contre le tétanos ;
– Le dépistage de la tuberculose par test tuberculinique.
HEPATITE B
La vaccination contre l’hépatite B est obligatoire pour tous les travailleurs (sauf administratifs) des services où sont effectués des examens ou des soins médicaux, pour les travailleurs des laboratoires où sont manipulés des produits biologiques humains ainsi que pour le personnel des cabinets dentaires. Outre la vaccination, un contrôle de l’immunisation est requis deux mois après la primo-vaccination de base. Le taux d’AcHBs doit être supérieur ou égal à 10 mUI/ml. Si ce taux protecteur n’est pas atteint, une double dose supplémentaire de vaccin est administrée . En cas de non réponse à ce double rappel, la personne sera signalée comme non répondeuse.
TETANOS
En milieu de soins, cette vaccination est n’obligatoire que pour le personnel des services d’autopsie.
DEPISTAGE DE LA TUBERCULOSE
Des dispositions spécifiques à la tuberculose sont reprises dans les articles 61 et 62 de l’Arrêté Royal du 4 août 1996 évoqué ci-dessus. Il y est notamment stipulé que « sauf en cas de contre-indication, les travailleurs des milieux à risque ne peuvent être admis ou maintenus aux travaux cités qu’à la condition de se soumettre à un test tuberculinique et, si ce dernier a donné un résultat négatif, à la répétition de ce test sur base annuelle. » Dans ces mêmes entreprises, sur proposition du conseiller en prévention-médecin du travail, motivée par une situation épidémiologique particulière et après avis du Comité, les travailleurs ne peuvent être maintenus au travail que s’ils ont subi un test tuberculinique ayant donné un résultat positif ou s’ils possèdent un certificat médical attestant que, depuis trois ans, ils ont été vaccinés contre la tuberculose ou ont reçu le BCG.
Les secteurs à risque sont les services ou unités de soins aux bacillaires dans les hôpitaux et les laboratoires de biologie clinique dans lesquels des produits biologiques infectés par le bacille de la tuberculose sont manipulés.
Dans la pratique, la vaccination par le BCG, considérée comme insuffisamment efficace et non dépourvue d’effets secondaires, n’est plus appliquée dans notre pays. La surveillance par test tuberculinique et le suivi des virages constituent la stratégie préventive appliquée par tous les médecins du travail ayant en charge la surveillance du secteur hospitalier.
Utilisez vous l’avis du CSS n° 8579 : Recommandations relatives à la prévention de la tuberculose dans les institutions de soins OUI
IV. Vaccinations recommandées en milieu de soins
ROUGEOLE
A. Situation épidémiologique
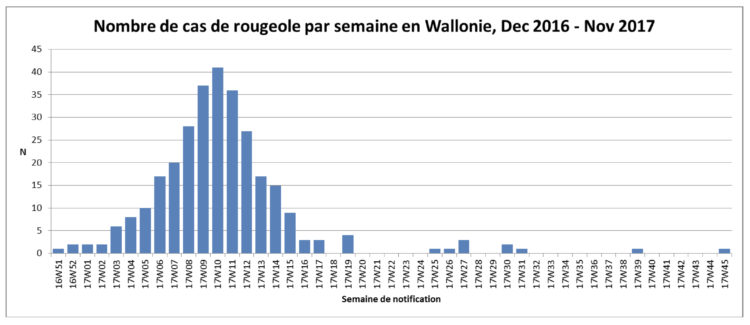
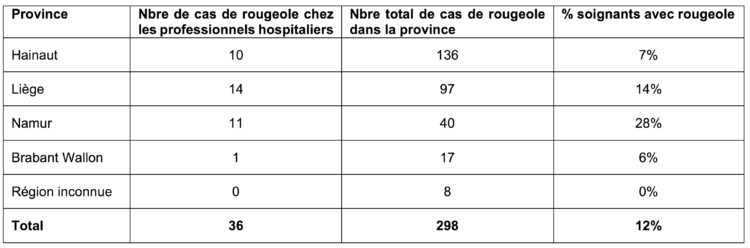
La rougeole est une des affections les plus contagieuses parmi les affections évitables par la vaccination et la transmission a souvent lieu avant l’éruption, entravant l’efficacité potentielle des mesures d’isolement. Cette affection continue à être considérée comme endémique en Belgique [2]. Depuis l’épidémie de 2011 qui a touché plus de 650 personnes, la Belgique connaît une recrudescence de cette affection. En 2017, une seconde épidémie de 300 cas environ a touché essentiellement la Wallonie et 37 travailleurs du secteur de la santé ont été atteints.
En juin et juillet 2017, la prison de Gand a également été atteinte: 19 prisonniers et 5 travailleurs ont contracté la maladie.
Si la majorité des cas de rougeole sont suivis au domicile, la gravité de la maladie associée à une moindre connaissance du corps médical vis-à-vis de cette affection en amène un certain nombre en milieu hospitalier. Les travailleurs de santé non vaccinés et non immunisés contre cette affection ont un risque de la contracter et de la transmettre à des patients. Selon une revue de la littérature [3], le risque de contracter une rougeole est multiplié par 2 à 19 pour les professionnels de santé, en comparaison avec la population générale.
Les études de séroprévalence publiées entre 1994 et 2013 montrent que 3 à 14 % des travailleurs de santé sont séronégatifs pour la rougeole [3].
B. Immunité naturelle et post-vaccinale
L’immunité naturelle est permanente. L’efficacité vaccinale du vaccin trivalent RRO est de 95% pour une dose et de 98% pour la rougeole (chiffre moins élevé pour les oreillons) pour deux doses. La protection conférée par le vaccin serait acquise à vie [4].
C. Recommandation vaccinale en milieu de soins
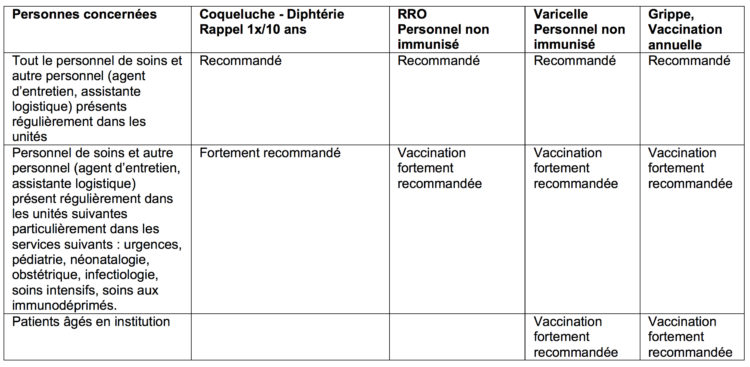
Le personnel de soins devrait donc être correctement protégé contre cette affection, tout particulièrement dans les services d’urgences, de soins intensifs, de pédiatrie, d’obstétrique, de dermatologie, d’infectiologie, de médecine interne générale, de soins aux immunodéprimés. L’attitude pratique à recommander est reprise dans l’encadré 1.
D. Attitude pratique en cas de contact d’une personne non immunisée avec un patient atteint
Eviction de soins aux patients atteints.
Vaccination dans les 72 heures après le contact.
E. Ecartement du milieu de travailLe travailleur atteint doit être écarté du travail jusqu’à guérison complète.
OREILLONS
A. Situation épidémiologique
De petites épidémies peuvent survenir chez les jeunes adultes non ou incomplètement vaccinés. C’est ainsi qu’en 2012, on a recensé 2648 cas en Belgique [5]. Cette épidémie a touché principalement une population de jeunes adultes des écoles supérieures dans tout le pays. Entre janvier et juin 2013, la déclaration étant devenue obligatoire, plus de 2000 cas ont été déclarés en Flandre et plus de 1000 cas en Wallonie et à Bruxelles [5].
La résurgence des oreillons est probablement causée par des facteurs tels que la couverture vaccinale insuffisante, la protection incomplète après la vaccination (circulation de sérotypes non repris dans le vaccin), la baisse de l’immunité au cours du temps et l’intensité des échanges sociaux au sein de certaines populations. Néanmoins, les personnes correctement vaccinées à deux doses courent un risque moindre de complications. Une transmission du virus au personnel de santé a été signalée de façon épisodique [6].
B. Recommandation vaccinale en milieu de soins
La vaccination est particulièrement recommandée au personnel soignant non immunisé des services d’urgences, de pédiatrie, de maladies infectieuses.
C. Attitude pratique en cas de contact d’une personne non immunisée avec un patient atteint
Eviction des soins à la personne atteinte. Une vaccination de rattrapage peut être administrée aux personnes qui n’ont pas antérieurement reçu les deux doses de vaccination RRO. Cependant, contrairement à la rougeole, cette vaccination n’enraye pas la maladie.
D. Ecartement du milieu de travail
Le travailleur atteint doit être écarté du travail pendant une période de 9 jours à dater du début des symptômes.
RUBEOLE
A. Situation épidémiologique
Depuis 2012, on constate une réémergence des cas de rubéole dans des populations insuffisamment vaccinées. C’est ainsi qu’on a recensé dans l’union européenne, 27276 cas de rubéole au premier trimestre 2013 pour 8920 cas en 2012 [7]. La majorité de ces cas ont été recensés en Pologne et en Roumanie. En Belgique, il n’y a pas de données épidémiologiques récentes, la maladie n’étant pas soumise à déclaration obligatoire de manière uniforme dans tout le pays. Un seul cas importé de rubéole congénitale a été déclaré en 2012. Dans notre pays, la couverture vaccinale pour la première dose de vaccin était de 95 % en 2012. Pour la deuxième dose, cette couverture est moindre, entre 70,5 et 92,5% selon les études réalisées entre 2006 et 2012 [8].
B. Immunité naturelle et post-vaccinale
L’immunité acquise naturellement est définitive. L’immunité vaccinale est acquise 2 à 4 semaines après la vaccination avec un taux de séroconversion proche de 100% et pour une période de 10 à 20 ans.
C. Recommandation vaccinale en milieu de soins
La vaccination est indispensable pour toutes les femmes en âge de procréer. Tout le personnel des services d’urgences, de pédiatrie et d’obstétrique doit, bien sûr, être en ordre pour cette vaccination.
D. Attitude pratique en cas de contact d’une personne non immunisée avec un patient atteint
Identification du statut immunitaire des femmes enceintes ou susceptibles de l’être parmi les sujets exposés. Pour les femmes non immunisées ou en attente de résultat de la sérologie, proscrire tout contact avec le sujet atteint.
E. Ecartement du milieu de travail
Le travailleur atteint doit être écarté jusqu’à guérison clinique
Rougeole, rubéole, oreillons (RRO) en pratique
En pratique
Tous les professionnels de santé devraient donc idéalement être immunisés contre ces 3 affections et plus particulièrement dans les services d’urgences, de soins intensifs, de pédiatrie, d’obstétrique, de dermatologie, d’infectiologie, de médecine interne générale et de de soins aux immunodéprimés. Les adultes pouvant apporter la preuve écrite de la réalisation de deux doses (dans l’enfance, vers 12 mois et 10-13 ans ou à l’âge adulte, à un intervalle d’un mois) peuvent être considérés comme protégés ainsi que les personnes nées avant 1970.
La vaccination devrait être complétée ou réalisée pour les travailleurs nés après 1970, non vaccinés ou incomplètement vaccinés. Il convient de s’assurer de l’absence de toute grossesse débutante au moment de la vaccination et d’informer de la nécessité d’éviter toute grossesse dans le mois qui la suit.
Si le travailleur non immunisé (ou considéré comme tel en l’absence de documents écrits) refuse la vaccination, il faut le préciser dans le dossier médical afin d’assurer les mesures préventives nécessaires en cas de situation à risque (éviction, vaccination). Le cas échéant, une sérologie peut être prescrite pour confirmer ou infirmer cette non-immunité.
NB : un test à la tuberculine ne pourra être réalisé jusque 1 mois après la vaccination RRO, car il pourrait être faussement négatif.
COQUELUCHE
A. Situation épidémiologique
L’augmentation des cas de coqueluche s’observe depuis 2 décennies dans tous les pays industrialisés et est d’origine plurifactorielle.
Le premier facteur est la perte d’immunité au cours du temps ; la protection chez les adultes vaccinés ou atteints de coqueluche dans l’enfance disparaît progressivement vu la faible probabilité de «boost naturel», l’infection circulant peu dans nos pays. Par ailleurs, certaines données montrent que la durée de protection offerte par le vaccin acellulaire serait moindre que pour le vaccin entier. L’amélioration du diagnostic, clinique et sérologique contribue également à cette augmentation de cas.
Des cas de coqueluche chez le personnel soignant sont rapportés dans la littérature [9] [10]. Ces cas sont, par ailleurs, probablement sous-estimés.
B. Immunité naturelle et post-vaccinale
La durée de la protection après la maladie naturelle est estimée entre 5 et 15 ans. Après la vaccination, des études sérologiques ont montré chez l’enfant, une diminution marquée, voire une disparition des anticorps post-vaccinaux 5 à 10 après le dernier rappel [11]. Chez l’adulte, peu de données sont disponibles.
C. Recommandations vaccinale en milieu de soins
Tous les professionnels de santé devraient donc être correctement immunisés contre cette affection [12]. En maternité, néonatalogie et pédiatrie, c’est une nécessité. Un rappel de vaccin sera administré tous les 10 ans. Il est légitime d’administrer également le vaccin au personnel soignant des services de médecine interne, infectiologie, pneumologie, soins aux immunodéprimés.
D. Attitude en cas de coqueluche identifiée chez le personnel soignant
Ecartement du lieu de travail pour une durée de 5 jours après la mise en route de l’antibiothérapie. Cette antibiothérapie ne guérit pas le patient, sauf si elle est prise dans les 24 premières heures, mais elle permet d’éviter la contagion
DIPHTERIE
A. Situation épidémiologique
Grâce à la vaccination, l’incidence de la diphtérie due à l’espèce Corynebacterium diphtheriae a considérablement diminué en Belgique: on compte une quinzaine de cas seulement pendant la période de 1980 à 2012. La diphtérie reste cependant une maladie difficile à éliminer, car si le vaccin protège efficacement contre les manifestations dues à la toxine, il n’empêche pas la colonisation du nasopharynx, même chez les sujets vaccinés.
La recrudescence des cas en Russie et dans certains pays d’Europe de l’Est entre 1990 et 2001, où 160.000 cas et plus que 4.000 décès ont été rapportés, démontre combien la diphtérie peut facilement réapparaître dans les populations qui ne sont plus adéquatement immunisées.
Outre la diphtérie classique liée à Corynebacterium diphtheriae, d’autres espèces comme Corynebacterium ulcerans peuvent être responsables d’infections humaines. C’est ainsi qu’en Europe occidentale, quelques cas de diphtérie respiratoire et/ou systémique causés par C. ulcerans ont été signalés ces dernières années [13]. On sait peu de choses sur les facteurs qui contribuent à la virulence de cet agent pathogène zoonotique, mais ce fait doit inciter à la vigilance en ce qui concerne la vaccination du personnel soignant.
B. Immunité naturelle et post-vaccinale
La maladie est non immunisante.
En Belgique, le niveau sérologique de protection contre la diphtérie mesuré dans la population adulte montre qu’après une vaccination complète dans l’enfance, l’immunité résiduelle diminue progressivement. Des taux supérieurs au seuil de protection sont observés chez seulement 20 à 45 % des plus de 40 ans [14].
C. Recommandation vaccinale en milieu de soins
Il est donc indispensable de poursuivre la vaccination de l’adulte (un rappel tous les 10 ans). Le personnel de soins des services d’urgences, de soins intensifs, d’infectiologie, de pédiatrie devrait être correctement immunisé contre cette affection.
VARICELLE
A. Situation épidémiologique
La varicelle est une maladie infantile fréquente dans les pays tempérés. En Belgique, des études sérologiques montrent que 80 % des enfants de plus de 5 ans ont fait la varicelle et que 98 % des adultes de 30 ans sont immunisés. Les personnes originaires des pays tropicaux ont, par contre, une réceptivité plus élevée à l’âge adulte que dans les pays tempérés [15]. Bien que l’évolution de la varicelle soit généralement bénigne, le nombre d’hospitalisations lié à cette affection en Belgique est de l’ordre de 1000 par an, dont 1 à 2 décès [16].
B. Immunité naturelle et post-vaccinale
L’immunité acquise après une varicelle est considérée comme définitive vis-à-vis de la varicelle, mais temporaire pour le zona.15 à 20 % des personnes qui ont fait la varicelle risquent de développer un zona au cours de leur vie. La vaccination en deux doses est sûre et efficace et, selon les données scientifiques disponibles à l’heure actuelle, confère une protection de 10 à 20 ans. Des incertitudes persistent quant à son impact sur l’incidence du zona.
C. Recommandation vaccinale en milieu de soins
Actuellement, le Conseil Supérieur de la Santé ne recommande pas la vaccination généralisée contre la varicelle, mais préconise la vaccination des personnes à risque : personnes non immunisées en contact étroit avec des patients immunodéprimés, les adultes non immunisés occupés dans le secteur des soins de santé ou en contact étroit avec de jeunes enfants, les femmes non immunisées en âge de procréer[16]. La vaccination comporte deux doses administrées à un intervalle de 4 à 6 semaines. Contrairement aux enfants pour lesquels une anamnèse est généralement fiable en ce qui concerne les antécédents de cette affection, environ 90 % des adultes âgé de plus de 17 ans et qui pensent ne pas avoir contracté la varicelle possèdent des anticorps ! Un dosage des anticorps étant d’un coût dix fois moindre que la vaccination, il est recommandé de le réaliser préalablement.
Il convient de s’assurer de l’absence d’une grossesse au moment de la vaccination et dans le mois qui la suit.
D. Attitude en cas de contact d’un travailleur non-immunisé avec un patient atteint
La vaccination en post-exposition permet de prévenir la varicelle chez plus de 90 % des personnes susceptibles si le vaccin est administré dans les 3 jours qui suivent le contact. L’efficacité est d’autant meilleure qu’il est administré tôt.
E. Ecartement du milieu de travail
Le travailleur atteint doit être écarté du travail jusqu’à assèchement des lésions.
GRIPPE
A. La grippe en milieu de soins
Des épidémies nosocomiales de grippe ont été décrites dans de multiples structures de soins.
La transmission de la grippe à partir des personnes infectées y est bien établie, tant vers les patients que vers les professionnels de santé. Une majorité des grippes survenant chez des patients transplantés immunodéficients ou atteints de leucémie aiguë sont des infections nosocomiales. Le personnel de soins non vacciné en constituerait la source principale [17].
Certains éléments aggravent le risque de transmission en milieu hospitalier : les professionnels de santé ont tendance, par conscience professionnelle, à venir travailler en dépit de symptômes évocateurs et le diagnostic de grippe n’est pas toujours posé ou l’est tardivement chez des patients hospitalisés. Pourtant, Les bénéfices de la vaccination des travailleurs de santé en terme de prévention collective et individuelle, de santé publique, de réduction de l’absentéisme sont connus depuis longtemps [18][19].
Cependant malgré les recommandations de l’OMS qui prônent la vaccination de tous les soignants, la couverture vaccinale des professionnels de santé contre la grippe reste insuffisante. En 2014-2015, dans 13 états de l’union européenne, ces taux de vaccination variaient de 5 à 54,9 % [20]. De nombreux professionnels de santé ne sont, en effet, et pour de multiples raisons, pas convaincus de l’efficacité et de l’utilité de la vaccination contre la grippe pour leur santé personnelle et en redoutent les effets secondaires [21].
B. Recommandation vaccinale
Le Conseil Supérieur de la Santé dans son dernier avis recommande toujours formellement la vaccination du personnel de santé dans son ensemble [22] et nous partageons entièrement cette recommandation. Cette vaccination devrait être impérative pour le personnel en contact avec des patients fragilisés : services de soins aux patients âgés institutionnalisés, aux immunodéprimés, aux cardiaques, insuffisants rénaux, etc.
V Conclusion
Sensibiliser les travailleurs aux risques et à leur prévention fait partie intégrante des missions du conseiller en prévention-médecin du travail. Les situations rencontrées dernièrement dans le cadre de l’épidémie de rougeole ainsi que des enquêtes menées auprès de travailleurs [23] démontrent qu’une meilleure sensibilisation et prise en charge du personnel de santé en matière de maladies évitables par la vaccination est nécessaire. Le potentiel de gravité de ces maladies est probablement sous-estimé par les travailleurs des institutions de soins. Un programme clair en matière de vaccinations non obligatoires doit être défini avec l’employeur en fonction des spécificités de l’entreprise de soins concernée. Pour ce faire, l’hygiène hospitalière est l’interlocuteur privilégié du Conseiller en prévention-Médecin du travail. S’assurer de l’immunisation des travailleuses en âge de procréer rejoint, en outre, le domaine de la protection de la maternité. Les travailleurs non immunisés qui refusent la vaccination doivent être correctement signalés à l’employeur et au service d’hygiène hospitalière de façon à instaurer rapidement les mesures nécessaires en situation de contage.
VI. Références bibliographiques
1. Arrêté royal du 4 août 1996 concernant la protection des travailleurs contre les risques liés à l’exposition à des agents biologiques au travail. M.B. 1.10.1996 A e. et Code du Bien-être au travail, Livre 7, Titre 1 ; http://www.emploi.belgique.be/moduleTab.aspx?id=619&idM=102t
2. Grammens T, Maes V, Hutse V, Laisnez V, Schirvel C, Trémérie JM, Sabbe M. Different measles outbreaks in Belgium, January to June 2016 – a challenge for public health. Euro Surveill. 2016;21(32):pii=30313. DOI: http://dx.doi.org/10.2807/1560-7917.ES.2016.21.32.30313
3. Parker Fiebelkorn, W.A. Orenstein , J.F. Seward. A global perspective of vaccination of healthcare personnel against measles : Systematic review. Vaccine 32 (2014) 4823–4839.http://www.sciencedirect.com/science/article/pii/S0264410X13015041
4. https://www.wiv-isp.be/matra/Fiches/Rougeole.pdf
5. https://www.wiv-isp.be/matra/Fiches/Oreillons.pdf
6. Pizetto B. Infections nosocomiales virales et à agents transmissibles non conventionnels. Editions John Libbey Eurotext. Paris 2001, p 531
7. Czarkowski MP, Derrough T, Paradowska-Stankiewicz I, Stefanoff P. Ongoing outbreak of rubella among young male adults in Poland: increased risk of congenital rubella infections. Euro Surveill. 2013; 18(21)
8. Grammens T, Litzroth V, Maes V, Mendes da Costa E, Muyldermans G, Quoilin S, SabbeM. Maladies infectieuses pédiatriques à prévention vaccinale, Rapport annuel 2015, Santé publique et surveillance, Décembre 2016. Bruxelles, p 61-62
9. U. Heininger. Vaccination of health care workers against pertussis : Meeting theneed for safety within hospitals. Vaccine 32 (2014) 4840–4843.
10. Braunstein D , Desmons S, Succo T (et al) Epidémie de coqueluche dans un établissement d’hébergement pour personnes âgées dépendantes, Bouches-du-Rhône, août 2013, Bulletin Epidémiologique Hebdomadaire, n° 5, 2015-02-03, pp. 83-88
11. Aase, T.K. Herstad, S. Bakken Jorgensen et al. Anti-pertussis antibody kinetics following DTPa-IPV booster vaccination in Norwegian children 7-8 years of age. Vaccine. 2014 ; 32 : 5931-5936.
12. Conseil supérieur de la Santé. Guide de vaccination : Vaccination anticoquelucheuse de l’adulte, CSS 9110. Révision aout 2013.
13. Grammens T, Litzroth V, Maes V, Mendes da Costa E, Muyldermans G, Quoilin S, Sabbe M. Maladies infectieuses pédiatriques à prévention vaccinale, Rapport annuel 2015, Santé publique et surveillance, Décembre 2016/Bruxelles, Belgique, p 24-25
14. Vaccination contre la diphtérie, le tétanos et la coqueluche, Révision 2013. https:/www.health.belgium.be
15. http://www.chu-rouen.fr/mtph/fiches/VARICELLE.pdf.
16. Avis du Conseil Supérieur de la Santé n° 9212. Vaccination des enfants, des adolescents et des personnes à risque contre la varicelle. Mars 2017
17. Azoulay E, Legoff J, Schnell D. Infections respiratoires grippales chez les patients immunodéprimés. Réanimation (2009)18, 301-308.
18. Hauge M, Lind A, Margolis KL, McFadden R, Murdoch M, , Nichol KL , et al. The effectiveness of vaccination against influenza in healthy, working adults. New England Journal of Medicine 1995; 333: 889-893
19. Brown D, Buynder S, Keen N, Konrad F, Murray J, Preston PD. Healthcare worker influenza immunization vaccinate or mask policy: Strategies for cost effective implementation and subsequent reductions in staff absenteeism due to illness. Vaccine, Volume 33, Issue 13, 24 March 2015, Pages 1625-1628
20. European Centre for Disease prevention and Control (ECDC). Technical report. Seasonal influenza vaccination and antiviral use in Europe. Overview of vaccination recommendations and coverage rates in the EU Member States for the 2013–14 and 2014–15 influenza seasons http://venice.cineca.org/Seasonal-influenza-vaccination-antiviral-use-europe.pdf
21. Asguassou S Contal E, Dipanda M, Manckoundia P, Perrin S, Putot A, Sordet-Guepet H. La couverture vaccinale contre la grippe saisonnière du personnel soignant en gériatrie : mise au point. Revue d’Épidémiologie et de Santé Publique. Volume 64, Issue 6, December 2016, Pages 415-423
22. Avis du Conseil supérieur de la Santé n°9418. Vaccination contre la grippe saisonnière. Saison hivernale 2018-2018. Juin 2017
23. Abiteboul D, Bouvet E, Ciotti C, Fonteneau L, Guthmann J-P, Lévy-Brulh D, Pelissier G. Couverture vaccinale des soignants travaillant dans les établissements de soins de France. Résultats de l’enquête nationale Vaxisoin, 2009. BEH 35-36/ 27 septembre 2011