1. Hospitalisation à domicile, organisation et coordination
L’hospitalisation à domicile connaît actuellement un développement croissant en Belgique. Les projets pilotes sur cette thématique s’étoffent [1]. Le principe est d’organiser le retour du patient à domicile avec poursuite de soins complexes (comme l’administration de traitements anti-infectieux par voie intra-veineuse) instaurés au cours d’une hospitalisation. L’OPAT (Outpatient Parenteral Antimicrobial Therapy) est très développée aux Etats-Unis mais aussi dans certains pays d’Europe comme la France ou l’Angleterre (4,4 millions de journées d’hospitalisation à domicile en France en 2014 [2]).
L’administration de thérapeutiques anti-infectieuses par voie intra-veineuse est la première indication d’hospitalisation à domicile devant la nutrition parentérale et la chimiothérapie. Des soins complexes peuvent également être poursuivis à domicile comme les soins de plaies utilisant des dispositifs à pression négative.
Les types de pathologies infectieuses pouvant être traitées en hospitalisation à domicile sont nombreuses et variées.
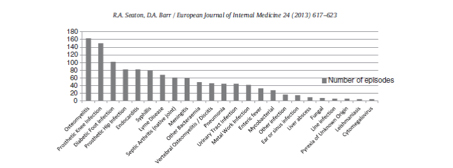
Figure 1 : Types d’infections prises en charge dans le service d’hospitalisation à domicile de Glasgow entre 2001 et 2011 à l’exclusion de 1389 infections peau et parties molles (adapté de « Outpatient antimicrobial therapy : Principles and practice » [3])
Des recommandations spécifiques à l’organisation de l’hospitalisation à domicile ont été publiées en Angleterre [2], notamment concernant les critères de sélection des patients et la checklist des items à valider avant d’envisager le retour du patient en hospitalisation à domicile.
Figure 2 : checklist avant instauration d’une hospitalisation à domicile (extrait de « Outpatient antimicrobial therapy : Principles and practice » [4])
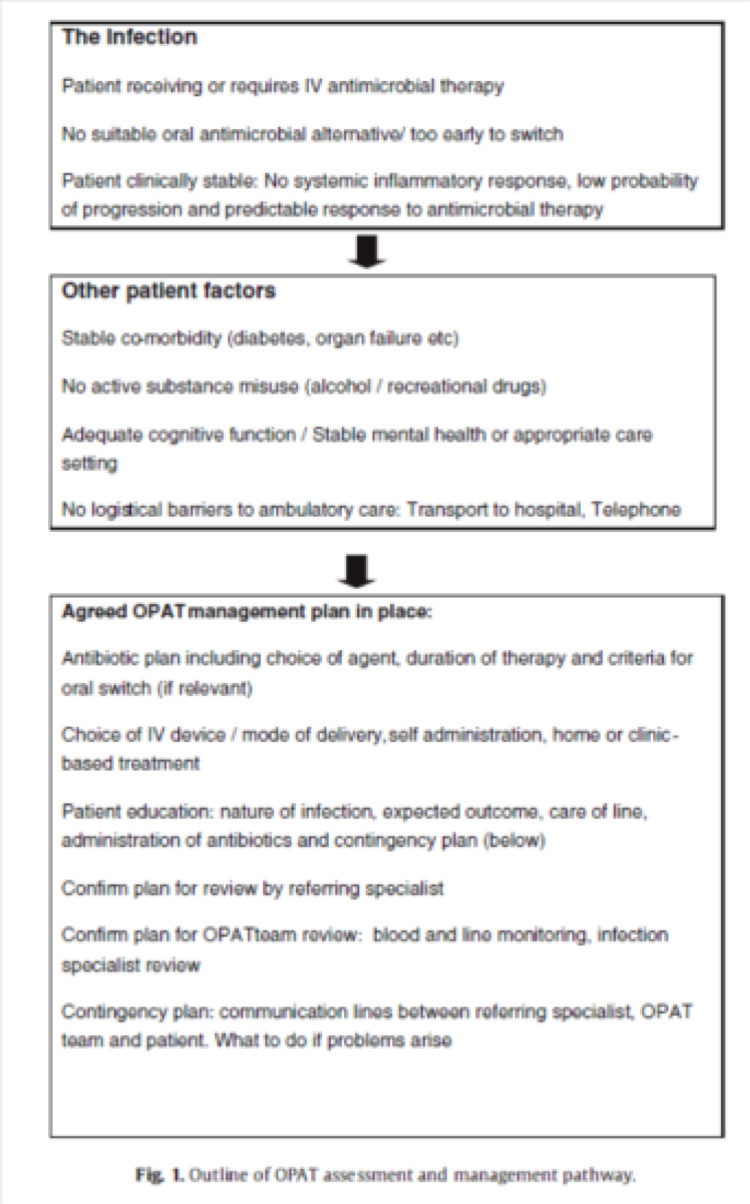
Le succès du développement de l’hospitalisation à domicile passe par l’organisation rigoureuse d’une filière de soins. Le médecin coordinateur, qui peut être un infectiologue ou un médecin hospitalier travaillant en collaboration avec le médecin infectiologue, définit si l’état clinique du patient est compatible avec une hospitalisation à domicile (apyrexie, bonne réponse au traitement anti-infectieux,…). Il vérifie l’absence de contre-indication au retour à domicile avec un dispositif d’abord vasculaire (toxicomanie, état cognitif du patient, conditions sanitaire au domicile du patient,…). Il définit alors le type de traitement anti-infectieux à poursuivre et les modalités d’administration. L’infirmier coordinateur est un infirmier hospitalier, affecté au service d’hospitalisation à domicile. Son rôle n’est pas d’effectuer les soins au domicile du patient mais de permettre la continuité des soins en organisant le retour à domicile du patient dans des conditions optimales. Il constitue le chef d’orchestre, véritable lien entre les différents intervenants (médecin spécialiste, pharmacie hospitalière et officine de ville, médecin traitant, équipe infirmière réalisant les soins au domicile du patient..). Il est également le garant de l’application des protocoles d’hygiène en vigueur dans l’établissement hospitalier pour la manipulation des dispositifs d’abord vasculaire au domicile du patient.
Les équipes infirmières réalisant les soins au domicile du patient doivent avoir reçu une formation spécifique à l’utilisation du cathéter. Pour les voies veineuses périphériques, un rappel de la procédure de préparation des solutés à injecter et de l’entretien du cathéter doit être effectué. Cette formation peut être dispensée par les infirmières hygiénistes ou l’infirmier coordinateur. Pour les cathéters type Peripherical Inserted Central Catheter (piccline), la formation doit être complétée par une session spécifique abordant la procédure de manipulations du cathéter et des réfections de pansement. Cette formation peut être dispensée par les infirmières hygiénistes, l’infirmier coordinateur et un support peut être apporté par la firme commercialisant le piccline). La prescription de soins infirmiers pour les soins du cathéter doit être précise (notamment concernant le rythme de changement des dispositifs ou des pansements ainsi que la procédure détaillée des soins). Les besoins en matériel doivent avoir été anticipés afin de pouvoir réaliser des soins infirmiers de qualité au domicile du patient. Avant la sortie, la disponibilité du matériel nécessaire en officine de ville doit avoir été vérifiée (afin de pouvoir solliciter la pharmacie hospitalière en cas d’indisponibilité du matériel en ambulatoire). Idem pour le traitement anti-infectieux. L’infirmier coordinateur doit également pouvoir se déplacer au domicile du patient à l’instauration du traitement afin de vérifier que l’ensemble des conditions préalablement définies sont respectées.
L’éducation du patient et de son entourage est également un point crucial dans le projet d’hospitalisation à domicile. Le patient est acteur de son projet thérapeutique. Il doit avoir compris les enjeux d’un retour à domicile avec un dispositif invasif comme un cathéter. En l’absence de compliance du patient, le contrat de soins pourrait être rompu. L’ablation du cathéter ou un retour en hospitalisation classique devrait alors être envisagé. Des directives d’urgence doivent également être données en cas de survenue de complications liées au cathéter (conduite à tenir, coordonnées des personnes de contact). Les urgences hospitalières auront une procédure à appliquer en cas de suspicion d’occlusion du cathéter (rinçages pulsés, héparinisation du cathéter voire utilisation d’urokinase).
Le suivi du patient doit également être planifié : rendez-vous de consultation avec le médecin spécialiste, bilans biologiques, éventuels examens complémentaires.
Une organisation rigoureuse de l’hospitalisation à domicile contribue à garantir la sécurité du patient en hospitalisation à domicile. Une répartition claire des rôles et responsabilité de chaque intervenant permet de maintenir une continuité des soins lors du retour à domicile.
2. A chaque situation son cathéter
Le choix du type de dispositif d’abord veineux est une étape importante dans la préparation du retour à domicile. Un mauvais choix de type de cathéter entraîne une augmentation des complications lié à l’inadaptation du dispositif et une diminution du confort du patient.
Figure 3 : Différents types d’abords vasculaires (extrait de « The Michigan Appropriateness Guide for Intravenous Catheters (MAGIC) » [5])
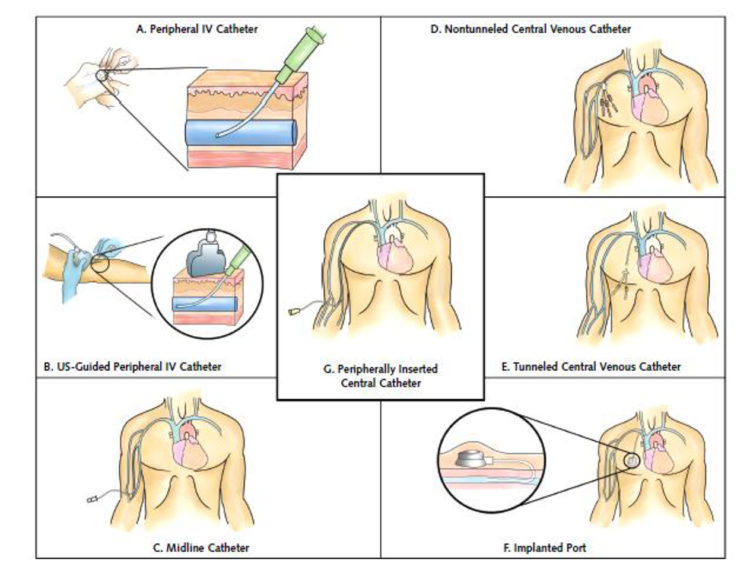
Un cathéter veineux périphérique peut être envisagé si la durée du traitement par voie intra-veineuse est courte (idéalement < 5 jours), le traitement ne contient de molécules veinotoxiques (comme la vancomycine, par exemple) et si le réseau veineux du patient est de bonne qualité.
Le dispositif doit être changé toutes les 72 à 96 heures [6].
Pour les durées de traitement de moins de 14 jours, un cathéter de type midline peut être envisagé. La longueur du cathéter est de 8 à 25 cm. La durée d’utilisation est limitée à 6 semaines. La perfusion de solutés au pH extrême (<5 ou >9) et/ou hyperosmolaire (> 600 mosmol/l) est déconseillée sur ce type de dispositif puisqu’il ne s’agit pas d’une voie veineuse centrale. Il existe des données montrant un taux de complications non significativement différent entre midline et piccline pour la perfusion de vancomycine malgré le pH de la molécule [7].
Lorsque le capital veineux est pauvre, la durée de traitement supérieure à 2 semaines ou si les molécules employées sont veinotoxiques, la pose d’un piccline est une alternative présentant de nombreux avantages. Contrairement au midline, il s’agit d’un cathéter veineux central.
Le cathéter peut être maintenu jusqu’à 3 mois voire 1 an.
Tous types de traitements anti-infectieux peuvent être administrés via le piccline (sous réserve de respecter les incompatibilités médicamenteuses si plusieurs molécules sont utilisées). Ce dispositif n’est pas indiqué en réanimation pour la perfusion rapide de solutés de remplissage vasculaire.
Pour les traitements de plus d’un mois, un Port a cath peut être implanté, principalement si des traitements répétés de façon intermittente sont envisagés (en oncologie, par exemple).
Il existe des outils permettant de définir quel cathéter est le mieux adapté à la situation du patient [4].
Figure 4: Dispositifs d’abord veineux recommandés pour la perfusion de solutés non veino-toxiques (extrait de « The Michigan Appropriateness Guide for Intravenous Catheters (MAGIC) » [5])
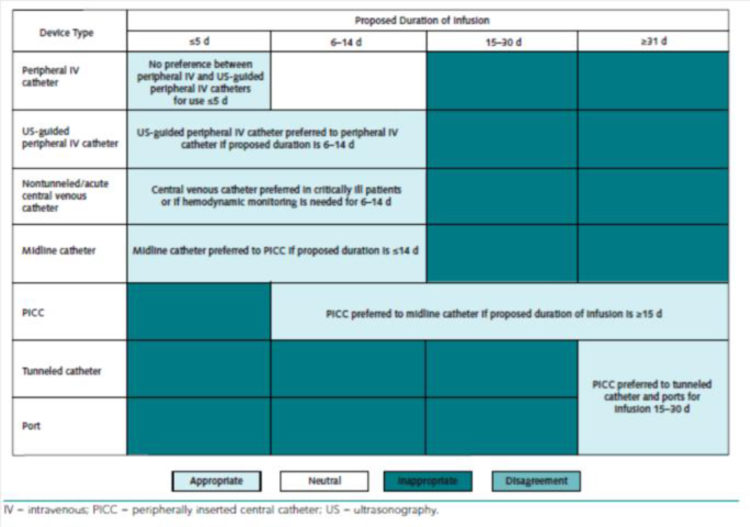
Figure 5 : Dispositifs d’abords veineux recommandés pour la perfusion de solutés veino-toxiques (extrait de « The Michigan Appropriateness Guide for Intravenous Catheters (MAGIC) » [5])
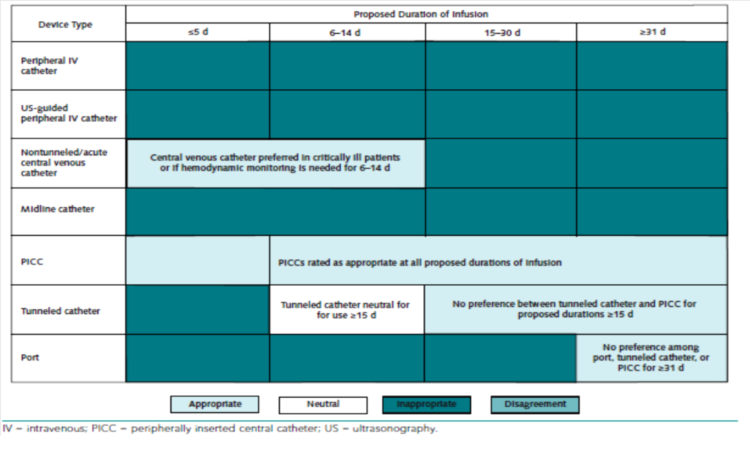
Il existe également des recommandations spécifiques pour les patients risquant d’avoir nécessité de recours à l’hémodialyse avec réalisation d’une fistule artério-veineuse [5].
Le choix d’un type de cathéter adapté à la situation du patient est un élément important dans le parcours de soins du patient aussi bien en hospitalisation classique qu’en hospitalisation à domicile. La disponibilité de nouveaux types de cathéters comme les midlines ou les picclines permet de répondre à de nouveaux besoins spécifiques au retour à domicile. La discussion du choix du cathéter le mieux adapté à un éventuel retour à domicile doit être anticipée (dès que la situation clinique de patient est stabilisée).
3. Piccline, clés du succès
Le piccline est de plus en plus utilisé dans le cadre de l’hospitalisation à domicile.
Son ancêtre, le drum catheter, utilisé dans les années 70, jouit d’une mauvaise réputation en raison des difficultés de pose et des fréquentes thromboses (à mettre en rapport avec son calibre important).
Figure 6 : drum catheter
Figure 7: piccline
Le Piccline est un dispositif développé dans les années 90 aux Etats Unis, actuellement en pleine expansion en Europe.
Il s’agit d’un cathéter général en silicone ou en polyuréthane, d’une longueur de 50 à 60 cm, inséré dans la veine basilique voire brachiale ou céphalique, dont l’insertion est guidée par échographie, nécessitant des conditions d’asepsie chirurgicale durant la pose.
Une valve bidirectionnelle peut être intégrée ou à connecter au piccline. L’utilisation de cette valve permet de diminuer le risque d’obstruction du cathéter, d’empêcher un reflux sanguin et de se protéger du risque d’embolie gazeuse.
Le cathéter est maintenu par un système de fixation « stabilisateur » ne nécessitant pas de points de suture (système type Griplock©,…).
Le piccline est un cathéter veineux central, dont l’extrémité se situe au niveau de la veine cave supérieure, nécessitant les mêmes précautions lors de sa manipulation que pour les voies veineuses centrales classiques utilisées en réanimation.
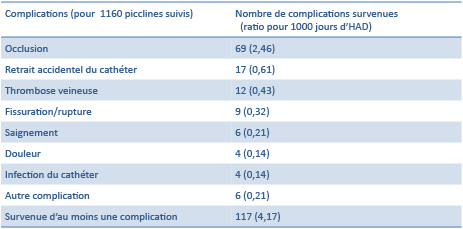
Les études les plus récentes [8] montrent la survenue de complications liées au cathéter chez 9% des patients suivis en hospitalisation à domicile. L’occlusion du cathéter est la complication la plus fréquente (2,46 occlusions pour 1000 jours d’hospitalisation à domicile).
Figure 8 : Complications liées au piccline en hospitalisation à domicile (adapté de « Vascular access complications during outpatient parenteral antimicrobial therapy at home: a retrospective cohort study. »)
L’occlusion et l’infection du cathéter peut être prévenue en suivant les recommandations de bonnes pratiques et gestion des risques associés au picc formulées par la société française d’hygiène hospitalière [9].
Si la présence de plusieurs lumières n’est pas nécessaire, un piccline monolumière sera préféré.
Concernant le diamètre de la lumière, il sera idéalement ≤ 4 french gauge (fr) pour les cathéters monolumières et ≤ 5 fr pour les multilumières (les calibres supérieurs sont associés à un risque majoré d’occlusion du cathéter [9]).
La formation du nursing est un élèment qui permet de diminuer les complications liées au piccline : Le respect de bundles (dont le suivi d’une formation spécifique des soignants) définissant les règles de manipulation du cathéter permet de réduire les complications de 13% à 4,24% [8].
Les rinçages pulsés par bolus successifs de 3 ml de NaCl 0,9% pour usage intra-veineux permettent de réduire les risques d’occlusion du cathéter (minimum 10 à 20 ml/jour après chaque utilisation et au minimum une fois par jour en cas de non utilisation du cathéter durant plusieurs jours). L’ablation du cathéter doit être envisagée dès qu’il n’est plus utile.
Pour toutes les manipulations distales, un geste d’hygiène des mains (friction avec une solution hydro-alcoolique) est recommandé.
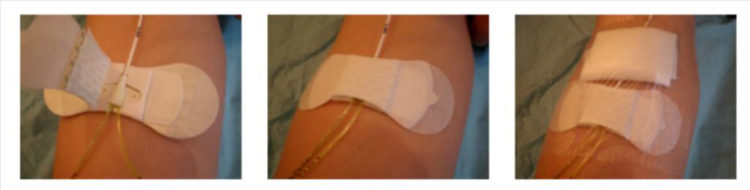
La réfection du pansement est une étape critique des soins du cathéter, qui comprend le changement du dispositif de fixation et de la valve. Un délai maximal de 8 jours entre chaque réfection de pansement est conseillé (ainsi qu’à chaque fois que le pansement est souillé ou décollé).
La réfection du pansement doit être réalisée dans des conditions aseptiques (port d’un masque chirurgical pour l’opérateur et le patient, utilisation de gants stériles et de matériel stérile).
Le point d’insertion du cathéter et le dispositif de fixation doivent être recouvert par un même pansement transparent semi-perméable.
Figure 9 : Dispositif de fixation du piccline
La mise à disposition de sets de soins comprenant tout le matériel nécessaire à la réfection du pansement facilite la réalisation des soins à domiciles dans des conditions d’hygiène optimale.
Figure 10: Exemple de set de réfection de pansement de piccline

Le retrait du cathéter est fait par le médecin coordinateur ou par l’infirmier coordinateur sous supervision médicale. Ce geste peut être fait en consultation. La longueur totale du cathéter doit être vérifiée. L’extrémité proximale sera envoyée en culture uniquement en cas de suspicion d’infection du cathéter.
Conclusion :
L’analyse rétrospective du taux de complications liées au traitement anti-infectieux en hospitalisation classique ou en hospitalisation ne montre pas de différence significative [10], y compris dans des populations spécifiques comme la gériatrie [11] ou la pédiatrie dans les pays ayant développé l’hospitalisation à domicile. Ces résultats sont obtenus au prix d’une organisation rigoureuse de la filière de soins, du choix du cathéter le plus adapté à la situation du patient et du respect des précautions d’hygiène lors des soins à domicile. L’utilisation de cathéters de type piccline est possible à domicile sous réserve d’une formation et d’un accompagnement des équipes infirmières intervenant à domicile. Le rôle de l’infirmier coordinateur du service d’hospitalisation à domicile ainsi que de l’équipe d’hygiène hospitalière est essentiel dans l’encadrement de ces nouvelles pratiques.
Le développement de l’hospitalisation à domicile se heurte également à des difficultés pratiques de disponibilité des antibiotiques ou du matériel nécessaire à la réalisation des injections en officine de ville (ainsi qu’à l’inadaptation des conditionnements). Le coût restant à charge du patient est actuellement également problématique puisqu’il n’existe actuellement pas de « forfait OPAT » comme pour la nutrition parentérale à domicile. Tous les aspects positifs, en terme de succès thérapeutique, de satisfaction du patient mais également du point de vue médico-économique incitent à poursuivre le développement de l’hospitalisation à domicile.
Références bibliographiques
[1] Farfan-Portet MI, Denis A, Mergaert L. L’hospitalisation à domicle: Orientations pour un modèle belge. KCE reports 250.Health Services Research. 2015
[2] Données de la federation nationale française des établissements d’hospitalisation à domicile 2014
[3] Chapman AL, Seaton RA, Cooper MA et al. Good practice recommendations for outpatient parenteral antimicrobial therapy (OPAT) in adults in the UK:a consensus statement. J Antimicrob Chemotherap. 2012. 67; 1053-1062
[4] Seaton RA, Barr DA. Outpatient parenteral antibiotic therapy: principles and practice.Eur J Intern Med. 2013, 24; 617-623
[5] Chopra V, Flanders SA, Saint S. The Michigan Appropriateness Guide for Intravenous Catheters (MAGIC): Results From a Multispecialty Panel Using the RAND/UCLA Appropriateness Method. Ann Intern Med. 2015. 163 (S); 1-48
[6] O’Grady NP, Alexander M, Burns LA et al. Guidelines for the prevention of intravascular catheter-related infections.Am J Infect Control. 2011. 39; S1-34
[7] Caparas JV, Hu JP. Safe administration of vancomycin through a novel midline catheter: a randomized, prospective clinical trial. J Vasc Access. 2014. 15 ; 251-256
[8] Shrestha NK, Shrestha J, Everett A et al. Vascular access complications during outpatient parenteral antimicrobial therapy at home: a retrospective cohort study. J Antimicrob Chemotherap. 2016. 741; 506-512
[9] Recommandations par consensus formalisé: Bonnes pratiques et gestion des risques associés au picc. Hygiènes. 2013. 6; 1-124
[10] Seetoh t, Lye DC, Cook AR. An outcomes analysis of outpatient parenteral antibiotic therapy (OPAT) in a large Asian cohort. Int J Antimicrob Chemotherap. 2013. 41; 569-573
[11] Mujal A, Sola J, Hernandez M. Safety and effectiveness of outpatient parenteral antimicrobial therapy in older people.J Antimicrob Chemotherp. 2016.