


Nous allons nous baser sur les « Recommandations en matière de stérilisation, CSH n°7848 »1 pour la stérilisation. Dans ce cas, la stérilité des instruments à l’issue d’un nettoyage validé, à savoir une désinfection thermique de haut niveau (valeur Ao2 de minimum 3000) et une stérilisation, ne peut être garantie lorsque l’empaquetage des instruments s’est effectué à mains nues. Des preuves sont apportées dans le présent document à l’aide d’un système formel et logique. Si nous voulons conférer une garantie de stérilité aux instruments stérilisés, nous devrons adapter notre processus ou notre point de vue.
Extraits CSH n° 7848: [1]
« Stérilisation : mise en œuvre d’un processus visant à rendre stérile la charge introduite dans un stérilisateur (EN 285-8). Ce processus s’inscrit lui-même dans une suite de processus qui concourent à détruire ou à éliminer tous les micro-organismes vivants de quelque nature et sous quelque forme que ce soit, portés par des objets parfaitement nettoyés. (définitions) »…
« La stérilisation fait partie des procédés spéciaux dont les résultats, et plus particulièrement la stérilité du matériel traité, ne peuvent être certifiés par un contrôle du produit fini.
La maîtrise du processus de stérilisation est la base même du résultat que le patient est en droit d’attendre. Cette maîtrise passe par le contrôle du processus de stérilisation conjugué à un nombre important d’actions de contrôles en amont et en aval de la stérilisation proprement dite. La biocharge doit être maintenue aussi basse que possible.
Une maîtrise efficace de la biocharge ne peut être obtenue que par des méthodes de nettoyage et de désinfection préalablement validées mais aussi par une maîtrise de l’environnement (locaux, air ambiant, personnel…) »…
« Un nettoyage et/ou une désinfection insuffisants peuvent offrir aux germes une protection contre l’agent de stérilisation et entraîner des contaminations chez les patients. »…
« Pour le matériel médical critique, la valeur de A0 (niveau de désinfection)² doit être d’au moins 3.000. »
« Les normes ont été établies pour des charges à stériliser dont la contamination initiale est bien maîtrisée. A lui seul, un paramètre correct ne peut garantir la stérilité d’une charge. Par contre, à lui seul, un paramètre incorrect met en évidence une défaillance ; la charge ne peut être libérée. »
Le pharmacien hospitalier a notamment pour mission de contrôler les différentes étapes précédant la stérilisation : nettoyage, désinfection, emballage du matériel à stériliser.
Lors de l’établissement de recommandations concernant les techniques de stérilisation, il convient de tenir compte du respect des mesures de précaution requises pour réduire la charge microbienne (biocharge).
Les exigences en matière de stérilisation peuvent se résumer comme suit :
« Tous les matériaux de parachèvement et les surfaces de travail sont lisses et lavables (CSH n° 7848). »
L’on oublie ou occulte souvent que la zone « propre » du CS (Centre de stérilisation)[2] où il est procédé au contrôle des instruments, à leur emballage et à leur stérilisation constitue la zone la plus critique du CS. Dans cette zone, les instruments « parfaitement » nettoyés et ayant fait l’objet d’une désinfection de « haut niveau » (et ce contrairement à la zone « stérile » où les instruments sont stockés en attendant d’être utilisés) ne sont pas protégés contre des contaminations organiques ni contre des transmissions de composants microbiens (microbiota).
Dans le manuel intitulé « Ziekenhuishygiëne »3 (hygiène hospitalière), on apprend dans le chapitre « Microbiologisch onderzoek van oppervlakken » (Examen microbiologique des surfaces) que « pour être validées, les surfaces normales ne peuvent comporter plus de 5 colonies par plaque (25 cm2). »
La zone d’empaquetage d’un CS est donc une zone propre. La contamination microbienne de tous les matériaux de finition et surfaces de travail doit être minime (< 5 unités formant une colonie (UFC)/25 cm²). Ces surfaces n’ont pas de microbiota commensaux propres (flore). La biocharge éventuellement présente sur ces surfaces doit toujours être considérée comme une contamination.
Chaque surface de chaque organisme pluricellulaire complexe entrant en contact avec l’environnement extérieur développe des microbiota commensaux propres, comme c’est le cas sur la peau de nos mains. A la suite du contact avec des matières vivantes et non vivantes, la peau absorbe également des micro-organismes transitoires et transmet des microbiota commensaux mais aussi transitoires.
De la même manière, nous transmettons des substances organiques et inorganiques par le contact. Ces échanges sont très intenses. Ils permettent à certaines races d’animaux de dépister des individus.
Les recommandations de l’OMS (« Recommandations OMS pour l’hygiène des mains au cours des soins)4 stipulent que (traduction) : « La peau humaine normale est colonisée par des bactéries. Le nombre total de bactéries aérobies varie de plus de 1 x 106 UFC/cm2 sur le front, 5 x 104 UFC/cm2 sur l’abdomen à 1 x 104 KVE/cm2 (KVE/cm² ou UFC/cm2)sur l’avant-bras. Le nombre total de bactéries sur les mains des professionnels de la santé oscille entre 3,9 x 104 et 4,6 x 106 UFC/cm2. Lors de l’utilisation de la méthode « Fingertip press », la contamination oscille entre 0 et 300 UFC ».
Dans une autre référence, Pessoa-Silva C.L. et al.5 démontrent à l’aide de la méthode « Fingertip press » que 360 des 398 cultures prélevées auprès de professionnels de la santé se sont avérées positives aux bactéries.
Lucet J.C., et al.6 démontrent quant à eux ce qui suit à l’aide de la méthode « Fingertip press » : sur un total de 516 cultures (258 avant l’hygiène des mains (HM) et 258 après HM), 383 se sont révélées positives. Dans ce cadre, il est crucial de noter que le nombre d’UFC avant HM ne présente PAS de divergence notable.
Hoffman P.N., et al.7 démontrent à l’aide de la méthode « Swab » qu’un swab (tampon à prélèvements) réalisé sur la peau sous une bague contient en moyenne 1600 UFC/swab et qu’un swab de la peau sur un lieu de contrôle dénombre en moyenne 180 UFC/swab. Salisbury DM, et al. 8 démontrent à l’aide d’une méthode « timed-friction rinse » que sur 915 échantillons de mains sans bague et avant leur nettoyage, on obtient en moyenne 3303 UFC et que sur 245 échantillons de mains sans bague et après leur nettoyage, on obtient en moyenne 1775 UFC.
Annette Schuermans, et al.9 démontrent à l’aide de la méthode « Fingertip press » que 51,8 % des 1643 personnes examinées dénombraient plus de 50 UFC sur les 5 empreintes digitales de leur main dominante avant l’exécution d’un acte pour lequel les mains sont supposées avoir été récemment lavées ou désinfectées.
En juin 2013, la Vlaams Agentschap Zorg en Gezondheid (Agence flamande soins et santé) a évalué l’hygiène des mains au sein de l’AZ Nikolaas. A cet effet, des tampons à prélèvements (swabs) ont été utilisés entre les doigts des collaborateurs. Les valeurs cibles de ces types de prélèvement ne sont pas mentionnées dans les ouvrages, mais la limite a été fixée à 500 UFC/swab en concertation avec le WIV-ISP (Dr Nadine Botteldoorn).
En guise de premier petit échantillonnage, l’auteur a, en mars 2014, à l’aide de la méthode « Fingertip press », étudié au hasard les doigts de la main dominante de 13 collaborateurs du CS en zone « propre ». Cinq boîtes (38 %) dénombraient des UFC supérieures à 100. Sept (54 %) en dénombraient plus de 50 (à comparer à l’étude susmentionnée du Prof. A. Schuermans9).
Toujours en mars 2014 est paru « Contamination of Stethoscopes and Physicians’ Hands After a Physical Examination »10. Le tableau suivant indique les résultats de la contamination bactérienne (exprimée en UFC/25 cm²) provoquée par un contact cutané avec des objets stériles : stéthoscope stérile, gants stériles (comparable au contact manuel avec des instruments stériles).
Tableau 1. Contamination des mains et du stéthoscope des médecins après un examen médical (Yves Longtin, et al., 2014 11)
UFC : unités formant colonies ; Min: minimum; Max: maximum.
Il convient également de tenir compte du fait qu’il a été démontré que l’observance pour l’hygiène des mains était trop faible, que l’exécution technique de l’hygiène des mains était souvent incorrecte et qu’il y avait une relation linéaire entre la transmission bactérienne et le niveau de contamination des mains11.
En résumé, on peut avancer que la biocharge de nos mains est élevée (surtout en rapport avec des surfaces normales propres) et que le contact avec les mains donne lieu à une importante transmission de bactéries (UFC). Le contact avec les mains conduit également à la transmission de substances organiques et inorganiques (lipides, particules cutanées, métaux, sels, etc.). En d’autres termes, le contact avec les mains accroît la biocharge et pollue.
Un nettoyage et/ou une désinfection insuffisants peuvent offrir aux germes une protection contre l’agent de stérilisation et entraîner des contaminations chez les patients. (CSH n° 7848).
Les instruments utilisés en chirurgie propre sont en principe exempts de bactéries.
A l’issue d’un nettoyage validé et d’une désinfection thermique de haut niveau validée (valeur Ao ≥ 3000, en pratique souvent 6000 12-13), l’instrument est en principe parfaitement propre et exempt de germes. Si, à l’issue du nettoyage et de la désinfection adéquats, il est procédé au contrôle et à l’emballage des instruments à mains nues, la pollution des instruments augmente et la biocharge n’est plus aussi faible que possible. La biocharge de gants jetables propres (surfaces normales) est en principe très réduite (surtout en comparaison à la biocharge de nos mains) et comparable à celle du matériau d’emballage.
Littérature scientifique et syllogistique14-20, le système formel logique d’Aristote.
Après manipulation à mains nues, la stérilité des instruments à l’issue d’une stérilisation validée ne peut plus être garantie. Pour les variables scientifiques, veuillez voir ci-dessus.
Une preuve est un raisonnement valable aux prémisses vraies. Un raisonnement n’est valable que si les prémisses sont vraies. La conclusion est alors vraie également (Aristote).
Major (Aam) : après stérilisation validée, des instruments garantis stériles (a) sont des instruments parfaitement propres affichant une biocharge aussi basse que possible (m) -> point de départ, CSH n° 7848.
Minor (Ebm) : après manipulation à mains nues, les instruments (b) ne sont pas des instruments parfaitement propres affichant une biocharge aussi basse que possible (m) -> littérature scientifique, preuves (voir ci-dessus).
Conclusion (Eba) : après manipulation à mains nues, les instruments (b) ne sont pas des instruments garantis stériles après stérilisation validée (a)
(Aam
Ebm
Eba -> est un Camestres, un syllogisme valide de la 2e figure avec AEE, qui devait être prouvé.)
Si nous voulons conserver les « Recommandations pour stérilisation » du Conseil supérieur de l’hygiène (CSH n° 7848) et offrir une garantie de stérilité, le port de gants lors du contrôle et de l’emballage (donc à l’issue du nettoyage et de la désinfection validés) en constitue la suite logique (un discours tel que, certaines choses étant posées, quelque autre chose en résulte nécessairement par cela seul que les premières sont posées (Aristote)).
Avec le temps, nos possibilités techniques en matière de prévention et de contrôle des infections dans le secteur des soins sont également de plus en plus nombreuses. En comparaison au nettoyage et à la désinfection manuels, l’utilisation de méthodes de nettoyage et de désinfection validées constitue un avancement qualitatif majeur. La plus-value de ces processus partiels ne peut s’éroder dans la suite du processus, au risque de voir la facture s’alourdir à la fin du processus. La plus-value du nettoyage et de la désinfection validés est liée à l’utilisation de gants pendant la phase d’emballage. Nos capacités cognitives évoluent souvent moins rapidement que nos capacités techniques, et nous ne tenons pas assez compte de nos microbiota commensaux. L’on considère trop souvent l’homme comme un être complexe et à part entière et oublie qu’il coexiste avec une multitude de micro-organismes. L’homme est le fruit de l’évolution de la planète terre.
« A » est défini comme le temps nécessaire, exprimé en secondes, à une température de 80°C, pour atteindre un certain effet désinfectant.
Lorsque la température est de 80°C et que la valeur Z est équivalente à 10, le terme « A0 » est utilisé.
1 unité Ao = 1 seconde à 80°C.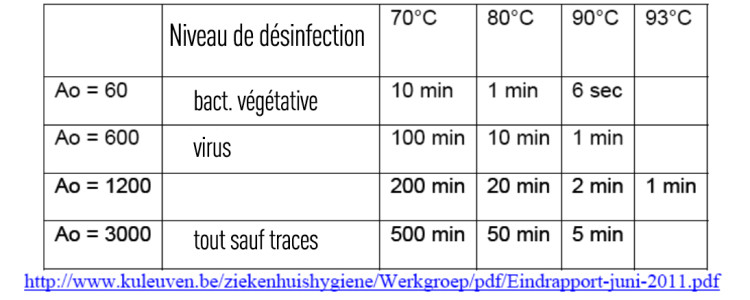
La syllogistique est un système formel logique. La forme ou la structure du raisonnement en détermine la validité. On distingue 256 modes syllogiques. Camestres est un syllogisme valable.
Un syllogisme (raisonnement valable) se compose d’énoncés catégoriques, 2 faisant office de prémisses et 1 de conclusion. Un prédicat (a) est affirmatif ou négatif par rapport à un sujet (b). Le moyen terme (m) n’apparaît que dans les prémisses. Il existe 4 sortes d’énoncés S- P :
Aba: universel affirmatif
Iba: particulier affirmatif
Eba: universel négatif
Oba: particulier négatif.
1. Conseil supérieur de l’hygiène (CSH) n° 7848, Recommandations en matière de stérilisation
2. Thermal Disinfection – The Ao Concept and the Biological Background, Urs Rosenberg, Borer Chemie AG, Switzerland
3. Reybrouck G., Schuermans A., Van de Putte M. Ziekenhuishygiëne. Acco Leuven / Leusden, uitgave 2000
4. World Health Organization Patient Safety: WHO Guidelines on Hand Hygiene in Health Care: First Global Patient Safety Challenge, Clean Care is Safer Care. Geneva Switzerland: World Health Organization; 2009
5. Pessoa-Silva C.L. et al.: Dynamics of bacterial hand contamination during routine neonatal care. Infect Control Hosp Epiemiol 25:192-197, Mar. 2004
6. Lucet J.C., et al.: Hand contamination before and after different hand hygiene techniques: a randomized clinical trial. J Hosp Infect 50:276-280, Apr. 2002.
7. Hoffman P.N., et al.: Micro-organisms isolated from skin under rings worn by hospital staff. BMJ290(6463):206-207. Jan. 1985.
8. Salisbury DM, et al.: The effect of rings on microbial load of health care workers’ hands. Am J Infect Control, 1997;25:24-27
9. Schuermans, A. et al.: Sensibilisatiecampagne handhygiëne door de Regionale Werkgroep voor Ziekenhuishygiëne Vlaams-Brabant en Limburg. NOSO-info, vol. VIII nr. 4, 2004
10. Longtin, Y. et al., Contamination of Stethoscopes and Physicians’ Hands After a Physical Examination. Mayo Clin Proc. March 2014:89(3):291-299.van der Velden L.B., Nabuurs-Franssen M.H., van Leeuwen A., Isken M., Voss A.
11. Pittet D., et al Evidence-based model for hand transmission during patient care and the role of improved practices. . The Lancet Infectious Diseases 1/2006; 6(10):641-52.
12. Van der Velden L.B. et al., Thermal disinfection of bedpans: European ISO 15883-3 guideline requirements are insufficient to ensure elimination of ARE and OXA-48 outbreak-strains. Antimicrobial Resistance and Infection Control: Abstracts from the 2nd International Conference on Prevention and Infection Control (ICPIC 2013), Antimicrobial Resistance and Infection Control 2013, 2(Suppl 1):O66 doi:10.1186/2047-2994-2-S1-O66
13. Bories, Y. Bedpanspoelers, centrale vaatwassers in ziekenhuizen en woon- en zorgcentra en de verspreiding van multiresistente darmcommensalen, Yvo Bories, NOSO-info, vol. XVII nr 4, 2013
14. Van Riel G., Fundamentele wijsbegeerte, , Acco 2010
15. Cloots A., Fundamentele wijsbegeerte, , Acco 2012
16. De Pater W.A., Vergauwen R.M.A., Logica: formeel en informeel, Universitaire Pers Leuven 2005
17. Werkgroep ziekenhuishygiëne, Eindrapport-juni-2011 KULeuven
18. Wenzel R.P., Prevention and Control of Nosocomial Infections, fourth edition, Lippincott Williams & Wilkins 2007
19. Wenzel R.P. Minimizing Surgical-Site Infections. Editorial. New Engl J. Med 362;1:75-77, 2010
20. Sintubin, M. De wetenschap van de aarde – over een levende planeet, Acco 2012
Tout patient d’hémodialyse chronique est confronté au risque d’une bactériémie associée aux cathéters (BAC). Le risque de développer cette complication dépend de la voie d’accès choisie : un cathéter de dialyse temporaire ou permanent induit un risque d’infection supérieur à une fistule artério-veineuse [1,2,3]. Selon certaines sources, les taux d’hospitalisation et de mortalité liés à des infections sont 2 à 3 fois plus élevés dans le cas de patients d’hémodialyse sur cathéter[4,5]. La pathogénèse des BAC est claire. Les bactéries pénètrent dans les vaisseaux sanguins à partir de la peau, par le biais du site d’insertion du cathéter, ou des bactéries formant un biofilm pénètrent directement dans le cathéter à la suite d’une manipulation non aseptique [6].
Au vu des potentielles conséquences lourdes des BAC sur les patients d’hémodialyse, la surveillance des BAC auprès des patients d’hémodialyse chronique s’avère particulièrement judicieuse. Cet article est un compte rendu d’un projet d’amélioration de la qualité suivant la méthode en 7 étapes. [7] Ce projet a été élaboré de manière autonome par l’unité de dialyse. La méthode appliquée est celle du Netwerk Klinische Paden de la KU Leuven dont le but est de soutenir les équipes multidisciplinaires dans l’élaboration, la mise en place, l’évaluation et le suivi continu de l’organisation d’un processus de soins.
Approche selon le cycle PDCA (Plan-Do-Check-Act/Adjust)
Fig.1. Méthode en 7 étapes pour mettre en place un itinéraire de soins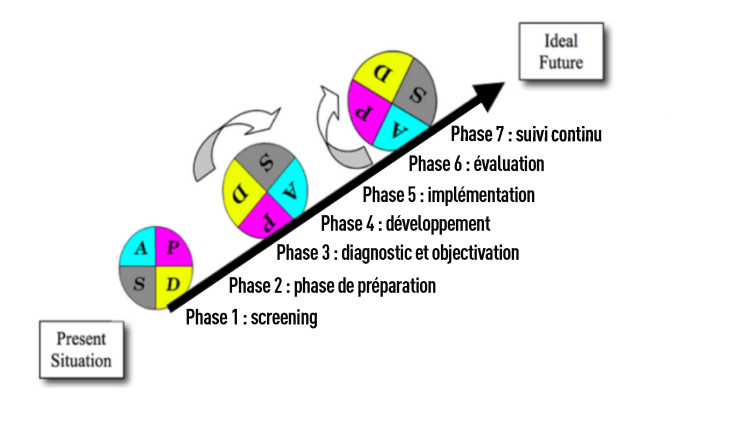
Phase 1 : screening
Toutes les hémocultures de patients en dialyse chronique prélevées lors d’une même année civile ont été étudiées pour identifier la présence de pathogènes (hémocultures positives). Les définitions du protocole sepsis de l’Institut Scientifique de Santé Publique (WIV-ISP) ont été appliquées. Les patients dialysés aigus temporaires et les patients sous dialyse péritonéale nécessitant une hémodialyse temporaire n’ont pas été inclus. Dans le cadre de l’analyse, tout patient d’hémodialyse chronique présentant une hémoculture positive non secondaire à une autre infection a été considéré comme un patient présentant un sepsis associé à un cathéter, identifié dans cet article par l’abréviation BAC. D’après ce screening, les infections liées à des cathéters en 2008 et 2009 ont augmenté de 1,03 à 1,17 par 1000 jours-cathéter. Le centre de dialyse a perçu la nécessité d’élaborer un projet d’amélioration multidisciplinaire.
Phase 2 : approche par projets
Un néphrologue et 2 infirmiers de dialyse ont été désignés chefs de projet. Lors des moments de concertation d’équipe, il a été procédé à un brainstorming multidisciplinaire concernant des possibles actions d’amélioration visant à réduire le risque de BAC auprès de patients d’hémodialyse chronique. L’équipe de dialyse était clairement prête à changer et à innover. Un groupe de travail sur les soins impliquant l’utilisation d’un cathéter a été mis en place sur une base volontaire. Les soins au site de sortie et les manipulations du cathéter de dialyse sont considérés comme cruciaux dans la prévention des BAC. La procédure existante pour les soins liés à l’utilisation d’un cathéter a été passée sous la loupe et comparée aux directives Kidney Disease Outcomes Quality Initiative (directives KDOQI) [8].
Phase 3 : diagnostic & objectivation
C’est sous la devise « mesurer c’est savoir » que des données ont été rassemblées et traitées. Les chiffres BAC obtenus ont été comparés avec les critères de performance internationaux objectifs suivants.
Fig. 2. Critères d’évaluation du taux de BAC auprès des patients d’hémodialyse chronique
BAC : bactériémie associée aux cathéters
Un objectif de < 1 BAC/1000 jours-cathéter – dans le but d’offrir des soins excellents – a été formulé. Il est évalué chaque année si cette norme est atteinte.
Phase 4 : développement
Différentes actions ont été mises en place pendant la phase de développement.
Le groupe de travail sur les soins liés à l’utilisation d’un cathéter a révisé la procédure de soins liés à l’utilisation d’un cathéter en intégrant les directives KDOQI. Des seringues stériles pré-remplies de 20 ml de sérum physiologique ont été utilisées pour le rinçage du cathéter. Le contenu des sets de raccordement et de fermeture a été adapté. Le nombre de matériaux emballés séparément à utiliser a été revu à la baisse, réduisant la probabilité d’actes non stériles. La préparation du set de fermeture, les soins au site d’insertion du cathéter et le procédé lors du raccordement ont été rédigés. Il a été fait la promotion de l’hygiène des mains et de la désinfection de l’écran de l’appareil de dialyse (surface souvent touchée).
Vu que le dialysé endosse souvent également une responsabilité propre et doit participer à la prévention des BAC, une brochure destinée aux patients a été élaborée et des investissements dans une éducation des patients supplémentaire concernant la prévention d’infections dues à un cathéter ont été consentis.
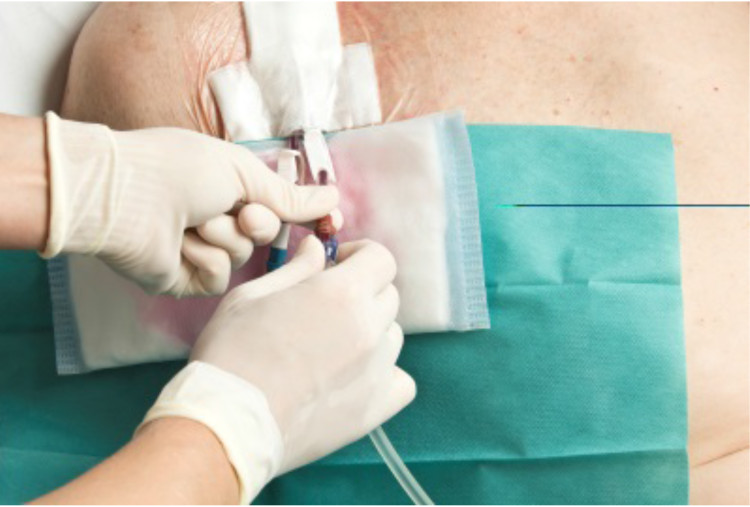
Fig. 3 exemples de quelques nouveautés dans la procédure de soins liés à l’utilisation de cathéters lors de dialyses
Nouveaux sets de raccordement et de fermeture
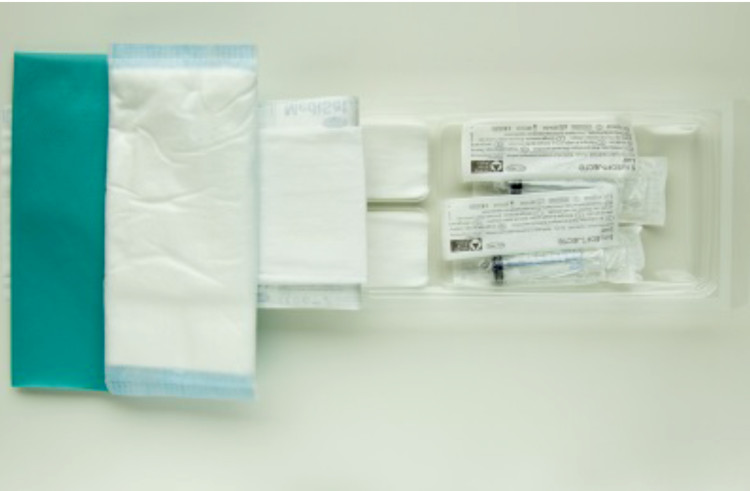
Désinfection des connexions à l’aide de compresses imprégnées de chlorhexidine alcoolique (« scrub the hub »)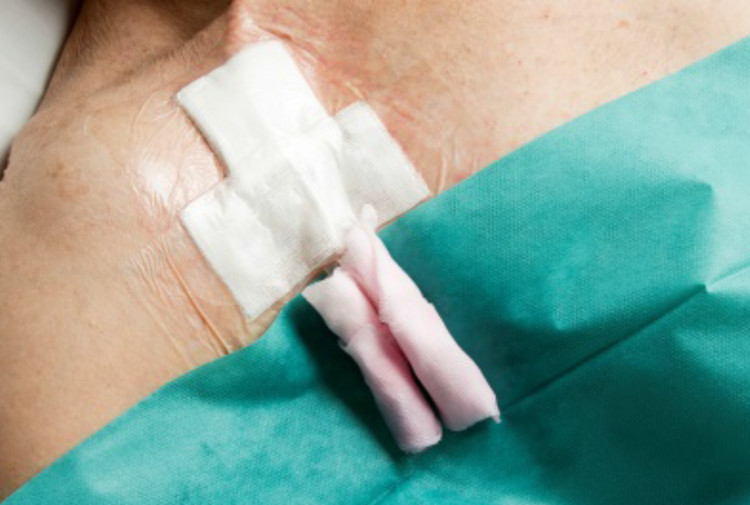
Bouchons obturateurs dans chlorhexidine alcoolique Utilisation d’acide fusidique en pommade uniquement dans des indications bien précises (en cas de cathéter temporaire ; en cas de cathéter définitif si cuff visible ou pendant une courte période en cas de rougeurs au niveau du site d’insertion du cathéter après prélèvement de culture))
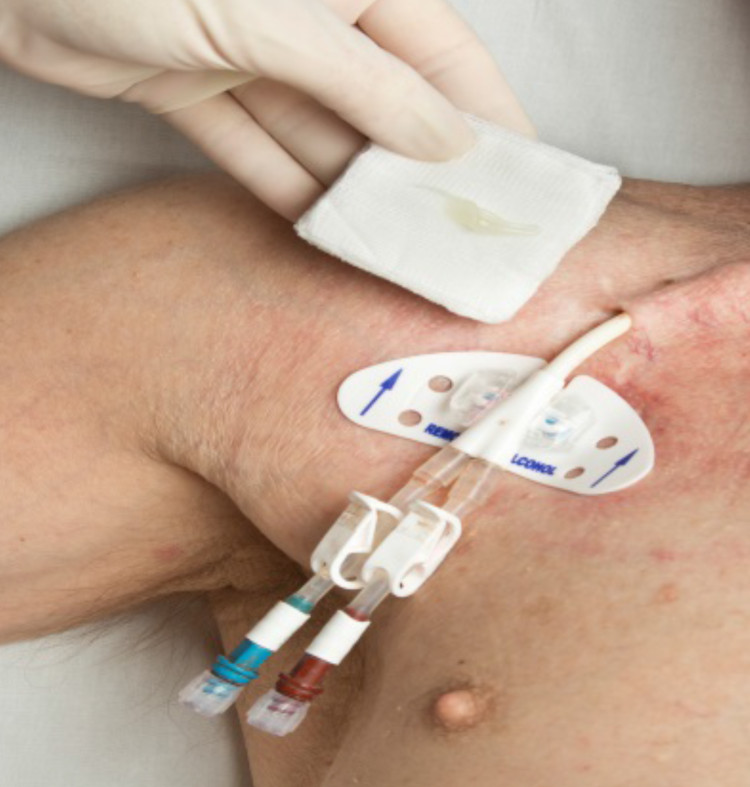
Phases 5 & 6 : mise en place et évaluation
Le nouveau procédé a été expliqué à tous les infirmiers de dialyse à l’occasion d’une réunion d’équipe. A l’issue d’une phase d’information poussée, toutes les mesures (dont l’information des patients) ont immédiatement été appliquées à large échelle en 2012. La nouvelle procédure concernant les soins liés à l’utilisation de cathéters est disponible dans le livre de procédures électronique et évaluée lors des moments de concertation en équipe. Les indications pour l’utilisation de pommade antibiotique (acide fusidique Fucidin®) ont été clairement établies. Les résultats du processus d’amélioration de la qualité se sont avérés positifs. Le taux de BAC s’élevait en 2012 à 0,75/1000 jours-cathéter.
Phase 7 : suivi continu
Chaque année, il est procédé à une évaluation objective formelle de l’indicateur de résultat et de l’organisation du processus de soins. Après l’introduction d’actions d’amélioration dans le processus de soins, le taux de BAC a diminué pour ensuite rester à un faible niveau (moins de 1 BAC par 1000 jours-cathéter).
Fig. 4 Evolution des BAC/1000 jours-cathéter (de dialyse) auprès des patients d’hémodialyse chronique, avant et après intervention dans un hôpital aigu.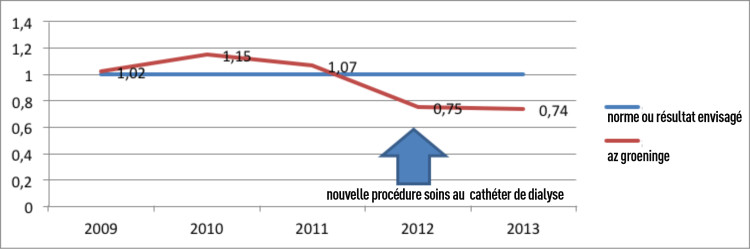
Des procédures claires et des soins uniformes liés à l’utilisation de cathéters ont permis d’améliorer les la qualité des soins, donnant lieu à une réduction effective du nombre de BAC. Mesurer une qualité, comparer des chiffres avec une norme acceptée à l’échelle internationale et mettre en place un projet de qualité PDCA sont autant d’actions suscitant une implication et rapprochant différents membres d’équipe/disciplines. La surveillance actuelle des BAC devrait pouvoir être étendue au contrôle de l’utilisation des antibiotiques, de la durée de vie des cathéters de dialyse et du nombre d’hospitalisations liées à l’utilisation d’un cathéter.
L’étude NOTICE (National Opportunity To Improve Infection Control in End-stage renal disease) a récemment démontré la présence de grandes disparités concernant les mesures de prévention des infections sur les unités de dialyse aux États-Unis ; les meilleures pratiques ne sont pas partout traduites dans la pratique quotidienne [9]. Les choses ne sont peut-être pas différentes dans notre pays. Notre expérience nous a appris que le meilleur moyen d’y remédier était de faire appel à un projet d’amélioration de la qualité locale à l’aide d’une équipe motivée de néphrologues et infirmiers de dialyse.
[1] Inrig JK, Reed SD, Szczech LA, et al. Relationship between clinical outcomes and vascular access type among hemodialysis patients with Staphylococcus aureus bacteremia. Clin J Am Soc Nephrol 2006; 1:518.
[2] Fan PY, Schwab SJ. Vascular access: concepts for the 1990s. Clin J Am Soc Nephrol 1992; 3:1.
[3] Patel PR, Kallen AJ, Ardujo MJ, Epidemiology, surveillance and prevention of bloodstream infections in hemodialysis patients, Am J Kidney Dis, 2010, 56(3), 566-577.
[4] Pastan S, Soucie JM, McClellan WM. Vascular access and increased risk of death among hemodialysis patients. Kidney Int 2002; 62:620.
[5] Allon M, Daugirdas J, Depner TA, et al. Effect of change in vascular access on patient mortality in hemodialysis patients. Am J Kidney Dis 2006; 47:469.
[6] Allon M. Dialysis catheter-related bacteremia: treatment and prophylaxis. Am J Kidney Dis 2004; 44:779.
[7] 7 fasenmodel voor de ontwikkeling, implementatie, evaluatie en continue opvolging van zorgpaden, Netwerk Klinische Paden, Centrum voor Ziekenhuis-en Verplegingswetenschap KU Leuven https://nkp.be/zorgpaden/methodologie
[8] Clinical Practice Guidelines and Clinical Practice Recommendations for vascular access, 2006 updates NKF DOQI.
[9] Chenoweth CE et al., Variation in infection prevention practices in dialysis facilities: results from the National Opportunity to improve Infection Control in ESRD (End-Stage Renal Disease) Project, Inf Control and Hosp Epidem, 2015, 36(7), 802-806.

Chaque année, le Conseil Supérieur de la Santé émet un avis concernant la vaccination contre la grippe saisonnière. Il y détermine les groupes de personnes prioritaires à vacciner. Parmi ces groupes, on retrouve celui du personnel du secteur de la santé (1).
Depuis quelques années, l’équipe en charge de l’hygiène hospitalière de l’AZ Sint-Maarten Mechelen-Duffel se base sur cet avis pour élaborer une campagne de vaccination ciblée, et ce afin d’atteindre un taux de vaccination aussi élevé que possible auprès des membres du personnel. Le tableau 1 indique une forte fluctuation du taux de vaccination par le passé. En 2009 et 2010, plus de la moitié des collaborateurs ont été vaccinés. L’on doit cet excellent résultat aux craintes entourant une possible pandémie de grippe mexicaine. Mais cette amélioration fut de courte durée, le taux de vaccination chutant ensuite considérablement les années suivantes.
Tableau 1 Taux de vaccination global du personnel de l’AZ Sint-Maarten 2008 – 2012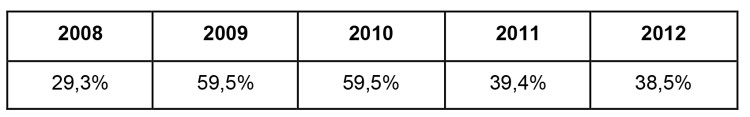
Vers un nouveau mode de vaccination
Une campagne a été élaborée afin de sensibiliser tous les collaborateurs sur la vaccination contre la grippe. Tout d’abord, un symposium concernant la vaccination en général a été organisé au printemps 2012, à l’occasion duquel une attention toute particulière a été apportée quant à l’importance de la vaccination contre la grippe. Ce procédé a permis de transmettre des connaissances précises concernant les symptômes et le vaccin. Toutes les raisons pour lesquelles il est recommandé de se faire vacciner ont été évoquées ; les arguments pour ne pas se faire vacciner et les préjugés ont été réfutés. L’orateur invité était le Dr. Marc Van Ranst de la KULeuven.
Suite à son allocution, les enseignements nécessaires ont été tirés pour donner forme à la campagne : une réunion d’information a été organisée à l’intention des infirmier(ère)s en chef ; une communication a été diffusée par le biais de l’intranet de l’hôpital ; une affiche faisant mention des principaux arguments en faveur de la vaccination et des données pratiques a été distribuée dans tous les départements. La campagne s’est concentrée avant tout sur les départements dans lesquels séjournent des patients présentant un risque élevé de complications en cas de grippe: les soins intensifs, la gériatrie, la maternité, l’oncologie et les soins chroniques. La principale mesure concerne cependant les changements majeurs apportés à l’approche de la vaccination proprement dite. Il est ressorti de l’exposé du Dr. Van Ranst que l’implication d’une équipe de vaccination conduisait à un taux de vaccination d’environ 50 %. D’autres mesures, comme l’organisation de conférences ou la distribution de chèques-cadeaux aux personnes se faisant vacciner, n’induisent qu’une amélioration marginale de quelques points de pourcentage du taux de vaccination.
Depuis deux ans, le vaccin est administré par une équipe de vaccination. En réalité, il est question d’un infirmier de l’équipe mobile de chaque campus, qui pendant plusieurs jours, pendant la période entre la mi-octobre et la mi-novembre, se rend dans les départements et vaccine tous les collaborateurs intéressés. Les collaborateurs affectés au service de nuit sont vaccinés par le coordinateur de nuit responsable et les collaborateurs en congé de longue maladie sont contactés par écrit par le département des ressources humaines (RH) et invités à éventuellement se présenter à l’hôpital pendant cette période pour se faire vacciner. Lorsque la période d’activité de l’équipe de vaccination touche à sa fin, il est encore possible de se faire vacciner au service des urgences. Les collaborateurs ne doivent donc pas prendre l’initiative de se faire vacciner. Une fois vaccinés, ils reçoivent une friandise et le badge « ik doe mee » (je participe) distribué par l’Agence flamande soins et santé (2). Les départements dont tous les membres du personnel sont vaccinés reçoivent une tarte à l’occasion de leur prochaine réunion de service.
Les collaborateurs ne se faisant pas vacciner doivent porter, en cas d’épidémie de grippe, un asque couvrant le nez et la bouche lors de contacts directs avec des patients. A cet effet, il convient de consulter le bulletin hebdomadaire du WIV-ISP. Les instituts de formation dont les étudiants suivent un stage à l’hôpital sont invités à encourager leurs étudiants à se faire vacciner chez leur médecin généraliste. S’ils ne sont pas vaccinés, ils seront également invités à porter un masque couvrant le nez et la bouche lors d’épidémies.
Depuis la création d’une équipe de vaccination, le taux de vaccination des collaborateurs a augmenté par rapport aux années antérieures (voir tableau 1). Cette évolution apparaît dans le tableau 2 ci-dessous :
Tableau 2 : taux de vaccination du personnel de l’AZ Sint-Maarten 2013 – 2014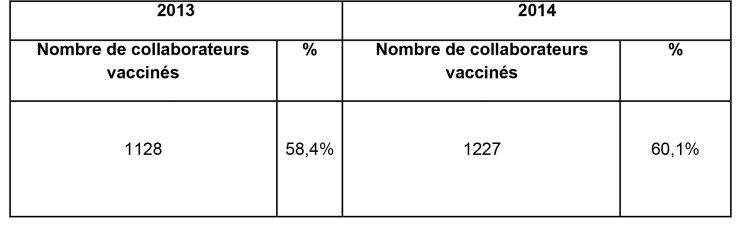
« Never change a winning team ». Pour la prochaine saison hivernale, l’approche de la vaccination contre la grippe ne changera pas. L’équipe en charge de l’hygiène hospitalière estime que les collaborateurs vaccinés l’an dernier le feront également cette année et les années suivantes. Une sensibilisation permanente et des informations ciblées aux départements affichant de bas taux de vaccination seront mises en œuvre pour accroître systématiquement le taux. Avenir
1°) Avis du Conseil Supérieur de la Santé 9211 ; vaccination contre la grippe saisonnière Saison hivernale 2014-2015
2°) http://www.griepvaccinatie.be/

Comme le rappelle très justement Naima Hammami, les septicémies sont les plus sévères des infections associées aux soins avec une morbidité et une mortalité attribuable non négligeable.
Dans notre pays comme un peu partout, 24% de ces infections sont liées à la présence d’un cathéter veineux central. Cela veut dire en clair que 24% des septicémies sont évitables puisque de nombreuses études dont certaines toutes récentes ont bien montré le haut potentiel de prévention de ces infections. Ce haut potentiel de prévention en fait évidemment un bel indicateur de qualité des soins.
Des moyens les plus simples comme l’hygiène des mains, aux méthodes les plus sophistiquées comme les cathéters imprégnés, les patchs de chlorhexidine etc… beaucoup de moyens de prévention ont été essayés seuls ou en association (care bundle) avec plus ou moins de succès.

Dans le monde hospitalier, la protection du patient contre les risques est une préoccupation constante. Les risques peuvent être de multiples origines : biologiques, chimiques, électriques, liés aux radiations, à l’organisation de l’hôpital, au choix et à l’emploi d’équipements à titre d’exemple.
Dans cette contribution, nous allons nous concentrer, période automnale oblige, sur les obligations qui pourraient incomber à l’hôpital ou à son personnel, pour protéger le patient d’une contamination par le virus très contagieux de la grippe. Plus particulièrement, nous allons tenter de déterminer si l’hôpital peut encourir une responsabilité juridique en cas de maladie grippale d’un patient contaminé par un membre du personnel non vacciné. Cette question concerne principalement les unités de soins car les contacts y sont plus prolongés et donc le risque de contamination plus avéré. Nous partirons de l’hypothèse qu’il peut être démontré, par le patient (ou ses ayants-droits en cas de décès), un lien causal certain et exclusif entre sa contamination par le virus de la grippe et la non vaccination du travailleur qui est en contact avec lui (et sauf contre-indication médicale dans le chef de ce dernier). En effet, il peut y avoir d’autres sources de contamination : des visiteurs, d’autres patients ou des facteurs organisationnels. Par ailleurs, en milieu hospitalier, cette question est plus aiguë car il est peu fréquent que le patient soit vacciné contre la grippe à la différence par exemple du résident dans une maison de repos ou de repos et de soins. Enfin, nous allons voir que l’intérêt de cette analyse réside dans le fait que la vaccination contre la grippe n’est pas obligatoire en milieu professionnel.
L’étude de cette question


Les septicémies acquises à l’hôpital (HA-SEP) sont les plus sévères des infections hospitalières1-3. En Belgique, 24% des HA-SEP sont associées à l’utilisation de cathéters veineux centraux (CVC) et l’unité de soins la plus souvent impliquée est l’unité de soins intensifs (USI) (données 2014)4,5. La littérature a bien démontré un potentiel de réduction important pour les septicémies associées à un CVC (SEP-CVC). Les stratégies de prévention ciblent d’une part une diminution de l’exposition au facteur de risque (CVC) et d’autre part des pratiques adéquates au niveau de l’insertion et la maintenance du cathéter.6-9 Certaines études estiment que jusqu’à 70% des SEP-CVC pourraient être évitées avec la mise en œuvre de ces stratégies10-12.
Dans ce cadre, un programme de surveillance des septicémies à l’hôpital est essentiel et a été mis en place depuis 1992 en Belgique. Les données du programme de surveillance permettent de suivre l’évolution des SEP-CVC et d’évaluer le résultat des actions de prévention mises en place dans les hôpitaux belges.
Cet article fait la synthèse des données de surveillance relatives à l’épidémiologie des SEP-CVC en Belgique, y compris l’impact d’un changement dans la définition de cas.
Le programme national de surveillance des septicémies à l’hôpital (SEP) en Belgique a été institué en 1992. Le protocole de surveillance est disponible sur le site web de l’Institut Scientifique de Santé Publique (WIV-ISP)13. La surveillance a comme objectif de suivre les tendances des septicémies (tant au niveau de l’hôpital que national) afin de guider et d’évaluer les efforts de prévention. La participation est devenue obligatoire par Arrêté Royal à partir de 2014.
En bref, la surveillance des SEP comprend l’enregistrement pendant une période minimale de 3 mois par an de tous les cas de septicémies acquises à l’hôpital (HA-SEP). Les HA-SEP, par définition, sont des septicémies survenant chez un patient hospitalisé depuis au moins 2 jours et confirmées par hémocultures; au moins une hémoculture positive pour un micro-organisme pathogène reconnu, ou deux hémocultures provenant de prélèvements différents lorsque seuls des micro-organismes contaminants de la peau ont été isolés. Le clinicien doit indiquer l’origine suspectée de la septicémie parmi différentes options, dont «CVC» et «inconnue», ainsi que la confirmation éventuelle de cette suspicion (c’est-à-dire même micro-organisme retrouvé dans les hémocultures et au niveau du site d’origine suspecté; par exemple le CVC).
Lors de l’analyse des données, le total des septicémies dont l’origine probable est un CVC est calculé de la manière suivante : (1) HA-SEP avec CVC comme origine «suspectée» (confirmée, ou non) + (2) HA-SEP sans cause identifiée (origine inconnue) avec présence d’un CVC au moment de l’infection, ou endéans les 2 jours précédant celle-ci (Figure 1). Cette dernière catégorie a été ajoutée en 2013 afin de correspondre à la définition du CDC (Centres for disease control & prevention, USA). Ce regroupement est fait lors de l’analyse des données, et a donc pu être appliqué aux données récoltées avant ce changement de définition. En pratique, les septicémies avec «origine CVC confirmée» sont l’équivalent américain de CR-BSI (central-line related bloodstream infection) ou «septicémies liées à un CVC»; les septicémies avec «origine CVC probable» sont l’équivalent américain de CLABSI (central line-associated bloodstream infections) ou «septicémies associées à un CVC», que nous appelons ici CVC-SEP.
Figure 1: Septicémies associées aux cathéters veineux centraux, origine confirmée versus origine probable, surveillance SEP 2013
CVC; cathéter veineux central, SEP ; septicémies
Les résultats complets sont présentés dans le rapport annuel4.
• Description des cas
En 2014, 130 hôpitaux ont rapporté 6.847 HA-SEP; parmi lesquelles 1 813 (26%) étaient des septicémies associées à un CVC (c’est-à-dire CVC considéré comme l’origine probable de l’infection selon les définitions exposées ci-dessus). L’origine CVC était confirmée pour 43% des cas (778/1 813). Pour 25% des cas (482/1 813) le clinicien avait indiqué «origine de l’infection : inconnue» cependant un CVC était présent au moment de l’infection ou endéans les 2 jours avant le début de l’infection. Cette dernière proportion varie d’un hôpital à l’autre (médiane 19% ; P25-75 : 0-39%). Un tiers des septicémies dont l’origine probable est un CVC a été diagnostiqué dans une USI. Les microorganismes en cause sont principalement des germes Gram positifs. La médiane du délai d’acquisition (P25-P75) est de 23 jours (8-27) après l’admission à l’hôpital.
Tableau 1: Description des épisodes de septicémies associées à un cathéter veineux central, 2014
En 2014, 118/130 hôpitaux ont rapporté des données complètes (numérateur et dénominateur) permettant le calcul de l’incidence des septicémies associées à un CVC. Celle-ci est plus élevée dans les hôpitaux universitaires, les USI et dans la région de Bruxelles. A noter que la proportion d’hôpitaux universitaires est la plus élevée à Bruxelles (4 hôpitaux universitaires /15 hôpitaux participants en 2014). (tableau 2)
Tableau 2: Incidence des septicémies associées à un cathéter veineux central par 10.000 journées d’hospitalisation, 2014
La figure 2 montre l’incidence moyenne nationale des CVC-SEP pour 2000 – 2014. En 2014, l’incidence moyenne des septicémies associées à un CVC, par 10.000 journées d’hospitalisation était de 2,2 à l’hôpital et 13,3 à l’USI. Ces chiffres sont les plus élevés depuis 2011. Ces infections sont néanmoins peu fréquentes en nombre absolu, avec une médiane (P25-P75) de 3 épisodes (0-6) par trimestre et par hôpital.
Figure 2 : Incidence des septicémies associées au cathéter veineux central dans les hôpitaux belges, 2000-2014
Un grand nombre d’hôpitaux a participé à la surveillance des septicémies acquises à l’hôpital en 2014. Il existe une grande variabilité entre les hôpitaux, laquelle persiste après stratification selon différentes catégories (taille de l’hôpital, hôpital universitaire ou non). Cela pointe vers un important potentiel de prévention6-9,14.
Le système de surveillance documente une augmentation des septicémies associées à un CVC depuis 2011. Cette augmentation est marquée, que l’on prenne ou non en compte les septicémies pour lesquelles le clinicien a enregistré «origine inconnue» et qui ont été à l’analyse classées comme «origine CVC probable». Depuis 2011 et l’importante révision du protocole de surveillance, le nombre d’hôpitaux enregistrant des données a beaucoup augmenté. Une augmentation de la détection due à une meilleure sensibilisation autour de la problématique des septicémies associées au CVC est probable.
Ces données soulignent l’importance des définitions de cas, et de leur interprétation. Il est clair que la définition utilisée pour «septicémies associées au CVC» (CVC : origine probable) est très sensible mais manque de spécificité. Considérer – par défaut – une septicémie comme associée à un CVC, du simple fait qu’un CVC était présent avant l’infection, alors que le clinicien a estimé l’origine inconnue, inclut vraisemblablement certains faux positifs. Or cette catégorie représente un quart des septicémies associées au CVC. D’un autre côté, la définition utilisée pour les septicémies liées à un CVC (origine CVC confirmée) manque de sensibilité, car souvent le CVC n’a pas été mis en culture, et la confirmation de l’origine «CVC» n’a pas été obtenue. Il faut se rappeler qu’une définition de cas utilisée dans un but de surveillance doit avant tout être reproductible quitte à être moins fiable car le but est de suivre les tendances. (Au contraire d’un diagnostic clinique qui doit être fiable, car le but est de traiter un patient). Si les biais restent relativement constants, l’interprétation des tendances reste possible. La proportion de septicémies «origine inconnue, avec CVC présent» dans le total des septicémies associées à un CVC est restée remarquablement stable au niveau national entre 2000 et 2014. Il est donc important de présenter ensemble les données de septicémies associées au CVC et liées à un CVC, la «vérité» se trouvant quelque part entre les deux.
Il faut également dissocier l’utilisation de ces données pour le suivi des tendances au niveau national, et au niveau local. Les hygiénistes, qui avec les cliniciens, utilisent les chiffres de surveillance pour le suivi dans leur hôpital, sont les mieux placés pour interpréter leurs propres données, et apprécier les biais inhérents aux définitions de cas utilisées. Si ces données sont utilisées de cette façon, le système de surveillance atteint son objectif.
Des tentatives d’amélioration de la définition de cas sont cependant en cours. Environ un quart des septicémies associées au CVC dans la catégorie «origine inconnue avec présence d’un CVC» est situé en hémato-oncologie; certaines pourraient être dues à des bactériémies primaires associées à une rupture de la barrière muqueuse digestive chez des patients neutropéniques ou des greffés de la moelle osseuse (mucosal barrier injury, MBI)15. Le groupe de travail SEP a pris la décision d’inclure cette origine possible dans la liste des options offertes comme «origine suspectée» de la septicémie
(http://www.nsih.be/download/SEP/Minutes_SEP_WG_2015-06-24.pdf).
Nous pourrons suivre l’impact de cet ajout sur la proportion des SEP-CVC avec origine «inconnue».
En Belgique, les données concernant les septicémies associées au CVC (au niveau de tout l’hôpital) sont rapportées par patient jours, et non par journées cathéters ce qui est habituellement recommandé. Cependant le comptage des journées cathéter pour tout l’hôpital implique une charge de travail substantielle, et le calcul d’une incidence par journées d’hospitalisation permet à l’hôpital de suivre son propre problème (peut-être moins de se comparer aux autres, mais ce n’est pas le but). Une publication récente comparant pour le même hôpital les incidences de septicémies associées au CVC par nombre de journées d’hospitalisation, et par journées cathéter a montré que ces chiffres étaient fortement corrélés16.
Le comptage des journées cathéter est optionnel dans la surveillance SEP, mais a néanmoins un intérêt si le but est de suivre le ratio d’utilisation des CVC (‘device utilization ratio’=nombre de journées cathéter/nombre de journées patients), par exemple dans une perspective de diminution de l’exposition au CVC. Nous avons effectué une étude explorant la validité d’un échantillonnage hebdomadaire en USI (à la place d’un comptage exhaustif). Ceci sera ajouté au protocole SEP en 2016, mais restera limité aux USI.
Nous observons en Belgique depuis 2011 une augmentation des septicémies associées au CVC qui est sans doute due à une amélioration de la détection. Le problème est réel et en grande partie évitable. Notre unité a lancé une enquête internationale en ligne qui s’adresse aux médecins et aux infirmières travaillant dans des unités de soins intensifs (pas aux hygiénistes !) et dont le but est de mesurer les pratiques de prévention des septicémies associées aux CVC.
N’hésitez pas à diffuser cette enquête auprès des personnes concernées dans votre hôpital !
http://www.world-critical-care.org/index.php?option=com_content&view=article&id=266
Références
1. Vrijens F, Hulstaert F, Gordts B et al. Nosocomial infections in Belgium, part 2 : Impact on Mortality and Costs. 2009 KCE reports Vol 102C.
2. Vrijens F, Hulstaert F, Van de Sande S, Devriese S, Morales I, Parmentier Y. Hospital-acquired, laboratory-confirmed bloodstream infections: linking national surveillance data to clinical and financial hospital data to estimate increased length of stay and healthcare costs. Journal of Hospital Infection 2010;75(3):158-162.
3. Vrijens F, Hulstaert F, Devriese S, Van de Sande S. Hospital-acquired infections in Belgian acute-care hospitals: an estimation of their global impact on mortality, length of stay and healthcare costs. Epidemiol Infect 2012;140(1):126-136.
4. Hammami N, Lambert ML. Surveillance of bloodstream infections in Belgian hospitals (‘SEP’) – Annual report 2014, Surveillance data 2000-2014 – Hospital stay data 2000-2012. 2015
5. Mertens K. Surveillance national acquises dans les unités de soins intensifs – Rapport annuel 2012. 2014
6. Pronovost PJ, Goeschel CA, Colantuoni E et al. Sustaining reductions in catheter related bloodstream infections in Michigan intensive care units: observational study. BMJ 2010;340:c309.
7. Palomar M, Alvarez-Lerma F, Riera A et al. Impact of a National Multimodal Intervention to Prevent Catheter-Related Bloodstream Infection in the ICU: The Spanish Experience. Crit Care Med 2013;41(10):2364-2372.
8. Berenholtz SM, Pronovost PJ, Lipsett PA et al. Eliminating catheter-related bloodstream infections in the intensive care unit. Crit Care Med 2004;32(10):2014-2020.
9. Blot K, Bergs J, Vogelaers D, Blot S, Vandijck D. Prevention of central line-associated bloodstream infections through quality improvement interventions: a systematic review and meta-analysis. Clin Infect Dis 2014;59(1):96-105.
10. Umscheid CA, Mitchell MD, Doshi JA, Agarwal R, Williams K, Brennan PJ. Estimating the proportion of healthcare-associated infections that are reasonably preventable and the related mortality and costs. Infect Control Hosp Epidemiol 2011;32(2):101-114.
11. Lambert ML, Silversmit G, Savey A et al. Preventable proportion of severe infections acquired in intensive care units: case-mix adjusted estimations from patient-based surveillance data. Infect Control Hosp Epidemiol 2014;35(5):494-501.
12. Rossello-Urgell J, Vaque-Rafart J, Hermosilla-Perez E, Allepuz-Palau A. An approach to the study of potentially preventable nosocomial infections. Infect Control Hosp Epidemiol 2004;25(1):41-46.
13. Hammami N, Lambert ML. Nationale surveillance voor septicaemieën in het ziekenhuis (SEP) – Revisie SEP surveillance protocol v4.2. 2015
14. Marschall J, Mermel LA, Fakih M et al. Strategies to prevent central line-associated bloodstream infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol 2014;35(7):753-771.
15. Centers for Disease Control and Prevention (CDC). Bloodstream Infection Event (Central Line-Associated Bloodstream Infection and Non-central line-associated Bloodstream Infection)-January 2015. 2015 http://www.cdc.gov/nhsn/PDFs/pscManual/4PSC_CLABScurrent.pdf
16. Horstman MJ, Li YF, Almenoff PL, Freyberg RW, Trautner BW. Denominator Doesn’t Matter: Standardizing Healthcare-Associated Infection Rates by Bed Days or Device Days. Infect Control Hosp Epidemiol 2015;36(6):710-716.
* NVKVV = Nationaal Verbond van Katholieke Vlaamse Verpleegkundigen en Vroedvrouwen
Comme depuis quelques années, le groupe de travail (GT) a organisé 6 réunions en 2014, à chaque fois d’une durée de 4 heures. Le groupe de travail compte 15 membres, dont 14 membres effectifs et 1 membre correspondant. Un membre a quitté le groupe de travail à la suite d’un changement de fonction au sein de l’hôpital et a été remplacé par un nouveau membre.
Cette année encore, le GT s’est penché sur des questions de ses membres ou des questions posées par des externes par le biais du NVKVV.
Voici quelques exemples de questions abordées : le niveau de protection du prestataire de soins lors d’un accident par piqûre lors du port de gants, la nécessité du repositionnement d’un cathéter périphérique ayant été placé en phase pré-hospitalière, l’aménagement d’un vestiaire dans le quartier opératoire (zone sale/propre), règlement d’ordre intérieur pour dialyse chronique. Le résultat de la discussion a à chaque reprise été transmis à la personne à l’origine de la question.
Un deuxième « IP advies « Mobiele IT Technologie (smartphones, iPhone, iPad, tablets …) in zorginstellingen » (Avis en matière de prévention des infections « Technologie IT mobile (smartphones, iPhone, iPad, tablettes, etc.) dans les établissements de soins ») a été établi et publié dans la rubrique « Wetenschap en praktijk » (Science et pratique) du site web du NVKVV. Cet avis a également été publié dans NVKVV direct et a été cité comme référence dans une publication consacrée à ce sujet dans Nursing.
Un membre du GT souhaitait bénéficier d’un soutien lors de l’adaptation de la procédure MRSA dans son hôpital. Il a adressé un questionnaire à tous les membres du GT. A l’issue du traitement de toutes les données extraites du questionnaire, la procédure adaptée a été présentée et expliquée à tous les membres.
En décembre, un membre du GT a donné des explications concernant un outil pour l’établissement de l’élaboration du plan de gestion et du rapport d’activités sur l’hygiène hospitalière, voir obligation légale.
Il a été proposé de renouveler le logo du GT. Chacun a été invité à introduire un projet.
Lors de la réunion du mois de janvier, le programme de la journée d’étude sur l’hygiène hospitalière a été finalisé et les conventions nécessaires ont été établies avec les conférenciers et sponsors.
La journée d’étude, organisée le 24 mars, à l’occasion de la 40e semaine des infirmiers et sages-femmes, a abordé un sujet d’actualité : « Cadres référentiels et recommandations : de la théorie à la pratique ». La matinée a été consacrée aux cadres référentiels offerts dans le cadre de l’Inspection des Soins et l’Accréditation. Durant l’après-midi, les conférenciers ont évoqué les recommandations imposées par le Conseil Supérieur de la Santé. Comment les cadres référentiels et les recommandations théoriques sont-ils mis en pratique ? Les 6 conférenciers, dont 5 membres du GT et 1 participant à la formation spécialisée d’infirmier hygiéniste hospitalier au NVKVV, se sont inspirés de ces recommandations pour diriger leurs projets dans leur propre établissement.
Le compte rendu de l’intégralité de la journée d’étude a été publié dans Noso-Info, Vol. XVIII n°3, 2014 p. 18-20. Un conférencier a publié un article concernant sa contribution à la journée d’étude dans le dernier numéro de 2013, p. 6-9 et l’intervention de 3 conférenciers a été publiée dans Noso-Info, Vol. XIX n°1, 2015 p. 7-19.
La formation d’infirmier hygiéniste hospitalier d’un an s’est clôturée en 2014 sur la présentation des travaux de séminaire.
En mai, la réunion du GT a été organisée sur un site externe, en présence des diplômés. Le programme fut varié : la matinée a été consacrée à 3 présentations, à l’évaluation de la journée d’étude et à une réflexion collective sur des sujets de la journée d’étude de 2015. L’après-midi a été consacrée à l’évaluation de la formation et à la distribution des attestations. Dix personnes ont terminé avec fruit la formation d’infirmier hygiéniste hospitalier. Elles ont été invitées à participer à l’avenir aux réunions du GT (photo 1).
Photo 1 : les membres du GT et les diplômés de la formation d’infirmier hygiéniste hospitalier
Au printemps, 2 formations internes « infirmiers référents en hygiène hospitalière » ont été organisées, 8 des 79 participants provenant de maisons de repos et de soins. Elles s’inscrivent dans le cadre d’un projet pilote auquel l’hôpital participe. Cette formation a été évaluée en juillet.
Toujours au printemps, une formation « infirmiers référents en hygiène hospitalière pour maisons de repos et de soins » a été organisée au NVKVV. 12 infirmiers employés dans différentes maisons de repos et de soins flamandes y ont participé. Au mois de mai, une journée de bilan a été organisée pour 30 infirmiers référents en hygiène hospitalière de maisons de repos et de soins.
Le projet pilote axé sur la collaboration entre l’hôpital et les maisons de repos et de soins a donné lieu à une question : quelle formation prévoir pour les infirmiers hygiénistes en maisons de repos et de soins ? La formation actuelle d’infirmier hygiéniste hospitalier a été examinée dans le contexte des maisons de repos et de soins. La proposition a été abordée au sein du GT, mettant en avant les sujets similaires pour les hôpitaux et les maisons de repos et de soins et la formation pour laquelle des éléments distincts doivent être mis en place.
Lors de la réunion du mois de janvier, l’atelier « Build your own Infection Control Link Nurse » consacré à la perception et aux compétences des infirmiers référents en hygiène hospitalière a été expliqué par un membre du GT. Cet atelier est le fruit d’une collaboration entre notre GT et le « Royal College of Nursing » de Londres. L’atelier aborde quelques questions concernant les connaissances théoriques, aptitudes pratiques et compétences comportementales dont un bon infirmier référent en hygiène hospitalière doit disposer.
Un aperçu de la perception actuelle et réelle des infirmiers référents dans nos hôpitaux a été réalisé, à l’aide de copier-coller (photo 2). Les informations rassemblées peuvent servir à évaluer le fonctionnement des infirmiers référents en hygiène hospitalière au sein de l’établissement propre. Toutes les données ont été obtenues par le biais du membre du GT et analysées pour permettre une comparaison entre les établissements de soins en Belgique, mais aussi avec les britanniques. L’objectif final est l’élaboration d’un profil de compétences professionnel européen pour infirmier référent en hygiène hospitalière au sein d’EUNETIPS.
Photo 2 : atelier « Build your own Infection Control Link Nurse »
En novembre 2013, lors d’une concertation informelle avec le Dr. Pia Cox, des propositions ont été formulées concernant une collaboration future. Pia Cox est médecin en prévention des infections travaillant pour le « Vlaams Agentschap Zorg & Gezondheid/afdeling toezicht Volksgezondheid voor Vlaams Brabant en Limburg » (Agence soins et santé flamande/division surveillance de la santé publique pour le Brabant flamand et le Limbourg).
Le GT considérait une collaboration avec Pia Cox et son équipe comme une opportunité. Le fait que chaque cadre d’exigences contienne des éléments relatifs à l’hygiène hospitalière était considéré comme un point fort. Pia Cox et son équipe ont participé à la réunion du mois de mars. Ils représentent, au sein de l’Agence soins et santé, le GT sur l’hygiène hospitalière. A l’issue d’une brève présentation et du passage en revue des activités des deux groupes, un signal de collaboration clair est apparu. Pia et son équipe ont proposé l’élaboration conjointe d’un cadre d’exigences sur l’hygiène hospitalière, composé d’aspects structurels et légaux auxquels répondre. Des conventions concrètes ont été établies pour y parvenir.
L’ABIHH a élaboré un questionnaire pour identifier les pratiques actuelles en matière de prévention des infections au service endoscopie. Le président de l’association francophone d’infirmiers hygiénistes hospitaliers a demandé notre collaboration pour la diffusion de cette enquête auprès des collègues néerlandophones.
En janvier, le dernier sujet du cadre de référence pour la désinfection de scopes flexibles a été abordé. Le GT a parcouru les remarques des médecins, ainsi que les réponses des pouvoirs publics. Lors de notre réunion, un point de vue a été adopté, point de vue qu’un membre du GT a défendu lors de la réunion suivante du cadre de référence.
La publication n° 8580 du CSS, intitulée recommandations en matière de prévention des infections durant les travaux de construction, de rénovation et les interventions techniques dans les institutions de soins – recommandations pour les intervenants internes et externes, a été finalisée et publiée. Les présentations PowerPoint et les fiches techniques ont été transmises par un membre ayant participé activement au développement de cette publication au nom du GT.
La plateforme fédérale d’hygiène hospitalière a organisé le 19 septembre un atelier dans le but d’harmoniser le fonctionnement des différentes instances actives dans le domaine de la prévention des infections en Belgique. Le GT sur l’hygiène hospitalière a été convié à la session « collaboration entre différentes instances ». L’ensemble de tâches formation, transfert d’informations et promotion de la lutte contre les infections a été confié à ABIHH, NVKVV et BICS.
Deux membres du GT ont donné une présentation à l’occasion d’une journée d’étude néerlandophone et francophone concernant les résultats de l’enquête menée par le GT concernant la politique d’épilation préopératoire en Belgique. Les résultats ont été publiés dans le Noso-Info 2013, 3.
L’atelier « Build your own Infection Control Link Nurse » a été présenté pour la 2ème fois par un membre du GT lors du congrès IPS (Infection Prevention Society) à Glasgow. En Flandre, l’atelier a déjà été organisé dans 3 hôpitaux. Tous les membres du GT ont été invités à organiser l’atelier dans leur hôpital au printemps 2015.
Le GT a été invité par l’ABIHH à mandater quelques conférenciers pour la « 14e Rencontre Internationale Francophone des Infirmier(e)s en Hygiène Hospitalière » du mois d’octobre. Trois membres du GT ont introduit une proposition, dont 2 ont été retenues par le congrès, à savoir la proposition concernant le profil de compétences professionnel de l’infirmier hygiéniste hospitalier et la proposition concernant l’atelier « Build your own Infection Control Link Nurse ».
Au mois de décembre, nous avons été conviés au symposium de l’ABIHH sur l’Ebola. Deux membres du GT ont participé au symposium, l’un d’entre eux ayant donné une présentation sur l’approche concrète dans un hôpital régional.
En 2014, le magazine Noso-Info a publié 6 articles par le biais du groupe de travail. En marge du rapport d’activités 2013 et du rapport de la journée d’étude de 2014, 2 membres du GT et 2 conférenciers de la journée d’étude de 2013 ont publié un article. 5 conférenciers de la journée d’étude 2014 sont prêts à rédiger un article.
Il a été décidé d’également publier sur le site web du GT sur l’hygiène hospitalière du NVKVV tous les articles publiés dans Noso-Info et rédigés par un membre du GT ou par un membre externe du GT.
Après 31 ans au poste de présidente, l’heure est venue de passer le flambeau à Pedro Braekeveld. La fonction de membre de la rédaction de Noso-Info sera assurée à partir de 2015 par Guido Demaiter.
Je remercie tous les membres, actuels ou passés, du GT pour leur confiance longue de plusieurs années et la collaboration fructueuse.


Les infections septicémiantes associées aux cathéters centraux (CLABSI) constituent un problème de santé publique et font partie, dans de nombreux pays, des programmes prioritaires pour la maîtrise des infections associées aux soins (1-4).
En Belgique, on estime à 2.1/10 000 jours -patients le nombre de CLABSI observées dans les unités de soins (5). Ces infections ont un impact sur la morbidité des patients et une mortalité comprise entre 12 et 25% (6). Les CLABSI prolongent la durée de séjour de 7,5 à 25 jours et sont responsables d’une augmentation des coûts des soins de santé (3, 6). La plupart de ces infections sont évitables par le respect de bonnes pratiques de soins, et ce depuis l’insertion du cathéter jusqu’au maintien de la ligne veineuse (1-7). L’étude de Pronovost a montré que tendre vers le risque «zéro CLABSI» était possible par l’observance d’un certain nombre de recommandations (8).
Dans la littérature, différentes approches pour diminuer l’incidence des CLABSI ont été publiées. Les «care bundles», centrés sur l’insertion du cathéter ou plus rarement sur la gestion veineuse ont montré leur efficacité pour diminuer l’incidence des CLABSI (9-10). Malheureusement, leur implémentation au quotidien est lourde car elle implique un surplus de travail pour les équipes soignantes.
Des approches multidimensionnelles ont également montré leur efficacité mais sont encore plus complexes à implémenter (11-13).
Dans ce contexte, une partie des membres de la Plateforme régionale d’hygiène hospitalière du Hainaut (PFRHHH) a décidé de réaliser un audit de pratiques concernant la gestion des cathéters centraux. L’objectif était de mener une action commune pour la prévention des CLABSI. Cette approche était beaucoup plus simple à mettre en place que les méthodologies décrites plus haut.
Le but de l’audit n’était pas de mesurer un taux d’infection de cathéter et de quantifier son éventuelle diminution, mais d’évaluer la qualité des soins pour le maintien des lignes de perfusion et de repérer les unités les plus à risques de CLABSI.
Choix des hôpitaux et du type d’action pour la prévention des CLABSI
L’audit de pratiques a été réalisé dans 7 hôpitaux membres de la PFRHHH (8 sites). Ce travail reposait donc sur le projet des membres de réaliser une action commune dans la prévention des CLABSI. Chaque hôpital était libre ensuite de développer dans son institution d’autres actions pour la prévention des CLABSI.
Période de l’audit
Le projet a été présenté en séance de la PFRHHH en février 2014 et l’audit s’est déroulé du 6 mai au 19 juillet 2014.
Elaboration de l’audit
L’objectif de l’audit était de réaliser une «photo instantanée» de la gestion des voies centrales durant la période «post-insertion» du cathéter. Il devait être réalisé un jour donné (pour l’entièreté d’une unité de soins) parmi les unités éligibles de l’institution. Pour la récolte des données administratives, le protocole de l’audit s’est inspiré du «Point Prevalence Survey of Healthcare Associated Infections and Antimicrobial use in European Acute care Hospital». Le choix des services audités s’est porté sur les unités de soins d’un hôpital aigu, à l’exception de la dialyse, du quartier opératoire, de l’hôpital de jour et de la néonatologie. Seuls les patients porteurs d’un cathéter central (KTVC) dans ces unités étaient observés.
L’élaboration de la «check-list» des points critiques à contrôler s’est inspirée de «care bundles post insertion» et de différentes recommandations de bonnes pratiques pour la prévention des CLABSI : SHEA/IDSA Practice Recommendations (7), Institute for Healthcare Improvement Central line bundle (14), les IDSA guidelines (4) et les recommandations de la SFHH (15).
Les points principaux suivants étaient contrôlés: gestion du pansement du KTVC (aspect, date du changement), gestion des tubulures/robinets, hygiène des mains lors de la manipulation du KTVC (optionnel) et type de désinfectant utilisé (optionnel). Quelques informations supplémentaires concernant le cathéter étaient également enregistrées : lieu de son insertion, site anatomique de pose, indication du maintien en place, type de KTVC et âge du KTVC.
Chaque institution a reçu 2 formulaires : le premier concernait la récolte des données administratives et le second la liste des points à observer avec quelques informations complémentaires concernant le patient. Ces formulaires ont été encodés pour l’analyse individuelle et globale des données. Tous ces résultats ont été transmis aux hôpitaux participants pour qu’ils puissent réaliser un feedback à leurs équipes soignantes.
7 hôpitaux de la PFRHHH (pour 8 sites) ont réalisé l’audit, soit une participation de 7/18 (38%).
Le tableau 1 reprend les données anonymisées de chacune des institutions et le nombre d’observations de KTVC.
Tableau 1 : Données administratives des hôpitaux et nombre de KTVC observés lors de l’audit
Le tableau 2 reprend la répartition des observations, en fonction des unités de soins.
Le tableau 3 détaille le lieu d’insertion du KTVC et le tableau 4 le site anatomique de pose du KTVC. Au moment de l’observation, les KTVC étaient présents en moyenne depuis 8,1 jours (médiane de 5 jours).
Tableau 2 : Répartition du nombre de KTVC en fonction des unités de soins
Tableau 3 : Lieu d’insertion du KTVC
Tableau 4 : Site anatomique de pose du KTVC
Le nombre de voies du KTVC se répartissait comme suit : 21% de mono-voies, 40% de deux voies et 34% de trois voies. Quand plusieurs voies étaient présentes, 28% d’entre elles n’étaient pas perfusées.
Une nutrition parentérale coulait sur 29/116 (25%) des KTVC. 73% des KTVC étaient utilisés pour perfuser des médications et/ou antibiotiques et 6% n’avaient que pour but une hydratation du patient.
Les pansements présents étaient majoritairement transparents (96/116, 83%), parmi ceux-ci 10% comportaient une compresse. 7% des pansements étaient « non-tissés »
stériles. Le tableau 5 synthétise les caractéristiques du pansement du KTVC.
Tableau 5 : Aspect du pansement des KTVC observés
L’aspect des lignes veineuses est repris dans le tableau 6.
Tableau 6 : Aspect des lignes veineuses des KTVC observés
Les désinfectants utilisés (donnée optionnelle, 44 réponses) étaient majoritairement le digluconate de chlorhexidine 0,5% (52% des cas), suivi de la chlorhexidine 2% (27%). L’usage de polyvidone iodée alcoolique (PVPI) était de 16% pour la concentration de 1,5% et de 5% pour la concentration de 1%.
Le dernier point à observer de façon optionnelle était l’hygiène des mains lors de la manipulation du cathéter, aussi bien pour la réfection du pansement que pour la réalisation d’une injection. Cet item n’était donc pas toujours observable au moment de l’observation. Cette donnée n’a donc été enregistrée que pour 30 KTVC (26%) et l’analyse n’en a dès lors pas été faite.
Discussion
La majorité des KTVC présents dans nos unités de soins se trouvent à l’USI (42%) et sont fréquemment mis en place dans ces mêmes unités (39,7%). Ces chiffres sont conformes à ceux publiés dans la littérature (1). Ils confirment l’importance d’implémenter des stratégies de type care bundles et/ou approche multidimensionnelle prioritairement dans ces unités de soins. Une approche de type «care bundle d’insertion du KTVC» pourrait également être implémentée en salle d’opérations, vu le nombre important de KTVC placés au quartier opératoire (51,7%).
Les unités médicales (hors gériatrie) comptabilisent 24% des KTVC de nos institutions. Des audits de pratiques accompagnés de formation à la bonne gestion des KTVC pourraient également être mis en place dans ces unités.
Pour ce qui est du site anatomique de pose du KTVC, le site jugulaire est préféré en dépit du fait que celui-ci est associé à un nombre plus élevé de CLABSI que le site sous-clavier (1, CDC category IB). Des considérations traumatiques (pneumothorax) entrent probablement en ligne de compte pour expliquer cette préférence. Le message que la voie fémorale doit être au maximum évitée (CDC Category IA) est par contre bien intégré, ce site anatomique est choisi dans seulement 7% des cas.
Concernant le nombre de voies, élément également associé à un nombre plus élevé de CLABSI, le KTVC trois voies est encore très fréquemment utilisé, avec l’observation que toutes ces voies n’étaient pas perfusées au moment de l’audit. Le message d’utiliser le KTVC qui présente le moins de voies devra également être réitéré (CDC Category IB, 7).
La durée médiane du cathéter au moment de l’observation était de 5 jours. Cette donnée ne représentait pas la durée finale de maintien du KTVC. Il est impossible de conclure quand au fait que la réévaluation quotidienne de la nécessité du KTVC était bien faite, ce point constituant un des facteurs les plus importants dans la prévention des CLABSI (7, CDC Category IA).
Le pansement transparent était majoritairement utilisé, comme préconisé dans les recommandations (CDC Category IA), mais seulement 78% de ceux-ci permettaient de visualiser le site d’insertion du KTVC. La propreté du pansement doit également être améliorée, 82% seulement donnaient satisfaction. La fréquence élevée (36%) de régulateur de débit interpelle, car elle allonge inutilement la longueur des tubulures. Or il est recommandé de minimiser au maximum tout contact avec une porte d’entrée microbienne et la présence de ce régulateur augmente le risque d’un contact avec le sol (15). Pour limiter le risque de contamination, la manipulation des cathéters, tubulures et robinets doit être réalisée aseptiquement après leur désinfection à l’aide d’une solution alcoolique (CDC Category IA). Cette donnée, qui était optionnelle dans l’audit, montrait le bon respect de cette recommandation.
L’observation de la compliance à l’hygiène des mains, reprise dans de nombreux «bundles», était restée optionnelle car pas toujours réalisable lors de la présence de l’auditeur. Cet item est par ailleurs contrôlé lors des campagnes nationales « Hygiène des mains ». Il constitue toutefois un élément clé dans la prévention des CLABSI (CDC Category IB).
L’audit de bonnes pratiques de la gestion des KTVC a permis d’identifier, au sein des hôpitaux de la PFRHHH, certaines faiblesses dans la gestion des KTVC.
Sans surprise, l’USI est un endroit central dans la prévention des CLABSI. Le quartier opératoire a également été identifié comme un endroit où une surveillance étroite de la mise en place des KTVC pourrait être réalisée.
Concernant les unités de soins, les points faibles sont notamment la propreté du pansement, l’absence de visualisation du site d’insertion du KTVC et l’utilisation fréquente –et probablement peu utile -de régulateur de débit.
Plusieurs EOH ont réalisé un feedback des résultats afin de re-sensibiliser les équipes soignantes à la bonne gestion du cathéter central pour la prévention des CLABSI.
Chaque hôpital adaptera par la suite sa stratégie en fonction des ressources humaines dont il dispose et des priorités qu’il aura identifiées dans la prévention des CLABSI, tout en gardant à l’esprit qu’il est primordial de réévaluer quotidiennement l’indication du maintien du KTVC et d’en diminuer au maximum les manipulations.
1. Sacks GD, Diggs BS, Hadjizacharia P, Green D, Salim A, Malinoski DJ. Reducing the rate of catheter-associated bloodstream infections in a surgical intensive care unit using the Institute for Healthcare Improvement central line bundle. Am J Surg. 2014 Jun;207(6):817–23.
2. Blot K, Bergs J, Vogelaers D, Blot S, Vandijck D. Prevention of central line-associated bloodstream infections through quality improvement interventions: a systematic review and meta-analysis. Clin Infect Dis Off Publ Infect Dis Soc Am. 2014 Jul 1;59(1):96–105.
3. Herzer KR, Niessen L, Constenla DO, Ward WJ, Pronovost PJ. Cost-effectiveness of a quality improvement programme to reduce central line-associated bloodstream infections in intensive care units in the USA. BMJ Open. 2014 Sep 25;4(9):e006065–e006065.
4. O’Grady NP, Alexander M, Burns LA, Dellinger EP, Garland J, Heard SO, et al. Guidelines for the Prevention of Intravascular Catheter-related Infections. Clin Infect Dis. 2011 May 1;52(9):e162–93.
5. Rapport préliminaire Surveillance SEP 2014, ISP-WIV, Naima Hammami : en cours.
6. McPeake J, Cantwell S, Malcolm G B, Malcolm D. Central line insertion bundle: experiences and challenges in an adult ICU. Nurs Crit Care. 2012 May;17(3):123–9.
7. Marschall J, Mermel LA, Fakih M, Hadaway L, Kallen A, O’Grady NP, et al. Strategies to prevent central line-associated bloodstream infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014 Sep;35 Suppl 2:S89–107.
8. Pronovost P, Needham D, Berenholtz S, Sinopoli D, Chu H, Cosgrove S, et al. An intervention to decrease catheter-related bloodstream infections in the ICU. N Engl J Med. 2006 Dec 28;355(26):2725–32.
9. Tang H-J, Lin H-L, Lin Y-H, Leung P-O, Chuang Y-C, Lai C-C. The impact of central line insertion bundle on central line-associated bloodstream infection. BMC Infect Dis. 2014;14(1):356.
10. Guerin K, Wagner J, Rains K, Bessesen M. Reduction in central line-associated bloodstream infections by implementation of a postinsertion care bundle. Am J Infect Control. 2010 Aug;38(6):430–3.
11. Cherifi S, Gerard M, Arias S, Byl B. A multicenter quasi-experimental study: impact of a central line infection control program using auditing and performance feedback in five Belgian intensive care units. Antimicrob Resist Infect Control. 2013;2(1):33.
12. Weeks KR, Hsu Y-J, Yang T, Sawyer M, Marsteller JA. Influence of a multifaceted intervention on central line days in intensive care units: Results of a national multisite study. Am J Infect Control. 2014 Oct;42(10):S197–202.
13. Thom KA, Li S, Custer M, Preas MA, Rew CD, Cafeo C, et al. Successful implementation of a unit-based quality nurse to reduce central line-associated bloodstream infections. Am J Infect Control. 2014 Feb;42(2):139–43.
14. How-to Guide: Prevent Central Line- Updated March 2012 Associated Bloodstream Infections (CLABSI), Institute for Healthcare Improvement.
SFHH: Surveiller et prévenir les infections associées aux soins, Hygiènes, Vol. XVIII – n°4, sep.2010, p121-127.


L’enquête de prévalence menée en Europe en 2013 a identifié Clostridium difficile comme le huitième pathogène le plus fréquent dans les infections associées aux soins en Belgique (4.2% de toutes les infections).1 Cette bactérie provoque une colite pseudomembraneuse et la diarrhée est le symptôme principal. Les complications possibles comprennent déshydratation, déséquilibre électrolytique avec choc, mégacôlon toxique et perforation digestive.
L’augmentation de l’incidence et de la sévérité des infections à Clostridum difficile (CDI) observée dans plusieurs pays pendant la dernière décade a été associée à l’émergence d’une souche hypervirulente, le ribotype 027, tout d’abord aux Etats-Unis et au Canada, en Europe par la suite.2,3 Dans certains pays d’Europe, notamment en Allemagne, Hongrie, Pologne et Roumanie, la prévalence du ribotype 027 reste élevée et est peut-être en augmentation.4 Cependant une baisse de prévalence du ribotype 027 a été rapportée en Belgique5 et au Royaume-Uni.6 Les CDI dues au ribotype 078 ont augmenté au Royaume-Uni, en Belgique et aux Pays-Bas; ce ribotype est associé à un taux de complications élevé en comparaison avec d’ autres ribotypes, et touche les personnes moins âgées.6-8 Il est intéressant de noter que ce ribotype 078 est fréquemment retrouvé chez les cochons et les veaux.9
Le programme national obligatoire de surveillance des CDI dans les hôpitaux belges a été institué en 2007. Le protocole de surveillance est disponible sur le site web de l’Institut Scientifique de Santé Publique WIV-ISP.10
En bref, la surveillance des CDI comprend un volet épidémiologique et un volet microbiologique. Chaque épisode survenant pendant la période de surveillance (minimum 6 mois par an) fait l’objet d’un enregistrement en ligne dans le système NSIHweb1. Les souches isolées des 5 premiers cas de chaque semestre doivent être envoyées au laboratoire du Centre National de Référence (CNR) afin d’y être enregistrées et ribotypées.
Les résultats complets sont présentés dans le rapport annuel.11-13
Le tableau 1 montre le nombre d’hôpitaux ayant participé à la surveillance des CDI et les caractéristiques des cas. En 2013, le nombre maximum d’épisodes rapporté par un hôpital pour un semestre a été de 83; Trois quarts des hôpitaux ont rapporté moins de 16 épisodes et 50% ont rapporté moins de 8 épisodes par semestre.

1 73% non-récurrent, 18% inconnu
2 Définition d’un épisode acquis à l’hôpital déclarant : début de la diarrhée deux jours ou plus après l’admission à l’hôpital déclarant
3 Pas de séjour dans une institution de soins dans les 12 semaines précédant le début de l’épisode et début de diarrhée moins de 2 jours après l’admission
4 Séjour dans cet hôpital ou autre institution dans les 4 semaines précédant le début de l’épisode et début de l’épisode moins de 2 jours après l’admission dans l’hôpital déclarant
Pour les cas acquis à l’hôpital déclarant, la majorité des infections surviennent en gériatrie (37% en 2013), médicine-interne (8%), soins intensifs (7%), onco-hématologie (7%) et gastro-entérologie (6%). Les cas acquis à l’hôpital déclarant étaient plus âgés que les autres (médiane 80 ans, versus 74 ans respectivement).
La proportion des épisodes récurrents (9%) est restée stable au cours du temps. Cette proportion ne doit pas être confondue avec le taux de rechute parmi les cas (données non disponibles dans notre système de surveillance).
En 2013, l’incidence moyenne des CDI acquises à l’hôpital déclarant était de 0.96 / 1000 admissions (0.89 en 2012). A titre de comparaison, l’incidence moyenne des infections nosocomiales à MRSA (échantillons cliniques) était de 1.1/1000 admissions dans les hôpitaux aigus en Belgique en 2012.14
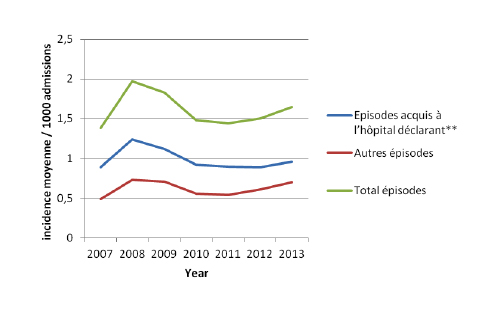
Seuls les hôpitaux ayant fourni des données complètes pour l’année entière sont inclus
* Incidence moyenne: total des épisodes/total des dénominateurs
** début de la diarrhée 2 jours ou plus après admission à l’hôpital déclarant
Avant 2008, il n’était pas possible de faire la différence entre « pas de cas » et pas de « rapportage » pour un hôpital. Donc pour l’année 2007, les données d’incidence sont donc sous-estimées (puisque certains des hôpitaux, n’ayant pas rapporté, ont été considérés comme n’ayant rapporté aucun cas).
La Figure 1 montre une augmentation de l’incidence durant les trois dernières années. Les taux d’incidences des CDI acquis à l’hôpital déclarant ainsi que des autres CDI, sont en 2013 à leur niveau le plus élevé depuis 2009. Il existe une grande variation des incidences entre hôpitaux (non montré) et entre régions (voir Tableau 2).
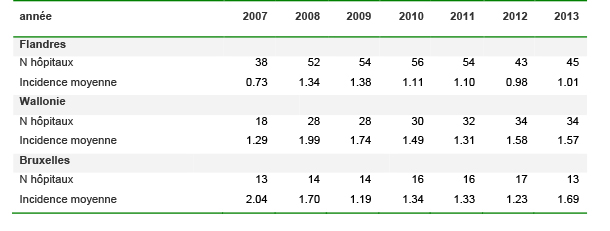
Seuls les hôpitaux ayant fourni des données complètes pour l’année entière sont inclus.
Hôpitaux aigus: définis sur base d’une durée moyenne de séjour <14 jours. Incidence moyenne : total épisodes/total dénominateurs
Le taux de complications rapportées a diminué depuis 2007 ; le taux de décès est stable depuis 2010 (voir Tableau 3).
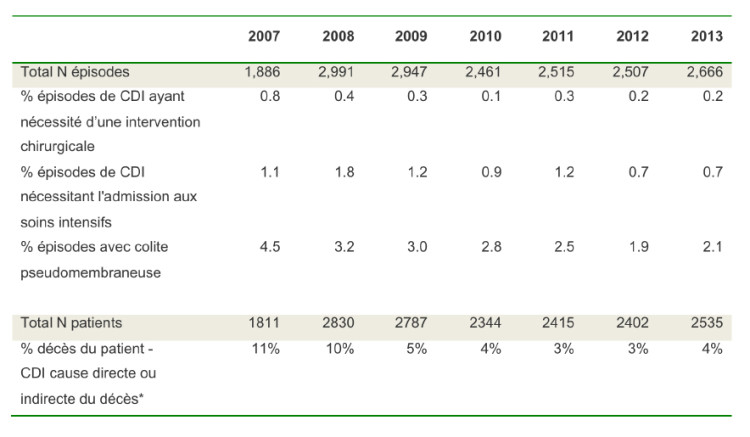
*décès dans les 30 jours après le diagnostique
En 2013, le typage de 585 souches de Clostridium difficile provenant de 103 hôpitaux différents a identifié 133 ribotypes différents, dont 72 n’ont été isolés qu’une seule fois, et 60 n’avaient jamais été isolés en Belgique auparavant. Les ribotypes les plus fréquemment isolés étaient les ribotypes 014 (8% du total des souches typées) et 020 (7%).
Le ribotype hypervirulent 027 représentait 19% du total des souches typées en 2009 (le ribotype le plus fréquemment isolé) mais seulement 4% en 2013. Par contre, plusieurs ribotypes émergent de façon remarquable : le ribotype 078 a émergé en 2010 mais est de nouveau en diminution depuis 2011 ; le ribotype 070, trouvé dans 10 hôpitaux en 2012 ( 1.5% du total des souches typées) était trouvé dans 24 hôpitaux (5% des souches) en 2013.
Les données de surveillance montrent une augmentation de l’incidence des CDI ces dernières années. L’incidence en 2013 était la plus élevée depuis 2009. Par contre, les taux de complications et de décès ont beaucoup diminué durant la même période. L’utilisation de plus en plus fréquente de méthodes moléculaires pour la détection des gènes des toxines dans les selles, dont la sensibilité est significativement augmentée par rapport aux méthodes immunologiques, pourrait expliquer partiellement cette augmentation d’incidence mais cela reste à démontrer.
En plus, cette augmentation au niveau national cache de grandes disparités entre hôpitaux et entre régions, ce qui indique que le potentiel de prévention reste élevé.
Les données démontrent également la grande diversité des souches réparties dans tout le pays. Ceci illustre la multiplicité des sources de transmission.
Il est maintenant possible de lier les données du WIV-ISP avec les données du NRC, ce qui permettra dans un futur proche d’étudier les différents ribotypes en relation avec leurs caractéristiques épidémiologiques.
Les infections à Clostridium difficile font l’objet d’un intérêt accru au niveau européen. Le centre européen pour le contrôle des maladies transmissible (ECDC) a récemment inclus les CDI dans la liste des maladies devant faire l’objet d’une surveillance prioritaire, et des recommandations européennes en matière de surveillance sont en cours d’élaboration. 15
La Belgique dispose d’un des meilleurs systèmes de surveillance en Europe en ce qui concerne les CDI – une couverture géographique incluant la quasi-totalité des hôpitaux aigus, un laboratoire de référence, un enregistrement par épisode, et la possibilité de lier données épidémiologiques et microbiologiques par cas. La mise à jour des recommandations en matière de prévention, diagnostic et traitement, 16 devrait commencer en 2015.
La participation à la surveillance des WIV-ISP ne sera plus obligatoire dans le courant de 2015. L’obligation de participer s’appliquera – au choix – à au moins un des quatre programmes de surveillance suivants :
Nous espérons qu’en dépit du changement de loi, la Belgique sera en mesure de continuer à suivre les tendances en matière d’incidence des CDI, et à fournir à chaque hôpital un outil permettant le suivi de l’incidence au niveau local dans un objectif d’amélioration continue. Nous espérons continuer à améliorer la collaboration entre cliniciens, hygiénistes, microbiologistes dans la foulée des excellents résultats obtenus en matière de surveillance des CDI depuis son début en 2007.
(1) Wilcox M. C. difficile Infection: EUCLID Study Reveals >39K Cases May Be Missed Yearly. presented in Barcelona 2014.
(2) Kuijper EJ, Coignard B, Brazier JS, Suetens C, Drudy D, Wiuff C, et al. Update of Clostridium difficile-associated disease due to PCR ribotype 027 in Europe. Euro Surveill 2007 Jun;12(6):E1-E2.PM:17991399
(3) Warny M, Pepin J, Fang A, Killgore G, Thompson A, Brazier J, et al. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005 Sep 24;366(9491):1079-84.PM:16182895
(4) Davies KA. Increased diversity of C. difficile PCR-ribotypes across European countries and disparity of 027 prevalence; results of a European prevalence study of Clostridium difficile infection (EUCLID). 2014.
(5) Viseur N, Lambert M. Epidemiologie des infections à Clostridium difficile en Belgique: Rapport 2012. Institute Scientifique de Santé Publique (WIV-ISP), Bruxelles; 2012. https://www.wiv-isp.be/nsih/surv_cdif/results_fr.asp
(6) Public Health England. Clostridium difficile Ribotyping Network (CDRN) for England and Northern Ireland. 2014 Jan. Report No.: PHE publications gateway number: 2013396. http://www.hpa.org.uk/webc/HPAwebFile/HPAweb_C/1317140658750
(7) Leiden University Medical Center DoMM, Center for Infectious Diseases Control (CIb) RB. Seventh Annual Report of the National Reference Laboratory for Clostridium difficile and results of the national surveillance May 2012 to May 2013. http://www.rivm.nl/dsresource?objectid=rivmp:211067&type=org&disposition=inline&ns_nc=1
(8) Walker AS, Eyre DW, Wyllie DH, Dingle KE, Griffiths D, Shine B, et al. Relationship between bacterial strain type, host biomarkers, and mortality in Clostridium difficile infection. Clin Infect Dis 2013 Jun;56(11):1589-600.PM:23463640
(9) Jones AM, Kuijper EJ, Wilcox MH. Clostridium difficile: a European perspective. J Infect 2013 Feb;66(2):115-28.PM:23103666
(10) Wetenschappelijk Instituut Volksgezondheid B, Insitute Scientifique de Santé Publique B. Surveillance nationale des infections à Clostridium difficile dans les hôpitaux – Protocole de Surveillance V5 ; Nationale surveillance van Clostridium difficile-infecties in de ziekenhuizen Surveillanceprotocol v5. http://www nsih be/surv_cdif/download_fr asp; http://www nsih be/surv_cdif/download_nl asp Last update 2014 October
(11) Neely FN, Lambert M, Catry B. Epidémiologie des infections à Clostridium difficile en Belgique: Rapport 2014. Insitut Scientifique de la Santé Publique; 2014 Jul. Report No.: PHS-2014-024 .http://www.nsih.be/surv_cdif/results_fr.asp
(12) Neely FN, Lambert M, Catry B. Epidemiologie van Clostridium difficile infecties in België: Rapport 2014. Brussel: Wetenschappelijk Instituut voor Volksgezondheid; 2014 Jul. Report No.: PHS-2014 – 25 .http://www.nsih.be/download/CDIF/CDIF-AR-2014-NL.pdf
(13) Neely FN, Lambert M, Catry B. Epidemiology of Clostridium difficile infection in Belgium: Report 2014. Brussels: Scientific Institute of Public Health; 2014 Jul. Report No.: PHS-2014-023 .http://www.nsih.be/download/CDIF/CDIF-AR-2014-EN.pdf
(14) Jans B, Glupczynski Y, Denis O. Surveillance des bactéries résistantes aux antibiotiques dans les hôpitaux belges: rapport annuel 2012. Brussels: Scientific Institute of Public Health (WIV-ISP); 2013 Dec 1. http://www.nsih.be/surv_mrsa/download_fr.asp
(15) ESCMID Study Group for Clostridium difficile. Work package 4: To develop a European enhanced CDI surveillance protocol with case-based epidemiological data and microbiological data for typing and susceptibility testing linked at the national level. http://www ecdisnet eu/index php/wp4 2014 [cited 2014 Nov 19]
(16) Conseil Supérieur de la Santé, Belgian Infection Control Society, Institut Scientifique de Santé Publique. Recommandations belges pour le contrôle et la prévention des infections à Clostridium difficile dans les hôpitaux aigus et dans les maisons de repos et de soins. 2008 May. Report No: 8365. http://www.gezondheid.belgie.be/internet2Prd/groups/public/@public/@shc/documents/ie2divers/14112500_fr.pdf