La stérilité des instruments ayant été manipulés à mains nues n’est plus garantie en dépit d’une stérilisation validée
Résumé
Nous allons nous baser sur les « Recommandations en matière de stérilisation, CSH n°7848 »1 pour la stérilisation. Dans ce cas, la stérilité des instruments à l’issue d’un nettoyage validé, à savoir une désinfection thermique de haut niveau (valeur Ao2 de minimum 3000) et une stérilisation, ne peut être garantie lorsque l’empaquetage des instruments s’est effectué à mains nues. Des preuves sont apportées dans le présent document à l’aide d’un système formel et logique. Si nous voulons conférer une garantie de stérilité aux instruments stérilisés, nous devrons adapter notre processus ou notre point de vue.
Introduction – le point de départ : les « Recommandations en matière de stérilisation, Conseil supérieur de l’hygiène (CSH) »
Extraits CSH n° 7848: [1]
« Stérilisation : mise en œuvre d’un processus visant à rendre stérile la charge introduite dans un stérilisateur (EN 285-8). Ce processus s’inscrit lui-même dans une suite de processus qui concourent à détruire ou à éliminer tous les micro-organismes vivants de quelque nature et sous quelque forme que ce soit, portés par des objets parfaitement nettoyés. (définitions) »…
« La stérilisation fait partie des procédés spéciaux dont les résultats, et plus particulièrement la stérilité du matériel traité, ne peuvent être certifiés par un contrôle du produit fini.
La maîtrise du processus de stérilisation est la base même du résultat que le patient est en droit d’attendre. Cette maîtrise passe par le contrôle du processus de stérilisation conjugué à un nombre important d’actions de contrôles en amont et en aval de la stérilisation proprement dite. La biocharge doit être maintenue aussi basse que possible.
Une maîtrise efficace de la biocharge ne peut être obtenue que par des méthodes de nettoyage et de désinfection préalablement validées mais aussi par une maîtrise de l’environnement (locaux, air ambiant, personnel…) »…
« Un nettoyage et/ou une désinfection insuffisants peuvent offrir aux germes une protection contre l’agent de stérilisation et entraîner des contaminations chez les patients. »…
« Pour le matériel médical critique, la valeur de A0 (niveau de désinfection)² doit être d’au moins 3.000. »
« Les normes ont été établies pour des charges à stériliser dont la contamination initiale est bien maîtrisée. A lui seul, un paramètre correct ne peut garantir la stérilité d’une charge. Par contre, à lui seul, un paramètre incorrect met en évidence une défaillance ; la charge ne peut être libérée. »
Le pharmacien hospitalier a notamment pour mission de contrôler les différentes étapes précédant la stérilisation : nettoyage, désinfection, emballage du matériel à stériliser.
Lors de l’établissement de recommandations concernant les techniques de stérilisation, il convient de tenir compte du respect des mesures de précaution requises pour réduire la charge microbienne (biocharge).
Les exigences en matière de stérilisation peuvent se résumer comme suit :
- Processus validés pour le nettoyage, la désinfection et la stérilisation ;
- Elimination de tous les micro-organismes vivants de quelque nature et sous quelque forme que ce soit ;
- Objets parfaitement nettoyés ;
- Une valeur Ao (niveau de désinfection) de minimum 3000 ;
- La biocharge doit être maintenue aussi basse que possible ;
- Garantie de la stérilité par contrôle du processus.
Contexte
Surfaces normales
« Tous les matériaux de parachèvement et les surfaces de travail sont lisses et lavables (CSH n° 7848). »
L’on oublie ou occulte souvent que la zone « propre » du CS (Centre de stérilisation)[2] où il est procédé au contrôle des instruments, à leur emballage et à leur stérilisation constitue la zone la plus critique du CS. Dans cette zone, les instruments « parfaitement » nettoyés et ayant fait l’objet d’une désinfection de « haut niveau » (et ce contrairement à la zone « stérile » où les instruments sont stockés en attendant d’être utilisés) ne sont pas protégés contre des contaminations organiques ni contre des transmissions de composants microbiens (microbiota).
Dans le manuel intitulé « Ziekenhuishygiëne »3 (hygiène hospitalière), on apprend dans le chapitre « Microbiologisch onderzoek van oppervlakken » (Examen microbiologique des surfaces) que « pour être validées, les surfaces normales ne peuvent comporter plus de 5 colonies par plaque (25 cm2). »
La zone d’empaquetage d’un CS est donc une zone propre. La contamination microbienne de tous les matériaux de finition et surfaces de travail doit être minime (< 5 unités formant une colonie (UFC)/25 cm²). Ces surfaces n’ont pas de microbiota commensaux propres (flore). La biocharge éventuellement présente sur ces surfaces doit toujours être considérée comme une contamination.
Les mains et l’hygiène des mains
Chaque surface de chaque organisme pluricellulaire complexe entrant en contact avec l’environnement extérieur développe des microbiota commensaux propres, comme c’est le cas sur la peau de nos mains. A la suite du contact avec des matières vivantes et non vivantes, la peau absorbe également des micro-organismes transitoires et transmet des microbiota commensaux mais aussi transitoires.
De la même manière, nous transmettons des substances organiques et inorganiques par le contact. Ces échanges sont très intenses. Ils permettent à certaines races d’animaux de dépister des individus.
Les recommandations de l’OMS (« Recommandations OMS pour l’hygiène des mains au cours des soins)4 stipulent que (traduction) : « La peau humaine normale est colonisée par des bactéries. Le nombre total de bactéries aérobies varie de plus de 1 x 106 UFC/cm2 sur le front, 5 x 104 UFC/cm2 sur l’abdomen à 1 x 104 KVE/cm2 (KVE/cm² ou UFC/cm2)sur l’avant-bras. Le nombre total de bactéries sur les mains des professionnels de la santé oscille entre 3,9 x 104 et 4,6 x 106 UFC/cm2. Lors de l’utilisation de la méthode « Fingertip press », la contamination oscille entre 0 et 300 UFC ».
Dans une autre référence, Pessoa-Silva C.L. et al.5 démontrent à l’aide de la méthode « Fingertip press » que 360 des 398 cultures prélevées auprès de professionnels de la santé se sont avérées positives aux bactéries.
Lucet J.C., et al.6 démontrent quant à eux ce qui suit à l’aide de la méthode « Fingertip press » : sur un total de 516 cultures (258 avant l’hygiène des mains (HM) et 258 après HM), 383 se sont révélées positives. Dans ce cadre, il est crucial de noter que le nombre d’UFC avant HM ne présente PAS de divergence notable.
Hoffman P.N., et al.7 démontrent à l’aide de la méthode « Swab » qu’un swab (tampon à prélèvements) réalisé sur la peau sous une bague contient en moyenne 1600 UFC/swab et qu’un swab de la peau sur un lieu de contrôle dénombre en moyenne 180 UFC/swab. Salisbury DM, et al. 8 démontrent à l’aide d’une méthode « timed-friction rinse » que sur 915 échantillons de mains sans bague et avant leur nettoyage, on obtient en moyenne 3303 UFC et que sur 245 échantillons de mains sans bague et après leur nettoyage, on obtient en moyenne 1775 UFC.
Annette Schuermans, et al.9 démontrent à l’aide de la méthode « Fingertip press » que 51,8 % des 1643 personnes examinées dénombraient plus de 50 UFC sur les 5 empreintes digitales de leur main dominante avant l’exécution d’un acte pour lequel les mains sont supposées avoir été récemment lavées ou désinfectées.
En juin 2013, la Vlaams Agentschap Zorg en Gezondheid (Agence flamande soins et santé) a évalué l’hygiène des mains au sein de l’AZ Nikolaas. A cet effet, des tampons à prélèvements (swabs) ont été utilisés entre les doigts des collaborateurs. Les valeurs cibles de ces types de prélèvement ne sont pas mentionnées dans les ouvrages, mais la limite a été fixée à 500 UFC/swab en concertation avec le WIV-ISP (Dr Nadine Botteldoorn).
En guise de premier petit échantillonnage, l’auteur a, en mars 2014, à l’aide de la méthode « Fingertip press », étudié au hasard les doigts de la main dominante de 13 collaborateurs du CS en zone « propre ». Cinq boîtes (38 %) dénombraient des UFC supérieures à 100. Sept (54 %) en dénombraient plus de 50 (à comparer à l’étude susmentionnée du Prof. A. Schuermans9).
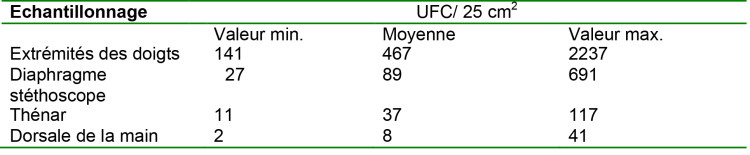
Toujours en mars 2014 est paru « Contamination of Stethoscopes and Physicians’ Hands After a Physical Examination »10. Le tableau suivant indique les résultats de la contamination bactérienne (exprimée en UFC/25 cm²) provoquée par un contact cutané avec des objets stériles : stéthoscope stérile, gants stériles (comparable au contact manuel avec des instruments stériles).
Tableau 1. Contamination des mains et du stéthoscope des médecins après un examen médical (Yves Longtin, et al., 2014 11)
UFC : unités formant colonies ; Min: minimum; Max: maximum.
Il convient également de tenir compte du fait qu’il a été démontré que l’observance pour l’hygiène des mains était trop faible, que l’exécution technique de l’hygiène des mains était souvent incorrecte et qu’il y avait une relation linéaire entre la transmission bactérienne et le niveau de contamination des mains11.
En résumé, on peut avancer que la biocharge de nos mains est élevée (surtout en rapport avec des surfaces normales propres) et que le contact avec les mains donne lieu à une importante transmission de bactéries (UFC). Le contact avec les mains conduit également à la transmission de substances organiques et inorganiques (lipides, particules cutanées, métaux, sels, etc.). En d’autres termes, le contact avec les mains accroît la biocharge et pollue.
Un nettoyage et/ou une désinfection insuffisants peuvent offrir aux germes une protection contre l’agent de stérilisation et entraîner des contaminations chez les patients. (CSH n° 7848).
Les instruments
Les instruments utilisés en chirurgie propre sont en principe exempts de bactéries.
A l’issue d’un nettoyage validé et d’une désinfection thermique de haut niveau validée (valeur Ao ≥ 3000, en pratique souvent 6000 12-13), l’instrument est en principe parfaitement propre et exempt de germes. Si, à l’issue du nettoyage et de la désinfection adéquats, il est procédé au contrôle et à l’emballage des instruments à mains nues, la pollution des instruments augmente et la biocharge n’est plus aussi faible que possible. La biocharge de gants jetables propres (surfaces normales) est en principe très réduite (surtout en comparaison à la biocharge de nos mains) et comparable à celle du matériau d’emballage.
Matériau et méthode
Littérature scientifique et syllogistique14-20, le système formel logique d’Aristote.
Hypothèse
Après manipulation à mains nues, la stérilité des instruments à l’issue d’une stérilisation validée ne peut plus être garantie. Pour les variables scientifiques, veuillez voir ci-dessus.
La preuve logique
Une preuve est un raisonnement valable aux prémisses vraies. Un raisonnement n’est valable que si les prémisses sont vraies. La conclusion est alors vraie également (Aristote).
Major (Aam) : après stérilisation validée, des instruments garantis stériles (a) sont des instruments parfaitement propres affichant une biocharge aussi basse que possible (m) -> point de départ, CSH n° 7848.
Minor (Ebm) : après manipulation à mains nues, les instruments (b) ne sont pas des instruments parfaitement propres affichant une biocharge aussi basse que possible (m) -> littérature scientifique, preuves (voir ci-dessus).
Conclusion (Eba) : après manipulation à mains nues, les instruments (b) ne sont pas des instruments garantis stériles après stérilisation validée (a)
(Aam
Ebm
Eba -> est un Camestres, un syllogisme valide de la 2e figure avec AEE, qui devait être prouvé.)
Conclusion
Si nous voulons conserver les « Recommandations pour stérilisation » du Conseil supérieur de l’hygiène (CSH n° 7848) et offrir une garantie de stérilité, le port de gants lors du contrôle et de l’emballage (donc à l’issue du nettoyage et de la désinfection validés) en constitue la suite logique (un discours tel que, certaines choses étant posées, quelque autre chose en résulte nécessairement par cela seul que les premières sont posées (Aristote)).
Discussion
Avec le temps, nos possibilités techniques en matière de prévention et de contrôle des infections dans le secteur des soins sont également de plus en plus nombreuses. En comparaison au nettoyage et à la désinfection manuels, l’utilisation de méthodes de nettoyage et de désinfection validées constitue un avancement qualitatif majeur. La plus-value de ces processus partiels ne peut s’éroder dans la suite du processus, au risque de voir la facture s’alourdir à la fin du processus. La plus-value du nettoyage et de la désinfection validés est liée à l’utilisation de gants pendant la phase d’emballage. Nos capacités cognitives évoluent souvent moins rapidement que nos capacités techniques, et nous ne tenons pas assez compte de nos microbiota commensaux. L’on considère trop souvent l’homme comme un être complexe et à part entière et oublie qu’il coexiste avec une multitude de micro-organismes. L’homme est le fruit de l’évolution de la planète terre.
Annexe 1
« A » est défini comme le temps nécessaire, exprimé en secondes, à une température de 80°C, pour atteindre un certain effet désinfectant.
Lorsque la température est de 80°C et que la valeur Z est équivalente à 10, le terme « A0 » est utilisé.
1 unité Ao = 1 seconde à 80°C.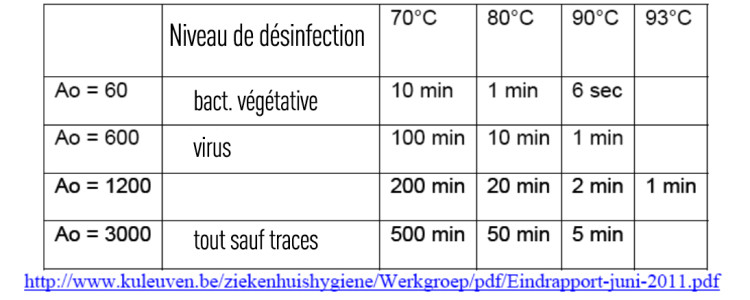
Annexe 2
La syllogistique est un système formel logique. La forme ou la structure du raisonnement en détermine la validité. On distingue 256 modes syllogiques. Camestres est un syllogisme valable.
Un syllogisme (raisonnement valable) se compose d’énoncés catégoriques, 2 faisant office de prémisses et 1 de conclusion. Un prédicat (a) est affirmatif ou négatif par rapport à un sujet (b). Le moyen terme (m) n’apparaît que dans les prémisses. Il existe 4 sortes d’énoncés S- P :
Aba: universel affirmatif
Iba: particulier affirmatif
Eba: universel négatif
Oba: particulier négatif.
Références
1. Conseil supérieur de l’hygiène (CSH) n° 7848, Recommandations en matière de stérilisation
2. Thermal Disinfection – The Ao Concept and the Biological Background, Urs Rosenberg, Borer Chemie AG, Switzerland
3. Reybrouck G., Schuermans A., Van de Putte M. Ziekenhuishygiëne. Acco Leuven / Leusden, uitgave 2000
4. World Health Organization Patient Safety: WHO Guidelines on Hand Hygiene in Health Care: First Global Patient Safety Challenge, Clean Care is Safer Care. Geneva Switzerland: World Health Organization; 2009
5. Pessoa-Silva C.L. et al.: Dynamics of bacterial hand contamination during routine neonatal care. Infect Control Hosp Epiemiol 25:192-197, Mar. 2004
6. Lucet J.C., et al.: Hand contamination before and after different hand hygiene techniques: a randomized clinical trial. J Hosp Infect 50:276-280, Apr. 2002.
7. Hoffman P.N., et al.: Micro-organisms isolated from skin under rings worn by hospital staff. BMJ290(6463):206-207. Jan. 1985.
8. Salisbury DM, et al.: The effect of rings on microbial load of health care workers’ hands. Am J Infect Control, 1997;25:24-27
9. Schuermans, A. et al.: Sensibilisatiecampagne handhygiëne door de Regionale Werkgroep voor Ziekenhuishygiëne Vlaams-Brabant en Limburg. NOSO-info, vol. VIII nr. 4, 2004
10. Longtin, Y. et al., Contamination of Stethoscopes and Physicians’ Hands After a Physical Examination. Mayo Clin Proc. March 2014:89(3):291-299.van der Velden L.B., Nabuurs-Franssen M.H., van Leeuwen A., Isken M., Voss A.
11. Pittet D., et al Evidence-based model for hand transmission during patient care and the role of improved practices. . The Lancet Infectious Diseases 1/2006; 6(10):641-52.
12. Van der Velden L.B. et al., Thermal disinfection of bedpans: European ISO 15883-3 guideline requirements are insufficient to ensure elimination of ARE and OXA-48 outbreak-strains. Antimicrobial Resistance and Infection Control: Abstracts from the 2nd International Conference on Prevention and Infection Control (ICPIC 2013), Antimicrobial Resistance and Infection Control 2013, 2(Suppl 1):O66 doi:10.1186/2047-2994-2-S1-O66
13. Bories, Y. Bedpanspoelers, centrale vaatwassers in ziekenhuizen en woon- en zorgcentra en de verspreiding van multiresistente darmcommensalen, Yvo Bories, NOSO-info, vol. XVII nr 4, 2013
14. Van Riel G., Fundamentele wijsbegeerte, , Acco 2010
15. Cloots A., Fundamentele wijsbegeerte, , Acco 2012
16. De Pater W.A., Vergauwen R.M.A., Logica: formeel en informeel, Universitaire Pers Leuven 2005
17. Werkgroep ziekenhuishygiëne, Eindrapport-juni-2011 KULeuven
18. Wenzel R.P., Prevention and Control of Nosocomial Infections, fourth edition, Lippincott Williams & Wilkins 2007
19. Wenzel R.P. Minimizing Surgical-Site Infections. Editorial. New Engl J. Med 362;1:75-77, 2010
20. Sintubin, M. De wetenschap van de aarde – over een levende planeet, Acco 2012
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)