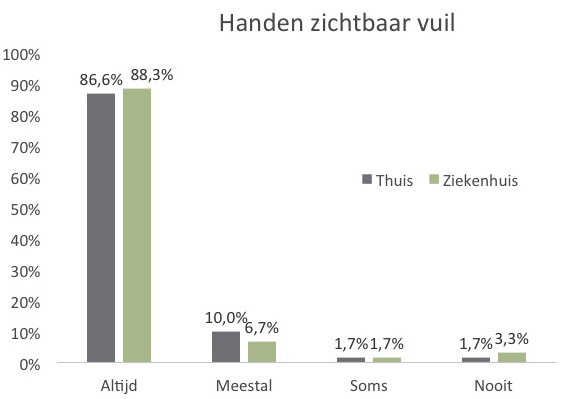
Inleiding
De enkele epidemieën die de laatste jaren in België werden geregistreerd (bof in 2013, mazelen in 2011 en 2017), hebben aangetoond dat een deel van de Belgische jongvolwassenen niet voldoende tegen deze twee aandoeningen beschermd is. Ze bewijzen ook het belang van vaccinatie van het zorgpersoneel dat in de eerste lijn optreedt. Terwijl het kader van de verplichte vaccinaties duidelijk gedefinieerd is en door de preventieadviseur-bedrijfsarts wordt opgevolgd, is dat van de aanbevolen vaccinaties veel minder gestructureerd. Dit artikel geeft een kort overzicht van de wettelijke verplichtingen en een reeks aanbevelingen voor goede praktijken inzake het vaccinatiebeleid in deze sector.
I. Vaccinaties op het werk: wat bepaalt de arbeidswetgeving?
Vaccinatie in de zorgverlening kadert in een globaal preventiebeleid voor besmettelijke ziekten, opgesteld door de werkgever in samenwerking met de preventieadviseur-bedrijfsarts, de dienst ziekenhuishygiëne en elke andere relevante betrokkene.
Vanuit wettelijk perspectief wordt het thema geregeld door het Koninklijk Besluit van 4 augustus 1996 betreffende de bescherming van de werknemers tegen de risico’s bij blootstelling aan biologische agentia [1] en in het bijzonder de volgende artikels:
Art VII 1-5 tot 1-8 : “De werkgever voert de risico-evaluatie uit in samenwerking met de preventieadviseur-bedrijfsarts, bepaalt de preventieve maatregelen en verzekert de voorlichting van de blootgestelde werknemers en het toezicht op hun gezondheid. Deze evaluatie moet geregeld worden herhaald en in elk geval bij elke wijziging van de arbeidsomstandigheden of wanneer blijkt dat een werknemer lijdt aan een infectie of een ziekte die het gevolg is van een dergelijke blootstelling. De elementen die tot de evaluatie hebben bijgedragen, de resultaten van de evaluatie en de algemene maatregelen die moeten worden getroffen, worden verzameld in een schriftelijk document, dat aan het advies van het Comité voor Preventie en Bescherming op het Werk (CPBW) wordt voorgelegd.”
Art VII 1-51 à 1-58 : ”Indien uit de risico-analyse blijkt dat werknemers aan biologische agentia worden of kunnen worden blootgesteld, moet de werkgever de werknemers die niet voldoende geïmmuniseerd zijn, de mogelijkheid bieden zich te laten vaccineren indien het een biologisch agens betreft waarvoor een doeltreffend vaccin beschikbaar is en moet hij ze laten vaccineren indien het een verplicht vaccin betreft (hepatitis B, tetanus, tuberculinetest). De vaccinaties worden uitgevoerd door de preventieadviseur-bedrijfsarts of, indien de werknemer het wenst, door een arts naar zijn keuze.
Daarnaast heeft de preventieadviseur-bedrijfsarts ook de verantwoordelijkheid de nodige maatregelen te treffen jegens een werknemer die aan een ernstige besmettelijke ziekte lijdt om de gezondheid van zijn collega’s te beschermen.
II. Doelstellingen van de vaccinatie van het gezondheidspersoneel
De vaccinatie van het zorgpersoneel heeft een dubbel doel :
– Ze moet de werknemers van besmettingsrisico’s vrijwaren door hen aan de hand van deze elementaire preventiemaatregel individuele bescherming te verzekeren. Dit is de preventieve rol, vereist door de arbeidswetgeving. Deze preventieve vaccinatie dient ook om de werkneemster in de vruchtbare leeftijd te beschermen tegen aandoeningen die ernstige gevolgen kunnen hebben voor de zwangere vrouw en het ongeboren kind, en kadert in die zin in de bescherming van het moederschap.
– Ze moet ook vermijden dat kwetsbare gehospitaliseerde patiënten besmet raken met een ziekte die voor hen potentieel ernstig kan zijn. Deze maatregel valt eerder onder het aspect van de collectieve bescherming door het opkrikken van de ziekenhuishygiëne.
Deze twee doelstellingen zijn uiteraard onderling verbonden en complementair.
III. Vaccinaties en tuberculinetest, verplicht in zorgomgevingen
De volgende vaccinaties zijn sinds het Koninklijk Besluit van 4 augustus 1996 [1: Art 1-64 en 1-74] verplicht :
– vaccinatie tegen hepatitis B;
– vaccinatie tegen tetanus;
– opsporing van tuberculose met de tuberculinetest.
HEPATITIS B
De vaccinatie tegen hepatitis B is verplicht voor alle werknemers (behalve administratief personeel) van de diensten waar medische onderzoeken worden uitgevoerd of medische zorg wordt verstrekt, voor de werknemers van laboratoria waar menselijke biologische producten worden gehanteerd en voor het personeel van tandartspraktijken. Behalve de vaccinatie is een controle van de immunisatie vereist, twee maanden na de eerste basisvaccinatie. Het HbsAg-niveau moet hoger zijn dan of gelijk aan 10 mUI/ml. Indien deze beschermingsgraad niet wordt bereikt, wordt supplementair een dubbele dosis van het vaccin toegediend. In geval van het uitblijven van een respons op deze dubbele rappel, zal de persoon beschouwd worden als niet-reagerend.
TETANUS
In het zorgmilieu is deze vaccinatie alleen verplicht voor het personeel van de autopsiediensten.
OPSPORING VAN TUBERCULOSE
Artikels 61 en 62 van het Koninklijk Besluit van 4 augustus 1996 bevatten specifieke bepalingen met betrekking tot tuberculose. Ze stellen in het bijzonder dat “tenzij in geval van contra-indicatie, de werknemers van risicomilieus slechts tot de vermelde functies mogen worden toegelaten of deze mogen behouden als ze zich aan een tuberculinetest onderwerpen en, indien deze een negatief resultaat oplevert, de test jaarlijks moeten herhalen”. In deze ondernemingen mogen de werknemers, op voorstel van de preventieadviseur-bedrijfsarts, gemotiveerd door een bijzondere epidemiologische situatie en na het advies van het Comité te hebben ingewonnen, alleen in hun functie blijven als ze een tuberculinetest hebben ondergaan met een positief resultaat of indien ze een medisch attest bezitten dat ze sinds drie jaar gevaccineerd zijn tegen tuberculose. De risicosectoren zijn de diensten of eenheden voor de verzorging van bacillendragers in ziekenhuizen en de laboratoria voor klinische biologie waar biologische producten, besmet met de tuberkelbacil, worden gehanteerd. In de praktijk wordt BCG-vaccinatie, die als onvoldoende doeltreffend wordt beschouwd en niet vrij is van neveneffecten, in ons land niet meer toegepast. Alle bedrijfsartsen die belast zijn met controle in de ziekenhuissector, houden er voortaan een preventieve strategie op na met controle op basis van tuberculinetest en de opvolging van de afwijkingen.
IV. Vaccinaties, aanbevolen in zorgomgevingen
MAZELEN
A. Epidemiologische situatie
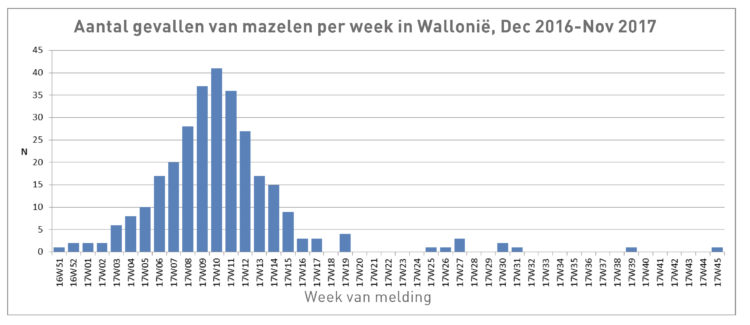
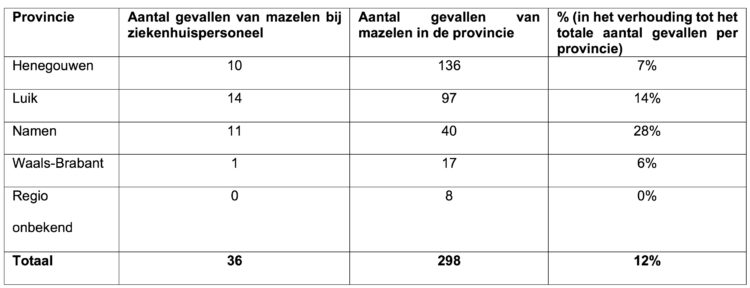
Van alle aandoeningen die met vaccinatie te voorkomen zijn, is mazelen een van de meest besmettelijke. De overdracht vindt vaak plaats nog voor de uitslag verschijnt, wat de potentiële efficiëntie van isolatiemaatregelen ondermijnt. Deze ziekte wordt in België nog altijd als endemisch beschouwd.[2] Sinds de epidemie van 2011, die meer dan 650 mensen trof, kent ons land een toename van de ziekte. In 2017 deed zich een tweede epidemie voor met zo’n 300 gevallen, voornamelijk in Wallonië, en raakten 37 werknemers uit de gezondheidssector besmet. In juni en juli 2017 werd ook de gevangenis van Gent getroffen: 19 gevangenen en 5 werknemers liepen de ziekte op. Hoewel de meeste gevallen van mazelen thuis worden opgevolgd, komt ten gevolge van de ernst van de ziekte en een lagere kennis van het medische personeel hierover een deel van de gevallen in het ziekenhuis terecht. Gezondheidswerkers die niet tegen deze aandoening gevaccineerd en geïmmuniseerd zijn, lopen het risico besmet te raken en ze aan patiënten door te geven. Uit een studie van de literatuur [3] blijkt dat het risico om mazelen op te lopen bij gezondheidswerkers 2 tot 19 maal hoger is dan bij de algemene bevolking.
Uit studies naar de seroprevalentie, gepubliceerd tussen 1994 en 2013, blijkt dat 3 à 14 % van de gezondheidswerkers seronegatief zijn voor mazelen.[3]
B. Natuurlijke en post-vaccinale immuniteit
Natuurlijke immuniteit is permanent. De vaccinale efficiëntie van het trivalente vaccin tegen mazelen, bof en rodehond is 95% voor één dosis en 98% voor twee doses. Het vaccin zou levenslang bescherming bieden.[4]
C. Vaccinatie-aanbeveling in zorgomgevingen
Het zorgpersoneel moet dus naar behoren tegen deze ziekte worden beschermd, in het bijzonder op spoeddiensten, intensieve zorgen, pediatrie, verloskunde, dermatologie, infectiologie, algemene inwendige geneeskunde en de afdelingen voor immunogedeprimeerde patiënten. De aanbevolen praktische aanpak wordt samengevat in kader 1.
D. Praktische aanpak in geval van contact met een niet-geïmmuniseerde persoon met een besmette patiënt
Vermijden van verzorging van besmette patiënten. Vaccinatie binnen de 72 uur na het contact.
E. Verwijdering uit de werkomgeving
De besmette werknemer moet van het werk worden verwijderd tot hij helemaal genezen is.
BOF
A. Epidemiologische situatie
Kleine epidemieën kunnen zich voordoen bij jongvolwassenen die niet of onvolledig gevaccineerd zijn. Zo werden in 2012 in België 2.648 gevallen geregistreerd.[5] Deze epidemie trof hoofdzakelijk een bevolking van jongvolwassenen aan hogescholen in het hele land. Tussen januari en juni 2013, nadat de aangifte werd verplicht, werden in Vlaanderen meer dan 2.000 en in Wallonië en Brussel meer dan 1.000 gevallen vastgesteld.[5] De toename van bofgevallen is waarschijnlijk te wijten aan factoren zoals onvoldoende vaccinale dekking, onvolledige bescherming na de vaccinatie (circulatie van serotypes die niet in het vaccin zijn opgenomen), de daling van de immuniteit in de loop der tijd en de hogere intensiteit van de sociale contacten bij bepaalde bevolkingsgroepen. Nochtans lopen correct gevaccineerde personen die twee doses kregen, minder risico op complicaties. Een aantal keer werd overdracht van het virus op gezondheidswerkers gemeld.[6]
B. Vaccinatie-aanbeveling in zorgomgevingen
De vaccinatie wordt in het bijzonder aanbevolen aan het niet-geïmmuniseerde zorgpersoneel van de spoeddiensten, pediatrie en de dienst besmettelijke ziekten.
C. Praktische aanpak in geval van contact van een niet-geïmmuniseerde persoon met een besmette patiënt
Verwijdering van de besmette persoon uit de zorgverlening. Een inhaalvaccin kan worden toegediend aan personen die eerder niet de twee doses van BMR-vaccinatie hebben ontvangen. In tegenstelling tot de mazelen, wordt bof door deze vaccinatie niet tegengehouden.
D. Verwijdering uit de werkomgeving
De besmette werknemer moet van zijn werk worden verwijderd voor een periode van 9 dagen vanaf het begin van de symptomen.
RODEHOND
A. Epidemiologische situatie
Sinds 2012 merken we een terugkeer van rodehond bij onvoldoende gevaccineerde bevolkingsgroepen. Zo werden in de Europese Unie 27.276 gevallen van rodehond geregistreerd tijdens het eerste trimester van 2013, tegenover 8.920 gevallen in 2012.[7] De meeste van deze gevallen werden in Polen en Roemenië gemeld. In België bestaan er geen recente epidemiologische gegevens, omdat de aangifte van de ziekte nog altijd niet eenvormig verplicht is in het hele land. In 2012 werd een ingevoerd geval van congenitale rodehond gemeld. In ons land bedroeg de vaccinale dekking voor de eerste dosis 95% in 2012. Voor de tweede dosis ligt deze dekking lager, tussen 70,5 en 92,5%, volgens studies, uitgevoerd tussen 2006 en 2012.[8]
B. Natuurlijke en post-vaccinale immuniteit
De natuurlijk verworven immuniteit is definitief. De vaccinale immuniteit wordt verworven 2 à 4 weken na de vaccinatie, met een seroconversiepercentage van bijna 100% en voor een periode van 10 à 20 jaar..
C. Vaccinatie-aanbeveling in zorgomgevingen
Vaccinatie is noodzakelijk voor alle vrouwen in de vruchtbare leeftijd. Het spreekt voor zich dat al het personeel van de spoeddiensten, pediatrie en verloskunde tegen rodehond moet gevaccineerd zijn.
D. Praktische aanpak in geval van contact van een niet-geïmmuniseerde persoon met een besmette patiënt
Bepaling van de immuniteit van de zwangere vrouwen of vrouwen die zwanger kunnen zijn en die blootgesteld worden. Voor niet-geïmmuniseerde vrouwen of vrouwen die op het resultaat van de serologie wachten, elk contact met de besmette persoon verbieden.
E. Verwijdering uit de werkomgeving
De besmette werknemer moet uit de werkomgeving worden verwijderd tot hij klinisch genezen is.
Kader 1: Bof, mazelen en rodehond (BMR) in de praktijk
In de praktijk
Alle gezondheidswerkers zouden idealiter tegen deze drie aandoeningen geïmmuniseerd moeten zijn. Dit geldt in het bijzonder voor het personeel van de spoeddiensten, intensieve zorgen, pediatrie, verloskunde, dermatologie, infectiologie, algemene inwendige geneeskunde en zorgafdelingen voor immunogedeprimeerden. Volwassenen die een schriftelijk bewijs kunnen voorleggen dat ze de twee doses hebben ontvangen (als kind, rond de 12 maanden en rond de 10-13 jaar, of als volwassene met een interval van een maand) kunnen als beschermd worden beschouwd, evenals personen die voor 1970 geboren zijn. Voor werknemers, geboren na 1970, die niet of onvolledig gevaccineerd zijn, moet de vaccinatie worden uitgevoerd of voltooid. Er dient te worden nagegaan of de werkneemster niet pas zwanger is op het ogenblik van de vaccinatie en ze moet worden geïnformeerd dat ze de eerste maand na de vaccinatie moet vermijden om zwanger te raken. Als de niet-geïmmuniseerde werknemer (of de werknemer die bij gebrek aan schriftelijk bewijs als niet-geïmmuniseerd kan worden beschouwd) vaccinatie weigert, moet dit in zijn medische dossier worden vermeld om de nodige preventiemaatregelen (verwijdering, vaccinatie) te treffen in geval van risicosituaties. Desgevallend kan een serologie worden voorgeschreven om deze niet-immuniteit te bevestigen of te weerleggen.
NB: een tuberculinetest kan pas uitgevoerd worden vanaf 1 maand na BMR-vaccinatie, gezien de kans op vals-negatieve resultaten.
KINKHOEST
A. Epidemiologische situatie
De stijging van het aantal gevallen van kinkhoest sinds twee decennia in alle geïndustrialiseerde landen is aan meerdere factoren te wijten. De eerste factor is het immuniteitsverlies na verloop van tijd. De bescherming bij volwassenen die als kind werden gevaccineerd of kinkhoest kregen, verdwijnt geleidelijk wegens de geringe kans op een natuurlijke ‘boost’, doordat de infectie in onze streken weinig aanwezig is. Daarnaast tonen bepaalde gegevens aan dat de duur van de bescherming van het acellulaire vaccin minder hoog zou zijn dan die van het volledige vaccin. De verbetering van de klinische en serologische diagnose heeft ook bijgedragen tot de stijging van het aantal geregistreerde gevallen. In de literatuur werden gevallen van kinkhoest bij het zorgpersoneel gerapporteerd. [9] [10] Het aantal van deze gevallen is waarschijnlijk onderschat.
B. Natuurlijke en post-vaccinale immuniteit
De duur van de natuurlijke bescherming na de ziekte wordt op 5 tot 15 jaar geraamd. Na de vaccinatie bij kinderen hebben serologische studies een merkbare vermindering en zelfs verdwijning van de postvaccinale antistoffen aangetoond 5 à 10 jaar na de eerste herhaling.[11] Over de volwassenen zijn weinig gegevens beschikbaar.
C. Vaccinatie-aanbevelingen in zorgomgevingen
Alle gezondheidswerkers zouden correct tegen deze aandoening geïmmuniseerd moeten zijn.[12] In de materniteit, op neonatalogie en op pediatrie is dit zelfs noodzakelijk. Om de 10 jaar moet een herhaling van het vaccin worden toegediend. Er zijn goede redenen om het vaccin ook toe te dienen aan het zorgpersoneel van de diensten inwendige geneeskunde, infectiologie, pneumologie en verzorging van immunogedeprimeerden.
D. Aanpak in geval van kinkhoest bij het zorgpersoneel
Verwijdering van de werkplaats voor 5 dagen vanaf de start van de behandeling met antibiotica. Deze antibioticatherapie geneest de patiënt niet, tenzij deze wordt toegediend de eerste 24u, maar biedt wel bescherming tegen transmissie.
DIFTERIE
A. Epidemiologische situatie
Dankzij de vaccinatie is het aantal gevallen van difterie door Corynebacterium diphtheriae in België aanzienlijk gedaald. In de periode tussen 1980 en 2012 werden slechts een vijftiental gevallen geregistreerd. Difterie blijft niettemin moeilijk uit te roeien, want hoewel het vaccin door de toxine een efficiënte bescherming biedt tegen de symptomen, voorkomt het de kolonisatie van de neuskeelholte niet, zelfs bij gevaccineerde personen. De toename van de ziekte tussen 1990 en 2001 in Rusland en bepaalde Oost-Europese landen, waar 160.000 gevallen en meer dan 4.000 overlijdens werden gerapporteerd, bewijst hoe gemakkelijk difterie zich opnieuw kan verspreiden in niet voldoende geïmmuniseerde bevolkingsgroepen. Naast de klassieke difterie door Corynebacterium diphtheriae, kunnen ook andere soorten, zoals Corynebacterium ulcerans, infecties bij mensen veroorzaken. Zo werden in West-Europa de laatste jaren enkele gevallen van respiratoire en/of systemische difterie door C. ulcerans gemeld.[13] We weten weinig over de factoren die bijdragen tot de virulentie van deze zoönoseverwekker, maar dit feit stemt tot waakzaamheid met betrekking tot de vaccinatie van het zorgpersoneel.
B. Natuurlijke en post-vaccinale immuniteit
De ziekte is niet immuniserend. In België blijkt uit onderzoek van het serologische beschermingsniveau tegen difterie bij de volwassenen bevolking na volledige vaccinatie in de kindertijd, dat de residuele immuniteit geleidelijk daalt. Slechts 20 à 45% van de 40-plussers haalt nog de beschermingsdrempel.[14]
C. Vaccinatie-aanbeveling in zorgomgevingen
Het is dus absoluut nodig de vaccinatie van de volwassenen verder te zetten (een herhaling om de 10 jaar). Het zorgpersoneel op spoeddiensten, intensieve zorgen, infectiologie en pediatrie moet correct tegen deze aandoening worden geïmmuniseerd.
WATERPOKKEN
A. Epidemiologische situatie
Waterpokken is een kinderziekte, die veel voorkomt in landen met een gematigd klimaat. In België hebben serologische studies uitgewezen dat 80% van de kinderen van meer dan 5 jaar oud waterpokken heeft gehad en dat 98% van de 30-jarige volwassenen geïmmuniseerd is. Mensen uit tropische landen daarentegen, hebben op volwassen leeftijd een hogere receptiviteit dan in landen met een gematigd klimaat.[15] Hoewel waterpokken doorgaans een goedaardige evolutie kennen, worden in België jaarlijks zo’n 1.000 mensen voor deze aandoening in het ziekenhuis opgenomen en overlijden 1 à 2 personen eraan.[16]
B. Natuurlijke en post-vaccinale immuniteit
De verworven immuniteit nadat iemand waterpokken heeft gehad, wordt wat waterpokken zelf betreft, als definitief beschouwd, maar is tijdelijk voor gordelroos. Vijftien à 20% van de personen die waterpokken heeft gehad, loopt het risico in de loop van hun leven gordelroos te ontwikkelen. De vaccinatie in twee doses is zeker en doeltreffend. Volgens de wetenschappelijke gegevens waarover we vandaag beschikken, biedt ze 10 à 20 jaar bescherming. Over de impact op de incidentie van gordelroos bestaat onzekerheid.
C. Vaccinatie-aanbeveling in zorgomgevingen
Vandaag beveelt de Hoge Gezondheidsraad geen algemene vaccinatie tegen waterpokken aan, maar wel die van risicopersonen, i.e. niet-geïmmuniseerde personen die in nauw contact staan met immunogedeprimeerde patiënten, niet-geïmmuniseerde volwassenen die in de gezondheidssector werken of in nauw contact staan met jonge kinderen, en niet-geïmmuniseerde vrouwen in de vruchtbare leeftijd.[16] De vaccinatie omvat twee doses, die met een interval van 4 à 6 weken worden toegediend. In tegenstelling tot kinderen, voor wie de anamnese doorgaans betrouwbaar is wat antecedenten over de aandoening betreft, bezit ongeveer 90% van de 17-plussers die denken dat ze nog geen waterpokken hebben gehad, antistoffen! Aangezien de meting van de antistoffen tienmaal minder kost dan de vaccinatie, is het aanbevolen deze vooraf uit te voeren. Er dient te worden nagegaan of de vrouwen die zich laten inenten niet pas zwanger zijn op het ogenblik van de vaccinatie en ze moeten worden geïnformeerd dat ze ook niet zwanger mogen worden in de daarop volgende maand.
D. Aanpak in geval van contact van een niet-geïmmuniseerde werknemer met een besmette patiënt
Door vaccinatie na blootstelling kan waterpokken bij meer dan 90% van de vatbare personen worden voorkomen indien het vaccin wordt toegediend binnen de drie dagen na het contact. Hoe sneller het wordt toegediend, hoe hoger de efficiëntie.
E. Verwijdering uit de werkomgeving
De getroffen werknemer moet uit de werkomgeving worden verwijderd tot de wondjes zijn gedroogd.
GRIEP
A. Griep in zorgomgevingen
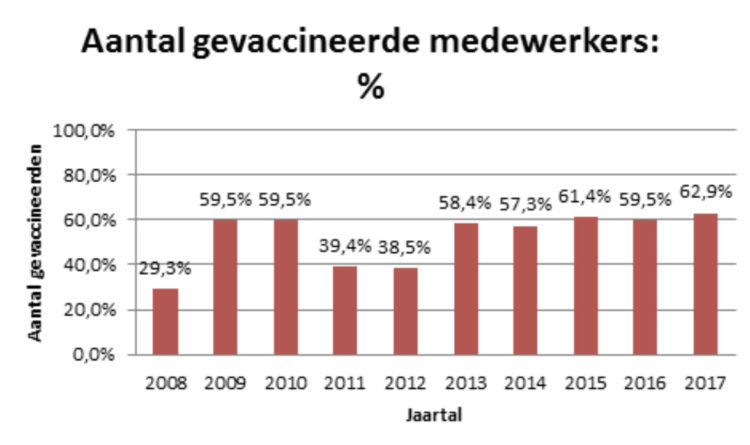
In tal van zorginstellingen zijn nosocomiale griepepidemieën beschreven. De overdracht van griep vanwege besmette personen, zowel naar patiënten als naar gezondheidswerkers, is duidelijk vastgesteld. De meeste gevallen van griep bij transplantatiepatiënten met immunodeficiëntie of leukemiepatiënten zijn nosocomiale infecties. De voornaamste bron van besmetting zou bij niet-gevaccineerde zorgverleners liggen.[17] Bepaalde elementen verhogen het besmettingsrisico in ziekenhuizen: de gezondheidswerkers blijven uit plichtsbesef werken ondanks merkbare symptomen en bij gehospitaliseerde patiënten wordt de diagnose van griep niet of slechts laattijdig gesteld. De voordelen van vaccinatie van de gezondheidswerkers in termen van collectieve en individuele preventie, volksgezondheid en bestrijding van het absenteïsme zijn nochtans al lang bekend.[18][19] Maar ondanks de aanbevelingen van de WHO om alle zorgverleners te vaccineren, blijft het percentage van gezondheidswerkers die zich tegen griep laten vaccineren te laag. In 2014-2015 schommelde dit vaccinatiepercentage in 13 lidstaten van de Europese Unie tussen 5 en 54,9%. [20] Veel gezondheidswerkers zijn om uiteenlopende redenen niet overtuigd van de doeltreffendheid en het nut van het griepvaccin voor hun persoonlijke gezondheid en vrezen de neveneffecten.[21]
B. Vaccinatie-aanbeveling
In haar jongste advies beveelt de Hoge Gezondheidsraad nog altijd formeel aan het voltallige gezondheidspersoneel te vaccineren [22] en wij staan volledig achter deze aanbeveling. Deze vaccinatie zou verplicht moeten zijn voor personeel dat in contact staat met kwetsbare patiënten, met name bejaarden in instellingen, immunogedeprimeerden, hartpatiënten, mensen met nierinsufficiëntie enz.
Kader 2: Samenvattende tabel van niet-verplichte vaccinaties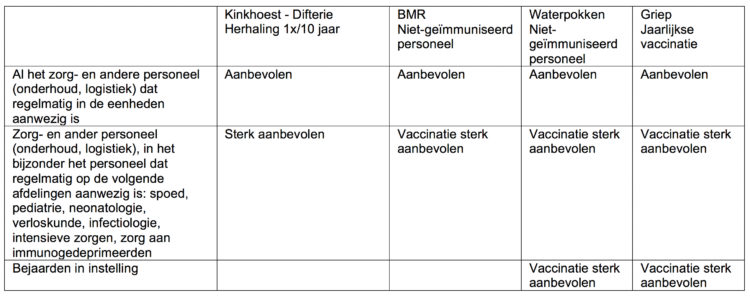
V. Besluit
De sensibilisering van de risicowerknemers en de preventie maken integraal deel uit van de taken van de preventieadviseur-bedrijfsarts. De situaties die zich de laatste tijd hebben voorgedaan, met name de mazelenepidemie en de enquêtes bij de werknemers [23], bewijzen dat het nodig is het gezondheidspersoneel beter te sensibiliseren en op te volgen inzake ziekten die met vaccinatie te voorkomen zijn. Werknemers in zorginstellingen onderschatten vermoedelijk de potentiële ernst van deze ziekten. Samen met de werkgever moet een duidelijk programma rond niet-verplichte vaccinaties worden opgesteld in functie van de specifieke kenmerken van de betreffende zorginstelling. Hiertoe is de dienst ziekenhuishygiëne de bevoorrechte gesprekspartner van de preventieadviseur-bedrijfsarts. Immunisering van werkneemsters in de vruchtbare leeftijd is bovendien een aspect dat kadert binnen de bescherming van het moederschap. Niet-geïmmuniseerde werknemers die weigeren zich te laten vaccineren moeten zich melden bij de werkgever en bij de dienst ziekenhuishygiëne om snel de nodige maatregelen te kunnen treffen in geval van besmetting.
VI. Referenties
1. Koninklijk Besluit van 4 augustus 1996 betreffende de bescherming van de werknemers tegen de risico’s bij blootstelling aan biologische agentia op het werk. Belgisch Staatsblad M.B. 1.10.1996 A en Codex over het welzijn op het werk, Boek 7, Titel 1 ; http://www.emploi.belgique.be/moduleTab.aspx?id=619&idM=102t
2. Grammens T, Maes V, Hutse V, Laisnez V, Schirvel C, Trémérie JM, Sabbe M. Different measles outbreaks in Belgium, January to June 2016 – a challenge for public health. Euro Surveill. 2016;21(32):pii=30313. DOI: http://dx.doi.org/10.2807/1560-7917.ES.2016.21.32.30313
3. Parker Fiebelkorn, W.A. Orenstein , J.F. Seward. A global perspective of vaccination of healthcare personnel against measles : Systematic review. Vaccine 32 (2014) 4823–4839.
http://www.sciencedirect.com/science/article/pii/S0264410X13015041
4. https://www.wiv-isp.be/matra/Fiches/Rougeole.pdf
5. https://www.wiv-isp.be/matra/Fiches/Oreillons.pdf
6. Pizetto B. Infections nosocomiales virales et à agents transmissibles non conventionnels. Editions John Libbey Eurotext. Paris 2001, p 531
7. Czarkowski MP, Derrough T, Paradowska-Stankiewicz I, Stefanoff P. Ongoing outbreak of rubella among young male adults in Poland: increased risk of congenital rubella infections. Euro Surveill. 2013; 18(21)
8. Grammens T, Litzroth V, Maes V, Mendes da Costa E, Muyldermans G, Quoilin S, SabbeM. Maladies infectieuses pédiatriques à prévention vaccinale, Rapport annuel 2015, Santé publique et surveillance, Décembre 2016. Bruxelles, p 61-62
9. U. Heininger. Vaccination of health care workers against pertussis : Meeting the need for safety within hospitals. Vaccine 32 (2014) 4840–4843.
10. Braunstein D , Desmons S, Succo T (et al) Epidémie de coqueluche dans un établissement d’hébergement pour personnes âgées dépendantes, Bouches-du-Rhône, août 2013, Bulletin Epidémiologique Hebdomadaire, n° 5, 2015-02-03, pp. 83-88
11. A. Aase, T.K. Herstad, S. Bakken Jorgensen et al. Anti-pertussis antibody kinetics following DTPa-IPV booster vaccination in Norwegian children 7-8 years of age. Vaccine. 2014 ; 32 : 5931-5936.
12. Hoge Gezondheidsraad. Vaccinatiegids: Vaccinatie van volwassenen tegen kinkhoest, HGR 9110. Revisie augustus 2013.
13. Grammens T, Litzroth V, Maes V, Mendes da Costa E, Muyldermans G, Quoilin S, Sabbe M. Maladies infectieuses pédiatriques à prévention vaccinale, Rapport annuel 2015, Santé publique et surveillance, Décembre 2016/Bruxelles, Belgique, p 24-25
14. Vaccinatie tegen difterie, tetanus en kinkhoest, Revisie 2013. https:/www.health.belgium.be
15. http://www.chu-rouen.fr/mtph/fiches/VARICELLE.pdf.
16. Advies van de Hoge Gezondheidsraad nr. 9212. Vaccinatie van kinderen, adolescenten en risicopersonen tegen waterpokken. Maart 2017
17. Azoulay E, Legoff J, Schnell D. Infections respiratoires grippales chez les patients immunodéprimés. Réanimation (2009)18, 301-308.
18. Hauge M, Lind A, Margolis KL, McFadden R, Murdoch M,
Nichol KL , et al. The effectiveness of vaccination against influenza in healthy, working adults. New England Journal of Medicine 1995; 333: 889-893
19. Brown D, Buynder S, Keen N, Konrad F, Murray J, Preston PD. Healthcare worker influenza immunization vaccinate or mask policy: Strategies for cost effective implementation and subsequent reductions in staff absenteeism due to illness. Vaccine, Volume 33, Issue 13, 24 March 2015, Pages 1625-1628
20. European Centre for Disease prevention and Control (ECDC). Technical report. Seasonal influenza vaccination and antiviral use in Europe. Overview of vaccination recommendations and coverage rates in the EU Member States for the 2013–14 and 2014–15 influenza seasons http://venice.cineca.org/Seasonal-influenza-vaccination-antiviral-use-europe.pdf
21. Asguassou S Contal E, Dipanda M, Manckoundia P, Perrin S, Putot A, Sordet-Guepet H. La couverture vaccinale contre la grippe saisonnière du personnel soignant en gériatrie : mise au point. Revue d’Épidémiologie et de Santé Publique. Volume 64, Issue 6, December 2016, Pages 415-423
22. Advies van de Hoge Gezondheidsraad nr. 9418. Vaccinatie tegen seizoensgebonden griep. Winterseizoen 2018-201. Juni 2017
23. Abiteboul D, Bouvet E, Ciotti C, Fonteneau L, Guthmann J-P, Lévy-Brulh D, Pelissier G. Couverture vaccinale des soignants travaillant dans les établissements de soins de France. Résultats de l’enquête nationale Vaxisoin, 2009. BEH 35-36/ 27 septembre 2011