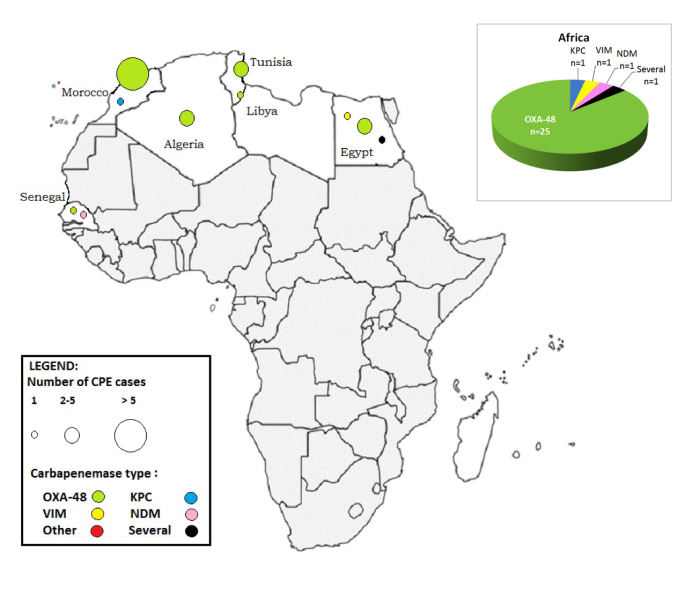
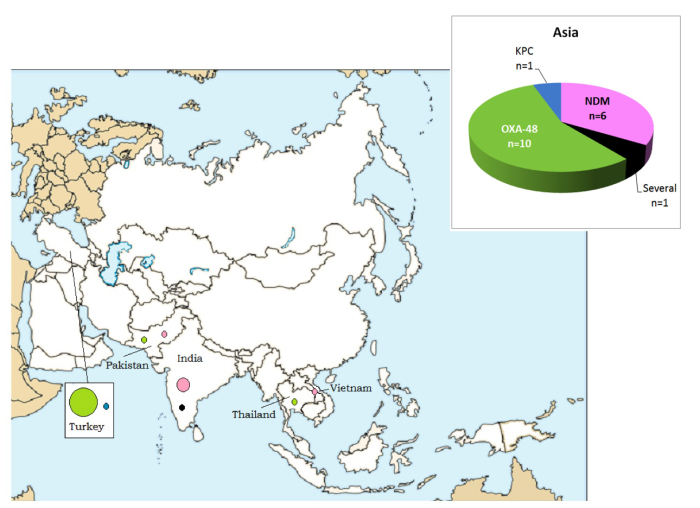
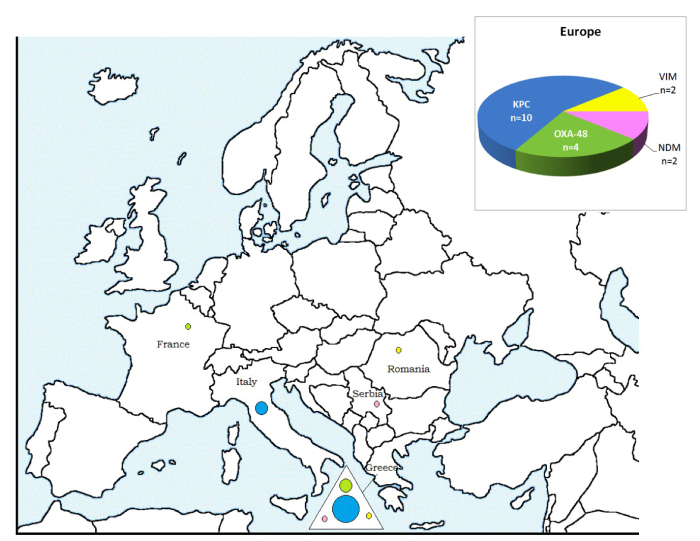
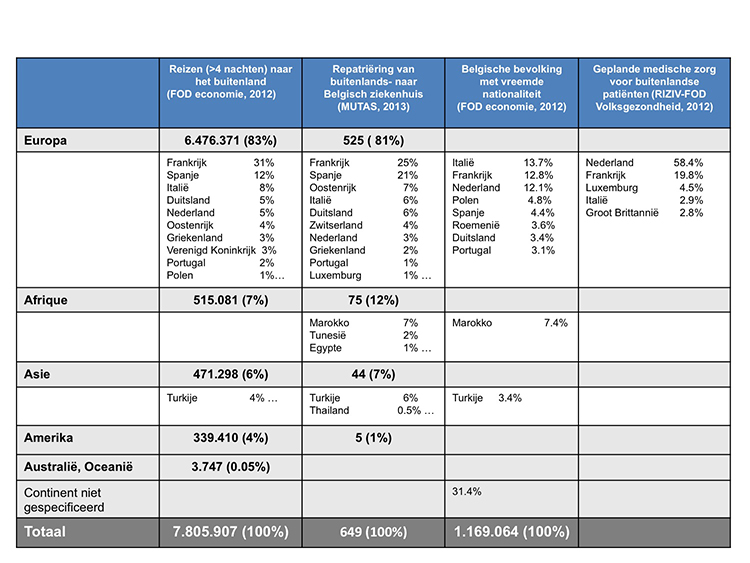
1. Inleiding
Definitie van empowerment
Tot voor kort werd in de literatuur onder empowerment meestal verstaan, “therapeutische opvoeding” of “gezondheidsopvoeding van de patiënt”. Deze terminologie klinkt ongetwijfeld minder paternalistisch dan definities zoals “opvoeding van de patiënt”. Volgens de Wereldgezondheidsorganisatie (WHO) is “de therapeutische opvoeding van de patiënt een continu proces, dat deel uitmaakt van het zorgpakket en patiëntgericht is. Die opvoeding omvat sensibilisering, informatieverstrekking, opleiding en psychosociale begeleiding en heeft betrekking op de ziekte, de voorgeschreven behandeling, de zorgen, de hospitalisatie en de andere zorginstellingen die erbij betrokken zijn. Dit proces moet de patiënt en zijn omgeving helpen de ziekte en de behandeling te begrijpen, beter samen te werken met de zorgverleners en de levenskwaliteit op peil te houden of te verbeteren”. Deze definitie onderstreept de complexe relatie patiënt/verzorger en maakt deel uit van de therapeutische relatie in het algemeen (Dumont, 2001).
In 2001 gaan ziekenhuizen steeds vaker werk maken van therapeutische opvoeding. Toen reeds bestond voor deze taak amper een wettelijk kader, wat een langetermijnvisie sterk bemoeilijkte.
Empowerment, of het autonomer worden of capaciteren, is het individu dat zijn economische, professionele, familiale en sociale lot zelf in handen neemt.
Volgens Bernard Vallerie (2008) duikt de term “empowerment” voor het eerst op in de Verenigde Staten aan het begin van de 20ste eeuw, bij vrouwen die strijd voeren voor de erkenning van hun rechten. Ook bij de methodes van “community organizing” van Saul Alinsky in de jaren 1930 valt de term en later nog in de jaren 1960, in de beweging die ijvert voor burgerrechten. In 1965 hanteert een groep psychologen de term in het kader van de communautaire psychologie. Het begrip zal daarna ingang vinden in tal van sectoren, o.a. in het overheidsbeleid rond armoedebestrijding. Daar krijgt de term empowerment een volledig omgekeerde invulling: het individu ervaart een geringere of het volledig verdwijnen van zijn autonomie in een vijandige context (powerlessness) (Aujoulat, 2007).
Het ontwikkelen van de handelingsbekwaamheid van personen en collectiviteiten (empowerment) en sociale praktijken: een aanpak die kan bijdragen tot een duurzame ontwikkelingsdynamiek. Bernard Vallerie, IUT2 Grenoble.
Empowerment vertaalt zich ook in verschillende dimensies: individueel, communautair en organisatorisch (Gendron, 2006).
Volgens de Wereldgezondheidsorganisatie is empowerment van patiënten afgestemd op de doelstellingen uit het huidige gezondheidsbeleid. Patiënten en burgers autonomer maken en patiëntgerichte zorgverlening verstrekken worden als hoekstenen beschouwd om de resultaten en de prestaties van gezondheidssystemen te verbeteren. De samenleving van vandaag verwacht een andere aanpak van de gezondheid, die meer uitgaat van een nauwere betrokkenheid van burgers en patiënten (Jakab 2012)
Waarom zet deze idee zich steeds meer door?
Ziekenhuiscontext
Sinds de tweede helft van de 20ste eeuw is de geneeskunde er snel op vooruitgegaan, zowel wat de thuisverzorging van de patiënt betreft, als ook die in het ziekenhuis.
Vanuit de basis zelf van de geneeskunde (anamnese, semiologie, diagnose- en therapeutische uitdaging) hebben onderzoekers snel de bestaande farmacopee uitgebreid, zelf nog na de Tweede Wereldoorlog en hebben ze technologieën ontwikkeld op vlak van onderzoek, medische en chirurgische behandelingen en communicatie, waarvan de impact nog duidelijker wordt in de snellere vooruitgang die we momenteel kennen.
De afgelopen 30 jaar hebben de voogdijoverheden mee de organisatie van de ziekenhuisgeneeskunde bepaald. De wetten Dehaene of Busquin zijn in België evenwel niet de reden waarom het intussen dringend nodig is de zorgverlening in ziekenhuizen beter af te stemmen op de noden van de patiënt.
Sinds de jaren 1980 zijn er in de grote sectoren van de geneeskunde en de chirurgie verschillende “aanverwante” specialiteiten opgedoken, die hebben geleid tot een overdreven specialisatie in zowel diagnose- als therapeutische domeinen. De gretigheid waarmee de artsen zelf op die evolutie zijn gesprongen, is ietwat uit de hand gelopen. Zo zijn bijvoorbeeld de algemene internisten verdwenen, zonder dat een andere specialist een gelijkaardige coördinerende rol binnen alle specialiteiten die er ondertussen in de interne geneeskunde zijn bijgekomen, op zich kan nemen. Deze leemte heeft niets te maken met intellectuele desinteresse maar veel meer met de nomenclatuur die deze praktijk, die geen enkele getarifeerde technische exploratie bevat, fel benadeelt.
Evoluties op vlak van diagnose en therapie hebben de duur van een gemiddelde hospitalisatie ingekort, wat ook een impact heeft op de werklast van de gezondheidszorgteams. Ondertussen is ook de ambulante ziekenhuisgeneeskunde er sterk op vooruitgegaan, vooral dan op vlak van chirurgische daghospitalisatie, oncologische daghospitalisatie en poliklinieken.
Dankzij de naoorlogse socio-economische evolutie en de ontwikkeling van de medische zorg is de levensverwachting fel toegenomen. De hogere gemiddelde leeftijd van de gehospitaliseerde patiënten heeft tegelijk wel gezorgd voor pathologieën die zwaarder en ernstiger zijn, en voor meer chronische ziekten (Ekinci, 2005). De WHO definieert die als “langdurige aandoeningen die over het algemeen, langzaam evolueren”. In Europa zijn cardiovasculaire ziekten de eerste doodsoorzaak (33 %), gevolgd door kankers (27 %). In België zou meer dan een vierde van de bevolking (27,2 %) aan een chronische aandoening lijden (KCE, 2012).
Een ziekenhuis is een complexe structuur waar heel wat medisch personeel, verpleegkundigen, paramedici, administratief en ondersteunend personeel werkzaam is en ook de structuren, motiveringen, vaardigheden en praktijken zijn vaak sterk verschillend.
Projecten rond kwaliteit van de zorgverlening en veiligheid van de patiënten moeten de organisatie verbeteren. Op vlak van zorgproces zijn reeds heel wat initiatieven genomen (klinische paden, checklists, transfer van patiënten, enz.). Uiteraard is de organisatie geen alleenstaand probleem, andere hangen ermee samen en zijn net zo belangrijk, zoals informatie en communicatie. Deze laatsten hebben betrekking op zowel de patiënt als het medisch personeel zelf.
Empowerment moet gekoppeld worden aan alle patiëntgerichte acties. Het aspect patiënt-“gericht” is al niet meer zo nieuw. Het paternalistische model heeft intussen plaats geruimd voor een participatief model, dat nog aan belang heeft gewonnen sinds de goedkeuring van de wet betreffende de rechten van de patiënt in 2002.
De 9 dimensies van de “patient-centred care” zijn (Leperre-Desplanques, Banaei-Bouchareb, Erbault, 2012):
- toegang tot zorgverlening,
- respect voor de waarden, voorkeuren en noden van de patiënten,
- coördinatie en integratie van zorgverlening,
- informatie, communicatie en opvoeding,
- fysiek comfort,
- emotionele steun en pijn- of angstverzachting,
- betrokkenheid van vrienden en familie,
- transitie en continuïteit,
- hoffelijkheid
Verwachtingen van de patiënten
Patiënten of gezondheidswerkers begrijpen niet altijd hetzelfde onder “Betrokkenheid van de patiënten“. Vaak wordt die gelijkgesteld met het opvolgen van de medische behandeling en de instructies van de arts. Soms wordt er ook onder verstaan, het verstrekken van algemene informatie over de symptomen van de patiënten. Minder vaak daarentegen, wordt die begrepen als een meer interactieve dialoog, of als een kans voor de patiënt om zijn mening te geven en actief betrokken te worden bij zijn medische behandeling.
Artsen en patiënten onderstrepen niet voldoende de concrete voordelen van een nauwere betrokkenheid bij het zorgproces. De idee van een betere samenwerking tussen gezondheidswerker en patiënt die tot betere resultaten leidt op vlak van gezondheid, blijkt niet altijd voldoende uit de wederzijdse appreciatie.
Volgens velen staat communicatie centraal. Voor patiënten betekent dit dat artsen hen uitleg moeten geven bij de diagnose en de behandeling. Voor de artsen moeten de patiënten de symptomen beschrijven en hen informeren over het verdere verloop van de behandeling.
De belangrijkste drempel voor een efficiënte communicatie is de tijd die geneesheren kunnen vrijmaken voor patiënten. Volgens patiënten en geneesheren hebben geneesheren te weinig tijd om de verschillende behandelingsopties te bespreken.
Bepaalde patiënten hebben het over een “traditionele relatie geneesheer – patiënt”, waarbij de geneesheer als een onaantastbaar persoon wordt gezien en patiënten hun mening niet durven te geven. Om die reden is het volgens patiënten makkelijker en efficiënter communiceren met verpleegkundigen dan met geneesheren, vooral in de ziekenhuizen.
Ook al wensen patiënten niet de verantwoordelijkheid voor de beslissing te dragen, toch vinden ze het belangrijk vragen te stellen en te begrijpen hoe de beslissingen worden genomen (Eurobarometer, 2012).
In de tekst “Clean care is safer care” herhaalt de WHO in mei 2013 haar engagement voor meer betrokkenheid van en samenwerking met, en het autonomer maken van patiënten. De doelstellingen daarvan zijn de volgende:
- werk maken van een echte veiligheidscultuur waarin patiënten, familie, bezoekers en gezondheidswerkers samenwerken;
- patiënten oproepen en aanmoedigen gezondheidswerkers te helpen om hun praktijken te verbeteren;
- handhygiëne verbeteren en zorggerelateerde infecties vermijden (WHO, 2013).
Het probleem wordt nog bemoeilijkt door de bevreemdende perceptie die de patiënt van de ziekte heeft: “zich niet langer herkennen” of “niet meer herkend worden”, “niet langer zichzelf toebehoren”, “niet meer dezelfde zijn”, enz. zijn vaak gehoorde uitspraken bij patiënten (Aujoulat, 2007). Ze zijn een uiting van de wanhoop van de patiënt die door de ziekte voor de pijnlijke uitdaging staat om “op een andere manier dezelfde” te worden, waarbij die “op een andere manier” verwijst naar de veranderingen die door de ziekte worden opgedrongen. Er bestaat dus een contrast tussen enerzijds empowerment als concept, dat in de literatuur vaak wordt beschreven als een proces om de controle te verwerven, gekoppeld aan educatieve doelstellingen zoals het versterken van het gevoel van zelfeffectiviteit t.o.v. gedragingen die we zelf niet altijd in de hand hebben – die de persoon dus zelf heeft gekozen -, en anderzijds empowerment als levenservaring, die niet is gericht op de uitbreiding maar wel op het wezen, en die dus acceptatie veronderstelt van een verlies van controle.
De patiënt heeft heel wat moeite om die complexe situatie te verwoorden, waardoor hij zich meestal gaat isoleren. Binnen een “klassieke consultatie” voelt hij zich niet op z’n gemak om dat te bespreken.
Ook de keuze is een essentieel aspect van de betrokkenheid van de patiënten en heeft betrekking op zaken zoals de keuzevrijheid om van geneesheer te veranderen of het kennen van alternatieve behandelingen.
Bijna alle patiënten hebben intussen een betere toegang tot informatie over hun symptomen, mogelijke diagnoses en zorgverlening. Deze evolutie is een positief element voor patiënten. Ze vinden echter dat informatie moet worden gereglementeerd om op internet nuttige garanties te krijgen.
Gezondheidswerkers zien wel voordelen in “betrokkenheid van de patiënten” omdat patiënten op die manier meer gemotiveerd zijn. Voordelen voor de patiënten zijn betere informatie, toelichting bij de therapeutische opties en een meer open dialoog waarin de communicatie efficiënter verloopt.
De belangrijkste nadelen van een grotere “betrokkenheid van de patiënten” zijn de nood aan meer middelen (meer tijd en meer personeel) en de mogelijke negatieve impact op de relatie patiënt/geneesheren. Een meer uitgebreide uitleg over de zorgen en het bespreken van verschillende opties impliceren dat geneesheren meer tijd moeten vrijmaken en dat het personeel vaker beschikbaar moet zijn, waarvoor momenteel geen middelen beschikbaar zijn (Eurobarometer, 2012). Dat soort begeleiding veronderstelt bovendien dat het ziekenhuis met andere externe structuren contact opneemt, waardoor het probleem nog complexer wordt.
De patiënt die sneller naar huis terugkeert heeft vaak bijkomende hulp nodig, die niet door de ziekteverzekering wordt vergoed.
In juni 2011 heeft de FOD Volksgezondheid zijn “Conceptnota Transmurale Zorg” gepubliceerd. Het ziekenhuis is slechts een stap in de zorgverlening aan de patiënten. De banden tussen het ziekenhuis en de structuren achteraf moeten worden aangehaald. We moeten jammer genoeg vaststellen dat wat dat betreft nog lang niet voldoende wordt tegemoetgekomen aan de noden van de zieken en dat er dus nog een hele weg af te leggen is. Het ziekenhuis heeft niet voldoende gesprekspartners en opvangstructuren voor patiënten. De situatie wordt er nog erger op met het tekort aan geneesheren. Rekening houdend met de evolutie van het aantal huisartsen (voor drie vertrekkers, komt er een in de plaats) ziet het er steeds meer naar uit dat hun taken en die van andere professionals uit de gezondheidssector elkaar zullen overlappen.
Wet betreffende de rechten van de patiënt
Op 22 augustus 2002 is de wet betreffende de rechten van de patiënt in werking getreden. Deze nieuwe wet heeft de medische beroepswereld ongetwijfeld nieuwe verplichtingen opgelegd. Onrechtstreeks heeft de wet ook voor een andere manier van communiceren met de patiënt gezorgd. Doordat de patiënt intussen het advies van een andere zorgverstrekker mag inwinnen en hij een kopij van zijn medisch dossier mag opvragen, komt hij steeds meer over zichzelf en over zijn ziekte te weten, en over wat de zorgverlener bij wie hij te rade gaat doet en zou kunnen doen.
De medische wereld gaat daardoor voorzichtiger te werk, omdat vanuit die hoek wordt gevreesd dat patiënten, die zich “actoren van hun ziekte” voelen, sneller naar de rechtbank stappen.
Jammer genoeg ondermijnt dat soort gedrag de vertrouwensrelatie. De patiënt gaat veel sneller klacht indienen tegen een geneesheer, die op zijn beurt zoveel mogelijk voorzorgsmaatregelen zal treffen en afstandelijker zal worden.
Artikel 17 van de wet op de ziekenhuizen (gecoördineerd op 07/08/1987) voegt een artikel 17novies toe en verplicht de ziekenhuizen over een ombudsdienst te beschikken.
Een van de belangrijkste taken van de ombudsman is het vergemakkelijken en herstellen van de dialoog tussen zorgverlener en patiënt, om geschillen te vermijden of op te lossen.
Rechten van de patiënt:
Art. 5. Kwaliteitsprestaties die aan zijn behoeften voldoen:
- Kwaliteit van de zorgverlening.
- Respect voor de menselijke waardigheid.
- Respect voor de autonomie.
- Geen discriminatie.
Art. 6. Vrije keuze beroepsbeoefenaar:
- Vrije keuze.
- Wijziging van keuze.
Art. 7. Recht op informatie:
- Over zijn gezondheidstoestand en de vermoedelijke evolutie ervan.
- In duidelijke taal.
- Schriftelijk, indien de patiënt daarom vraagt.
- In aanwezigheid van een vertrouwenspersoon, indien de patiënt dit wenst.
- Recht om niet te worden geïnformeerd.
Art. 8. Vrije en geïnformeerde toestemming:
- Na voorafgaandelijk en tijdig verstrekte informatie.
- Uitdrukkelijk gegeven, behalve indien de beroepsbeoefenaar uit de gedragingen van de patiënt redelijkerwijze diens toestemming kan afleiden.
- Schriftelijk bepaald in MD van de patiënt (voorwaarden).
- Weigering of intrekking van toestemming (voorwaarden).
Art. 9. Dossier van de patiënt:
- Zorgvuldig bijgehouden en veilig bewaard.
- Inzage in patiëntendossier (termijn – vertrouwenspersoon – persoonlijke notities – weigering).
- Kopij van het patiëntendossier (termijn – kost – weigering).
- Dossier van overleden patiënten.
Art. 10. Persoonlijke levenssfeer van de patiënt:
- Bij iedere tussenkomst van de beroepsbeoefenaar.
- Over informatie die verband houdt met zijn gezondheid.
- Respect voor de intimiteit van de patiënt.
- Geen inmenging is toegestaan (behalve uitzonderingen).
Art. 11bis. Recht op de meest aangepaste zorg:
- Met betrekking tot de pijn, voorkomen, er aandacht voor hebben, evalueren, in aanmerking nemen, behandelen en verzachten.
Plichten van de patiënt:
- Actief deelnemen aan de zorgrelatie om een open dialoog te garanderen.
- Alle nodige informatie overmaken zodat de zorgverstrekker de aangepaste zorgen kan verstrekken.
Rechten van de zorgverstrekker:
- Therapeutische uitzondering: in het belang van de patiënt kan de arts, in het kader van een multidisciplinair overleg, afwijken van de genomen beslissing.
- Toegang tot het medisch dossier weigeren indien hij over elementen beschikt die erop wijzen dat de patiënt onder druk staat.
- Vertrouwelijkheid van zijn persoonlijke notities in het medisch dossier (enkel onrechtstreekse consultatie, via tussenkomst van een geneesheer).
Plichten van de zorgverstrekker:
- Zich schikken naar de wetgeving inzake rechten van de patiënt.
- In geval van klacht, ingaan op een uitnodiging voor een onderhoud met de ombudsman
2. Doelstellingen
Algemeen
Het lijkt ons essentieel dat het overleg over de verbetering van het empowerment van de patiënten binnen het ziekenhuis, in aanwezigheid van alle betrokkenen gebeurt.
Daarbij kunnen we ons inspireren op het model van Robert Dilts met de zes verschillende piramideniveaus, vanaf de basis tot de top: omgeving, gedrag, capaciteiten, waarden en identiteit en uiteindelijk de missie. Dit model is bruikbaar voor alle leer-, veranderings-, en communicatieprocessen en voor het oplossen van problemen (Seidi, 2011). Door op elk niveau vragen te stellen, kunnen we informatie verzamelen waarmee exact kan worden bepaald waar verandering nodig is en de aanpak is slechts volledig, in aanwezigheid van alle actoren. Hoe meer een persoon afweet van zichzelf en van zijn gesprekspartner, hoe beter hij zich in de plaats van de andere kan stellen. Zo kunnen problemen makkelijker worden geïdentificeerd en wordt pure speculatie vermeden, die het welslagen van de nieuwe structuur in de weg zou staan. Op die manier is het mogelijk de problemen op een niveau toe te wijzen en de plaatsen aan te duiden waar verandering nodig is. De behandeling ervan gebeurt dan op het niveau er net boven.
Het project van empowerment van de patiënten heeft vooral betrekking op het team van geneesheren en verpleegkundigen. Nadat zij hun behoeften duidelijk hebben gemaakt, kan een meer algemeen debat worden gevoerd over de cultuur van de veiligheidskwaliteit van de zorgverlening en dus van de organisatiecultuur.
Zo kunnen de directies hun standpunt kenbaar maken en hun visie geven over de mogelijkheden op dat vlak. Die uitwisseling van ideeën moet op dezelfde manier worden doorgetrokken naar volgende punten, instrumenten en methodes.
Voor de gezondheidszorgteams is het eenvoudig: de noden zijn de beschikbaarheid op vlak van tijd en middelen, van lokalen voor opvang en opleiding, van telefoonlogistiek en secretariaat.
Men kan zich afvragen waarom die nog niet zijn ingewilligd, wanneer zo’n aanpak van de zorgverlening van patiënten hospitalisaties verkort en het ziekenhuis toelaat beter tegemoet te komen aan de vraag.
Inspelen op de verwachtingen van de patiënt
De diagnosefase kan aanvankelijk relatief complex zijn in functie van de symptomen van de patiënt. Zodra de ziekte bekend is worden de therapeutische doelstelling en de medische behandeling hem vaak als noodzakelijk voorgesteld (Barrier, 2009).
Van heel wat chronisch zieken wordt beweerd dat ze hun behandeling niet voldoende volgen en volgens schattingen leeft 30% van de chronische patiënten hun behandeling niet na.
Het medisch discours wordt nog al te vaak geassocieerd met een concept van normativiteit waarbij de norm als enige prioriteit voor de geneesheer wordt beschouwd.
Er moet rekening worden gehouden met de mate waarin de patiënt de diagnose kan aanvaarden en vervolgens kan ontdekken wat voor hem zijn gezondheidsnorm is voor een zo goed mogelijke ontplooiing in het kader van zijn ziekte. Pas dan bouwt de patiënt een reëel levensproject op, dat de beslissingen die hij moet nemen zal bepalen.
Dit is een delicaat punt bij de manier waarop de geneesheer met zijn tijd omgaat in zijn relatie met de chronische patiënt.
Bij een eerste diagnose mag het ontslag van de patiënt niet worden uitgesteld, indien niet alle overeenkomsten met de patiënt zijn nagekomen. De educatieve begeleiding moet ook ambulant worden voortgezet. In bepaalde gevallen gebeurt die opvang enkel ambulant.
Op dat ogenblik begint een belangrijke communicatiefase tussen de patiënt, de geneesheer en de gezondheidszorgteams. Er moeten immers samen met hem behandelingskeuzes worden bepaald en gevalideerd en vervolgens moeten zijn keuzes worden besproken in functie van zijn levensproject. Na deze fase kan worden beoordeeld in welke mate hij autonoom kan worden (Dumez, 2012).
De opvolging van de gevolgen van de behandeling is dus essentieel. Het is wel degelijk de patiënt die zelf de leiding over zijn behandeling heeft, die de controle over zijn ziekte moet behouden. Een autonome patiënt doet er alles aan om de beperkingen van zijn ziekte tot een minimum te beperken. Het is door zelf de controle over zijn behandeling te krijgen dat hij daarin zal slagen. De geneesheer verdwijnt als het ware naar de achtergrond. In noodsituaties moeten uiteraard beslissingen worden genomen en uiteraard is het aan de geneesheer, die over de heilzame kennis en actiemiddelen beschikt, om die te nemen.
Autonomie kan dus worden geïnterpreteerd als het verstandig omspringen met de afhankelijkheid die inherent is aan het statuut van patiënt. De patiënt kan dus een self management parcours volgen, waarbij hij tegelijk wordt begeleid door de zorgteams, in die mate zelf dat hij over zijn ziekte een expertise verwerft die hij met anderen zou kunnen delen. Dit brengt ons bij het begrip van “patiënt-expert” maar vooraleer dat concept volledig ingang vindt, is er nog een hele weg af te leggen.
Patiënt-expert
De patiënt kan expert zijn van hemzelf, voor hem zelf. Zo wordt hij een volwaardige partner van geneesheren en gezondheidszorgteams.
De patiënt-expert kan ook een bron zijn voor anderen, op verzoek van de gezondheidszorgteams bijvoorbeeld. Zijn expertise hoeft dan ook niet beperkt te blijven tot zijn ziekte.
De patiënt-expert kan tenslotte ook een helpende patiënt worden, vooral dan voor patiënten voor wie de ziekte nieuw is of voor patiënten die het moeilijk hebben.
Daarvoor moet hulp worden voorzien die permanent beschikbaar is. Informatica speelt daarin een centrale rol. De oriëntatienota van de FOD Volksgezondheid – RIZIV (2013) lanceert het idee van een module die moet voldoen aan verschillende criteria om de patiënt te helpen, om zijn evolutie op te volgen en complicaties te vermijden.
Deze opdracht kan zelf worden uitgebreid naar een “professionele” patiënt-expert, die dan abstractie moet maken van zijn persoonlijke ervaring en kennis moet opdoen over de ziekte, psychologie en communicatie. Maar wie gaat dat opleidingsprogramma in goede banen leiden? Hoe moet de gevolgde opleiding worden geëvalueerd? Wat met de “certificatie”? Dit zijn nog maar enkele vragen die rond dit thema vaak worden gesteld (Grimaldi, 2012).
Case management
Aangezien empowerment een aanpak is die vooral met chronische ziekten wordt gerelateerd, is het beheer ervan essentieel (FOD Volksgezondheid, RIZIV, 2013). In gewone gevallen zou de patiënt zelf in staat moeten zijn om met zijn ziekte om te gaan (of toch minstens tot op een bepaalde leeftijd). Wordt de situatie te complex, of neemt de autonomie van de patiënt af, dan zullen andere personen in het case management worden ingeschakeld. Dit vereist de aanstelling van een case manager maar ook een andere manier van coördinatie. Communicatie en een multidisciplinaire aanpak van de zorgen zijn 2 succesfactoren die in geen enkele kwaliteitsaanpak ontbreken. Dit impliceert niet enkel nieuwe functies maar ook een aangepaste opleiding.
Ethiek en deontologie
Empowerment van de patiënten lijkt dus een natuurlijke stap die zowel de patiënt als de geneesheer voordelen oplevert.
Over het algemeen mag het thema geen reden tot ongerustheid zijn, toch dient met een aantal gevallen rekening te worden gehouden, omwille van de rechten van de patiënten. Het gaat hier dan vooral over het medisch beroepsgeheim in geval van ondersteuning door een familielid: meningsverschillen tussen leden van eenzelfde familie, eventuele successie, enz. Moet deze hulp worden gekoppeld aan het idee van een officieel door de patiënt aangestelde vertrouwenspersoon (die ook kan worden ontslaan)?
Bij een volledige transmurale behandeling en geïntegreerde zorgen moeten de partners duidelijk zijn bepaald en moeten overeenkomsten worden opgesteld zodat het overmaken van het medisch dossier volledig conform de vereisten ter zake verloopt en de patiënt (of zijn vertegenwoordiger) ermee heeft ingestemd.
“Output” en indicatoren
Zoals voor elk project rond kwaliteit en veiligheid van de patiënten is het meten van resultaten een essentieel punt van feedback om vooruitgang te boeken.
Indicatoren die moeten worden besproken zijn: morbi-mortaliteit, herhospitalisaties, tevredenheid, ongewenste gebeurtenissen, feedback over ervaringen, bemiddeling, klachten, enz. Ze moeten kwalitatief en kwantitatief zijn, wetenschappelijk gevalideerd, door de gezondheidswerkers en vertegenwoordigers van de patiënten aanvaard. Voorts moet er ook feedback volgen over praktische aspecten (haalbaarheid) en kostenbeheersing.
3. Conclusies
De ontwikkeling van empowerment kan voor de belangrijkste aspecten verlopen volgens een principe van het klinisch pad, met respect voor alle essentiële stappen die leiden naar een meer autonome patiënt.
Het levensproject bepaalt dan wat als basisstandaard zal worden beschouwd. Voor patiënten met een zeer druk leven of die hun levenswijze zo veel mogelijk willen behouden, zal de nadruk liggen op personalisering en dus omkadering door gezondheidswerkers.
Indien we voor zo’n aanpak kiezen, kunnen we het ook hebben over een “geïntegreerd empowerment”. Deze benaming kan betrekking hebben op de globale organisatie van de ziekenhuis- en eerstelijnszorgen. De oriëntatienota FOD Volksgezondheid – RIZIV biedt heel wat perspectieven, tot zelfs de essentiële financiering van het globale en geïnformatiseerde patiëntdossier, conform de strenge voorwaarden op vlak van invoeren en betrouwbaarheid van de informatie.
Referenties
Aujoulat Isabelle (2007). L’empowerment des patients atteints de maladie chronique. Thèse de doctorat, UCL.
Barrier Philippe (2009). Le contrôle dans la maladie chronique, le point de vue du patient expert. 13è congrès de pneumologie de langue française, Lyon.
Dumez Vincent (2012). Partenariat de soins avec les patients : tendances et défis en contexte de maladies chroniques. 4è rendez-vous de la gestion des maladies chroniques, Montréal.
Dumont Jacques (2001). Etat des lieux sur le développement structurel de l’éducation thérapeutique du patient. L’Hôpital Belge, n° 4, 58-60.
Ekinci O. (2010). Getting to the heart of Things; European Hospital.
Eurobarometer (2012). Kwalitatieve studie, Europese Commissie. Volledig verslag. Betrokkenheid van de patiënten.
Gendron Jean Stephen (2006). Le principe de l’empowerment et de la PNL appliqués au monde des affaires. Association internationale de thérapeutes et association canadienne de PNL.
Grimaldi A. (2012). «Patient expert»: une clarification nécessaire. 2èmes rencontres d’éducation thérapeutique du patient, Lyon.
Jakab Zsuzsanna (2012). Patient empowerment in the European Region. First European Conference on Patient Empowerment. Copenhagen.
KCE (2012). Rapport 190 B, organisatie van zorg voor chronisch zieken in België.
Leperre-Desplanques Armelle, Banaei-Bouchareb Linda, Erbault Marie (2012). Accident vasculaire cérébral, Perspectives HAS, Expérience Patient. Plénière annuelle HAS.
WHO (2013). Patients have a voice too! http://www.who.int/gpsc/5may/5may2013_patient-participation/en/
Seidi Barbara (2011). L’Art de la PNL, Ixelles éditions, p 101-102.
FOD Volksgezondheid, RIZIV (2013). Oriëntatienota. Geïntegreerde visie op de zorg voor chronisch zieken in België.
Vallerie Bernard (2008). Développement du pouvoir d’agir des personnes et des collectivités (empowerment) et pratiques sociales. Une approche susceptible de contribuer à une dynamique de développement durable. In Fondation d’Auteuil, Familles et professionnels de l’action sociale. Eduquer ensemble. Lyon, Chronique sociale.