NVDR Eén van de auteurs werkt weliswaar op de R&D-afdeling van een bedrijf dat producten ontwikkelt die specifiek bedoeld zijn voor de biofilmbestrijding, toch meent het redactiecomité dat dit artikel op een volledig wetenschappelijke manier is geschreven.
Inleiding
In een recent rapport van het ECRI-instituut (een Amerikaans onafhankelijk adviesorgaan zonder winstoogmerk), waarin de tien grootste gezondheidsrisico’s worden geschat die met de in de geneeskunde gebruikte technologieën te maken hebben, komt de reinigings- en desinfectiecyclus van endoscopen na gebruik op de tweede plaats.1 Deze waarschuwing kan enigszins verrassend lijken, maar ze sluit wel aan bij verschillende recente publicaties waarin ernstige, door endoscopen overgedragen epidemieën beschreven staan.2–4 En het toenemend gebruik van dat soort instrumenten in vele geneeskundige disciplines (gastro-enterologie, urologie, pneumologie, NKO (neus-, keel- en oorziekten),….) is daar niet vreemd aan.
Het probleem om een endoscoop na gebruik grondig te reinigen en te ontsmetten ligt vooral aan de toenemende miniaturisatie, met steeds smallere kanalen waar tijdens het onderzoek onvermijdelijk lichaamsvochten doorheen gaan, waardoor binnen deze kanalen biofilms ontstaan.
Het begrip biofilm dook voor het eerst in de geneeskunde op in de laatste decennia van de twintigste eeuw en dan vooral in samenhang met infecties die werden vastgesteld bij patiënten die een chirurgisch implantaat hadden gekregen. Implantaatinfecties zijn verraderlijk en ontwikkelen zich traag, maar ze zijn vooral uiterst moeilijk of zelfs onmogelijk met geneesmiddelen te behandelen, waardoor ze in de meeste gevallen tot een heroperatie leiden.
Geleidelijk aan is het begrip biofilm uitgebreid naar andere domeinen van de geneeskunde (zoals tandplak of longinfecties bij mucoviscidosepatiënten). Maar het is vooral het algemene concept van biofilm als belangrijkste middel tot voortbestaan van micro-organismen in de natuur dat de afgelopen vijftien jaar is aangetoond.
Achtereenvolgens beschrijven we wat een biofilm is, identificeren we de problemen die een biofilm in de geneeskunde kan veroorzaken en evalueren we de belangrijkste manieren om biofilms te bestrijden.
Biofilm – Definitie en ontwikkelingsproces
In de natuur neemt zo’n 90 % van de bacteriën een levenswijze aan die biofilm wordt genoemd.5 Biofilms zijn gemeenschappen van micro-organismen, samengesteld uit bacteriën en/of schimmels van verschillende soorten, die zich op oppervlakken ontwikkelen. De groei van een biofilm is een proces dat 4 belangrijke stappen omvat.6
1. Hechtingsfase
In de natuur zal elke vloeistof die in contact komt met een inert oppervlak (een steen in de rivier of tandglazuur in de mond….) ervoor zorgen dat de moleculen of micro-organismen die de vloeistof bevat, zich afzetten op het lichaamsoppervlak. Het gaat hier om een eenvoudig adsorptiefenomeen dat voornamelijk wordt gestuurd door hydrofobe eigenschappen. De krachten die hier werken zijn beperkt en het fenomeen is in dit stadium omkeerbaar (zie figuur 1 A).
Moleculen die aan het oppervlak worden geadsorbeerd (vooral eiwitten) kunnen echter structuren hebben die specifieke doelen kunnen vormen waaraan sommige (niet alle) bacteriën die adhesines bevatten zich gaan hechten. Zodra deze adhesines zich aan hun doel hebben gehecht, wordt de binding veel stabieler. Zo is bijvoorbeeld bekend dat de vele bloedmoleculen en serositis (fibrinogeen, fibronectine, vitronectine, enz…..) die zich afzetten tijdens de operatie op een implantaat dat een chirurg aan het plaatsen is, epitopen presenteren die op een bevoorrechte manier herkend worden door stafylokokken, met bijvoorbeeld een SdrG oppervlakte-eiwit, dat in staat is om sterke covalente bindingen met fibrinogeen te leggen.7 De kracht tussen SdrG en fibrinogeen is bijzonder intens, 40 keer groter dan een klassieke hydrofobe interactie (2 nN versus 50 pN).8 Er is een rechtstreeks verband aangetoond tussen de overvloed aan SdrG op het oppervlak van de S. epidermidis en het vermogen van de stammen van deze soort om zich aan met fibrinogeen bedekte oppervlakken te hechten.9 De fysisch-chemische aard en de topografie van het oppervlak van micro-organismen spelen daarom een belangrijke rol in hun uiteindelijke hechting. Vooral microgestructureerde oppervlakken of oppervlakken met structurele gebreken zorgen ervoor dat bacteriën zich beter gaan verankeren omdat het interactiegebied groter is en de micro-organismen beschermd zijn tegen de afschuifkrachten van de vloeistof.10,11
2. Vermenigvuldiging en opbouw van de matrix van de biofilm
Zodra de omgevingsomstandigheden (temperatuur, luchtvochtigheid, voedingsstoffen….) het mogelijk maken vermenigvuldigen bacteriën zich en vormen ze microkolonies (zie figuur 1 B).12 Bacteriën die een beschermende matrix uitscheiden die bestaat uit verschillende extracellulaire polymere substanties (EPS), hebben dan een belangrijk voordeel. Die laatste bevat voornamelijk polysachariden maar ook eiwitten, DNA en lipiden. De EPS-matrix wordt dan een belangrijk onderdeel van de microkolonies.13 Zijn rol tijdens de accumulatiefase van de biofilm is immers om de samenhang tussen de bacteriën die de microkolonies vormen te verzekeren en hen te beschermen tegen bedreigingen van de externe omgeving, zoals bijvoorbeeld antibiotica14 of ontsmettingsmiddelen.15
3. Rijping
De derde fase, de rijping (zie figuur 1 C), treedt in werking wanneer microkolonies een hoeveelheid biomassa bereiken die een significante heterogeniteit binnen de biofilm genereert.16 De EPS-matrix beperkt immers de verspreiding van nutriënten en metabolisch afval en de circulatie van gassen in de biofilm (met name zuurstof en stikstofmonoxide)17, waardoor een groot aantal micro-omgevingen in de biofilm ontstaat. Bacteriën reageren op deze veranderende omstandigheden door hun stofwisseling aan te passen, bijvoorbeeld door over te schakelen van ademhaling naar fermentatie wanneer de zuurstof beperkt is.18 Het is onder deze heterogene omstandigheden dat zich zogenaamde «persistente» bacteriën ontwikkelen, die een zeer hoge tolerantie vertonen voor ontsmettingsmiddelen en antibiotica.
4. Verspreiding
Vanaf een bepaald rijpheidsstadium tenslotte, treedt de biofilm in een verspreidingsfase.19 De micro-organismen waaruit de rijpe biofilm is opgebouwd, komen continu vrij in de externe omgeving (zie figuur 1 D). Dit proces wordt op gecontroleerde wijze in gang gezet door de uitscheiding van enzymen of peptiden die de EPS-matrix kunnen destabiliseren.20 De bacteriën komen zo vrij uit de structuur van de biofilm om een nieuwe ecologische niche te koloniseren, op een ander oppervlak dat gunstig is voor de voltooiing van een nieuwe levenscyclus in de vorm van een biofilm.21,22
Figuur 1 – De vier ontwikkelingsstadia van de biofilm, chronologisch van links naar rechts.
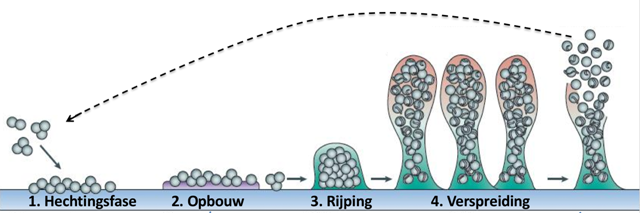
De EPS-matrix wordt in groen weergegeven, de bacteriën in oranje. A – Aanhechting van planktonische bacteriën, eerst omkeerbaar en dan onomkeerbaar. B – Accumulatie van biomassa voor de vorming van microkolonies. C – Rijping van de biofilm. De structuur neemt haar complexe 3-D vorm aan en binnen de biofilm ontwikkelen zich heterogeniteiten. D – Verspreiding, de biofilm geeft op een gedeeltelijk gecontroleerde manier bacteriën vrij in de omgeving. Deze laatsten kunnen nieuwe oppervlakken opnieuw koloniseren om een nieuwe cyclus te starten.
De verschillende rollen van de EPS-matrix
De samenstelling van de EPS-matrix kan sterk variëren afhankelijk van de soorten waaruit de biofilm bestaan. In de S. epidermidis biofilms is het dominante polymeer vaak poly-N-acetylglucosamine (PNAG)23, maar sommige stammen die geen PNAG kunnen aanmaken, vormen een tegenwicht door overexpressie van extracellulaire eiwitten24,25. Voor Pseudomonas aeruginosa bevat de matrix vooral alginaatachtige polysachariden, Pel en Psl polymeren.26 Ook extracellulaire DNA, ook wel DNAe genoemd, is een belangrijk aspect bij de matrix van de biofilms, met name dan bij Bacillus cereus.27 Lange nucleotidekettingen fungeren als cement voor de biofilm.28 De interactie van de EPS’s via verschillende soorten krachten (Van der Waals, elektrostatica en waterstofbruggen), zorgt voor cohesieve eigenschappen die de bacteriën in de biofilm met elkaar verbonden houden. Deze functie is essentieel om de integriteit van de biofilm in stand te houden en om te kunnen omgaan met externe krachten die de duurzaamheid van een biofilm aan de oppervlakte die het heeft gekoloniseerd in gevaar kunnen brengen.13
Naast deze eenvoudige mechanische cohesieve rol, fungeert de matrix van de biofilm als een reservoir van voedingsbestanddelen. Door zijn hygroscopische aard, kan die het water ophouden dat nodig is voor de groei van bacteriën.13 Biofilms zijn een manier van leven die vaak door bacteriën als een vorm van bescherming in stresssituaties wordt aangenomen. Het vermogen van de matrix van de biofilm om voedingsbestanddelen en water te adsorberen en vast te houden zorgt ervoor dat bacteriën in een biofilm onder minder gunstige omstandigheden kunnen blijven gedijen. De matrix fungeert ook als een beschermende barrière voor bacteriën in de biofilm. EPS vormen immers een dicht netwerk van polymeren dat de penetratie van predatoren (macrofagen, protozoa, virussen) in de biofilm sterk beperkt en zo de bacteriën die er verblijven, beschermt.21 Tot slot bevordert het de communicatiemechanismen tussen bacteriën, een fenomeen dat quorum sensing wordt genoemd. Dit systeem is gebaseerd op de detectie van signaalpeptiden die door de bacteriën zelf worden uitgestoten om hun soortgenoten te herkennen en hun gedrag te reguleren op basis van de dichtheid van hun populatie.29 In het geval van biofilm is de bacteriële populatie dicht en zet de matrix de signaalpeptiden in besloten ruimtes vast. Hierdoor worden de drempels van deze signaalmoleculen, zoals cyclische peptiden of homoserine lactonen, sneller bereikt, en zijn bacteriën in staat om samen te werken en zich te organiseren om te reageren op veranderingen in hun omgeving.30
Biofilms en de horizontale genoverdracht (HGO)
De nabijheid van micro-organismen en de stabiliteit van het milieu binnen biofilms bevorderen de genetische uitwisseling.31 In dit verband kunnen commensale (niet-pathogene) en pathogene micro-organismen op verschillende manieren genetische inhoud uitwisselen: directe uitwisseling van genetisch materiaal (conjugatie), absorptie van extern genetisch materiaal (transformatie) of modificatie van DNA door virusinfectie (transductie).
Deze genetische uitwisselingen worden kritisch wanneer het gaat om antibioticaresistentiegenen (bv. carbapenem-32 of vancomycine- 33resistentie) of genen die coderen voor virulentiefactoren. In dit geval wordt de biofilm een echt uitwisselingsforum waarin bacteriën hun persistentie- en pathogeniteitspotentieel verhogen.
Biofilms in een medische omgeving
De belangrijkste zorg van ziekenhuizen met betrekking tot biofilms heeft te maken met de betrokkenheid ervan bij diverse infectieuze aandoeningen. Sinds het pionierswerk van William Costerton in de jaren tachtig, is er heel wat literatuur die het probleem van biofilminfecties documenteert.34–37 Verschillende categorieën worden vaak genoemd. In de eerste categorie worden infecties aangetroffen op het deel van het lichaam van de patiënt die een invasieve operatie heeft ondergaan.38 Deze besmetting kan veroorzaakt zijn door de lucht, door contact met een lichaamsdeel van een lid van het medisch personeel of door een medisch hulpmiddel dat niet grondig werd gesteriliseerd of ontsmet. Vervolgens hangen twee categorieën infecties veroorzaakt door biofilms nauw samen met implantaten, namelijk infecties op centraal-veneuze katheters en urinaire katheters.39 De resistentie van biofilms tegen antibiotica bemoeilijkt de behandeling van patiënten met dergelijke aandoeningen.40 Vaak moet het geïnfecteerde hulpmiddel worden verwijderd. Meer in het algemeen kan elk geïmplanteerd materiaal als basis dienen voor de ontwikkeling van een biofilm als de hygiënische omstandigheden tijdens de operatie niet optimaal zijn.
Biofilms, een bron van ziekenhuisinfecties?
Hoewel de directe betrokkenheid van biofilms bij veel infectieuze processen vaststaat, blijft hun indirecte impact op de overdracht van ziekteverwekkers grotendeels onderschat. De ziekenhuisomgeving is echter niet immuun voor kolonisatie door bacteriële biofilms, die ideale reservoirs zijn voor micro-organismen. Deze reservoirs maken deel uit van een besmettingscyclus41 die patiënten, oorzakelijke agens (micro-organismen) en overbrengers zoals lucht, water42, medisch personeel, insecten43 of medische hulpmiddelen omvat.44
Verschillende studies maken melding van de aanwezigheid
van biofilms op oppervlakken in ziekenhuizen. Een studie uitgevoerd in een intensieve zorgafdeling van een Australisch ziekenhuis toonde na reiniging de aanwezigheid aan van methicilline resistente Staphylococcus aureus (MRSA) – en vancomycine-resistente enterokokken (VRE) -stammen in de vorm van biofilms. Zo testten de wanden van steriel geachte emmers, het stof van gordijnen of de oppervlakte van een plastic deur positief.45 Ook het geval van Acinetobacter baumannii riep vragen op. Veel bronnen melden namelijk dat de frequentie van de door deze soort veroorzaakte infecties toeneemt, waarschijnlijk als gevolg van de toegenomen persistentie van deze ziekteverwekker op inerte oppervlakken.46–48 Daarnaast kan A. baumannii zich als biofilm ontwikkelen op verschillende types inerte oppervlakken (glas, roestvrij staal en verschillende soorten plastic). Men vermoedt dat biofilms van A. baumannii een cruciale rol spelen bij het oplopen van infecties (met name urine- en bloedbaaninfecties) en het uitbreken van epidemieën in zorginstellingen.47,48
Ook het waterleidingsysteem van een ziekenhuis is een niet te onderschatten bron van microbiologische besmetting, meestal met Pseudomonas spp. en Legionella spp. bacteriën.49 In 2012 liepen acht patiënten in een ziekenhuis in Wisconsin binnen een relatief korte tijd (15 dagen) na hun opname in het ziekenhuis legionellose op. Het milieuonderzoek om de bron van de verontreiniging op te sporen toonde aan dat de oppervlakken van een decoratieve waterfontein grotendeels waren gekoloniseerd door Legionella-bacteriën, tot niveaus die 100.000 KVE (kolonie vormende eenheden)/oppervlakte-eenheid overschreden. Verdere analyse bevestigde de aanwezigheid van biofilm op verschillende onderdelen van de fontein.50 In een ander ziekenhuis in Noord-Ierland werd de uitgebreide aanwezigheid van biofilms van P. aeruginosa op het oppervlak van de waterkranen van een neonatale pediatrische afdeling vastgesteld. Deze biofilms vormen de meest waarschijnlijke bron van vele gevallen van P. aeruginosa-infecties bij zuigelingen, waarvan 4 met een dodelijke afloop.51 Beide voorbeelden tonen de sleutelrol van biofilm aan in de persistentie van pathogene bacteriën in het waterleidingsysteem. In contact met een biofilm fungeert water als een belangrijke overbrenger van ziektekiemen naar de patiënt.42,52
Ook medische hulpmiddelen kunnen door biofilms worden besmet. De huidige hoge normen inzake reiniging en ontsmetting slagen er niet in biofilms volledig uit te roeien, zelfs wanneer de aanbevelingen strikt worden opgevolgd. Deze biofilms zijn verankerd aan het oppervlak van medische hulpmiddelen en fungeren dan als hefboom voor de verspreiding van potentieel pathogene micro-organismen. Zo werden endotracheale tubes, die patiënten helpen bij de ademhaling, verantwoordelijk geacht voor de overdracht van ziekteverwekkers die op hun beurt tot ernstige longontstekingen, de zogenaamde ventilatorgeassocieerde pneumonieën, hebben geleid. In de meeste gevallen werden de kiemen die bij de patiënten longontstekingen veroorzaakten aangetroffen in biofilm op de wanden van de buizen.53,54 Een recente studie toonde aan dat de biofilms die deze buizen verontreinigen meersoortig zijn, met inbegrip van erkende ziekteverwekkers zoals P. aeruginosa, E. coli, K. pneumoniae maar ook microbiële soorten die zich vooral in de mond nestelen. Deze laatste worden geacht geen directe rol te spelen in de pathogenese. Ze zetten de vorming van een biofilm wel in gang, die mogelijk bovengenoemde pathogenen kan herbergen.55
Biofilms op oppervlakken en niet-implanteerbare medische hulpmiddelen zijn belangrijke reservoirs van pathogenen en opportunistische pathogenen, die een verhoogde bestendigheid vertonen. Hoewel het verband tussen deze biofilms en ziekenhuisinfecties minder goed gedocumenteerd is, zou een allesomvattende preventieaanpak rekening moeten houden met biofilms als schakel in de verspreiding en persistentie van ziektekiemen in de ziekenhuisomgeving.
Het bijzondere geval van endoscopen bij de overdracht van ziekteverwekkers van patiënt naar patiënt
Onder de medische hulpmiddelen heeft de medische en wetenschappelijke gemeenschap vooral oog voor de endoscopen. De «outbreaks» geassocieerd met het gebruik van endoscopen zijn niet langer een uitzondering en de gevallen van infecties die mogelijk verband houden met het gebruik van endoscopen worden steeds talrijker.56 In hun aanbevelingen voor 2008 verklaren de Centers for Disease Control (CDC) in de Verenigde Staten dat endoscopen veel vaker verantwoordelijk zijn voor uitbraken van besmettingen in de ziekenhuizen dan eender welk ander medisch hulpmiddel.57 Deze vaststelling werd in 2016 herhaald in de «Multisociety guidelines on endoscope reprocessing».58
De vorming van biofilms in de lumen van deze instrumenten bevordert sterk de persistentie van ziekteverwekkers zoals Klebsiella spp. en E. coli in gastroscopen, duodenoscopen en colonoscopen en ook van P. aeruginosa in bronchoscopen.59,60 De huidige ontsmettingsnormen zijn mogelijk ontoereikend om biofilms volledig uit te roeien, wat de deur open zet voor de accumulatie van bacteriële biomassa. Tijdens het gebruik en de reinigings- en ontsmettingscycli ontwikkelt de biofilm in endoscopen zich onder de vorm van de zogenaamde «Buildup Biofilm», waarvan bekend is dat die een verhoogde tolerantie vertoont voor de chemie die gebruikt wordt voor de ontsmetting van endoscopen. In een studie uit 2009 toonde dr. K. Alfa reeds de overvloed aan van deze ingenestelde en tegen ontsmetting resistente vorm van biofilm, die in een in vitro model van cyclus tot cyclus toeneemt.61 De grootste moeilijkheid voor de teams die verantwoordelijk zijn voor de ontsmetting van endoscopen is het gebrek aan middelen om een betrouwbare diagnose te stellen van de microbiologische reinheid van gebruiksklare hulpmiddelen.56 De huidige methoden voor het controleren van microbiologische besmetting van endoscopen zijn niet geschikt voor het opsporen van de aanwezigheid van dit type sterk ingenestelde en resistente biofilms zoals «Buildup biofilm». Bemonstering met een steriele oplossing wordt momenteel beschouwd als een van de referentiemethoden62, maar verzamelt slechts een deel van de biofilm die vrijkomt door de schuifkrachten van de steriele oplossing in het lumen van de endoscoop. Op basis van dit referentieprotocol is het dus niet mogelijk de werkelijke microbiologische besmetting van endoscopen te meten; het zal de besmetting veeleer onderschatten.
Onlangs nog werden in twee ziekenhuizen in Los Angeles twee gevallen van carbapenem-resistente enterobacteriën (CPE) – besmetting met dodelijke afloop in verband gebracht met het gebruik van duodenoscopen. Deze incidenten bevestigen de noodzaak om rekening te houden met de complexe vormen van microbiële besmetting in endoscopen en om de normen voor reiniging en ontsmetting daaraan aan te passen.
Strategieën om biofilmverontreiniging tegen te gaan
De afgelopen tien jaar heeft het besef van de risico’s die verbonden zijn met de aanwezigheid van biofilm op ziekenhuisoppervlakken en medische hulpmiddelen geleid tot de ontwikkeling van aangepaste oplossingen. De belangrijkste trend die op grote schaal wordt gevolgd, is de nadruk die intussen wordt gelegd op het belang van een grondige reiniging, vooraleer er ontsmettingsmiddelen worden gebruikt, waarvan de doeltreffendheid tegen biofilms beperkt is.63,64 In sommige gevallen hebben schoonmaakproducten in combinatie met een ontsmettingsmiddel, op basis van perazijnzuur bijvoorbeeld, een nadelig effect omdat de biofilm en het organisch materiaal zich op het te reinigen oppervlak gaan vastzetten.65 Besmettingen die zich op oppervlakken gaan vastzetten tasten de effectiviteit van het ontsmettingsmiddel aan door de toegang tot micro-organismen te beperken.66 Veel studies maken melding van de ontwikkeling van moleculen die voor een veel betere ontsmetting tegen bacteriën in biofilm zorgen. Met name de penetratie van biocide moleculen in biofilms is aanzienlijk verbeterd, bijvoorbeeld door de inkapseling ervan in nanodeeltjes.67 Deze laatste hebben een neutrale lading en een significant hogere diffusiecapaciteit via het polymeernetwerk van de bacteriële biofilm matrix. Ook een aanpak waarbij verschillende actieve bestanddelen worden gecombineerd met een anti-biofilm- en/of antibacterieel effect, heeft al veelbelovende resultaten opgeleverd.68
Ondanks de betere ontsmettingsformules is men het erover eens dat een efficiënte reiniging de beste manier is om ingenestelde organische stoffen af te breken en micro-organismen optimaal aan de ontsmettingsmiddelen bloot te stellen.69 Sommige op enzymen gebaseerde detergentformules voldoen aan dit criterium door op de componenten van de extracellulaire matrix van biofilms in te werken, waardoor de biofilms massaal worden opgelost. Recente resultaten van OneLife tonen de toegevoegde waarde van specifieke multi-enzymencomplexen aan bij het efficiënt verwijderen van biofilms, in vergelijking met andere detergenten (al dan niet enzymatisch).
Uitgaande van biofilmmodellen die in het laboratorium werden opgesteld op basis van in de Cliniques universitaires Saint-Luc geïsoleerde pathogene bacteriestammen (zie tabel 1), werden de prestaties op vlak van biofilmverwijdering van verschillende detergenten (zie tabel 2) geëvalueerd. Kort samengevat gebeurt dit als volgt: de biofilms worden gedurende 60 minuten in water van 40°C blootgesteld aan een detergent, gedoseerd volgens de aanbevelingen van de fabrikant zonder roeren of mechanische werking. De restbiomassa van de biofilms wordt vervolgens gekwantificeerd door middel van kleuring, waarna het percentage biofilmverwijdering ten opzichte van een onbehandelde controle wordt vastgesteld. Deze gepubliceerde resultaten (in het tijdschrift Central Service in 2017) tonen het brede werkingsspectrum en de superieure werkzaamheid van OneLife’s multi-enzyme detergent aan ten opzichte van andere producten (zie figuur 2).
Tabel 1 – Stammen gebruikt voor de vorming van biofilms in het laboratorium 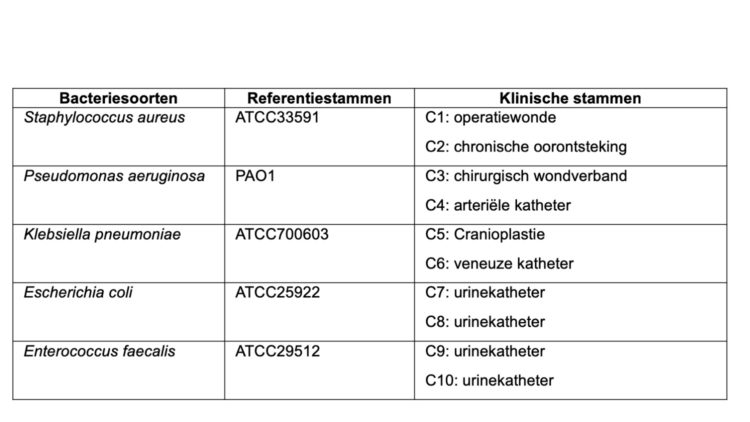
Tabel 2 – Beschrijving van de verschillende gebruikte detergenten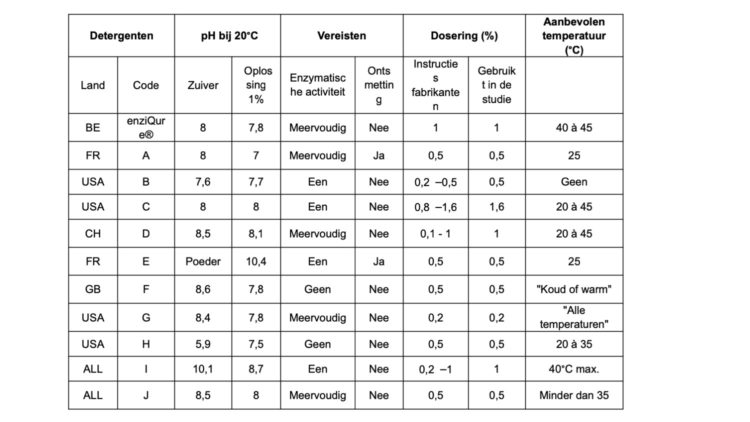
Figuur 2 – Percentages geëlimineerde biofilms gevormd in het laboratorium door de verschillende detergenten Elke geometrische vorm wordt geassocieerd met een bacteriële soort en elke kleur met een type isolaat: groen = referentie-isolaat (laboratorium); blauw en rood: klinische isolaten. De horizontale balken geven de algemene gemiddelden weer voor de 15 stammen per detergent met een betrouwbaarheidsinterval van 95%.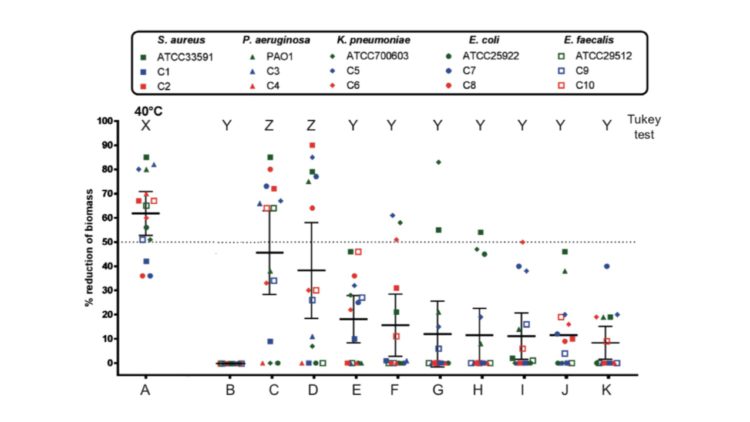
OneLife detergenten zijn ook getest in reële omstandigheden voor het handmatig reinigen van flexibele endoscopen in het CHU de Liège. EnziMed® Prevent, een detergent voor de dagelijkse en routinematige reiniging van endoscopen na elke procedure, werd vergeleken met een reinigingsmiddel met een andere samenstelling (niet-enzymatisch, pre-ontsmetting) door middel van een reinheidsanalyse vóór/na handmatige reiniging van endoscopen met behulp van de ATP-techniek (meting hoe vuil de instrumenten globaal genomen zijn). De resultaten worden in de komende weken gepubliceerd en tonen aan dat het gebruik van enziMed® Prevent een meerwaarde biedt voor een efficiënte handmatige reiniging, waardoor het instrument grondiger kan worden gereinigd vóór de chemische ontsmetting ervan met perazijnzuur (zie figuur 3). Het is nu algemeen aanvaard dat chemische ontsmetting alleen 100% effectief kan zijn als het wordt uitgevoerd op een schoon medisch hulpmiddel. Vuilresten kunnen de chemische ontsmetting verstoren en nadien een risico van microbiologische aanwezigheid in de endoscoop vormen.
Figuur 3 – Percentage endoscopen die voldoende proper zijn (drempelwaarde van 50 relative light units (RLU)) na handmatige reiniging met enziMed® Prevent of een niet-enzymatisch detergent (NEDD), afhankelijk van het type apparaat. De p-waarden van de chikwadraatvergelijkingstests zijn boven de histogrammen aangegeven.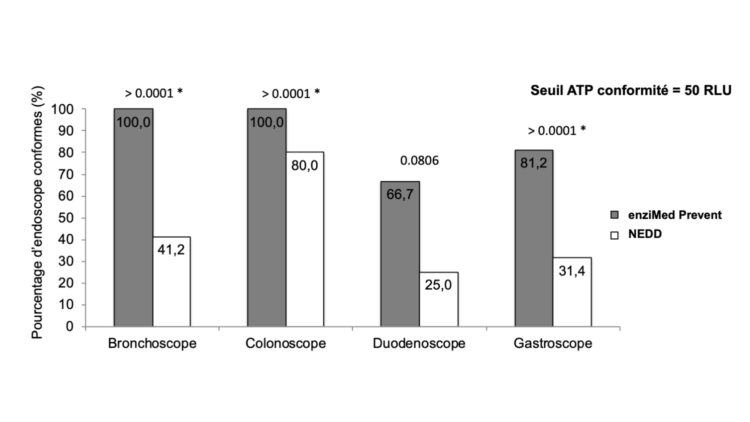
EnziQure®, een reinigingsmiddel voor de curatieve behandeling van biofilms door middel van een diepgaande reiniging, is ook getest in enkele tientallen ziekenhuizen in België en Frankrijk die persistente microbiologische besmetting in één of meer van hun endoscopen hebben vastgesteld. Door middel van een versterkt reinigingsprotocol met enziQure® (60 minuten inweektijd met 3 reinigingsbeurten met borstel) gevolgd door een gebruikelijke zelfreinigende ontsmetting, kon meer dan 90% van de behandelde endoscopen op een bevredigend microbiologisch niveau worden gereinigd (volgens de Franse kwaliteitsaanbevelingen van 2017).
Conclusies
Bacteriële biofilms zijn het resultaat van een evolutie die neigt naar het bevorderen van veerkrachtige levensstijlen, die bestand zijn tegen hoge druk van de omgeving. Biofilms zijn goed voor 90% van de bacteriële levenswijze in de natuur en koloniseren de ziekenhuisomgeving op inerte oppervlakken, in het waterleidingnet en op medische hulpmiddelen. Door hun aanwezigheid kunnen kiemen, die pathogeen kunnen zijn, soms verschillende maanden lang op oppervlakken gedijen en zo reservoirs vormen. Deze laatste vormen een gunstige omgeving voor genoverdracht, met name voor antibioticaresistentie.
Het belang van de rol van biofilms als oorzaak van ziekenhuisinfecties op geïmplanteerde medische hulpmiddelen is duidelijk aangetoond. De impact ervan als reservoir van ziekteverwekkers in ziekenhuizen, op inerte oppervlakken en niet-implanteerbare medische hulpmiddelen, wordt nu echter pas volledig onderzocht. De vele recente meldingen van uitbraken van CPE, Legionella of Pseudomonas wijzen erop dat biofilms een belangrijke oorzaak van besmetting van patiënten kunnen zijn. Daarom is de bestrijding van bacteriële biofilms cruciaal om de persistentie van ziekteverwekkers in ziekenhuizen te verminderen. Doordat ze fundamenteel verschillen van planktonische bacteriën, moeten strategieën ter bestrijding van biofilms zich richten op de integriteit van de biofilm en met name dan de PSE-matrix.
Dankwoord
De auteurs wensen behalve het team ziekenhuishygiëne en gastro-enterologie van het CHU Liège, ook prof. Françoise Van Bambeke en dr. Wafi Siala van het laboratorium voor moleculaire en cellulaire farmacologie van het Louvain Drug Research Institute van de UCL te bedanken voor hun medewerking aan de gegevens die in dit artikel worden voorgesteld.
Referenties
1 The Lancet Gastroenterology Hepatology TLG&. Scoping the problem: endoscopy-associated infections. Lancet Gastroenterol Hepatol 2018;3(7):445. Doi: 10.1016/S2468-1253(18)30168-7.
2 Jimeno A., Alcalde MM., Ortiz M., Rodríguez A., Alcaraz B., Vera F. Outbreak of urinary tract infections by Salmonella spp. after cystoscopic manipulation. Actas Urológicas Españolas 2016;40(10):646–9. Doi: 10.1016/j.acuro.2016.02.005.
3 Kola A., Piening B., Pape U-F., et al. An outbreak of carbapenem-resistant OXA-48 – producing Klebsiella pneumonia associated to duodenoscopy. Antimicrob Resist Infect Control 2015;4(1):8. Doi: 10.1186/s13756-015-0049-4.
4 Bancroft EA., English L., Terashita D., Yasuda L. Outbreak of Escherichia coli infections associated with a contaminated transesophageal echocardiography probe. Infect Control Hosp Epidemiol 2013;34(10):1121–3. Doi: 10.1086/673160.
5 Costerton JW., Lewandowski Z., Caldwell DE., Korber DR., Lappin-scott HM. Microbial biofilms. Annu Rev Microbiol 1995;49:711–45.
6 Monds RD., O’Toole GA. The developmental model of microbial biofilms: ten years of a paradigm up for review. Trends Microbiol 2009;17(2):73–87. Doi: 10.1016/j.tim.2008.11.001.
7 Hartford O., O’Brien L., Schofield K., Wells J., Foster TJ. The Fbe (SdrG) protein of Staphylococcus epidermidis HB promotes bacterial adherence to fibrinogen. Microbiology 2001;147(9):2545–52.
8 Herman P., El-Kirat-Chatel S., Beaussart A., Geoghegan JA., Foster TJ., Dufrêne YF. The binding force of the staphylococcal adhesin SdrG is remarkably strong. Mol Microbiol 2014;93(2):356–68. Doi: 10.1111/mmi.12663.
9 Vanzieleghem T., Herman-Bausier P., Dufrene YF., Mahillon J. Staphylococcus epidermidis Affinity for Fibrinogen-Coated Surfaces Correlates with the Abundance of the SdrG Adhesin on the Cell Surface. Langmuir 2015:150413154944000. Doi: 10.1021/acs.langmuir.5b00360.
10 Tang H., Cao T., Liang X., et al. Influence of silicone surface roughness and hydrophobicity on adhesion and colonization of Staphylococcus epidermidis. J Biomed Mater Res A 2009;88(2):454–63. Doi: 10.1002/jbm.a.31788.
11 Katainen J., Paajanen M., Ahtola E., Pore V., Lahtinen J. Adhesion as an interplay between particle size and surface roughness. J Colloid Interface Sci 2006;304(2):524–9. Doi: 10.1016/j.jcis.2006.09.015.
12 Busscher HJ., van der Mei HC. How do bacteria know they are on a surface and regulate their response to an adhering state? PLoS Pathog 2012;8(1):e1002440. Doi: 10.1371/journal.ppat.1002440.
13 Flemming H-C., Wingender J. The biofilm matrix. Nat Rev Microbiol 2010;8(9):623–33. Doi: 10.1038/nrmicro2415.
14 Davenport EK., Call DR., Beyenal H. Differential protection from tobramycin by extracellular polymeric substances from Acinetobacter baumannii and Staphylococcus aureus biofilms. Antimicrob Agents Chemother 2014;58(8):4755–61. Doi: 10.1128/AAC.03071-14.
15 Schwering M., Song J., Louie M., Turner RJ., Ceri H. Multi-species biofilms defined from drinking water microorganisms provide increased protection against chlorine disinfection. Biofouling 2013;29(8):917–28. Doi: 10.1080/08927014.2013.816298.
16 Stewart PS., Franklin MJ. Physiological heterogeneity in biofilms. Nat Rev Microbiol 2008;6(3):199–210. Doi: 10.1038/nrmicro1838.
17 Beyenal H., Lewandowski Z. Modeling mass transport and microbial activity in stratified biofilms. Chem Eng Sci 2005;60(15):4337–48. Doi: 10.1016/j.ces.2005.02.063.
18 Bester E., Kroukamp O., Wolfaardt GM., Boonzaaier L., Liss SN. Metabolic differentiation in biofilms as indicated by carbon dioxide production rates. Appl Environ Microbiol 2010;76(4):1189–97. Doi: 10.1128/AEM.01719-09.
19 Kaplan JB. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. J Dent Res 2010;89(3):205–18. Doi: 10.1177/0022034509359403.
20 McDougald D., Rice SA., Barraud N., Steinberg PD., Kjelleberg S. Should we stay or should we go: mechanisms and ecological consequences for biofilm dispersal. Nat Rev Microbiol 2012;10(1):39–50. Doi: 10.1038/nrmicro2695.
21 Jefferson KK. What drives bacteria to produce a biofilm? FEMS Microbiol Lett 2004;236(2):163–73. Doi: 10.1016/j.femsle.2004.06.005.
22 Hall-Stoodley L., Stoodley P. Biofilm formation and dispersal and the transmission of human pathogens. Trends Microbiol 2005;13(1):7–10. Doi: 10.1016/j.tim.2004.11.004.
23 Otto M. Staphylococcus epidermidis–the “accidental” pathogen. Nat Rev Microbiol 2009;7(8):555–67. Doi: 10.1038/nrmicro2182.
24 Christner M., Franke GC., Schommer NN., et al. The giant extracellular matrix-binding protein of Staphylococcus epidermidis mediates biofilm accumulation and attachment to fibronectin. Mol Microbiol 2010;75(1):187–207. Doi: 10.1111/j.1365-2958.2009.06981.x.
25 Valle J., Latasa C., Gil C., et al. Bap, a biofilm matrix protein of Staphylococcus aureus prevents cellular internalization through binding to GP96 host receptor. PLoS Pathog 2012;8(8):e1002843. Doi: 10.1371/journal.ppat.1002843.
26 Franklin MJ., Nivens DE., Weadge JT., Howell PL. Biosynthesis of the Pseudomonas aeruginosa Extracellular Polysaccharides, Alginate, Pel, and Psl. Front Microbiol 2011;2(August):167. Doi: 10.3389/fmicb.2011.00167.
27 Vilain S., Pretorius JM., Theron J., Brözel VS. DNA as an adhesin: Bacillus cereus requires extracellular DNA to form biofilms. Appl Environ Microbiol 2009;75(9):2861–8. Doi: 10.1128/AEM.01317-08.
28 Jakubovics NS., Shields RC., Rajarajan N., Burgess JG. Life after death: the critical role of extracellular DNA in microbial biofilms. Lett Appl Microbiol 2013;57(6):467–75. Doi: 10.1111/lam.12134.
29 Atkinson S., Williams P. Quorum sensing and social networking in the microbial world. J R Soc Interface 2009;6(40):959–78. Doi: 10.1098/rsif.2009.0203.
30 Dickschat JS. Quorum sensing and bacterial biofilms. Nat Prod Rep 2010;27(3):343–69. Doi: 10.1039/b804469b.
31 Molin S., Tolker-Nielsen T. Gene transfer occurs with enhanced efficiency in biofilms and induces enhanced stabilisation of the biofilm structure. Curr Opin Biotechnol 2003;14(3):255–61. Doi: 10.1016/S0958-1669(03)00036-3.
32 Goren MG., Carmeli Y., Schwaber MJ., Chmelnitsky I., Schechner V., Navon-Venezia S. Transfer of carbapenem-resistant plasmid from Klebsiella pneumoniae ST258 to Escherichia coli in patient. Emerg Infect Dis 2010;16(6):1014–7. Doi: 10.3201/eid1606.091671.
33 de Niederhäusern S., Bondi M., Messi P., et al. Vancomycin-resistance transferability from VanA enterococci to Staphylococcus aureus. Curr Microbiol 2011;62(5):1363–7. Doi: 10.1007/s00284-011-9868-6.
34 Dunny GM., Hancock LE., Shankar N. Enterococcal Biofilm Structure and Role in Colonization and Disease 2014.
35 Mombelli A., Décaillet F. The characteristics of biofilms in peri-implant disease. J Clin Periodontol 2011;38:203–13. Doi: 10.1111/j.1600-051X.2010.01666.x.
36 Wolcott R., Costerton JW., Raoult D., Cutler SJ. The polymicrobial nature of biofilm infection. Clin Microbiol Infect 2013;19(2):107–12. Doi: 10.1111/j.1469-0691.2012.04001.x.
37 Harriott MM., Noverr MC. Importance of Candida-bacterial polymicrobial biofilms in disease. Trends Microbiol 2011;19(11):557–63. Doi: 10.1016/j.tim.2011.07.004.
38 Kathju S., Nistico L., Hall-Stoodley L., Post JC., Ehrlich GD., Stoodley P. Chronic surgical site infection due to suture-associated polymicrobial biofilm. Surg Infect (Larchmt) 2009;10(5):457–61. Doi: 10.1089/sur.2008.062.
39 Trautner BW., Darouiche RO. Role of biofilm in catheter-associated urinary tract infection. Am J Infect Control 2004;32(3):177–83. Doi: 10.1016/j.ajic.2003.08.005.
40 Costerton JW., Montanaro L., Arciola CR. Biofilm in implant infections: its production and regulation. Int J Artif Organs 2005;28(11):1062–8.
41 Otter JA., Yezli S., Salkeld JAG., French GL. Evidence that contaminated surfaces contribute to the transmission of hospital pathogens and an overview of strategies to address contaminated surfaces in hospital settings. Am J Infect Control 2013;41(5):S6–11. Doi: 10.1016/j.ajic.2012.12.004.
42 Wingender J., Flemming H-C. Biofilms in drinking water and their role as reservoir for pathogens. Int J Hyg Environ Health 2011;214(6):417–23. Doi: 10.1016/j.ijheh.2011.05.009.
43 Graczyk TK., Knight R., Gilman RH., Cranfield MR. The role of non-biting flies in the epidemiology of human infectious diseases. Microbes Infect 2001;3(3):231–5. Doi: 10.1016/S1286-4579(01)01371-5.
44 Roberts CG. The role of biofilms in reprocessing medical devices. Am J Infect Control 2013;41(5 Suppl):S77-80. Doi: 10.1016/j.ajic.2012.12.008.
45 Vickery K., Deva a., Jacombs a., Allan J., Valente P., Gosbell IB. Presence of biofilm containing viable multiresistant organisms despite terminal cleaning on clinical surfaces in an intensive care unit. J Hosp Infect 2012;80(1):52–5. Doi: 10.1016/j.jhin.2011.07.007.
46 Roca I., Espinal P., Vila-Farrés X., Vila J. The Acinetobacter baumannii Oxymoron: Commensal Hospital Dweller Turned Pan-Drug-Resistant Menace. Front Microbiol 2012;3:148. Doi: 10.3389/fmicb.2012.00148.
47 Joshi SG. Acinetobacter baumannii : An emerging pathogenic threat to public health. World J Clin Infect Dis 2013;3(3):25. Doi: 10.5495/wjcid.v3.i3.25.
48 Longo F., Vuotto C., Donelli G. Biofilm formation in Acinetobacter baumannii. New Microbiol 2014;37:119–27.
49 Mulcahy LR., Isabella VM., Lewis K. Pseudomonas aeruginosa biofilms in disease. Microb Ecol 2014;68(1):1–12. Doi: 10.1007/s00248-013-0297-x.
50 Haupt TE., Heffernan RT., Kazmierczak JJ., et al. An Outbreak of Legionnaires Disease Associated with a Decorative Water Wall Fountain in a Hospital. Infect Control Hosp Epidemiol 2012;33:185–91. Doi: 10.1086/663711.
51 Walker JT., Jhutty A., Parks S., et al. Investigation of healthcare-acquired infections associated with Pseudomonas aeruginosa biofilms in taps in neonatal units in Northern Ireland. J Hosp Infect 2014;86(1):16–23. Doi: 10.1016/j.jhin.2013.10.003.
52 Falkinham JO., Hilborn ED., Arduino MJ., Pruden A., Edwards MA. Epidemiology and Ecology of Opportunistic Premise Plumbing Pathogens: Legionella pneumophila, Mycobacterium avium, and Pseudomonas aeruginosa. vol. In Press. 2015.
53 De Souza PR., De Andrade D., Cabral DB., Watanabe E. Endotracheal tube biofilm and ventilator-associated pneumonia with mechanical ventilation. Microsc Res Tech 2014;77(4):305–12. Doi: 10.1002/jemt.22344.
54 Gil-Perotin S., Ramirez P., Marti V., et al. Implications of endotracheal tube biofilm in ventilator-associated pneumonia response: a state of concept. Crit Care 2012;16(3):R93. Doi: 10.1186/cc11357.
55 Vandecandelaere I., Coenye T. Microbial composition and antibiotic resistance of biofilms recovered from endotracheal tubes of mechanically ventilated patients. Adv Exp Med Biol 2015;830:137–55. Doi: 10.1007/978-3-319-11038-7_9.
56 Kovaleva J., Peters FTM., van der Mei HC., Degener JE. Transmission of infection by flexible gastrointestinal endoscopy and bronchoscopy. Clin Microbiol Rev 2013;26(2):231–54. Doi: 10.1128/CMR.00085-12.
57 Rutala WA., Weber DJ., HICPAC. CDC Guidelines for Disinfection and Sterilization in Healthcare Facilities 2008:1–27.
58 Petersen BT., Cohen J., Hambrick RD., et al. Multisociety guideline on reprocessing flexible GI endoscopes: 2016 update. Gastrointest Endosc 2017;85(2):282–94. Doi: 10.1016/j.gie.2016.10.002.
59 Muscarella LF. Risk of transmission of carbapenem-resistant Enterobacteriaceae and related “superbugs” during gastrointestinal endoscopy. World J Gastrointest Endosc 2014;6(10):457–74. Doi: 10.4253/wjge.v6.i10.457.
60 Kovaleva J., Peters FTM., van der Mei HC., Degener JE. Transmission of infection by flexible gastrointestinal endoscopy and bronchoscopy. Clin Microbiol Rev 2013;26(2):231–54. Doi: 10.1128/CMR.00085-12.
61 Alfa MJ., Howie R. Modeling microbial survival in buildup biofilm for complex medical devices. BMC Infect Dis 2009;9:56. Doi: 10.1186/1471-2334-9-56.
62 Ministère de la santé et des solidarités DGS/DHOS C. Elements D’Assurance Qualite En Hygiene Relatifs Au Contrôle Microbiologique des Endoscopes et à la Tracabilite en Endoscopie 2007:1–55.
63 Abreu AC., Tavares RR., Borges A., Mergulhão F., Simões M. Current and emergent strategies for disinfection of hospital environments. J Antimicrob Chemother 2013;68(July):2718–32. Doi: 10.1093/jac/dkt281.
64 Dancer SJ. The role of environmental cleaning in the control of hospital-acquired infection. J Hosp Infect 2009;73(4):378–85. Doi: 10.1016/j.jhin.2009.03.030.
65 Kampf G., Fliss PM., Martiny H. Is peracetic acid suitable for the cleaning step of reprocessing flexible endoscopes? World J Gastrointest Endosc 2014;6(9):390–406. Doi: 10.4253/wjge.v6.i9.390.
66 Knieler R. Manual cleaning and disinfection of flexible endoscopes–an approach to evaluating a combined procedure. J Hosp Infect 2001;48 Suppl A:S84-7.
67 Forier K., Raemdonck K., De Smedt SC., Demeester J., Coenye T., Braeckmans K. Lipid and polymer nanoparticles for drug delivery to bacterial biofilms. J Control Release 2014;190:607–23. Doi: 10.1016/j.jconrel.2014.03.055.
68 Varposhti M., Abdi Ali A., Mohammadi P. Synergistic Effects of Bismuth Thiols and Various Antibiotics Against Pseudomonas aeruginosa Biofilm. Jundishapur J Microbiol 2014;7(3):e9142. Doi: 10.5812/jjm.9142.
69 Martiny H., Floss H., Zühlsdorf B. The importance of cleaning for the overall results of processing endoscopes. J Hosp Infect 2004;56 Suppl 2:S16-22. Doi: 10.1016/j.jhin.2003.12.027.
70 Auteur Thomas Van Vanzieleghem werkt ook bij OneLife S.A., Avenue Albert Einstein 15, 1348 Louvain-la-Neuve