1. Thuishospitalisatie, organisatie en coördinatie
Thuishospitalisatie kent momenteel een groot succes in België, waar het aantal pilootprojecten blijft toenemen.[1] Het principe achter thuishospitalisatie is om de terugkeer van de patiënt naar huis te organiseren, met voortzetting van de complexe zorgverlening (zoals intraveneuze anti-infectieuze behandelingen) die tijdens de hospitalisatie werd opgestart. OPAT (Outpatient Parenteral Antimicrobial Therapy) werd reeds sterk ontwikkeld, niet alleen in de Verenigde Staten maar ook in Frankrijk en Engeland (In Frankrijk, 4,4 miljoen dagen thuishospitalisatie in 2014 [2]).
Het toedienen van intraveneuze anti-infectieuze behandelingen is de eerste indicatie voor thuishospitalisatie, na parenterale voeding en chemotherapie. Ook complexe zorgverstrekking zoals wondverzorging kan via negatieve druktherapie thuis worden voortgezet.
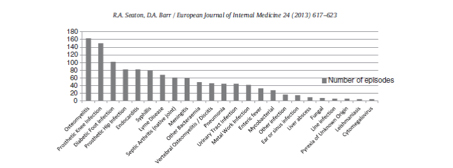
De types infectieuze aandoeningen die via thuishospitalisatie kunnen worden behandeld zijn talrijk en gevarieerd.
Figuur 1: Types infecties die de dienst thuishospitalisatie in Glasgow tussen 2001 en 2011 heeft behandeld, met uitzondering van 1389 infecties van huid en weke delen (Uit «Outpatient antimicrobial therapy: Principles and practice»[3])
In Engeland zijn specifieke aanbevelingen voor de organisatie van thuishospitalisatie gepubliceerd[2], met name op vlak van selectiecriteria voor patiënten en de checklist van onderdelen die moeten worden goedgekeurd, vooraleer de patiënt voor thuishospitalisatie in aanmerking kan komen.
Figuur 2: Checklist vóór toepassing van thuishospitalisatie (uittreksel uit «Outpatient antimicrobial therapy: Principles and practice»[4]).
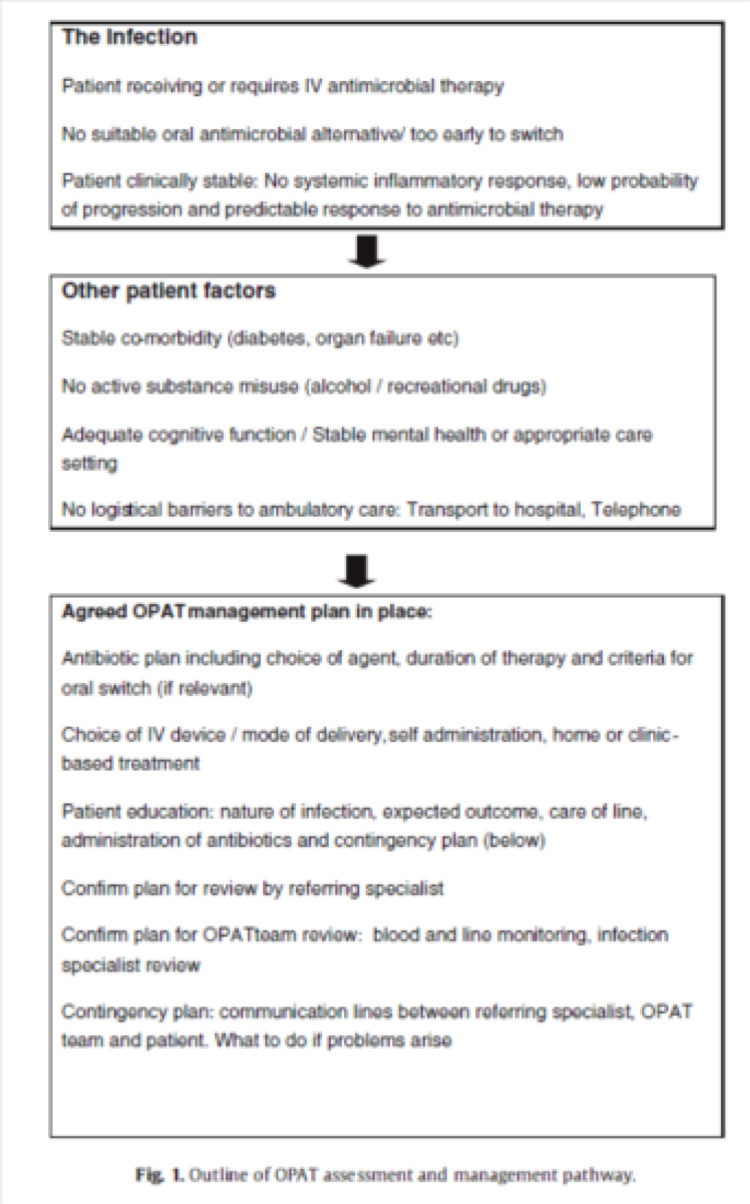
IV: intravenously, OPAT: outpatient parenteral antimicrobial therapy.
Het succes van thuishospitalisatie gaat gepaard met een strakke organisatie van de zorgketen. De coördinerend arts kan een infectioloog of ziekenhuisgeneesheer zijn, die nauw samenwerkt met de geneesheer-infectioloog en die bepaalt of de patiënt, rekening houdend met zijn toestand, al dan niet in aanmerking komt voor thuishospitalisatie (geen koorts, reageert goed op de anti-infectieuze behandeling,…). Hij gaat na of er geen tegenindicaties zijn voor een terugkeer naar huis van de patiënt met een vasculaire toegangsweg (toxicomanie, cognitieve toestand van de patiënt, gezondheidsvoorwaarden bij de patiënt thuis,…). Hij bepaalt vervolgens het type anti-infectieuze behandeling dat moet worden voortgezet en de toedieningsmodaliteiten. De coördinerende verpleegkundige is een ziekenhuisverpleegkundige die op de dienst thuishospitalisatie werkt. Hij staat niet in voor de thuisverzorging van de patiënt, hij ziet wel toe op de continuïteit van de zorgverlening door de terugkeer van de patiënt naar huis in optimale omstandigheden te organiseren. Hij coördineert alles en is de link tussen de verschillende actoren (geneesheer-specialist, ziekenhuisapotheek en stadsapotheek, behandelend geneesheer, verpleegkundig team dat de patiënt thuis verzorgt,…). Hij ziet ook toe op de toepassing van de hygiëneprotocollen die binnen het ziekenhuis gelden voor het manipuleren van de vasculaire toegangswegen bij de patiënt thuis.
De verpleegkundigen die de patiënt thuis verzorgen moeten vooraf een specifieke opleiding volgen over het gebruik van de katheter. Voor de toediening via perifere veneuze weg is een herhaling van de procedure voor de bereiding van de in te spuiten infusievloeistoffen en voor het onderhoud van de katheter noodzakelijk. De verpleegkundige-hygiënisten of de coördinerende verpleegkundige kan deze opleiding geven. Voor de katheters van het type Peripherical Inserted Central Catheter (PICC-line) moet de opleiding worden uitgebreid met een specifieke sessie over de procedure voor het manipuleren van de katheter en de vervanging van het verband. Deze opleiding kan worden gegeven door de verpleegkundige-hygiënisten of de coördinerende verpleegkundige. Ook het bedrijf dat de PICC-line commercialiseert kan bij de opleiding worden betrokken. Het beschrijven van de verpleegkundige zorgen voor het onderhoud van de katheter dient nauwkeurig te gebeuren (aantal keren dat het systeem of het verband moet worden vervangen en een gedetailleerde procedure van de zorgverstrekking). Om bij de patiënt thuis kwalitatief hoogstaande verpleegkundige zorgen te kunnen verstrekken, moet vooraf ook de hoeveelheid materiaal worden bepaald. Voor het vertrek van de patiënt moet worden nagegaan of het nodige materiaal in de stadsapotheek beschikbaar is (om wanneer het materiaal ambulant niet beschikbaar is, beroep te kunnen doen op de ziekenhuisapotheek). Idem voor de anti-infectueuze behandeling. De coördinerende verpleegkundige moet zich bij aanvang van de behandeling ook naar de woonplaats van de patiënt kunnen begeven, om er vooraf na te gaan of alle voorwaarden wel aanwezig zijn.
Een andere cruciaal element in de thuishospitalisatie is de scholing van de patiënt en zijn omgeving. De patiënt wordt actief betrokken bij zijn therapeutisch project. Hij moet goed beseffen wat voor uitdaging een terugkeer naar huis met een invasief systeem als een katheter wel is. Wanneer de patiënt de afspraken niet nakomt, kan het zorgcontract worden verbroken. Het verwijderen van de katheter of een terugkeer naar de klassieke hospitalisatie zijn dan mogelijke opties. Mochten er zich kathetergerelateerde complicaties voordoen moeten ook richtlijnen in geval van nood worden gegeven (op welke manier reageren, gegevens contactpersonen). De nooddiensten in het ziekenhuis moeten in geval van vermoeden van occlusie van de katheter een procedure toepassen (gepulseerd spoelen, hepariniseren van de katheter, of zelfs gebruik van urokinase).
Ook de opvolging van de patiënt moet worden gepland: afspraak met de geneesheer-specialist, biologische balans, eventuele bijkomende onderzoeken.
Een strikte organisatie van de thuishospitalisatie garandeert dat de thuishospitalisatie van de patiënt veilig zal verlopen. Een duidelijke verdeling van de taken en verantwoordelijkheden van de verschillende actoren zorgt voor een continuïteit van de zorgverlening bij de terugkeer naar huis.
2. Voor elke situatie een katheter
De keuze van het type veneuze toegangsweg is een belangrijke stap in de voorbereiding van de terugkeer naar huis. Een foute keuze van het type katheter veroorzaakt niet enkel meer complicaties wegens onaangepastheid van het systeem maar ook minder comfort voor de patiënt.
Figuur 3: Verschillende types vasculaire toegangswegen (uittreksel «The Michigan Appropriateness Guide for Intravenous Catheters (MAGIC)»[5])
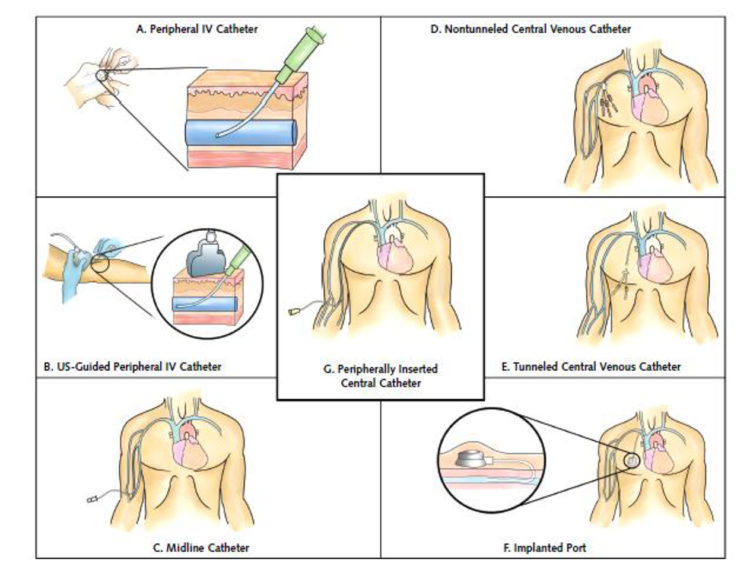
Een perifeer ingebrachte centraalveneuze katheter is een optie als de duur van de intraveneuze behandeling kort is (idealiter < 5 dagen), de behandeling geen venotoxische moleculen (zoals vancomycine) bevat, en als het netwerk van aders van de patiënt nog goed functioneert.
Het toedieningssysteem moet om de 72 à 96 uur worden vervangen.[6]
Voor behandelingen die minder dan 14 dagen duren kan worden gedacht aan een katheter van het type Midline. De katheter is 8 à 25 cm lang. De gebruiksduur is beperkt tot 6 weken. Infusie van vloeistoffen met extreme pH-waarden (<5 of >9) en/of van hyperosmolaire vloeistoffen (> 600 mosmol/L) wordt hier sterk afgeraden omdat het hier niet om een centraal veneuze toegangsweg gaat. Bepaalde gegevens wijzen op een complicatiepercentage dat niet significant verschillend is tussen de Midline en PICC-line voor de infusie van vancomycine, ondanks de pH-waarde van de molecule.[7]
Wanneer het veneus kapitaal gering is, de behandeling langer dan 2 weken duurt of indien de gebruikte moleculen venotoxisch zijn, is de plaatsing van een PICC-line een alternatief dat heel wat voordelen biedt. In tegenstelling tot de Midline gaat het om een centraal-veneuze katheter.
De katheter kan 3 maanden, tot zelfs 1 jaar blijven zitten.
Via de PICC-line kunnen verschillende types anti-infectieuze behandelingen worden toegediend (op voorwaarde dat rekening wordt gehouden met de onverenigbaarheid van bepaalde geneesmiddelen indien verschillende moleculen worden gebruikt). Dit systeem is niet aangewezen bij reanimatie via snelle infusie van vloeistoffen voor vasculaire vulling.
Voor behandelingen van meer dan een maand kan een poortkatheter worden ingebracht, vooral als er herhaalde behandelingen op intermitterende wijze zijn gepland (in oncologie bijvoorbeeld).
Er bestaan instrumenten om te bepalen welke katheter het best aan de situatie van de patiënt is aangepast [4].
Figuur 4: Systemen van veneuze toegangswegen aanbevolen voor de infusie van niet-venotoxische vloeistoffen (uittreksel uit «The Michigan Appropriateness Guide for Intravenous Catheters (MAGIC)»[5])
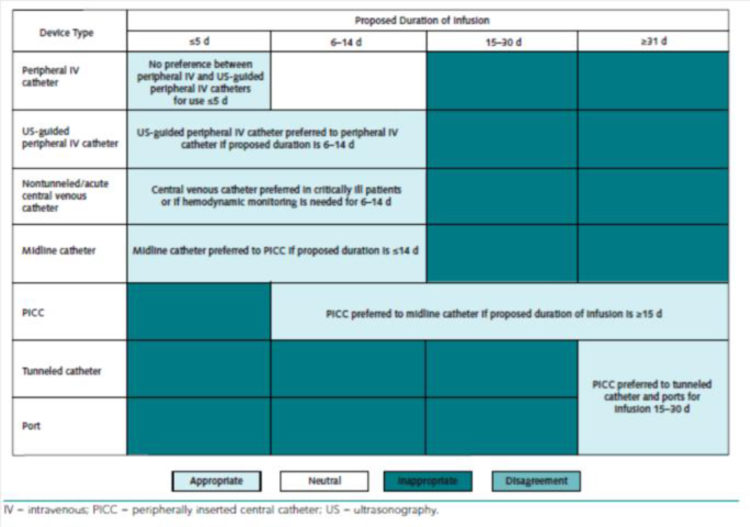
Figuur 5: Systemen van veneuze toegangswegen aanbevolen voor de infusie van venotoxische vloeistoffen (uittreksel uit «The Michigan Appropriateness Guide for Intravenous Catheters (MAGIC)»[5])
Er bestaan ook specifieke aanbevelingen voor patiënten die mogelijks dialyse moeten ondergaan en bij wie een shunt werd aangelegd.[5]
Het type katheter kiezen dat is aangepast aan de situatie van de patiënt is een belangrijk element in het zorgparcours van de patiënt, zowel in de klassieke hospitalisatie als bij de thuishospitalisatie. Dankzij de nieuwe types katheters zoals de Midlines of de PICC-lines kan worden ingespeeld op nieuwe specifieke behoeften bij de terugkeer naar huis. De discussie over de keuze van katheter die het meest geschikt is voor een eventuele terugkeer naar huis moet op voorhand worden gevoerd (zodra de klinische situatie van de patiënt stabiel is).
3. De PICC-line, sleutel voor succes
De PICC-line wordt steeds vaker gebruikt bij thuishospitalisatie.
Zijn voorloper, de drum katheter die in de jaren 1970 werd gebruikt, had een kwalijke reputatie omwille van de moeilijke plaatsing en de veelvuldige thromboses (had te maken met zijn aanzienlijke kaliber).
Figure 6 : drum katheter
Figure 7: PICC-line
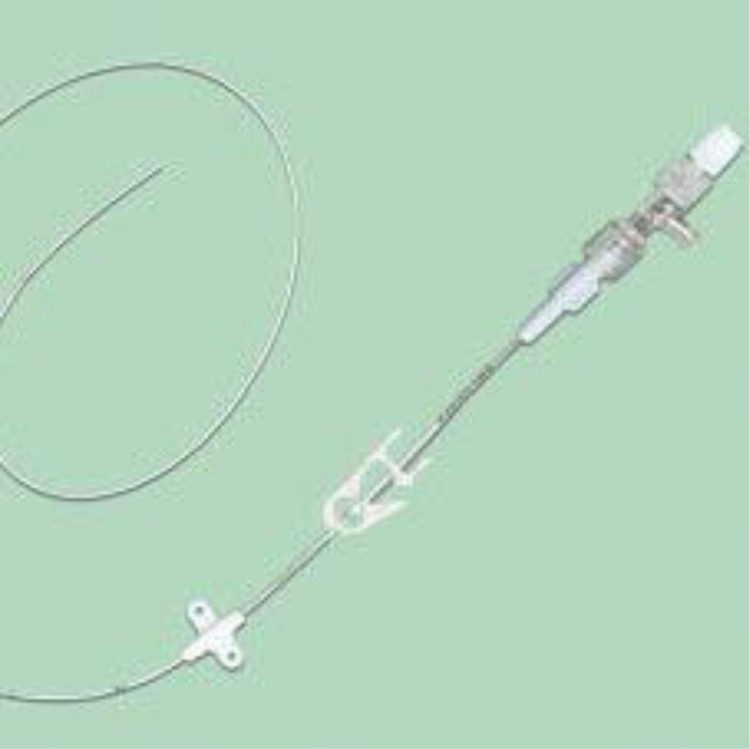
De PICC-line is een systeem dat in de jaren 1990 in de Verenigde Staten is ontwikkeld en dat momenteel in Europa doorbreekt.
Het is een algemene katheter uit siliconen of polyurethaan van 50 à 60 cm lang, die in de vena basalica of zelfs v. brachialis en v. cephalica wordt ingebracht. Het inbrengen gebeurt via echografie. Tijdens de plaatsing zijn dan ook chirurgisch aseptische omstandigheden vereist.
Een tweerichtingsklep kan in de PICC-line worden geïntegreerd of eraan worden gekoppeld. Deze klep moet ervoor zorgen dat de katheter minder snel dichtslibt, vermijdt dat het bloed terugstroomt en beschermt bovendien tegen risico op gasembolie.
De katheter blijft op z’n plaats zitten via een «stabiliserend» bevestigingssysteem waarvoor geen hechtingen nodig zijn (Griplock© systeem).
De PICC-line is een centraal-veneuze katheter waarvan het uiteinde zich ter hoogte van de vena cava superior bevindt. De voorzorgsmaatregelen bij manipulatie zijn dezelfde als voor de klassieke, in de reanimatie gebruikte centraal-veneuze toegangswegen.
Uit de meest recente [8] studies blijkt dat er zich bij 9% van de patiënten in thuishospitalisatie, kathetergerelateerde complicaties voordoen. Occlusie van de katheter is de meest frequente complicatie (2,46 occlusies voor 1000 dagen thuishospitalisatie).
Figuur 8: PICC-line gerelateerde complicaties bij thuishospitalisatie (uit «Vascular access complications during outpatient parenteral antimicrobial therapy at home: a retrospective cohort study. «.[8])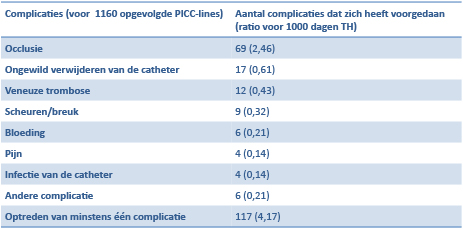
PICC: Peripherical Inserted Central Catheter TH: thuishospitalisatie
Occlusie en infectie van de katheter kunnen worden vermeden door de aanbevelingen inzake PICC-gerelateerd(e) goede praktijken en risicobeheer op te volgen, die door de Franse vereniging voor ziekenhuishygiëne werden geformuleerd..[9]
Als de aanwezigheid van meerdere lumina niet is vereist, zal worden gekozen voor een single-lumen PICC-line.
De lumen-diameter bedraagt idealiter ≤ 4 french gauge (fr) voor single-lumen katheters en ≤ 5 fr voor multi-lumen katheters (hogere kalibers worden geassocieerd met een verhoogd risico op occlusie van de katheter[9]).
Opleiding van het verpleegkundig personeel kan de PICC-line-gerelateerde complicaties sterk beperken: het naleven van de bundels (waaronder een specifieke opleiding voor zorgverstrekkers), die de regels bepalen voor het manipuleren van de katheter, doet het aantal complicaties dalen van 13% naar 4,24%.[8]
Door herhaalde pulserende spoelbeurten met opeenvolgende bolussen van 3 mL NaCl 0,9% voor intraveneus gebruik, kan het risico op occlusie van de katheter worden beperkt (minimum 10 à 20 mL/dag na elk gebruik, en minstens één keer per dag in geval de katheter verschillende dagen niet wordt gebruikt). Zodra de katheter niet langer nuttig is, moet worden gedacht aan verwijdering ervan.
Voor alle distale manipulaties wordt handhygiëne met een hydroalcoholische oplossing aanbevolen.
De vervanging van het verband, inclusief vervanging van het bevestigingssysteem en de klep, is een kritieke stap in het onderhoud van de katheter. Aangeraden wordt om het verband minstens om de 8 dagen te vervangen (en ook zodra het verband vuil is of loskomt).
De vervanging van het verband moet in aseptische omstandigheden gebeuren (verpleegkundige en patiënt dragen een chirurgisch masker, gebruik van steriele handschoenen en steriel materiaal).
Het insteekpunt van de katheter en het bevestigingssysteem moeten worden bedekt met eenzelfde transparant en semi-permeabel verband.
Figuur 9: Bevestigingssysteem van de PICC-line (Peripherical Inserted Central Catheter)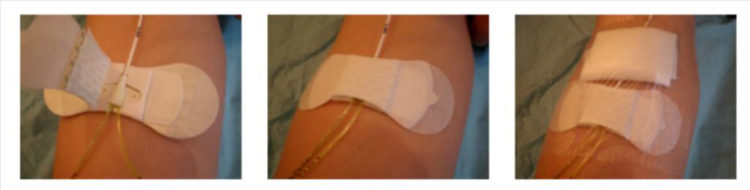
De terbeschikkingstelling van verzorgingssetjes, inclusief alle materiaal voor de vervanging van het verband, vergemakkelijkt thuiszorg in optimale hygiënische omstandigheden.
Figuur 10: Voorbeeld van een set voor de vervanging van het verband van de PICC-line (Peripherical Inserted Central Catheter)
Het verwijderen van de katheter gebeurt door de coördinerende geneesheer of de coördinerende verpleegkundige onder medische supervisie. Dit kan tijdens de consultatie gebeuren. De totale lengte van de katheter moet worden nagezien. Het proximale uiteinde zal enkel voor kweek naar het laboratorium worden gezonden als een infectie van de katheter wordt vermoed.
Conclusie:
Uit een retrospectieve analyse van complicaties als gevolg van een anti-infectueuze behandeling bij een klassieke ziekenhuis- versus een thuishospitalisatie, blijkt er geen significant verschil qua aantal te zijn, en dit in landen waar thuishospitalisatie al sterk ingeburgerd is [10], ook niet bij specifieke populaties zoals op geriatrie [11] of pediatrie. Deze resultaten eisten evenwel een strakke organisatie van de zorgketen, een keuze van de katheter die het best is aangepast aan de situatie van de patient, en het naleven van de maatregelen op vlak van hygiëne bij de patiënt thuis. Het gebruik van PICC-line katheters thuis is mogelijk, mits opleiding en begeleiding van de verpleegkundigen die de thuiszorg verstrekken. De rol van de coördinerend verpleegkundige en de dienst thuishospitalisatie, en van de teams ziekenhuishygiëne zijn essentieel bij de omkadering van dit soort nieuwe praktijken.
De ontwikkeling van de thuishospitalisatie wordt o.a. bemoeilijkt door praktische problemen zoals de beschikbaarheid van antibiotica of injectiemateriaal in stadsapotheken (en door de onaangepaste verpakkingen). Ook de kosten ten laste van de patiënt blijft momenteel nog een probleem, omdat er vooralsnog geen «OPAT forfait» bestaat zoals dat voor de parenterale voeding thuis, wel het geval is. Alle positieve aspecten zoals het therapeutische succes, de tevredenheid van de patiënt maar ook de voordelen op medisch-economisch vlak zijn argumenten om thuishospitalisatie verder te ontwikkelen.
Referenties
[1] Farfan-Portet MI, Denis A, Mergaert L. L’hospitalisation à domicle: Orientations pour un modèle belge. KCE reports 250.Health Services Research. 2015
[2] Données de la federation nationale française des établissements d’hospitalisation à domicile 2014
[3] Chapman AL, Seaton RA, Cooper MA et al. Good practice recommendations for outpatient parenteral antimicrobial therapy (OPAT) in adults in the UK:a consensus statement. J Antimicrob Chemotherap. 2012. 67; 1053-1062
[4] Seaton RA, Barr DA. Outpatient parenteral antibiotic therapy: principles and practice.Eur J Intern Med. 2013, 24; 617-623
[5] Chopra V, Flanders SA, Saint S. The Michigan Appropriateness Guide for Intravenous Catheters (MAGIC): Results From a Multispecialty Panel Using the RAND/UCLA Appropriateness Method. Ann Intern Med. 2015. 163 (S); 1-48
[6] O’Grady NP, Alexander M, Burns LA et al. Guidelines for the prevention of intravascular catheter-related infections.Am J Infect Control. 2011. 39; S1-34
[7] Caparas JV, Hu JP. Safe administration of vancomycin through a novel midline catheter: a randomized, prospective clinical trial. J Vasc Access. 2014. 15 ; 251-256
[8] Shrestha NK, Shrestha J, Everett A et al. Vascular access complications during outpatient parenteral antimicrobial therapy at home: a retrospective cohort study. J Antimicrob Chemotherap. 2016. 741; 506-512
[9] Recommandations par consensus formalisé: Bonnes pratiques et gestion des risques associés au picc. Hygiènes. 2013. 6; 1-124
[10] Seetoh t, Lye DC, Cook AR. An outcomes analysis of outpatient parenteral antibiotic therapy (OPAT) in a large Asian cohort. Int J Antimicrob Chemotherap. 2013. 41; 569-573
[11] Mujal A, Sola J, Hernandez M. Safety and effectiveness of outpatient parenteral antimicrobial therapy in older people.J Antimicrob Chemotherp. 2016.