Inleiding
Impetigo is een oppervlakkige huidinfectie die vooral voorkomt bij kinderen. Deze infectie wordt frequent veroorzaakt door Staphylococcus aureus, maar ook groep A beta-hemolytische streptokokken of Streptococcus pyogenes kunnen aanleiding geven tot impetigo. [10, 11] Uitbraken van impetigo door Staphylococcus aureus op de afdelingen materniteit en neonatale intensieve zorgen werden beschreven in de literatuur. [1-9] Bij deze uitbraken werden verzorgingsmateriaal en (asymptomatisch) dragerschap van Staphylococcus aureus bij moeders of gezondheidswerkers als mogelijke bronnen of vehikels aangehaald.
Dit artikel beschrijft 3 uitbraken van impetigo door Staphylococcus aureus op een afdeling materniteit in de periode juni 2012 – maart 2013.
Methode
Naar aanleiding van de uitbraken van impetigo door Staphylococcus aureus in ons ziekenhuis werd een epidemiologisch onderzoek gestart bestaande uit literatuuronderzoek, retrospectieve dossieranalyse, afname van omgevingsstalen, screenen van gezondheidswerkers en genotypering van de stammen door 2 externe laboratoria.
Het genetisch typeren van de stammen gebeurde in uitbraak 1 met Diversilab (BioMérieux), een commercieel beschikbaar en geautomatiseerd genotyperingssysteem gebaseerd op repetitieve sequentie-gebaseerde Polymerase Chain Reaction (PCR), rep-PCR genaamd. [13] Bij uitbraak 2 en 3 werd gebruik gemaakt van Spa-typering. Deze typering is gebaseerd op polymorfismen zowel in aantal als sequentie van repeat elementen van het hypervariabel deel van het spa-gen (staphylococcal protein A gen). [12]
Beschrijving van uitbraken en aanpak
In de periode juni 2012 – maart 2013 manifesteerden zich 3 uitbraken van impetigo op de afdeling materniteit van één van de campussen van het Onze-Lieve-Vrouw Ziekenhuis. Veertien neonati werden besmet met een methicilline gevoelige Staphylococcus aureus, waarvan 13 neonati een infectie ontwikkelden. De letsels situeerden zich voornamelijk ter hoogte van de liesregio, het aangezicht, de oksel en de navel. De mediane tijd van geboorte tot het optreden van de letsels bedroeg 5 dagen. In de meeste gevallen volstond een lokale behandeling; 3 neonati. Neonati hadden systemische behandeling met antibiotica nodig. Bij geen van de neonati traden complicaties op.
Uitbraak 1 : 01/06-12/07/2012
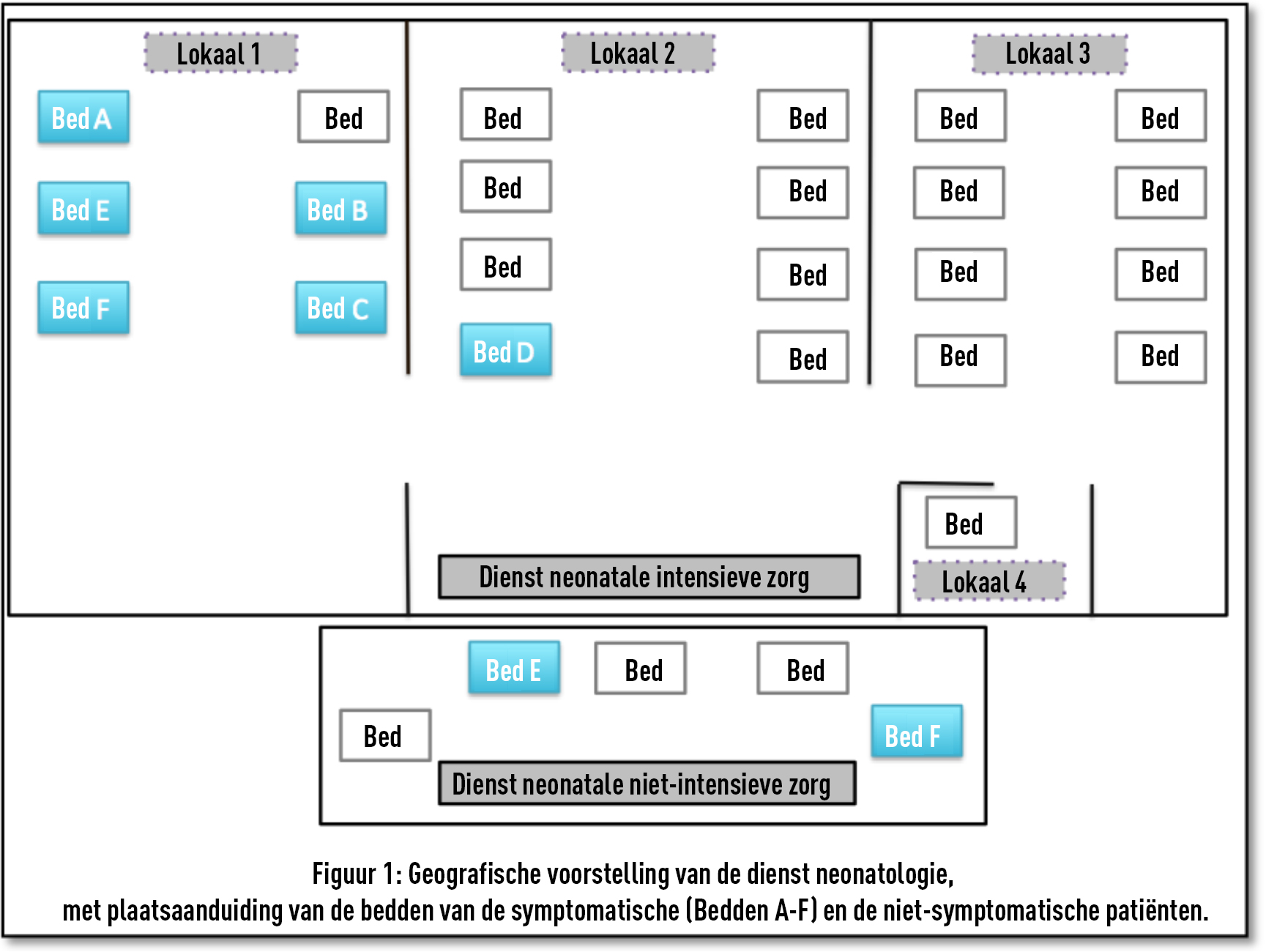
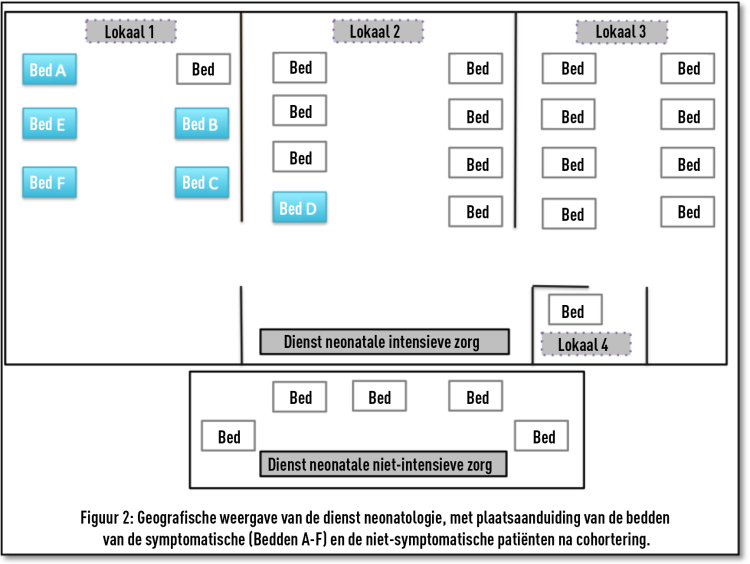
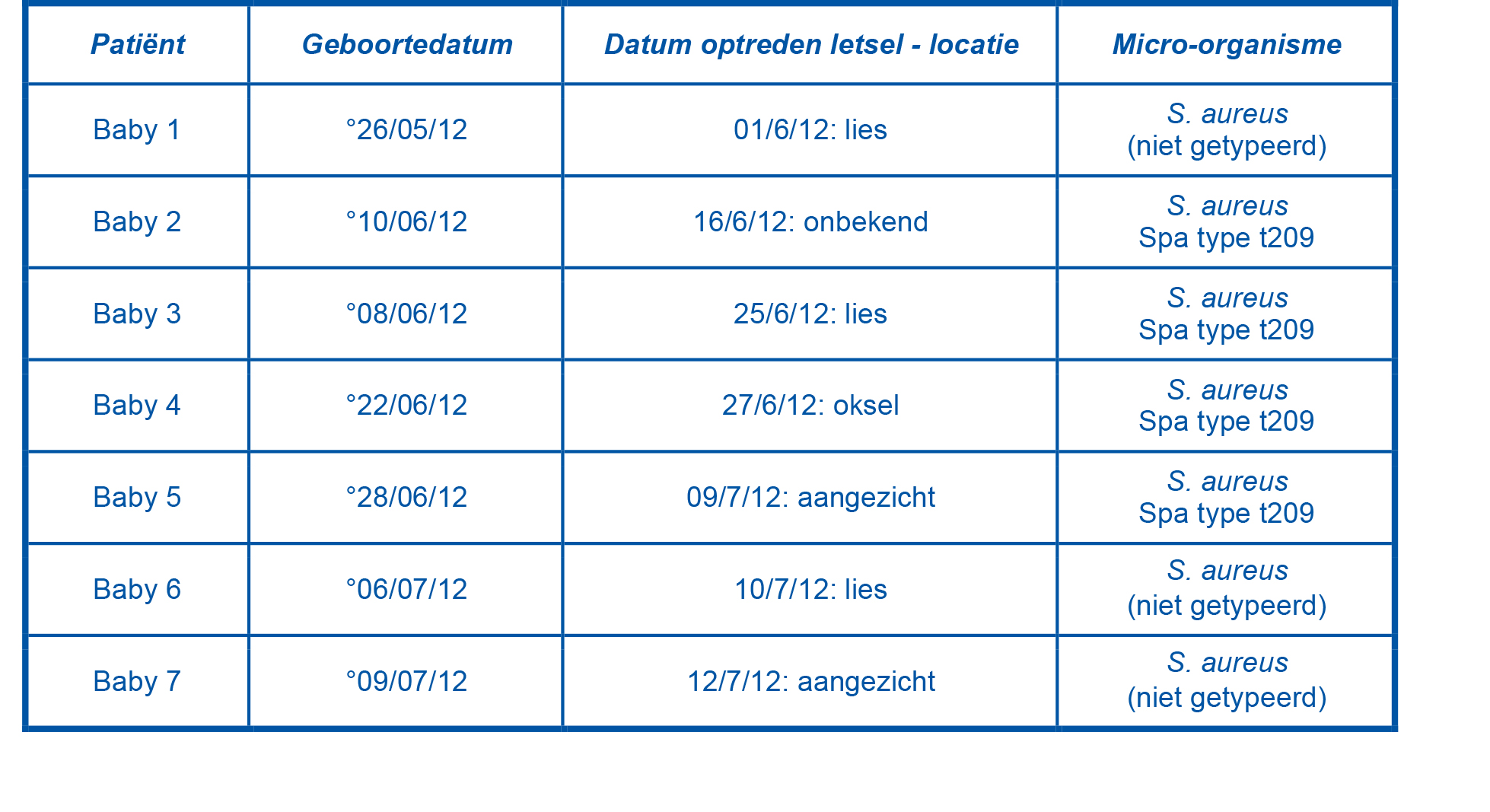
Tijdens deze uitbraak werden 7 neonati gediagnosticeerd met impetigo door S. aureus (zie tabel I). Bij de diagnose van impetigo bij baby 3 rees het vermoeden van een mogelijke uitbraak.
Onderstaande acties werden ondernomen door het Team voor ziekenhuishygiëne en epidemiologie (TZH) :
- Het belang van een goede handhygiëne en van het reinigen en ontsmetten van herbruikbaar materiaal werd gecommuniceerd naar de artsen en verpleging van de afdeling. Eveneens werd bevraagd of er huidletsels aanwezig waren bij gezondheidswerkers.
- Dossieranalyse van alle neonati, waarbij gegevens werden verzameld over datum en tijdstip van geboorte, type verlossing (vaginaal of sectio), gebruikte verloskamer, naam gynaecoloog, naam vroedvrouw, naam van eventueel aanwezige pediater, gebruik van reanimatietafel, gebruik van materiaal tijdens (vacuüm …) en onmiddellijk na de geboorte (aspiratiesonde, ballon …), eventuele verblijf op de neonatale eenheid, kamernummer op materniteit, type voeding (borst- of flesvoeding), aanwezige vroedvrouwen en kinderverzorgsters, datum van optreden van impetigoletsels en locatie van de letsels.
- Aangezien uit dossieranalyse bleek dat bij de geboorte van alle neonati met impetigo gebruik gemaakt werd van de reanimatietafel, werden omgevingsstalen afgenomen van de tafel en de medische hulpmiddelen. Vervolgens werden de reanimatietafel en toebehoren grondig gereinigd en nadien ontsmet met alcohol 70%. Op de saturatiemeter werd een methicilline gevoelige aureus (MSSA) teruggevonden, zowel in het staal van de display/bedieningsknop als in het staal van de kleefprobe. Naar aanleiding van deze vaststelling werd besloten om de kleefprobes niet meer te hergebruiken, maar voor elke neonatus gebruik te maken van een nieuwe kleefprobe, aangezien het materiaal waaruit de probe is vervaardigd geen goede reiniging en ontsmetting toelaat. Tevens werd het systematisch meten van de saturatie bij het nemen van de Guthrie-test (hielprik) op dag 4 stopgezet.
- De isolaten van 4 neonati (baby 2 tot en met 5) werden opgestuurd naar een extern labo voor genotypering. De stam van baby 1 was niet bewaard op het labo en kon derhalve niet meegestuurd worden. Aangezien in het extern labo eerstdaags een run opgestart zou worden, was er omwille van het korte tijdsbestek geen mogelijkheid om ook de isolaten van de andere neonati (baby 6 en 7) te includeren.
Uit de typering van de stalen bleek dat de stammen afkomstig van de 4 neonati identieke fingerprints (> 98% similariteit) vertoonden en bijgevolg behoorden tot dezelfde kloon. Aangezien geen nieuwe gevallen van impetigo optraden na 12/07/2012, werd ervan uitgegaan dat het hergebruik van de saturatieprobe een mogelijke rol in de overdracht gespeeld heeft. De MSSA-stam teruggevonden op de probe werd echter niet bewaard in het labo, zodat hiervan geen genotypering mogelijk was. De stam teruggevonden op de display/bedieningsknop werd – omwille van het korte tijdsbestek – niet meegestuurd voor genotypering bij uitbraak 1.
Tabel I: overzicht van het aantal besmettingen bij uitbraak 1 (1/06-12/07/2012)
Uitbraak 2: 29/10-18/11/2012
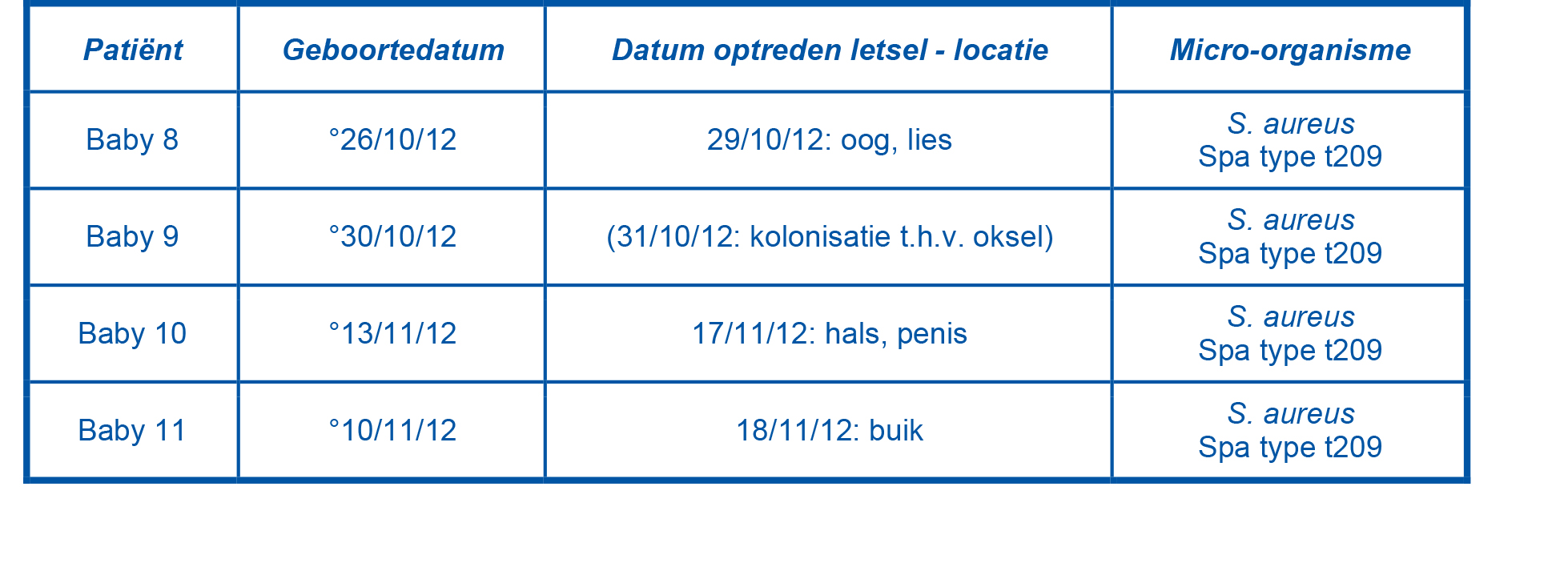
Tijdens deze uitbraak werden 4 neonati besmet met S. aureus, waarvan 3 neonati impetigo ontwikkelden. Bij de andere neonatus (baby 9) werd MSSA teruggevonden in een surveillancekweek die afgenomen werd na de geboorte wegens het optreden van koorts, maar deze baby ontwikkelde geen huidletsels (zie tabel II).
Onderstaande acties werden ondernomen door het TZH :
- Dossieranalyse, doch hierbij konden geen gemeenschappelijke factoren aan het licht gebracht worden.
- Overleg met pediaters en hoofdvroedvrouw: belang van handhygiëne en ontsmetten van materiaal voor gemeenschappelijk gebruik (vb. stethoscoop) werd nogmaals onderstreept.
- Observatie van de compliance handhygiëne en van de naleving van de basisvereisten handhygiëne.
- Opsturen van de isolaten van de 4 neonati uit uitbraak 2 voor Spa-typering naar het nationaal referentielabo voor aureus, samen met het isolaat van het saturatietoestel en de 4 reeds getypeerde isolaten van neonati uit uitbraak 1.
Op 17/12/2012 bleek dat de stammen van de neonati uit uitbraak 2 behoorden tot het Spa type t209 met aanwezigheid van het ETA-gen (exfoliatine A) en genetisch identiek waren aan de stammen van de neonati uit uitbraak 1. Het isolaat van de saturatiemeter behoorde tot een andere stam en was dus niet genetisch identiek aan de stammen van de neonati. Om die reden werd de hypothese dat overdracht gebeurde via de saturatiemeter verlaten.
Om (asymptomatisch) dragerschap bij gezondheidswerkers op te sporen, werden alle artsen, vroedvrouwen, kinderverzorgsters en paramedici van de afdeling materniteit gescreend voor MSSA ter hoogte van de neus (periode 19/12/2012 – 18/01/2013). Van de 36 gescreende gezondheidswerkers bleken er 14 positief voor MSSA en deze stammen werden opgestuurd voor genotypering naar het nationaal referentielabo voor S. aureus. Op 13/02/2013 bleek dat de stam van 1 gezondheidswerker behoorde tot het Spa type t209 met aanwezigheid van het ETA-gen (exfoliatine A) en dus identiek was aan de stammen van de neonati met impetigo.
De gezondheidswerker betrof een vroedvrouw die aanwezig was bij de geboorte van 4 neonati met impetigo (3 neonati uit uitbraak 1 en 1 neonatus uit uitbraak 2). Zij had daarnaast dienst op de afdeling materniteit tijdens het ziekenhuisverblijf van 5 van de andere neonati met impetigo (3 neonati uit uitbraak 1 en 2 neonati uit uitbraak 2), waarbij fysiek contact met de neonati mogelijk was.
De vroedvrouw onderging een decontaminatie-behandeling van 5 dagen bestaande uit het wassen van de huid en haren met een ontsmettende zeep (op basis van chloorhexidine), het gebruik van een antimicrobiële neuszalf (op basis van mupirocine) en van een ontsmettende keeloplossing (op basis van chloorhexidine). Toen bij controle de screening nog steeds positief was voor MSSA, werd de decontaminatiebehandeling herhaald. Sindsdien bleven de controlescreeningen negatief.
Tabel II: overzicht van het aantal besmettingen bij uitbraak 2 (29/10-18/11/2012)
Uitbraak 3: 14/01-28/03/2013
Tijdens deze uitbraak werden, verspreid in de tijd, 3 neonati gediagnosticeerd met impetigo door S. aureus (zie tabel III).
Bij de diagnose van impetigo bij baby 12 was de screening van de gezondheidswerkers nog lopende (zie uitbraak 2). Gezien het een alleenstaand geval betrof, werden in afwachting van de resultaten van de genotypering van de stammen afkomstig van de gezondheidswerkers, geen bijkomende acties ondernomen.
De isolaten van de neonati uit uitbraak 3 werden opgestuurd voor genotypering naar het nationaal referentielabo voor S. aureus. Enkel het isolaat van 14/01/2013 (baby 12) behoorde tot dezelfde stam als de isolaten van de neonati uit uitbraak 1 en 2, nl. Spa type t209 met aanwezigheid van ETA-gen (exfoliatine A). De isolaten van de 2 andere neonati behoorden elk tot een andere stam (Spa t012 en Spa t2778).
Tabel III: overzicht van het aantal besmettingen bij uitbraak 3 (14/01-28/03/2012)

Discussie
Van de 14 neonati die betrokken waren bij de 3 uitbraken van impetigo met S. aureus, behoorden 9 stammen tot hetzelfde type, nl. Spa type t209 met aanwezigheid van ETA-gen (exfoliatine A). Deze stam werd ook teruggevonden in de neusscreening van één van de gezondheidswerkers.
Dragerschap bij gezondheidswerkers als mogelijke bron van een uitbraak van impetigo met S. aureus werd beschreven in de literatuur. [1, 2, 5, 6, 8] Bij de uitbraken in ons ziekenhuis betrof het een vroedvrouw die aanwezig was bij de geboorte van 1 van de neonati met een besmetting door MSSA van het Spa type t209 (baby 10). Zij had daarnaast dienst op de afdeling materniteit tijdens het ziekenhuisverblijf van 6 van de andere neonati met een besmetting door MSSA van het Spa type t209 (baby’s 2, 4, 5, 8, 9 en 12), waarbij fysiek contact met de neonati mogelijk was. Maximaal 7 van de 9 bevestigde besmettingen met MSSA van het Spa type t209 zijn bijgevolg in relatie te brengen tot asymptomatisch dragerschap bij deze gezondheidswerker. Bij minstens 2 van de besmettingen (baby 3 en baby 11) was bijgevolg sprake van een andere bron of vehikel. Mogelijks heeft er een horizontale besmetting plaatsgevonden tussen neonati en dit via de handen van gezondheidswerkers of via besmet materiaal.
Niettegenstaande dat dragerschap van S. aureus bij gezondheidswerkers als mogelijke bron van een uitbraak van impetigo beschreven staat in de literatuur, heerste in het OLV ziekenhuis een zekere terughoudendheid om gezondheidswerkers te screenen. Pas toen uit de Spa-typering van uitbraak 2 bleek dat de stammen van de neonati van uitbraak 1 en 2 tot hetzelfde type behoorden, werd gestart met het opsporen van dragerschap van S. aureus bij alle zorgverstrekkers van de afdeling. Het opsporen van gezondheidswerkers bij een uitbraak wordt nog te vaak ervaren als het zoeken naar een ‘schuldige’ in plaats van het zoeken naar een verklaring voor de uitbraak. Inzicht in de manier van transmissie laat toe om gerichte acties te nemen teneinde de uitbraak te beëindigen.
Uitbraken met ETA-positieve S. aureus stammen worden in de literatuur beschreven door Jursa-Kulesza et al. (2009) [2] en Piechowicz et al. (2012) [8]. Het exfoliatief toxine (ET-A) zorgt er voor dat desmogleïne, een belangrijk eiwit van de menselijke huid, wordt afgebroken wat de blaarvorming veroorzaakt die kenmerkend is voor impetigo. Uitbraken met dit type S aureus zijn meestal niet asymptomatisch, waardoor de kans op detectie ervan groter is.
Er werden geen systematische screeningen uitgevoerd bij alle neonati aanwezig op de afdeling materniteit gedurende de uitbraken. Het totaal aantal besmette neonati kan dus hoger liggen dan 14. Gezien de uitbraak echter veroorzaakt werd door een ETA-positieve S. aureus stam, is de kans groot dat besmette neonati impetigo-letsels vertoonden. Desalniettemin werd de Spa type t209 stam met aanwezigheid van ETA-gen (exfoliatine A) ook teruggevonden in een surveillancekweek van de oksel bij een neonatus die postnataal koorts ontwikkelde (baby 9). Bij deze neonatus traden echter geen impetigo-letsels op. Het is dus mogelijk dat er nog andere asymptomatische neonati bij de uitbraken betrokken waren.
Om een mogelijke bron bij een uitbraak op te sporen is genotypering van de stammen zinvol. Aanvankelijk werd gedacht dat de saturatiemeter gerelateerd was aan de uitbraak, omdat bij de bemonstering van het toestel en de probe S. aureus teruggevonden werd. Genotypering van de stam teruggevonden op de display/bedieningsknop kon echter aantonen dat het een andere stam betrof. Doordat de stam teruggevonden op de saturatieprobe (na aanrijking in het labo) niet bewaard werd, kon deze niet getypeerd worden. Vermoedelijk betrof het ook hier een andere stam. Hoewel de saturatiemeter geen aantoonbare rol heeft gespeeld bij de uitbraken, onderstrepen de teruggevonden MSSA-stammen op de display/bedieningsknop en de probe wel het belang van
1) het reinigen en ontsmetten van herbruikbaar materiaal na gebruik bij een neonatus,
2) geen hergebruik van materiaal dat niet goed te reinigen en te ontsmetten is en
3) een goede handhygiëne bij de gezondheidswerkers.
Door middel van genotypering kan overdracht aangetoond worden. Een nadeel is echter dat het nog steeds vrij duur is. Bovendien wordt deze analysemethode momenteel enkel uitgevoerd in gespecialiseerde centra en kan het dagen tot weken duren vooraleer de resultaten gekend zijn. Dit beperkt de bruikbaarheid van genotypering bij acute uitbraken.
Besluit
Screenen van gezondheidswerkers voor S. aureus en het decontamineren van de gezondheidswerker die drager was van dezelfde stam als deze die teruggevonden werd bij de neonati bleek effectief in het beëindigen van de uitbraken van impetigo.
Dankbetuiging
Met dank aan het labo microbiologie van het Heilig-Hartenziekenhuis Roeselare-Menen en het Nationaal referentielaboratorium voor S. aureus (Cliniques Universitaires de Bruxelles (ULB) – Hôpital Erasme) voor de typering.
Bibliografie
- Conceição T, Aires de Sousa M, Miragaia M et al. Staphylococcus aureus reservoirs and transmission routes in a Portuguese Neonatal Intensive Care Unit: a 30-month surveillance study. Microb Drug Resist 2012; 18(2):116-24
- Jursa-Kulesza J, Kordek A, Kopron K, Wojciuk B, Giedrys-Kalemba S. Molecular studies of an impetigo bullosa epidemic in full-term infants. Neonatology 2009; 96(1):61-8
- Koningstein M, Groen L, Geraats-Peters K et al. The use of typing methods and infection prevention measures to control a bullous impetigo outbreak on a neonatal ward. Antimicrob Resist Infect Control 2012;1:37
- Kurlenda J, Grinholc M, Krzysztoń-Russjan J, Wiśniewska K. Epidemiological investigation of nosocomial outbreak of staphylococcal skin diseases in neonatal ward. Antonie Van Leeuwenhoek 2009; 95(4):387-94
- Nakashima AK, Allen JR, Martone WJ et al. Epidemic bullous impetigo in a nursery due to a nasal carrier of Staphylococcus aureus: role of epidemiology and control measures. . Infect Control 1984; 5(7):326-31.
- Occelli P, Blanie M, Sanchez R et al. Outbreak of staphylococcal bullous impetigo in a maternity ward linked to an asymptomatic healthcare worker. J Hosp Infect 2007; 67(3):264-70
- Pawun V, Jiraphongsa C, Puttamasute S et al. An outbreak of hospital-acquired Staphylococcus aureus skin infection among newborns, Nan Province, Thailand, January 2008. Euro Surveill 2009; 14(43):pii=19372
- Piechowicz L, Garbacz K, Budzyńska A, Dąbrowska-Szponar M. Outbreak of bullous impetigo caused by Staphylococcus aureus strains of phage type 3C/71 in a maternity ward linked to nasal carriage of a healthcare worker. Eur J Dermatol 2012; 22(2):252-5
- Wilcox MH, Fitzgerald P, Freeman J et al. A five year outbreak of methicillin-susceptible Staphylococcus aureus phage type 53,85 in a regional neonatal unit. Epidemiol Infect 2000; 124(1):37-45
- http://www.kindengezin.be/gezondheid-en-vaccineren/ziek/impetigo/ geraadpleegd op 4/8/2014
- http://www.gezondheid.be/index.cfm?fuseaction=art&art_id=8777 geraadpleegd op 4/8/2014
- https://mrsa.rivm.nl/verspreiding-typen-mrsa-nederland/ geraadpleegd op 11/08/2014
- http://www.biomerieux-usa.com/servlet/srt/bio/usa/dynPage?open=USA_PRD_LST&doc=USA_PRD_LST_G_PRD_USA_9&lang=en geraadpleegd op 11/8/2014