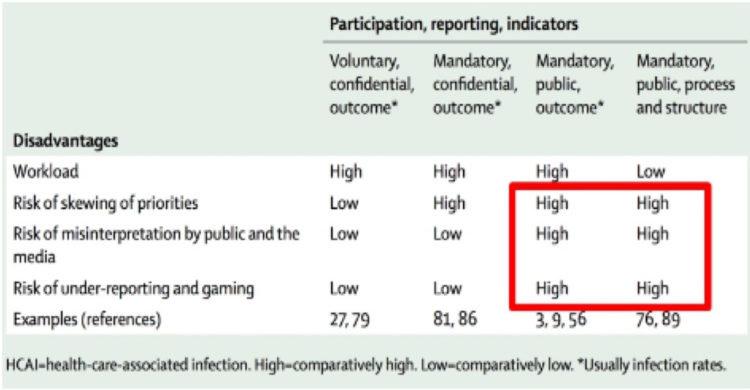
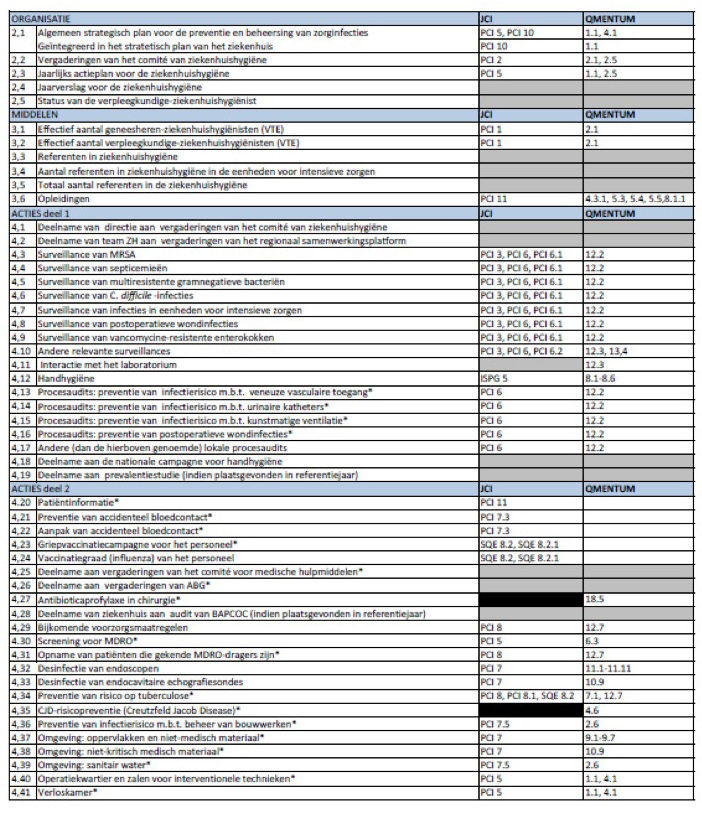
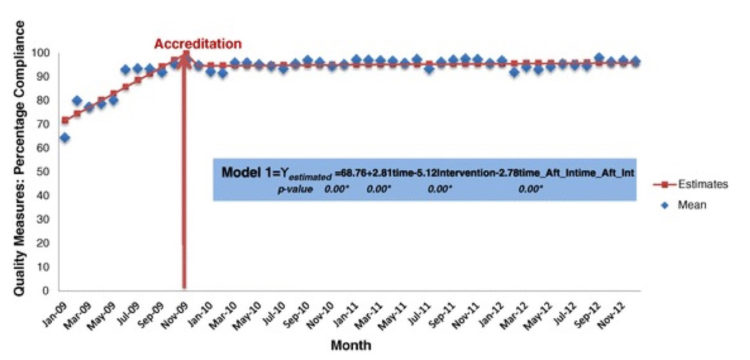
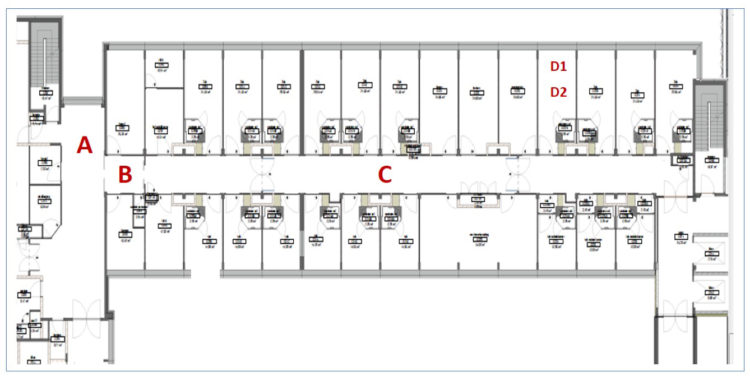
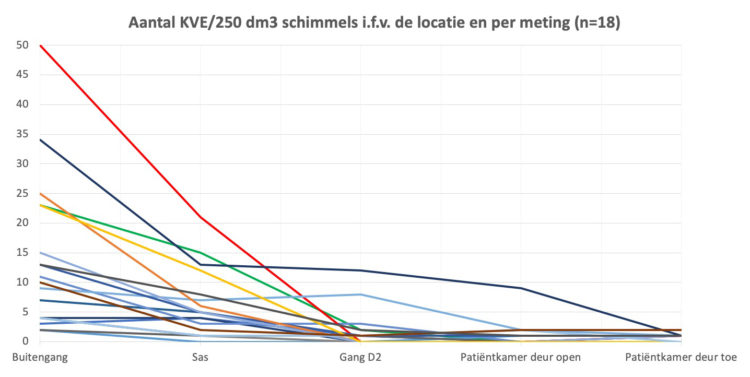
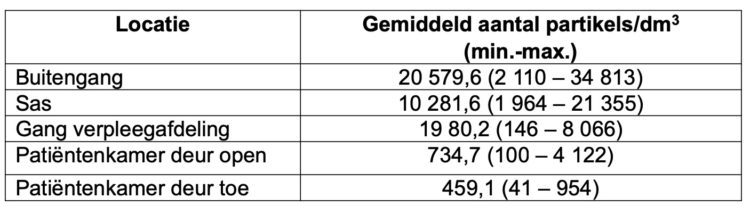
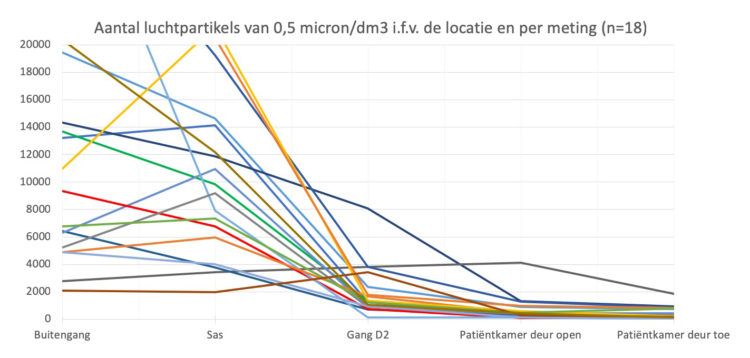
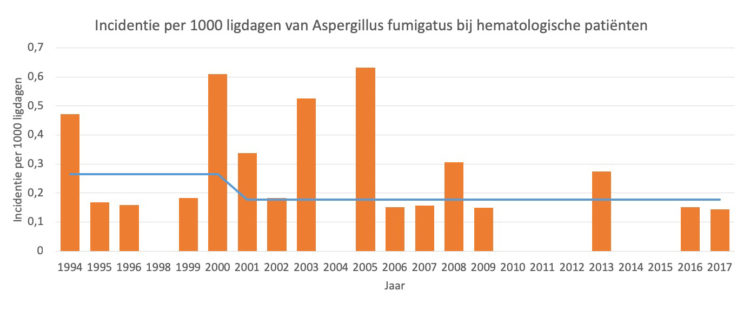
Richardson M, Rautemaa-Richardson R.
Exposure to Aspergillus in Home and Healthcare Facilities’ Water Environments: Focus on Biofilms.
Microorganisms. 2019 Jan 5;7(1).
Abstract
Aspergillus conida are ubiquitous in the environment, including freshwater, water for bathing, and in drinking water. Vulnerable patients and those suffering from allergic diseases are susceptible to aspergillosis. Avoidance of Aspergillus is of paramount importance. Potential outbreaks of aspergillosis in hospital facilities have been described where the water supply has been implicated. Little is known regarding the risk of exposure to Aspergillus in water. How does Aspergillus survive in water? This review explores the biofilm state of Aspergillus growth based on recent literature and suggests that biofilms are responsible for the persistence of Aspergillus in domestic and healthcare facilities’ water supplies.
Abdolrasouli A, Petrou MA, Park H, Rhodes JL, Rawson TM, Moore LSP, Donaldson H, Holmes AH, Fisher MC, Armstrong-James D.
Surveillance for Azole-Resistant Aspergillus fumigatus in a Centralized Diagnostic Mycology Service, London, United Kingdom, 1998-2017.
Front Microbiol. 2018 Sep 20;9:2234.
Abstract
Background/Objectives: Aspergillus fumigatus is the leading cause of invasive aspergillosis. Treatment is hindered by the emergence of resistance to triazole antimycotic agents. Here, we present the prevalence of triazole resistance among clinical isolates at a major centralized medical mycology laboratory in London, United Kingdom, in the period 1998-2017.
Methods: A large number (n = 1469) of clinical A. fumigatus isolates from unselected clinical specimens were identified and their susceptibility against three triazoles, amphotericin B and three echinocandin agents was carried out. All isolates were identified phenotypically and antifungal susceptibility testing was carried out by using a standard broth microdilution method.
Results: Retrospective surveillance (1998-2011) shows 5/1151 (0.43%) isolates were resistant to at least one of the clinically used triazole antifungal agents. Prospective surveillance (2015-2017) shows 7/356 (2.2%) isolates were resistant to at least one triazole antifungals demonstrating an increase in incidence of triazole-resistant A. fumigatus in our laboratory. Among five isolates collected from 2015 to 2017 and available for molecular testing, three harbored TR34/L98H alteration in the cyp51A gene that are associated with the acquisition of resistance in the non-patient environment.
Conclusion: These data show that historically low prevalence of azole resistance may be increasing, warranting further surveillance of susceptible patients.
Motta O, Zarrella I, Cucciniello R, Capunzo M, De Caro F.
A new strategy to control the proliferation of microorganisms in solid hospital waste and the diffusion of nosocomial infections.
Infez Med. 2018 Sep 1;26(3):210-215.
Abstract
A possible tool to reduce nosocomial infections is to identify unknown sources of contamination and then to provide a measure for controlling the related infections. In this study, solid hospital waste was considered a potential source of contamination, and a strategy to reduce the potential risk of pathogen contamination was tested. This paper describes a novel technique for waste management in healthcare settings with a view to facilitating infection prevention and control. We explored the innovative use of sodium dichloroisocyanurate (NaDCC) by investigating the microbicidal activity of chlorine, which derives from the hydrolysis of NaDCC mediated by humidity, and by testing its effect on the inhibition of microorganism growth. NaDCC was inserted in a solid hospital waste bin containing also Lauria-Bertani agar plates, with different dilutions of a known titre of three different microorganisms, namely Escherichia coli, Staphylococcus aureus and Aspergillus brasiliensis. The plates were incubated in the container with or without the antimicrobial agent (control, CNT) at room temperature for 5 days. The number of colony-forming units (CFUs) present on each plate was then counted. Microorganisms capable of proliferating in the CNT waste bin were not able to grow in the presence of NaDCC. Furthermore, the molecular chlorine which developed and was released in the waste bin under the experimental conditions (T=20°C, t=5 days) was quantified using iodometric titration. NaDCC hydrolysis, mediated by humidity, has a strong and long-lasting microbicide effect. The proliferation of tested bacteria and fungi is totally inhibited. These results demonstrate the effectiveness of NaDCC in controlling and/or inhibiting microbial proliferation and support its possible use in the treatment of hospital waste to control the spread of nosocomial contamination.
Webb BJ, Ferraro JP, Rea S, Kaufusi S, Goodman BE, Spalding J.
Epidemiology and Clinical Features of Invasive Fungal Infection in a US Health Care Network.
Open Forum Infect Dis. 2018 Jul 31;5(8):ofy187.
Abstract
Background:
A better understanding of the epidemiology and clinical features of invasive fungal infection (IFI) is integral to improving outcomes. We describe a novel case-finding methodology, reporting incidence, clinical features, and outcomes of IFI in a large US health care network.
Methods:
All available records in the Intermountain Healthcare Enterprise Data Warehouse from 2006 to 2015 were queried for clinical data associated with IFI. The resulting data were overlaid in 124 different combinations to identify high-probability IFI cases. The cohort was manually reviewed, and exclusions were applied. European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group Consensus Group definitions were adapted to categorize IFI in a broad patient population. Linear regression was used to model variation in incidence over time.
Results:
A total of 3374 IFI episodes occurred in 3154 patients. The mean incidence was 27.2 cases/100 000 patients per year, and there was a mean annual increase of 0.24 cases/100 000 patients (P = .21). Candidiasis was the most common (55%). Dimorphic fungi, primarily Coccidioides spp., comprised 25.1% of cases, followed by Aspergillus spp. (8.9%). The median age was 55 years, and pediatric cases accounted for 13%; 26.1% of patients were on immunosuppression, 14.9% had autoimmunity or immunodeficiency, 13.3% had active malignancy, and 5.9% were transplant recipients. Lymphopenia preceded IFI in 22.1% of patients. Hospital admission occurred in 76.2%. The median length of stay was 16 days. All-cause mortality was 17.0% at 42 days and 28.8% at 1 year. Forty-two-day mortality was highest in Aspergillus spp. (27.5%), 20.5% for Candida, and lowest for dimorphic fungi (7.5%).
Conclusions:
In this population, IFI was not uncommon, affected a broad spectrum of patients, and was associated with high crude mortality.
Abdolrasouli A, Scourfield A, Rhodes J, Shah A, Elborn JS, Fisher MC, Schelenz S, Armstrong-James D
High prevalence of triazole resistance in clinical Aspergillus fumigatus isolates in a specialist cardiothoracic centre.
Int J Antimicrob Agents. 2018 Nov;52(5):637-642.
Abstract
Objectives:
To evaluate the prevalence of triazole-resistant Aspergillus fumigatus and common molecular cyp51A polymorphisms amongst clinical isolates in a specialised cardiothoracic centre in London, UK.
Methods:
All A. fumigatus isolates were prospectively analysed from April 2014 to March 2016. Isolates were screened with a four-well VIPcheck™ plate to assess triazole susceptibility. Resistance was confirmed with a standard microbroth dilution method according to European Committee on Antimicrobial Susceptibility Testing (EUCAST) guidelines. Triazole-resistant A. fumigatus isolates were subjected to a mixed-format real time polymerase chain reaction (RT-PCR) assay (AsperGenius®) to detect common cyp51A alterations.
Result:
We identified 167 clinical A. fumigatus isolates from 135 patients. Resistance to at least one azole antifungal drug was confirmed in 22/167 (13.2%) of isolates from 18/135 (13.3%) patients, including 12/74 (16.2%) patients with cystic fibrosis (CF). The highest detection rate of azole-resistant A. fumigatus was among the 11- to 20-y age group. All triazole-resistant isolates (n = 22) were resistant to itraconazole, 18 showed cross-resistance to posaconazole and 10 displayed reduced susceptibility to voriconazole. No pan-azole-resistant A. fumigatus was identified. TR34/L98H was identified in 6/22 (27.3%) of azole-resistant isolates and detectable in 5/12 (42%) patients with CF.
Conclusions:
In our specialist cardiothoracic centre, the prevalence of triazole-resistant A. fumigatus is alarmingly high (13.2%). The majority of azole-resistant isolates were from patients with CF. We found a higher prevalence of the environmentally driven mutation TR34/L98H in our A. fumigatus isolates than in published UK data from other specialist respiratory centres, which may reflect differing patient populations managed at these institutions.
Hoenigl M, Gangneux JP, Segal E, Alanio A, Chakrabarti A, Chen SC, Govender N, Hagen F, Klimko N, Meis JF, Pasqualotto AC, Seidel D, Walsh TJ, Lagrou K, Lass-Flörl C, Cornely OA; European Confederation of Medical Mycology (ECMM).
Global guidelines and initiatives from the European Confederation of Medical Mycology to improve patient care and research worldwide: New leadership is about working together.
Mycoses. 2018 Nov;61(11):885-894.
Abstract
Invasive mycoses present a global challenge with expansion into new hosts, emergence of new pathogens, and development of multidrug resistance. In parallel, new antifungal agents and advanced laboratory diagnostic systems are being developed. In response to these evolving challenges, the European Confederation of Medical Mycology (ECMM) is committed to providing international expertise, guidance, and leadership with the key objectives of improving diagnosis, treatment, outcome, and survival of persons with invasive fungal diseases. Representing 25 affiliated National Medical Mycology Societies, the ECMM has developed several major ways to achieving these critical objectives: (a) tasking specific medical mycology working groups; (b) founding the ECMM Academy and Fellow program (FECMM); (c) expanding the goals of ECMM beyond the European region; (d) implementing the ECMM Excellence Centre Initiative in Europe; and (e) the ECMM Global Guidelines and Neglected Orphan Disease Guidance Initiatives focusing on mucormycosis, rare mould diseases, rare yeast diseases, and endemic mycoses. We believe that these important initiatives and other strategies of the ECMM will advance the field of medical mycology and improve the outcome of patients with invasive mycoses worldwide.
Powers CN, Osier JL, McFeeters RL, Brazell CB, Olsen EL, Moriarity DM, Satyal P, Setzer WN.
Antifungal and Cytotoxic Activities of Sixty Commercially-Available Essential Oils.
Molecules. 2018 Jun 27;23(7). pii: E1549.
Abstract
There is an urgent and unmet need for new antifungal therapies. Global fungal infection rates continue to rise and fungal infections pose increasing burdens on global healthcare systems. Exacerbating the situation, the available antifungal therapeutic arsenal is limited and development of new antifungals has been slow. Current antifungals are known for unwanted side effects including nephrotoxicity and hepatotoxicity. Thus, the need for new antifungals and new antifungal targets is urgent and growing. A collection of 60 commercially-available essential oils has been screened for antifungal activity against Aspergillus niger, Candida albicans, and Cryptococcus neoformans, as well as for cytotoxic activity against MCF-7 and MDA-MB-231 human breast tumor cell lines; the chemical compositions of the essential oils have been determined by gas chromatography-mass spectrometry (GC-MS). Ten essential oils showed remarkable antifungal and cytotoxic activities: Indian, Australian, and Hawaiian sandalwoods; melissa; lemongrass; cilantro; cassia; cinnamon; patchouli; and vetiver.
Loeffert ST, Hénaff L, Dupont D, Bienvenu AL, Dananché C, Cassier P, Bénet T, Wallon M, Gustin MP, Vanhems P.
Prospective survey of azole drug resistance among environmental and clinical isolates of Aspergillus fumigatus in a French University hospital during major demolition works.
J Mycol Med. 2018 Sep;28(3):469-472.
Abstract
Objectives:
Recent studies have reported the emerging worldwide problem of azole drug resistance of A. fumigatus isolates. The aim of this study was to evaluate the antifungal susceptibilities of A. fumigatus isolates recovered from air and clinical samples collected in a French University hospital (Lyon), which underwent major deconstruction works over a one year-period.
Methods:
A daily surveillance of fungal contamination was implemented during 11-months. Environmental survey was realized by air samplings, outdoor and indoor, with an automatic agar sampler. In parallel, surveillance of IA infection cases was conducted by epidemiological investigation. Environmental and clinical isolates of A. fumigatus were identified by conventional methods and β-tubulin sequencing. Susceptibility testing of A. fumigatus isolates against Itraconazole (ITZ), Voriconazole (VCZ) was performed using Etest method.
Results:
A total of 3885 air samples (1744 outdoor samples and 2141 indoor samples) were collected. From the 3073 identified colonies of A. fumigatus, 400 A. fumigatus isolates were tested for their susceptibility to ITZ and VCZ, including 388 isolates coming from the environment (indoor n:157, outdoor n:231) and 12 isolates coming from clinical samples. All the 400 isolates were susceptible to azoles (≤1µg/mL).
Conclusions:
No environmental reservoir of A. fumigatus azole resistant strains was found in our hospital which was undergoing major demolition works. Further studies with larger number of A. fumigatus clinical isolates and environmental isolates from agricultural areas and healthcare establishments are needed to better appreciate the occurrence and prevalence of azole resistance
Caillaud D, Cheriaux M, Martin S, Ségala C, Dupuy N, Evrard B, Thibaudon M.
Short-term effect of outdoor mould spore exposure on prescribed allergy medication sales in Central France.
Clin Exp Allergy. 2018 Jul;48(7):837-845.
Abstract
Background:
Outdoor moulds are classically associated with exacerbations of asthma.
Objective:
The aim of this paper was to examine nasal allergy morbidity by studying the short-term relationship between mould spore exposure and daily sales of reimbursable anti-allergic treatment in central France.
Methods:
The relationship between daily changes in mould concentrations and daily sales obtained from the national healthcare database was analysed with generalized additive models, taking into account confounding factors such as air pollution, weather conditions, pollen counts, and days of the week.
Results:
During the study, the average total yearly number of treated people was around 10 000 over approximately 230 000 surveyed. The relative risk (95% CI confidence interval) of sales of oral antihistamines with topical treatment associated with an interquartile increase in mould concentration was significant for Cladosporium 1.079 [1.019-1.142] and Aspergillus-Penicillium (Asp-Pen) 1.051 [1.021-1.082] in the whole population. When the influence of age and sex was considered, the relationship was significant only in male children aged 0-12 years and those aged between 13 and 49 years for Cladosporium: 1.256 [1.081-1.460] and 1.151 [1.063-1.245], respectively. The relationship was also significant for Asp-Pen: 1.038 [1.003-1.075] for those aged between 13 and 49 years and 1.056 [1.007-1.108] for adults over 50 years of age.
Conclusion:
The association between prescribed daily sales of oral antihistamines with topical treatment sales is associated with temporal changes to Cladosporium and Aspergillus-Penicillium in the whole population. When the influence of age and sex was considered, these two moulds contributed to prescribed medication sales only in the male general population.
Bertuzzi M, Hayes GE, Icheoku UJ, van Rhijn N, Denning DW, Osherov N, Bignell EM.
Anti-Aspergillus Activities of the Respiratory Epithelium in Health and Disease.
J Fungi (Basel). 2018 Jan 8;4(1).
Abstract
Respiratory epithelia fulfil multiple roles beyond that of gaseous exchange, also acting as primary custodians of lung sterility and inflammatory homeostasis. Inhaled fungal spores pose a continual antigenic, and potentially pathogenic, challenge to lung integrity against which the human respiratory mucosa has developed various tolerance and defence strategies. However, respiratory disease and immune dysfunction frequently render the human lung susceptible to fungal diseases, the most common of which are the aspergilloses, a group of syndromes caused by inhaled spores of Aspergillus fumigatus. Inhaled Aspergillus spores enter into a multiplicity of interactions with respiratory epithelia, the mechanistic bases of which are only just becoming recognized as important drivers of disease, as well as possible therapeutic targets. In this mini-review we examine current understanding of Aspergillus-epithelial interactions and, based upon the very latest developments in the field, we explore two apparently opposing schools of thought which view epithelial uptake of Aspergillus spores as either a curative or disease-exacerbating event.
Douglas P, Tyrrel SF, Kinnersley RP, Whelan M, Longhurst PJ, Hansell AL, Walsh K, Pollard SJ, Drew GH.
Predicting Aspergillus fumigatus exposure from composting facilities using a dispersion model: A conditional calibration and validation.
Int J Hyg Environ Health. 2017 Jan;220(1):17-28.
Abstract
Bioaerosols are released in elevated quantities from composting facilities and are associated with negative health effects, although dose-response relationships are unclear. Exposure levels are difficult to quantify as established sampling methods are costly, time-consuming and current data provide limited temporal and spatial information. Confidence in dispersion model outputs in this context would be advantageous to provide a more detailed exposure assessment. We present the calibration and validation of a recognised atmospheric dispersion model (ADMS) for bioaerosol exposure assessments. The model was calibrated by a trial and error optimisation of observed Aspergillus fumigatus concentrations at different locations around a composting site. Validation was performed using a second dataset of measured concentrations for a different site. The best fit between modelled and measured data was achieved when emissions were represented as a single area source, with a temperature of 29°C. Predicted bioaerosol concentrations were within an order of magnitude of measured values (1000-10,000CFU/m3) at the validation site, once minor adjustments were made to reflect local differences between the sites (r2>0.7 at 150, 300, 500 and 600m downwind of source). Results suggest that calibrated dispersion modelling can be applied to make reasonable predictions of bioaerosol exposures at multiple sites and may be used to inform site regulation and operational management.
Williams C, Rajendran R, Ramage G.
Aspergillus Biofilms in Human Disease.
Adv Exp Med Biol. 2016;931:1-11.
Abstract
The biofilm phenotype of Aspergillus species is an important and accepted clinical entity. While industrially these biofilms have been used extensively in important biofermentations, their role in clinical infection is less well defined. A recent flurry of activity has demonstrated that these interesting filamentous moulds have the capacity to form biofilms both in vitro and in vivo, and through various investigations have shown that these are exquisitely resistant to antifungal therapies through a range of adaptive resistance mechanisms independent of defined genetic changes. This review will explore the clinical importance of these biofilms and provide contemporary information with respect to their clinical management..
Wirman L, Ross B, Reimann O, Steinmann J, Rath P-M
Airborne Aspergillus fumigatus spore concentration during demolition of a building on a hospital site, and patient risk determination for invasive aspergillosis including azole resistance
Journal of hospital infection. 2018 ;Vol.100 ; 3 ; pp e91-e97
Background
Invasive aspergillosis (IA) in immunocompromised patients has been associated with demolition in or adjacent to hospitals. In recent years, azole-resistant clinical isolates of Aspergillus fumigatus, the most common agent of IA, have emerged in Western Europe and are spreading globally.
Aim
To determine the potential risk of IA, including azole resistance, in patients caused by demolition of a hospital building.
Methods
Air sampling before, during and after demolition, screening for azole resistance, genotyping of non-susceptible isolates, and comparing those with strains from patients with azole-resistant IA during demolition.
Findings
Mean concentrations of A. fumigatus spores did not differ significantly between the three periods before [17.5 colony-forming units (cfu)/m³], during (20.8 cfu/m³) (P=0.26) and after (17.7 cfu/m³) demolition (P=0.33). No significant difference in IA cases documented by clinicians was found when comparing the timeframe of demolition with the previous year (44 vs 42 cases). Thirty of 200 A. fumigatus isolates (15%) showed azole resistance. Genotyping by microsatellite polymerase chain reaction of the azole-resistant environmental and clinical isolates showed a polyclonal distribution.
Conclusions
The results suggest that with implemented preventive measures, there is no increased risk for IA, including azole resistance, in immunocompromised patients during outdoor demolition work. Further prospective studies are needed to confirm these findings.
Mridula Gupta Michael Bisesi Jiyoung LeeP
Comparison of survivability of Staphylococcus aureus and spores of Aspergillus niger on commonly used floor materials
American Journal of Infection Control Volume 45, Issue 7, 1 July 2017, Pages 717-722.
Background
The survivability of Staphylococcus aureus and spores of Aspergillus niger was compared on 5 common floor materials.
Methods
Floor materials were inoculated with a known concentration of S aureus and spores of A niger on day 0. Their survivability was measured on days, 2, 7, 14, and 28 by bulk rinsate method and enumerated using culture-based method.
Results
The difference in change of S aureus levels was statistically significant for all tested days (P < .001) for all floor materials. Vinyl composition tile (VCT) and porcelain tile (PT) had statistically similar survivability and differed statistically from carpets. On both VCT and PT, positive growth for S aureus occurred by day 2 (1-1.7 log10), declined slightly (0.1 to −0.2 log10) by day 7, and remained positive until day 28. However, S aureus was undetected by day 7 on both carpets. A niger spores were undetected on residential broadloom carpet and rubber-backed commercial carpet after day 2 but survived on VCT, PT, and wood until day 28.
Conclusions
Floor materials with hard and smooth surfaces, such as VCT and PT, can allow survival of S aureus and A niger for up to 4 weeks. It may imply that floor materials can play a major role in preserving microbial contaminants in the built environment.
Absar Alum Galahad Zachariah Isaacs
Aerobiology of the built environment: Synergy between Legionella and fungi
American Journal of Infection Control Volume 44, Issue 9, Supplement, 2 September 2016, Pages S138-S143
The modern built environment (BE) design creates unique ecological niches ideal for the survival and mutual interaction of microbial communities. This investigation focused on the synergistic relations between Legionella and the fungal species commonly found in BEs and the impact of these synergistic relationships on the survival and transmission of Legionella.
Methods
A field study was conducted to identify the types and concentrations of fungi in BEs. The fungal isolates purified from BEs were cocultured with Legionella to study their synergistic association. Cocultured Legionella cells were aerosolized in an air-tight chamber to evaluate the efficacy of ultraviolet (UV) to inactivate these cells.
Results
Aspergillus, Alternaria, and Cladosporium were the most common fungi detected in samples that tested positive for Legionella. After coculturing, Legionella cells were detected inside fungal hyphae. The microscopic observations of Legionella internalization in fungal hyphae were confirmed by molecular analyses. UV disinfection of the aerosolized Legionella cells that were cocultured with fungi indicated that fungal spores and propagules act as a shield against UV radiation. The shield effect of fungal spores on Legionella cells was quantified at >2.5 log10.
Conclusions
This study provides the first evidence, to our knowledge, of Legionella cell presence inside fungi detected in an indoor environment. This symbiotic relationship with fungi results in longer survival of Legionella under ambient conditions and provides protection against UV rays.
Karen M. Ehret, Allison T. Chamberlain, Ruth L. Berkelman, Scott K. Fridkin
Select Preventing hospital-acquired Legionnaires’ disease: A snapshot of clinical practices and water management approaches in US acute-care hospitals
Infect Control Hosp Epidemiol Vol.39 ; nr 12 ; dec 2018 ; pp 1470-1472
In 2017, we surveyed 101 SHEA Research Network hospitals regarding Legionnaires’ disease (LD). Of 29 respondents, 94% have or are developing a water management plan with varying characteristics and personnel engaged. Most LD diagnostic testing is limited to urine antigen testing. Many opportunities to improve LD prevention and diagnosis exist.
Marie-Paule Fernandez-Gerlinger, Anne-Sophie Jannot, Sophie Rigaudeau, Juliette Lambert, Odile Eloy, François Mignon, Hassan Farhat, Sylvie Castaigne, Jacques Merrer, Philippe Rousselot
Select The Plasmair Decontamination System Is Protective Against Invasive Aspergillosis in Neutropenic Patients
Infect Control Hosp Epidemiol 2016;37:845–851
Objective
Invasive aspergillosis (IA) is a rare but severe infection caused by Aspergillus spp. that often develops in immunocompromised patients. Lethality remains high in this population. Therefore, preventive strategies are of key importance. The impact of a mobile air decontamination system (Plasmair, AirInSpace, Montigny-le-Bretonneux, France) on the incidence of IA in neutropenic patients was evaluated in this study.
Design
Retrospective cohort study
Methods
Patients with chemotherapy-induced neutropenia lasting 7 days or more were included over a 2-year period. Cases of IA were confirmed using the revised European Organization for Research and Treatment of Cancer (EORTC) criteria. We took advantage of a partial installation of Plasmair systems in the hematology intensive care unit during this period to compare patients treated in Plasmair-equipped versus non-equipped rooms. Patients were assigned to Plasmair-equipped or non-equipped rooms depending only on bed availability. Differences in IA incidence in both groups were compared using Fisher’s exact test, and a multivariate analysis was performed to take into account potential confounding factors.
Results
Data from 156 evaluable patients were available. Both groups were homogenous in terms of age, gender, hematological diagnosis, duration of neutropenia, and prophylaxis. A total of 11 cases of probable IA were diagnosed: 10 in patients in non-equipped rooms and only 1 patient in a Plasmair-equipped room. The odds of developing IA were much lower for patients hospitalized in Plasmair-equipped rooms than for patients in non-equipped rooms (P=.02; odds ratio [OR] =0.11; 95% confidence interval [CI], 0.00–0.84).
Conclusion
In this study, Plasmair demonstrated a major impact in reducing the incidence of IA in neutropenic patients with hematologic malignancies.

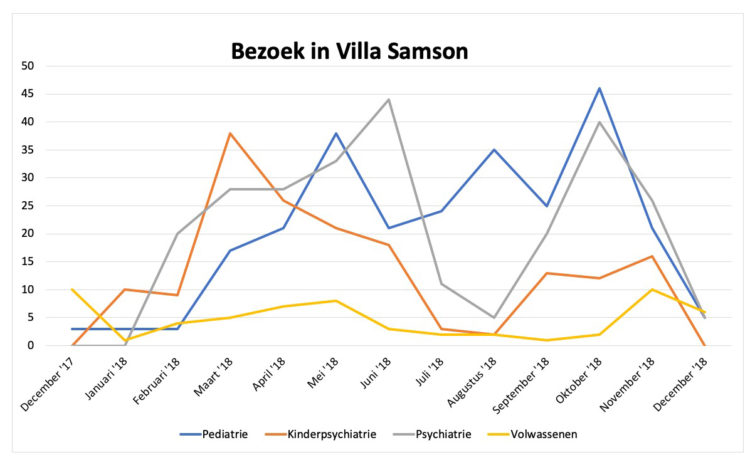
 “Animal-assisted interventions” (AAI), waarbij gebruik gemaakt wordt van huisdieren, is de laatste jaren steeds populairder geworden. Hoewel het wetenschappelijk bewijs voor de effecten van AAI op de gezondheid van patiënten eerder beperkt is (3, 6), blijkt een empirisch gestoeld geloof in de band tussen beide partijen voldoende om allerlei AAI initiatieven op te starten.
“Animal-assisted interventions” (AAI), waarbij gebruik gemaakt wordt van huisdieren, is de laatste jaren steeds populairder geworden. Hoewel het wetenschappelijk bewijs voor de effecten van AAI op de gezondheid van patiënten eerder beperkt is (3, 6), blijkt een empirisch gestoeld geloof in de band tussen beide partijen voldoende om allerlei AAI initiatieven op te starten. 





 Inleiding
Inleiding