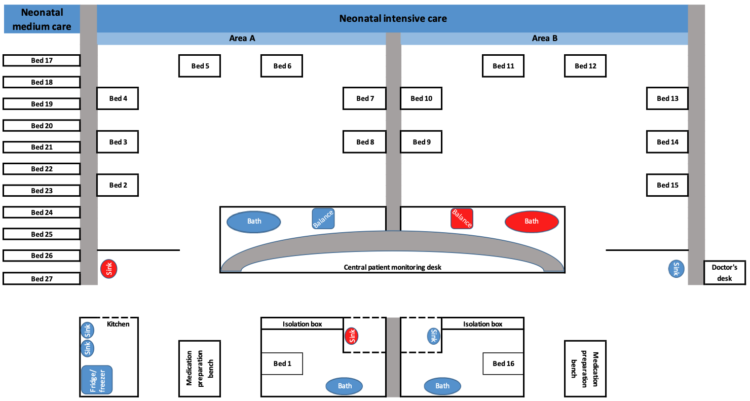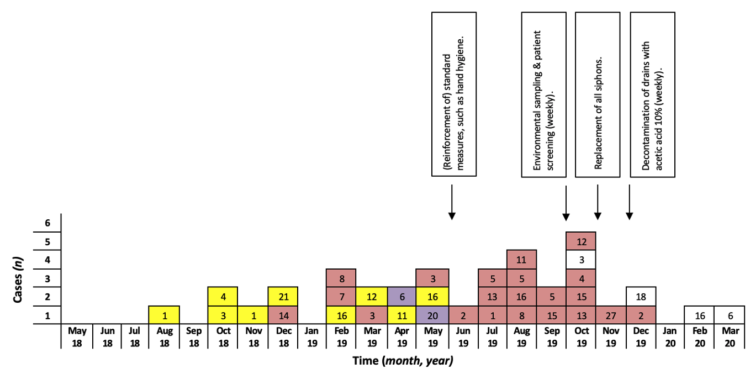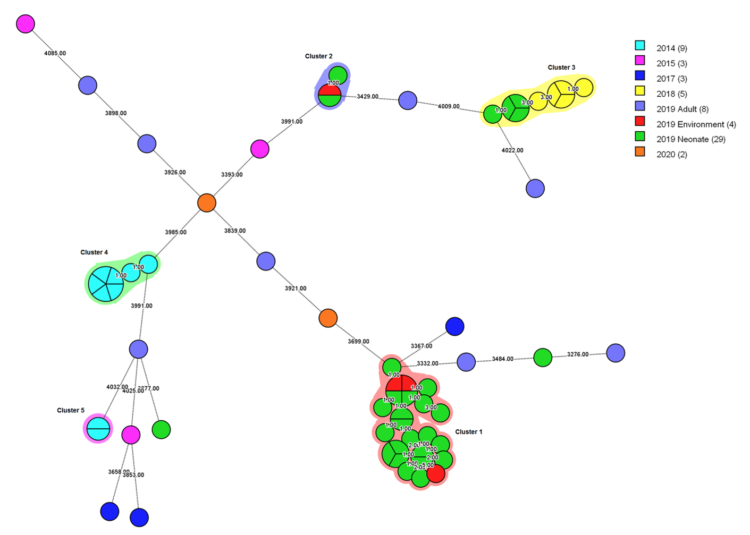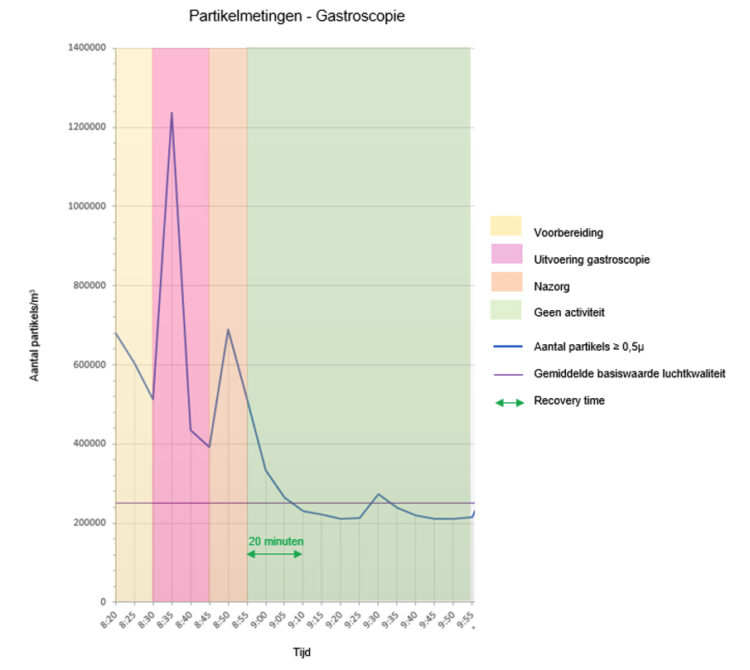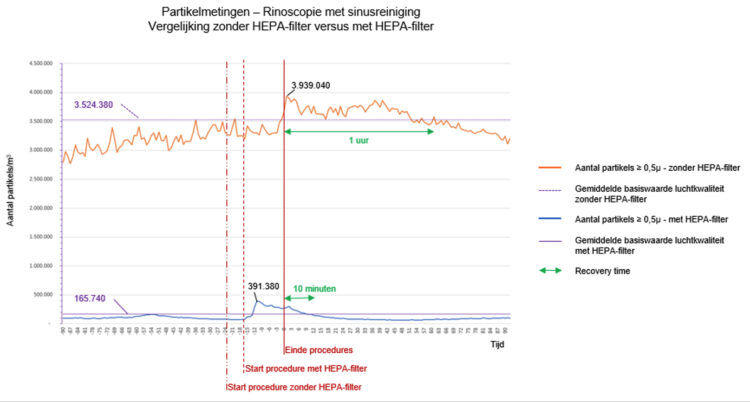
Met de SARS-CoV-2 pandemie wordt wereldwijd op grote schaal en langdurig gebruik gemaakt van cohortering 1-3. Hoewel cohortering niet nieuw is en traditioneel vernoemd wordt in publicaties rond uitbraakmanagement 4-7 ontbreekt een duidelijke operationalisering van het begrip cohortisolatie. Afhankelijk van het aantal betrokken besmette patiënten fungeert een volledige afdeling dan wel een onderdeel ervan als cohorte-afdeling. Vooral in laatste situatie ontstonden in het verleden soms discussies met het hoger management. Niet zelden betrof het de mate waarin afzonderlijke personeelsbestaffing “dag en nacht” voorzien dient te worden voor respectievelijk het besmet en niet besmet patiëntencohort op eenzelfde afdeling. Een dubbele bestaffing betekent immers een aanzienlijke meerkost voor de zorginstelling. Een tien maanden durende uitbraak van OXA-24 carbapenemase-producerende multidrug resistente Acinetobacter baumannii betekende een maandelijkse meerkost van 10000 euro, 59% hiervan betrof extra loonkosten van ingezet personeel 8.
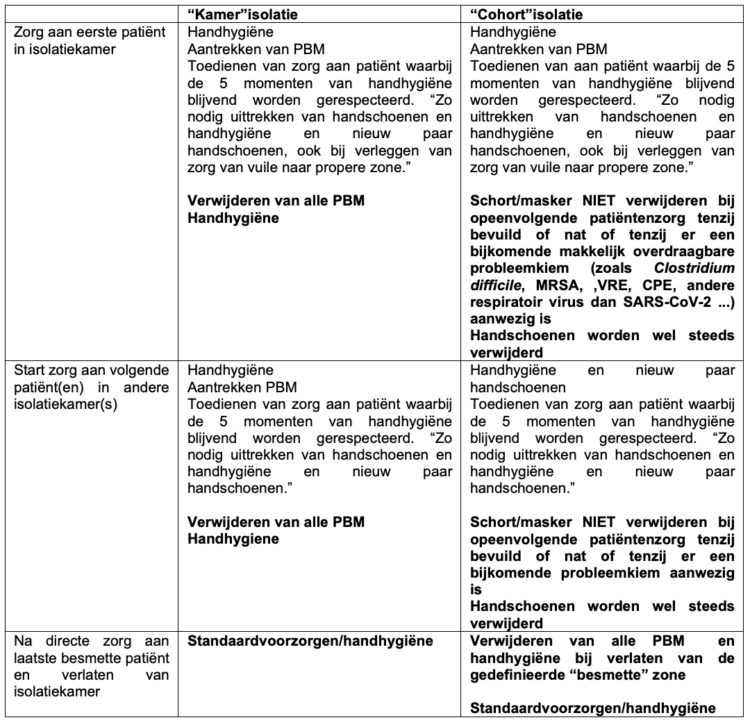
Hygiëneprincipes geldig in normale tijden bij kamerisolatie worden bij cohortisolatie deels overruled. Bij cohortering kunnen meerdere met dezelfde probleemkiem besmette patiënten verzorgd worden met dezelfde beschermende kledij mits het respecteren van de algemene voorzorgsmaatregelen. Bij aaneensluitende zorgverstrekking kunnen m.a.w. zorgverleners met grotendeels dezelfde persoonlijke beschermingsmiddelen (PBM) van de ene isolatiekamer naar de andere gaan op voorwaarde dat er geen bijkomende makkelijk overdraagbare pathogenen (zoals Clostridium difficile, MRSA, VRE, CPE…) aanwezig zijn. Soms worden bij cohortisolatie besmette zones gedefinieerd waartoe niet enkel de besmette patiëntenkamers en vuile utility worden gerekend maar ook gemeenschappelijke ruimtes zoals verpleegpost, dokterslokaal . Deze keuze veronderstelt dat men continu werkt met (potentieel) besmette PBM aan, een principe dat we zeker niet verdedigen. Het is aanbevolen om op een cohorte afdeling een zoneringsprincipe in te voeren met hygiëne-en kledij afspraken 9. Aandachtspunten rond noodzakelijke handhygiëne blijven vaak vaag geformuleerd waardoor ruimte vrijkomt voor eigen interpretaties. Zo onstaan onveilige werksituaties met risico op bv. MDRO-uitbraak 10 of hogere CLABSI cijfers 11,12.
Tabel 1 geeft het onderscheid weer tussen klassieke kamerisolatie en cohortisolatie.
Bij klassieke kamerisolatie komt naar onze mening compliance aan de 5 WHO handhygiënemomenten al danig onder druk te staan. Naast zelfbescherming moet de medewerker zich steeds focussen op de veiligheid van patiënten i.f.v. preventie van zorginfecties. Handschoenen frequent wisselen en handhygiëne toepassen bij eenzelfde patiënt in isolatie tijdens eenzelfde zorgmoment is geen sinecure. Tijdens cohortisolatie sluipt daarenboven het gevaar dat het handschoenen wisselen en het toepassen van handhygiëne ook tussen diverse patiënten onvoldoende aandacht krijgen. Zeker tijdens de eerste COVID-19 golf zorgde de angst voor het onbekende SARS-CoV-2 virus in sommige instellingen voor de introductie van het dubbel paar handschoenen dragen. Het buitenste paar handschoenen wordt verwijderd bij het verlaten van een isolatiekamer of bij het verleggen van de zorg van de ene patiënt naar de andere in eenzelfde isolatiekamer. Het onderste paar handschoenen, beschouwd als second skin, wordt ontsmet met handalcohol. Een nieuw paar handschoenen wordt nadien daarboven aangetrokken om een volgende COVID-19 patiënt te verzorgen. Dergelijke manier van werken bemoeilijkt een correcte toepassing van handhygiëne volgens de 5 WHO momenten.
Moore et al. (2021) rapporteert over de impact van de COVID-19 pandemie op handhygiënecompliance in 9 ziekenhuizen tijdens de eerste golf in de US 13. Een initiële stijging van de compliance van 45% tot 62% werd gevolgd door een gestage wekelijkse daling tot 53%. Gelimiteerde beschikbaarheid van alcoholische handontsmettingsmiddelen (AHR), substitutie van handhygiëne door het dragen van handschoenen, minder directe observatie door een druk bevraagd IPC team worden als mogelijke verklaringen voor de dalende handhygiëne compliance vernoemd. Tijdens de 2de COVID-19 golf werd een precampagne handhygiëne compliance verricht op onze dienst Intensieve Zorgen. Alle observaties gebeurden door een getrainde verpleegkundige ziekenhuishygiënist tijdens diverse 30 min. observatieperiodes. De handhygiëne compliance bedroeg overall 61% (n=174), een duidelijke daling t.o.v. het in 2019 posttestresultaat gemeten tijdens de 8ste nationale campagne handhygiëne 77% (n=173). Deze daling is o.i. niet enkel te wijten aan het traditionele daleffect zichtbaar bij een precampagnemeting maar ook aan de uitzonderlijk grote proportie patiënten verzorgd in bronisolatie (COVID-19 patiënten). Deze hypothese wordt mogelijks bevestigd in de analyse van beschikbare nationale data ingezameld tijdens de optionele precampagnemeting van de 9de Belgische handhygiënecampagne. Hoewel het dubbel paar handschoenen formeel afgeraden werd, kon deze praktijk toch niet geweerd worden in de COVID-19 zone op de dienst spoedgevallen. Verpleegkundigen die behoorden tot de mobiele equipe van spoed- en intensieve zorgen importeerden dit gebruik onvermijdelijk ook op IZ. Met wisselend succes konden de IZ verpleegkundigen door het team ziekenhuishygiëne overtuigd worden dat dit geen goede praktijk is. Het gebruik van een dubbel paar handschoenen buiten de context van hoogrisicochirurgie is in wezen een afgeleide van Ebola infectiepreventierichtlijnen 14,15. Bij hoogst besmettelijke en zeer dodelijk virale hemorragische koorts gepaard met afwezigheid van behandeling is het dragen van dubbel paar handschoenen te rechtvaardigen. Evenwel in kader van COVID-19 wordt deze praktijk resoluut afgeraden 1-3,16. In de HGR en WHO-richtlijnen m.b.t. handhygiëne wordt ook het ontsmetten van de handschoenen afgeraden 17-18.
De achterliggende rationale wordt niet gegeven. Het lijkt aannemelijk te veronderstellen dat bij gebruik van een alcoholische handrub (AHR) op handschoenen contact met alle delen van de handschoenen niet gewaarborgd is omwille van een gebrek aan gevoel. AHR producten zouden ook de integriteit van de handschoenen kunnen aantasten 19.
Slechts enkele experimentele studies zijn beschikbaar m.b.t. zin/onzin van desinfectie van handschoenen en het gebruik van een dubbel paar handschoenen. Casanova et al. (2012) bestudeerden in een experimentele setting met 18 deelnemers het effect van het dragen van een enkel paar handschoenen versus dubbel paar handschoenen op de virusoverdracht naar huid en kledij van zorgverleners tijdens het verwijderen van PBM 20. Druppelcontaminatie werd gesimuleerd door het aanbrengen van een 5 druppels van 5 log10 Escherichia virus MS2 op de voorzijde van de isolatiejas t.h.v. schouder, de rechter voorzijde van respectievelijk het N95 masker en beschermingsbril en de palmzijde van de handschoen van de dominante hand. Een significant lagere overdracht naar handen maar niet naar de scrubsuit van zorgverstrekkers werd gezien in de groep die een dubbel paar handschoenen droeg. De auteurs besluiten dat het gebruik van een dubbel paar handschoenen in grotere gecontroleerde studies moet onderzocht worden. Scheithauer et al. (2016) bestudeerde de bactericide doeltreffendheid van handschoendesinfectie volgens de EN 1500 hoewel deze norm hiervoor niet bedoeld is 21. Combinaties van 3 handschoenmerken met 5 AHR werden getest. De afwezigheid van microscopisch kleine gaten werd eveneens nagegaan volgens de EN 455-1. Nitrielhandschoenen scoorden beter dan latexhandschoenen maar verschillen werden opgemerkt naargelang de gecombineerde AHR. Bij enkele AHR combinaties slaagden de nitrielhandschoenen niet voor de lektest. Gao et al. (2016) toonde ongewenste effecten aan van AHR op de treksterkte van zowel latex als nitriel handschoenen 22. Eveneens werd een negatief effect waargenomen op de rekbaarheid van latexhandschoenen maar niet van nitrielhandschoenen. Het dragen van een dubbel paar handschoenen leidt sowieso tot een langere draagduur en bevordert het ontstaan van irritatieve dermatitis, een probleem dat ook tijdens COVID-19 pandemie duidelijk frequenter werd geobserveerd 23. Garrido-Molina et al. (2021) bestudeerde de compatibiliteit van diverse desinfectantia op ongepoederde nitrielhandschoenen 24. Desinfectantia die alcohol bevatten hebben een negatief effect op de treksterkte van nitrielhandschoenen. Een minder sterke handschoen verhoogt de kans op zelfcontaminatie van de drager.
Het risico op zelfcontaminatie bij verwijderen van PBM is bekend vanuit eerdere ervaringen met SARS en Ebola. Onoordeelkundig verwijderen van PBM na directe patiëntenzorg leidt tot een transfer van virus op de handen of de kledij van zorgverleners. 60% van de in 2004 gerapporteerde SARS-gevallen betrof zorgverstrekkers 25. Foutief of inconsistent gebruik van PBM werd hierbij als risicofactor aangeduid. Zelfs na een gepaste training blijft een 18.9% risico op zelfbesmetting bestaan 26.
Alhimidi et al. (2019) bestudeerde het risico op zelfcontaminatie bij verwijderen van handschoenen door gebruik te maken van een fluorescente oplossing 27. Zevenendertig op 100 geobserveerde zorgverleners contamineerde zichzelf tijdens het uitdoen van de handschoenen. Vingers en polsen worden het frequentst gecontamineerd. Het volgen van de CDC-richtlijnen 28 hierbij reduceert significant besmetting. In een simulatie waarbij enkel op de palmzijde van de handschoenen fluorescente oplossing werd aangebracht bleek zelfcontaminatie bij een aangepaste versie van de CDC aanbevolen techniek m.b.t. verwijderen van handschoenen het kleinst (laatste handschoen wordt verwijderd door wijs- en middelvinger onder de rand van nog aanwezige handschoen te brengen aan de handrugzijde i.p.v aan de handpalmzijde).
Het is duidelijk dat een blijvende inzet op training en sensibilisering rond het correct verwijderen van PBM noodzakelijk is. Dit is belangrijk zowel bij kamerisolatie als cohortisolatie, bij endemische problemen en evenzeer bij een epidemie of pandemie. Met name het verwijderen van gecontamineerde handschoenen is een risicovolle handeling. Verder onderzoek m.b.t. handhygiëne en handschoengebruik is zeker een noodzaak 29. Correcte handhygiëne en goed handschoengebruik zijn twee aandachtsgebieden waarin zorgverleners tijdens toepassing van cohortisolatie jammer genoeg frequent fouten maken.
Referenties
11. Rational use of personal protective equipment for coronavirus disease (COVID-19) and considerations during severe shortage, WHO, interim guidance 6 april 2020.
2. Infection prevention and preparedness for COVID-19 in healthcare setting, ECDC, 6th update, 9 february 2021.
3. Interim infection prevention and control recommendations fort healthcare personnel during the Coronavirus Disease 2019 (COVID-19) pandemic, CDC, 23 febr 2021.
4. Rosenberger (L.) et al., Quarantine, Isolation and Cohorting: from cholera to Klebsiella, Surgical infections, 2012, 13:2, 69-73.
5. Landelle (C.) et al., Protracted outbreak of multidrug-resistant Acinetobacter baumannii after intercontinental transfer of colonized patients, Inf Control Hosp Epidemiol, 2013, 34, 2, 119-124.
6. Enfiel (K.B.) et al., Control of simultaneous outbreaks of carbapenemase-producing Enterobacteriacea and extensively drug-resistant Acinetobacter baumannii infection in an Intensive Care Unit using interventions promoted in the CDC 2012 carbapenemase-resistant Enterobacteriacae toolkit, Inf Control Hosp Epidemiol, 2014, 34, 7, 810-817.
7. Aanbevelingen inzake preventie, beheersing en aanpak van patiënten die drager zijn van tegen antibiotica multiresistente organismen (MDRO) in zorginstellingen, HGR-aanbeveling nr. 9277, april 2019.
8. Demaiter (G.), Management van een oxa-24 Acinetobacter baumannii uitbraak: een ervaringsverslag, Dag van de Ziekenhuishygiëne, UZ Gent, 15 december 2014.
9. Demaiter (G.), Infectiepreventie en controle tijdens COVID-19: kroniek van het grote gelijk ? Noso-info; 2020, 24,2:9-13.
10. Patel (A..) et al., Rapid spread and control of multidrug-resistant gram negative bacteria in COVID-19 patient care units, Emerging Infectious Diseases, 2021, 27(4), 1234-1236.
11. McMullen 5K.M.) et al., Impact of SARS-CoV-2 on hospital acquired infection rates in the United States: predictions and early results, AJIC, 2020, 48:1409-1411.
12. Fakih (MG.) et al., COVID-19 pandemic, CLABSI and CAUTI: the urgent need to refocus on hardwiring prevention efforts, , Inf Control Hosp Epidemiol, 2021, 1-6, https://doi.org/10.1017/ice.2021.70
13. Moore (L.D.) et al., The impact of COVID-19 pandemic on hand hygiene performance in hospitals, AJIC, 2021,49:30-33.
14. Praktische aanbevelingen ter attentie van gezondheidswerkers en gezondheidsautoriteiten betreffende de identificatie en het beheer van vermoede of bevestigde dragers van zeer besmettelijke virussen (van het Ebola- of Marburgtype) in het kader van een uitbraak in West-Afrika, HGR aanbeveling nr. 9188, juli 2014.
15. Guidance on PPE to be used by healthcare workers during management of patients with confirmed Ebola or persons under investigation for Ebola who are clinically unstable or have bleeding, vomiting or diarrhea in U.S. Hospitals, including procedure for donning and doffing, CDC https://www.cdc.gov/vhf/ebola/healthcare-us/ppe/guidance.html#:~:text=Recommended%20PPE%20When%20Caring%20for,to%20at%20least%20mid%2Dcalf.&text=Single%2Duse%20(disposable)%20impermeable%20coverall.
16. COVID-19: guidance for maintaining services within healthcare setting: IPC recommendations, Public Health England, NHS, version 1.1., january 2021.
17. Aanbevelingen inzake handhygiëne tijdens de zorgverlening (herziening 2018), HGR aanbeveling nr. 9344, april 2018.
18. WHO guidelines on handhygiene in healthcare, january 2009.
19. Vandeputte (M.), Hygiëne in het ziekenhuis, Acco, Leuven, 2009, p.66.
20. Casanova (L.M.) et al., Effect of single-versus double gloving on virus transfer to healthcare workers’ skin and clothing during removal of personal protective equipment, AJIC, 2012,40:369-374.
21. Scheithauer (S.) et al., Disinfection of gloves: feasible, but pay attention to the disinfectant/glove combination, Journal of Hospital infection, 2016, 94:268-272.
22. Gao (P.) et al., Effect of multiple alcohol-based hand rub applications on the tensile properties of thirteen brands of medical exam nitrile and latex gloves, J Occup Environ Hyg, 2016:13:905-914.
23. Anedda (J.) et al., Changing gears: medical gloves in the era of coronavirus disease 2019 pandemic, Clin Dermatol. 2020, 38(6):734-736.
24. Garrido-Molina (J.M.) et al., Disinfection of gloved hands during the COVID-19 pandemic, Journal of Hospital Infection, 2021, 107, 5-11.
25. Chan-Yeung (M.), Severe acute respiratory syndrome (SARS) and healthcare workers, Int J Occup Environ Health, 2004;10, 421-7.
26. Tomas (M.E.) et al., Contamination of healthcare personnel during removal of protective equipment, JAMA Intern Med, 2015,175(12),1904-1910.
27. Alhimidi (H.) et al., Contamination of healthcare personal during removal of contaminated gloves, AJIC 2019 (47):850-852.
28. Sequence for putting on personal protective equipment (PPE), availabe from: https://www.cdc.gov/hai/pdfs/ppe/ppe-sequence.pdf
29. Chraïti (M.N.), Allegranzi (B.), Larson (E.), Glove use and handhygiene in Handhygiene: a handbook for medical professionals, ed. Pittet (D.), Boyce (J.M.), Allegranzi (B.), Wiley Blackwell, 2017.