I – Inleiding
Op 31 december 2019 verneemt het regionale kantoor van de Wereldgezondheidsorganisatie (WHO) dat er gevallen van virale longontsteking van ongekende oorsprong zijn vastgesteld in Wuhan, in de Volksrepubliek China(1). Het infectieuze agens is een nieuw coronavirus dat door het ‘International Committee on Taxonomy of Viruses’ eerst wordt aangeduid als ‘2019-nCoV’ en vervolgens als ‘SARS-CoV-2’ (Severe Acute Respiratory Syndrome-related Coronavirus 2). Dit virus verspreidt zich snel wereldwijd. De verspreiding en de ernst van de ziekte die het veroorzaakt, COVID-19 (Coronavirus Disease 2019), zijn zo alarmerend dat de WHO op 11 maart 2020 spreekt van een pandemie. Aangezien Europa het epicentrum van de pandemie is geworden(1), wordt in België op 18 maart 2020 een nationale lockdown afgekondigd. Door de intrede van het pandemische virus SARS-CoV-2 worden de preventieve maatregelen om de overdracht te controleren (DRUPPEL- en CONTACT-voorzorgsmaatregelen) in de ziekenhuizen versterkt. Daarnaast wordt een aantal bijkomende maatregelen ingevoerd om de zorgverleners die in contact komen met COVID-19-patiënten te beschermen. Ondanks alle maatregelen om het aantal infecties te controleren, wordt vanaf 2020 door tal van teams infectiepreventie en -controle wereldwijd herhaaldelijk melding gemaakt van ongecontroleerde overdracht van multiresistente bacteriën (MDRO) binnen de COVID-19-eenheden (2,3,4,5).
In dit artikel willen wij verslag uitbrengen van onze ervaring met een epidemie met carbapenemase producerende enterobacteriaceae (CPE) van het type OXA-48 bij COVID-19-patiënten in de afdeling Intensieve Zorgen (IZ) van het CHR Haute Senne in Zinnik. Deze epidemie wordt in oktober 2020 vastgesteld, parallel aan de tweede golf van COVID-19, en doet zich voor onder de vorm van twee in de tijd gescheiden uitbraken. In het eerste deel van dit artikel beschrijven wij de epidemiologische onderzoeken die voor elke uitbraak werden gevoerd en die ons inzicht hebben verschaft in de wijze waarop deze MDRO wordt overgedragen. Op die manier kon worden bepaald welke maatregelen doeltreffend zouden zijn om de epidemie te controleren.
In het tweede deel bespreken we kort de wetenschappelijke literatuur over MDRO-uitbraken op IZ tijdens de COVID-19-pandemie.
II – Eerste uitbraak
A/ Beschrijving
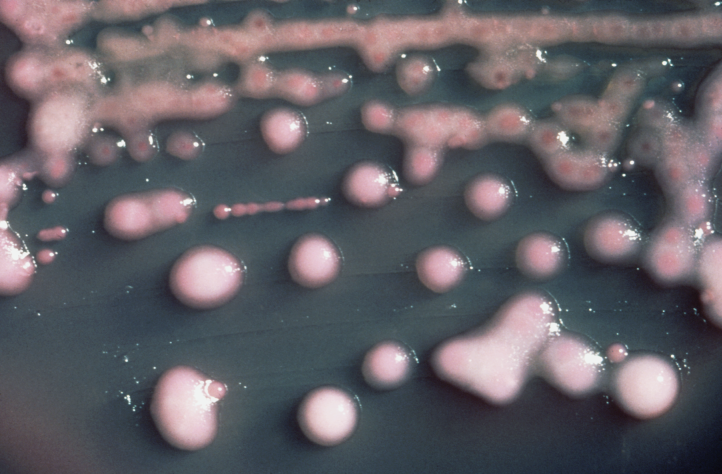
De epidemie met OXA-48 carbapenemase producerende Klebsiella pneumoniae doet zich voor in de afdeling Intensieve Zorgen van het CHR Haute Senne, een ziekenhuis met 246 erkende bedden. Deze eenheid telt 10 bedden en is goed voor 520 opnames per jaar, met een gemiddelde verblijfsduur van 4,5 dagen. Vier van de 10 kamers zijn isolatiekamers met sas. Bij opname in de eenheid worden alle patiënten systematisch gescreend op MRSA aan de hand van drie wissers (neus-, keel- en lieswisser) en op ESBL, CPE en VRE door middel van een rectale wisser. Deze screenings worden niet herhaald tijdens het verblijf van de patiënt, noch wanneer de patiënt de eenheid verlaat.
Uit de lokale epidemiologische situatie blijkt dat 20,5% van de Klebsiella pneumoniae die worden aangetroffen in klinische stalen van patiënten opgenomen in het CHR Haute Senne niet gevoelig zijn voor cefalosporines van de derde generatie en dat 8,4% ervan niet gevoelig is voor carbapenems. De incidentie van OXA-48 producerende enterobacteriaceae (klinische stalen) bedraagt ziekenhuisbreed 4,6 per 1000 opnames en de ziekenhuisbrede incidentiedensiteit is 0,8 per 1000 hospitalisaties. De incidentie van OXA-48 producerende enterobacteriaceae (klinische stalen) op IZ bedraagt 5,8 per 1000 opnames. De productie van carbapenemase type OXA-48 vormt het enige mechanisme dat in 2020 is vastgesteld bij CPE’s in het CHR Haute Senne.
Op 8 oktober 2020, tijdens de tweede golf van COVID-19, zien we de eerste tekenen van een ongecontroleerde MDRO-overdracht op IZ, wanneer een niet-COVID-19-patiënt (patiënt A), die al 6 dagen op IZ ligt, een bacteriëmie met een carbapenemase producerende Klebsiella pneumoniae OXA-48 ontwikkelt, met hetzelfde antimicrobiële gevoeligheidsprofiel als diegene die een andere niet-COVID-19-patiënt (indexpatiënt) vertoonde bij aankomst op IZ op 20 augustus 2020.
De rectale screening, die is uitgevoerd bij alle patiënten in de eenheid, wijst op de intestinale nosocomiale verwerving van de epidemische bacterie bij een andere patiënt (patiënt B) met COVID-19.
De attack-rate in deze eerste fase van de epidemie, d.w.z. het aantal gekoloniseerde/geïnfecteerde patiënten (CPE+ screening) in verhouding tot het totaal aantal patiënten dat in de maand oktober in de eenheid verbleef, bedraagt 7%.
Alle bacteriële stammen, zowel klinische stammen als omgevingsstammen, die tijdens de epidemie door kweek werden geïsoleerd, zijn voor typering naar het Nationaal Referentiecentrum (NRC) voor multiresistente gram-negatieve bacteriën gestuurd. De analyses konden echter niet worden uitgevoerd omdat het NRC werd lamgelegd door de tweede golf van COVID-19. Bijgevolg kunnen wij geen typeringsgegevens en met name geen sequentievergelijkingen van de genomen van de isolaten voorleggen, aan de hand waarvan wij de mate van genetische gelijkenis hadden kunnen vaststellen.
B/ Onderzoek
Een controle van de praktijken en toepassing van de procedures op het terrein brengt een aantal elementen aan het licht die wijzen op overdracht via de handen, gelinkt aan een verkeerd gebruik van persoonlijke beschermingsmiddelen (PBM’s).
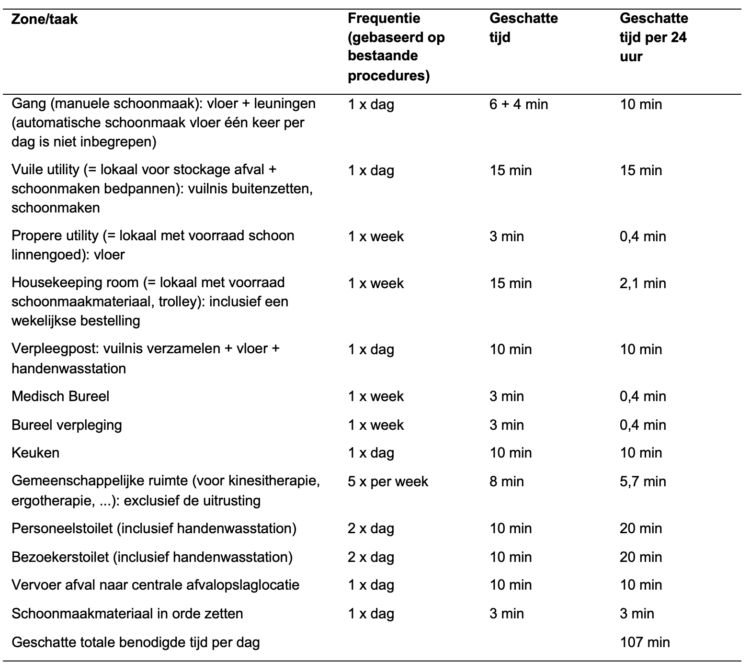
Tijdens de tweede golf draagt het verpleegkundig personeel van IZ een complexe outfit over hun werkuniform, met een combinatie van verschillende PBM’s: schort, muts, FFP2-mondmasker en vizier. Deze uitrusting wordt aangevuld met een dubbel paar handschoenen, waarvan alleen het bovenste paar tussen elke patiënt wordt verwisseld (cfr. figuur 1). Uit het epidemiologisch onderzoek blijkt echter dat deze cruciale stap, namelijk het wisselen van het bovenste paar handschoenen tussen elke patiënt, vaak wordt vergeten.
Figuur 1: Volgorde voor het aantrekken van de kledingstukken van de COVID-19-outfit van een verpleegkundige op IZ.

De verpleegkundige zet eerst het FFP2-masker op, gevolgd door de muts en het eerste paar handschoenen. Daarna volgt een overall met kap. De outfit wordt aangevuld met een tweede paar handschoenen om de mouwen af te sluiten. Dit paar dient tussen elke patiënt verwisseld te worden.
Een verkeerd gebruik van PBM’s in combinatie met een toegenomen passage van personeel tussen de kamers en het feit dat patiënten met verschillende infectierisico’s, al dan niet COVID-19, al dan niet gekoloniseerd met een OXA-48 producerende Klebsiella pneumoniae, in dezelfde eenheid verblijven, zijn factoren die waarschijnlijk verantwoordelijk zijn voor de verspreiding van de epidemische bacterie binnen de eenheid.
Parallel aan de systematische screening van de patiënten wordt een omgevingsonderzoek uitgevoerd om besmetting van de omgeving aan te tonen. Zo worden de wastafels (straalbreker, overloop en afvoeropening) evenals de toetsenborden van de computers in de 10 kamers van de eenheid bemonsterd aan de hand van wissers die op kweek worden gezet voor onderzoek naar OXA-48 producerende enterobacteriaceae. Voor geen enkele wastafel in de IZ-kamers kon de aanwezigheid van CPE worden aangetoond. Daarentegen wordt de aanwezigheid van OXA-48 carbapenemase producerende K. pneumoniae gedocumenteerd op een toetsenbord van een computer in een kamer van een patiënt met dezelfde bacterie. Dit element zal voor educatieve doeleinden worden gebruikt ter illustratie van de besmetting van omgevingsoppervlakken door de microbiële flora van patiënten.
C/ Maatregelen om de epidemie te controleren
De maatregelen om de epidemie te controleren zijn voornamelijk op drie pijlers gebaseerd: (1) geografische cohortering van de patiënten in de eenheid en van het personeel voor de zorgverlening aan CPE-positieve en CPE-negatieve patiënten, (2) herstellen van het juiste gebruik van de persoonlijke beschermingsmiddelen en (3) betere reiniging en ontsmetting van de omgeving.
1-Cohortering van patiënten met toegewezen verpleegkundig personeel:
Aan het plafond wordt een dekzeil opgehangen om de eenheid in twee delen te verdelen: de dragers van de epidemische bacterie, ongeacht hun COVID-19-status, worden aan één kant van de eenheid gegroepeerd. Verschillende zorgteams – zowel tijdens de dag als ’s nachts – behandelen patiënten die drager zijn van de epidemische bacterie en patiënten die geen drager zijn.
Deze maatregel impliceert een verhoging van het aantal verpleegkundigen op IZ.
2-Herstellen van het juiste gebruik van de PBM’s:
Het team infectiepreventie en -controle (IPC) geeft feedback over het onderzoek van de uitbraak aan het zorgpersoneel op IZ om de aandacht te vestigen op de overdracht van de epidemische bacterie via de handen en om de hypothese uit te sluiten dat de bacterie afkomstig is van of wordt doorgegeven via omgevingsbronnen.
Met het IZ-team wordt overeengekomen om het gebruik van wegwerpschorten met handschoenen te standaardiseren voor alle IZ-patiënten tijdens de epidemie met OXA-48 producerende Klebsiella pneumoniae.
3-Betere reiniging en ontsmetting van de omgeving:
Tijdens de epidemie met OXA-48 producerende Klebsiella pneumoniae wordt de schoonmaak op de IZ versterkt: de contactpunten van de deuren worden tweemaal per dag ontsmet, het schoonmaakpersoneel op IZ wordt versterkt om de ontsmetting van alle medische hulpmiddelen, de sanitaire voorzieningen en de oppervlakken in de ‘OXA-48’ kamers te waarborgen, zonder dat het ontsmettingsprotocol zelf werd aangepast. Het IPC-team superviseert het vrijgeven van deze kamers.
Patiënten die niet gekoloniseerd zijn met de epidemische Klebsiella pneumoniae worden tweemaal per week gescreend.
D/ Conclusie van de eerste uitbraak
Slechts twee van de drie vooropgestelde maatregelen konden in eerste instantie worden uitgevoerd; de cohortering van de patiënten met de epidemische bacterie moest worden uitgesteld wegens moeilijkheden om extra personeel aan te werven om het IZ-team te versterken.
Op 4 november 2020 bracht de tweewekelijkse screening een nieuw geval van nosocomiaal verworven K. pneumoniae OXA-48 aan het licht bij een COVID-19-patiënt die al een maand op IZ lag (patiënt C). Drie andere nieuwe patiënten (D, E en F) zullen in de loop van november de epidemische bacterie oplopen (cfr. figuur 2).
Dankzij de versterking van het zorgpersoneel op IZ en dankzij de invoering van de geografische cohortering van de CPE+-patiënten met specifiek zorgpersoneel in december 2020 zal de overdracht gecontroleerd kunnen worden en kan de OXA-48-producerende Klebsiella pneumoniae-epidemie tijdelijk worden opgelost.
Ten slotte worden 7 patiënten (waaronder de indexpatiënt) tussen oktober en december 2020 getroffen door deze epidemie. Vijf van de 7 patiënten zijn ouder dan 70 jaar, 5 van de 7 patiënten hebben COVID-19 en 6 van de 7 patiënten ontwikkelen een OXA-48 producerende Klebsiella pneumoniae-infectie (pneumonie (n=2), sepsis (n=3), urineweginfectie (n=1)). Drie van de 7 patiënten overlijden op IZ: 2 met OXA-48 veroorzakende Klebsiella pneumoniae sepsis, en één patiënt met SARS-CoV-2 hypoxemische pneumonie. Deze uitbraak is strikt beperkt gebleven tot enkel de IZ en heeft zich niet uitgestrekt tot andere afdelingen.
Figuur 2: Schema van de opeenvolgende verwervingen van de epidemische bacterie door 7 patiënten (waaronder de indexpatiënt) die bij deze uitbraak betrokken waren, onder de vorm van een tijdlijn
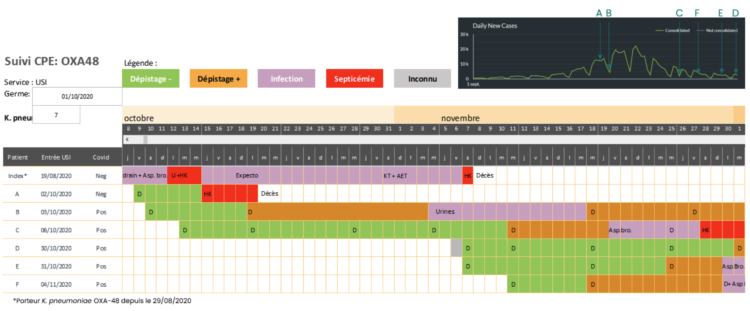
Een kleurcode duidt het onderscheid aan tussen niet-intestinale dragers (groen), intestinale dragers (oranje) en besmettingen zonder bacteriëmie (paars) of met bacteriëmie (rood). Bovenaan rechts wordt de grafische weergave van de incidentie van de nieuwe COVID-19-gevallen in België(6) getoond, voor dezelfde periode (tussen 1 september en 1 december 2020), waardoor het mogelijk is het tijdsverband te volgen tussen de opeenvolgende verwervingen van de epidemische bacterie op IZ enerzijds en de tweede COVID-19-golf anderzijds.
III – Tweede uitbraak
A/ Beschrijving van de uitbraak
Tussen december 2020 en februari 2021 wordt op IZ geen enkel nieuw geval van kolonisatie of nosocomiale infectie met OXA-48-producerende enterobacteriën vastgesteld.
Alle maatregelen die tijdens de epidemie van 2020 werden toegepast (versterking van de PBM’s, reiniging/ontsmetting van de omgeving), worden stopgezet na het vertrek van de laatste patiënt die er drager van was. Een wekelijkse rectale MDRO-screening blijft echter behouden voor de patiënten op IZ. Op 25 februari 2021 wordt een patiënt opgenomen op IZ wegens ademnood als gevolg van COVID-19. De rectale wisser voor de MDRO-screening (VRE/ESBL/CPE) is negatief bij opname. De screening die vervolgens wekelijks wordt herhaald, blijft negatief tot 1 april 2021. Op die datum wordt voor het eerst een OXA-48-producerende Klebsiella pneumoniae gedetecteerd in de rectale wisser. De afdeling IZ telde sinds de opname van de patiënt echter geen enkele patiënt die drager is.
B/ Onderzoek
De hypothese van een omgevingsbesmetting wordt overwogen en er wordt een nieuw omgevingsonderzoek uitgevoerd, op basis van hetzelfde protocol als dat van 2020, waarbij de wastafels (straalbreker, overloop en afvoeropening) van 7 van de 10 IZ-kamers worden bemonsterd. Hoewel het onderzoek in 2020 de aanwezigheid van CPE niet heeft kunnen aantonen, wordt de aanwezigheid van verschillende OXA-48 producerende Enterobacteriaceae-soorten (Klebsiella pneumoniae, Citrobacter freundii, Escherichia coli, Enterobacter cloacae en Serratia marcescens) aangetroffen in de wissers afkomstig van de wastafels van 5 van de 7 kamers die zijn bemonsterd in 2021.
C/ Maatregelen om de epidemie te controleren
Er worden onmiddellijk controlemaatregelen ingevoerd, gevolgd door nog andere maatregelen voor controle op lange termijn.
Onmiddellijke controlemaatregelen:
De wastafels in alle kamers worden afgesloten en de procedure voor persoonlijke verzorging op IZ wordt gewijzigd om het gebruik van de plaatselijke watervoorziening in de kamers te beperken en om te promoten dat patiënten uitsluitend verzorgend worden gewassen (gebruik van vooraf bevochtigde washandjes voor eenmalig gebruik en shampookap zonder spoelen). Het zorgpersoneel wordt bewust gemaakt van de rol van de levenloze omgeving, en meer in het bijzonder van het belang van biofilms, water en sanitaire installaties (wastafels, kranen, sifons) als reservoir of vector bij epidemieën. De directie wordt in kennis gesteld van de noodzaak om de wastafels en de sifons te vervangen en om een actieplan op lange termijn in te voeren om de kritieke punten van de structuur en de infrastructuur van IZ te herzien (zie hieronder).
Controlemaatregelen op lange termijn:
Het Comité voor Ziekenhuishygiëne en de ziekenhuisdirectie valideren het plan voor de herziening van de architectuur en de belangrijkste processen op IZ dat door het IPC-team en het IZ-team gezamenlijk werd ontwikkeld:
– Er wordt beslist om de aanwezigheid van wastafels in de IZ-kamers te behouden om het wettelijk kader te respecteren («Het moet mogelijk zijn om in de buurt van elk bed de handen te wassen» ).
– Een vervanging van de wastafels en de sifons in de kamers wordt overwogen volgens de criteria die zijn vastgelegd in de aanbevelingen van de Hoge Gezondheidsraad nr. 8580 (porseleinen wasbak, afgeronde randen schuin naar de kom toe, geen overloop, geen stop en geen zeepbakje, automatische kraan met sensor, geen straalregelaar, sifon die gemakkelijk te demonteren is).
– In de kamer worden de toegestane gebruiksvoorwaarden geafficheerd tegenover elke wastafel (cfr. figuur 3).
– Er wordt een protocol ingevoerd voor de regelmatige ontsmetting van de wastafels en sifons (bleekwater aan 2,6%, 300 ml, contacttijd 15 minuten, spoelen met koud water, telkens bij ontslag van de patiënt).
– Voor de afvoer van het dialysaat wordt in elke kamer een afzonderlijke leiding voorzien.
– De procedure voor het beheer van de excreta en lichaamsvochten op IZ wordt aangepast teneinde de verschillende trajecten voor afvalverwijdering, het gebruik van de bedpanspoeler en de eindsterilisatie van het herbruikbaar materiaal bij ontslag van de patiënt in kaart te brengen. Voor patiënten in isolatie wordt materiaal voor eenmalig gebruik en materiaal voor verzorgend wassen aanbevolen.
1 Koninklijk besluit tot vaststelling van de normen waaraan een functie intensieve zorg moet voldoen om te worden erkend, 27 april 1998
Figuur 3: Identificatie van de wastafels in de kamer

IV – Bespreking
De rapportage over ervaringen met epidemieën met multiresistente bacteriën bij patiënten die tijdens de pandemie in het ziekenhuis werden opgenomen in de COVID-19-afdelingen, zijn talrijk en worden uitvoerig geanalyseerd in de wetenschappelijke literatuur.
Er worden meerdere oorzaken gemeld voor het slecht functioneren van infectiepreventie- en controlemaatregelen(7). Zo zouden de COVID-19-uitrusting en -maatregelen, die de zorgverlener beschermen, een vals gevoel van veiligheid kunnen geven. Vooral omdat de complexiteit van de uitrusting niet bevorderlijk is voor het herhaaldelijk ontsmetten van de handen of voor de vereiste frequentie voor het wisselen van de handschoenen in het kader van de zorgverlening in een zorgeenheid. Er wordt namelijk regelmatig gewezen op een verkeerd gebruik van de PBM’s, terwijl tegelijkertijd de begeleiding van het IPC-team op het terrein afneemt, door de intensieve bevraging tijdens de pandemie. Door het tekort aan materiaal en de creativiteit die de teams aan de dag hebben gelegd om dit te verhelpen, worden de procedures regelmatig gewijzigd. Het personeel wordt geconfronteerd met een extreme werklast die impact kan hebben op de waakzaamheid en de naleving van de hygiëneprocedures. Daarnaast kan ook worden gewezen op de omkadering door reservepersoneel met weinig ervaring, dat gewoonlijk niet op IZ werkt. Dit verhoogt de kans om fouten te maken bij het uitvoeren van procedures die cruciaal zijn op gebied van infectiepreventie. Bovendien is het gebrek aan zorgpersoneel op zich een goed gedocumenteerde oorzaak van verhoogde risico’s op kruisoverdracht van multiresistente bacteriën(8).
Door haar vermogen om wisselende en onstabiele situaties te creëren, heeft de pandemie alle elementen van het infectiecontrolesysteem van de ziekenhuizen verzwakt. En wat onze ervaring in het CHR Haute Senne betreft, hebben wij analogieën kunnen vaststellen met alle bovengenoemde oorzaken van disfunctioneren.
Het is echter niet alleen het infectiecontrolesysteem dat in gebreke blijft. Het is inderdaad gebleken dat patiënten met een ernstige COVID-19 infectie een verhoogd risico lopen om bacteriële (co)infecties te ontwikkelen, waarschijnlijk als gevolg van hun vele comorbiditeiten, de langere ziekenhuisopname – vooral op IZ – en de slechte werking van het immuunsysteem door SARS-CoV-2(9). In een cohort van 221 patiënten met COVID-19 melden Zhang et al. (10) bijvoorbeeld een percentage bacteriële co-infectie bij patiënten met ernstige COVID-19 (verblijf op IZ + mechanische ventilatie) van 25,5% tegenover slechts 1,8% bij patiënten met niet-ernstige COVID-19 (p<0,001).
Verder lijkt het duidelijk dat het toegenomen gebruik van antibiotica bij patiënten die in het ziekenhuis worden opgenomen tijdens een pandemie, een belangrijke factor is bij de selectie van MDRO’s in de flora van de patiënten(11).
De verhoogde incidentie van MDRO-kolonisatie van patiënten tijdens de COVID-19-pandemie kan worden geïllustreerd door het retrospectief observationeel onderzoek van B Tiri et al(2). In de IZ-afdeling met 14 bedden van het ziekenhuis van Terni (554 bedden, Umbrië, Italië) zijn de incidentie van kolonisatie met carbapenem-resistente enterobacteriaceae en het percentage nosocomiale verwervingen significant hoger tijdens de eerste COVID-19-golf (maart-april 2020) dan in het pre-COVID-19-tijdperk of in de fase na de eerste golf. In het CHR Haute Senne wordt dit fenomeen tijdens de eerste golf niet waargenomen en tijdens de tweede golf hebben wij geen toename vastgesteld van de incidentie van kolonisatie van patiënten bij aankomst op IZ. Er is alleen een hoge piek nosocomiale besmettingen waargenomen, die samenhangt met de eerste uitbraak die in dit artikel wordt besproken.
V Pintado et al. (12) ten slotte tonen aan dat tussen 1 maart en 31 mei 2020, in het universitair ziekenhuis Ramón y Cajal in Madrid, CPE-infecties vaker voorkomen bij COVID-19-patiënten dan bij niet-COVID-19-patiënten (1,1% vs 0,5%, p=0,005). Het gebruik van antimicrobiële middelen (p=0,004), mechanische ventilatie (p<0,001) en opname op IZ (p<0,001) is hoger voor COVID-19-patiënten. Episoden van CPE-infectie worden vaker gediagnosticeerd als nosocomiale infecties op IZ bij COVID-19-patiënten (p<0,001). De frequentie van ernstige sepsis, septische shock (p=0,01) en de SOFA-score (Sequential Organ Failure Assessment) (p=0,04) is hoger bij de COVID-19-gevallen dan bij de controlepersonen. De totale mortaliteit op 30 dagen van de COVID-19-patiënten en de controlepersonen is respectievelijk 30% en 16,7% (p=0,25). In dat laatste geval is het verschil statistisch niet significant, maar het is interessant om voor ogen te houden dat de sterkte van de statistische test wordt beperkt door de kleine omvang van de cohorten in deze studie (30 COVID-19-patiënten en 24 niet-COVID-19-patiënten).
De algemene stijging van de werklast voor de IZ-afdelingen in de COVID-periode kan onder meer worden beoordeeld aan de hand van de Nursing Activities Score (NAS) en de berekening van de ideale verhouding verpleegkundigen per COVID-19-patiënt, rekening houdend met de toename van de activiteit. De gegevens van het CHR Haute Senne over de periode van 14
maart tot en met 30 april 2020 bevestigen een aanzienlijk hogere NAS-score, die een ideale verhouding van 0,82 verpleegkundigen per COVID-19-patiënt suggereert(13). Deze lokale gegevens worden bevestigd door een grotere steekproef uitgevoerd bij de vijf IZ-afdelingen van drie ziekenhuizen in Henegouwen, waaronder het CHR Haute Senne(14). Het is dus van belang niet te vergeten welke rol deze werklast heeft gespeeld bij de uitbraak van de epidemie, terwijl de IZ onderbestaft was en dat de versterking van het verpleegkundig personeel in de eenheid en de cohortering van de zorgverlening doeltreffende maatregelen zijn gebleken om de epidemie uiteindelijk uit te roeien.
Deze verschillende gegevens illustreren hoe de COVID-19-pandemie leidt tot de desorganisatie van het systeem, burn-out bij het personeel, kwetsbaarheid van COVID-19-patiënten en overmatig gebruik van breedspectrumantibiotica. Het zijn allemaal factoren die bijdragen tot de stijging van de incidentie van dragerschap, nosocomiale verwerving en de infectiepercentages veroorzaakt door diverse MDRO’s, waaronder de CPE’s.
De ervaring in het CHR Haute Senne met een epidemie van CPE in volle tweede golf van COVID-19 toont aan hoezeer de integratie van alle elementen van het systeem fundamenteel is in het beheer van een epidemie. De identificatie van kritische elementen om kruisoverdracht te verklaren, met name het verkeerd gebruik van de beschermingsmiddelen, ondersteund door personeelstekort en vermoeidheid, heeft zeker bijgedragen om te bepalen welke maatregelen het meest geschikt waren om de eerste uitbraak een halt toe te roepen. Op basis van onze gegevens kunnen we echter veronderstellen dat een verplaatsing van het CPE-reservoir met besmetting van secundaire reservoirs in de omgeving geruisloos heeft kunnen plaatsvinden in deze periode (van de flora van de patiënten naar de sifons van de wastafels), gekoppeld aan een ontsporing van de praktijken om biologische vloeistoffen, reinigingswater en andere afvalstoffen te verwijderen ten gevolge van alle bovenvermelde redenen van desorganisatie. Dit kan hebben bijgedragen tot de tweede uitbraak.
Op basis van de gegevens kan echter niet worden uitgesloten dat er mogelijk asymptomatische dragers zijn, die niet werden gedetecteerd door de screenings (en mogelijk aanwezigheid van asymptomatische dragers onder het personeel), die ook aan de basis hadden kunnen liggen voor het opnieuw opduiken van de epidemie.
Verder kan door het ontbreken van moleculaire typeringsgegevens, waarbij de klinische stammen van de epidemieën van 2020 en 2021 worden vergeleken met de omgevingsstammen, ook geen formeel verband worden gelegd tussen de eerste en de tweede uitbraak.
V – Conclusies
De combinatie van de tweede golf van COVID-19 en het langdurige verblijf van een patiënt met multiresistente bacteriën heeft in het begin van het laatste kwartaal van 2020 tot een epidemie van OXA-48 carbapenemase producerende Klebsiella pneumoniae op de IZ-afdeling van het CHR Haute Senne te Zinnik geleid. Van de zeven patiënten die positief testten, is er slechts één asymptomatisch gebleven. De andere zes patiënten hebben een OXA-48 Klebsiella pneumoniae-infectie ontwikkeld. Hoewel veel factoren waarschijnlijk hebben bijgedragen tot het ontstaan van de epidemie, is de kruisoverdracht voornamelijk te wijten aan een onjuist gebruik van handschoenen. Hoewel de epidemie onder controle was, kon enkele maanden later door een nieuwe nosocomiale verwerving van OXA-48 Klebsiella pneumoniae in dezelfde eenheid een reservoir van OXA-48 producerende enterobacteriaceae worden geïdentificeerd en gesaneerd in de wastafels van de kamers, al is de precieze rol van dit reservoir bij het ontstaan van de tweede uitbraak nog niet bewezen.
VI – Bibliografie
(1) https://www.who.int/fr/news/item/29-06-2020-covidtimeline
(2) B Tiri et al, Antimicrobial Stewardship Program, COVID-19, and Infection Control: Spread of Carbapenem-Resistant Klebsiella pneumoniae Colonization in ICU COVID-19 Patients. What Did Not Work? J Clin Med. 2020 Aug 25;9(9):2744
(3) R Amarsy et al, Outbreak of NDM-1-producing Klebsiella pneumoniae in the intensive care unit during the COVID-19 pandemic: Another nightmare, Am J Infect Control. 2021 Oct;49(10):1324-1326.
(4) E Farfour et al, Carbapenemase-producing Enterobacterales outbreak: Another dark side of COVID-19, Am J Infect Control. 2020 Dec; 48(12): 1533–1536.
(5) G Montrucchio et al, Carbapenem-resistant Klebsiella pneumoniae in ICU-admitted COVID-19 patients: Keep an eye on the ball, J Glob Antimicrob Resist. 2020 Dec;23:398-400.
(6) Belgium COVID-19 Dashboard – Sciensano > Cases:
https://datastudio.google.com/embed/reporting/c14a5cfc-cab7-4812-848c-0369173148ab/page/tpRKB
(7) W Mędrzycka-Dąbrowska et al, Carbapenem-Resistant Klebsiella pneumoniae Infections in ICU COVID-19 Patients—A Scoping Review, J Clin Med. 2021 May; 10(10): 2067.
(8) C Legeay et al, Is cohorting the only solution to control carbapenemase-producing Enterobacteriaceae outbreaks? A single-centre experience, J Hosp Infect. 2018 Aug;99(4):390-395
(9) Lai CC et al. Co-infections among patients with COVID-19: the need for combination therapy with non-anti-SARS-CoV-2 agents? J Microbiol Immunol Infect 2020;53:505–12.
(10) Zhang G et al. Clinical features and short-term outcomes of 221 patients with COVID-19 in Wuhan, China. J Clin Virol 2020;127:104364.
(11) Lai CC et al, Increased antimicrobial resistance during the COVID-19 pandemic, Int J Antimicrob Agents 2021 Apr;57(4):106324.
(12) V Pintado et al, Carbapenemase-producing Enterobacterales infections in COVID-19 patients, Infect Dis (Lond). 2021: 1–10
(13) P Reper et al, Nursing Activities Score is increased in COVID-19 patients, Intensive Crit Care Nurs. 2020 Oct; 60: 102891
(14) A Bruyneel et al, Impact of COVID-19 on nursing time in intensive care units in Belgium, Intensive Crit Care Nurs. 2021 Feb; 62: 102967.