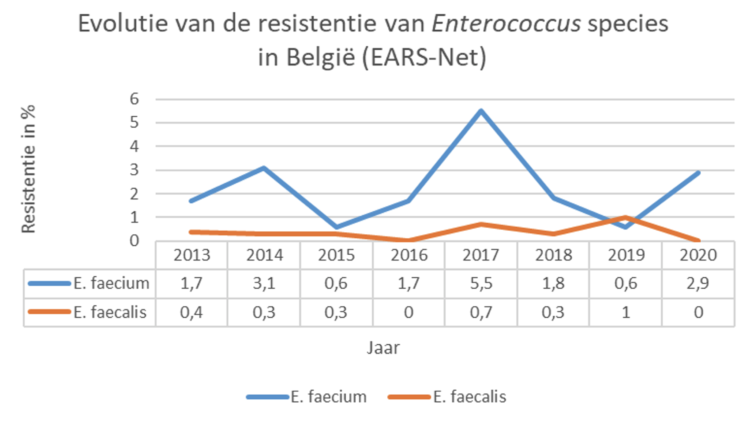
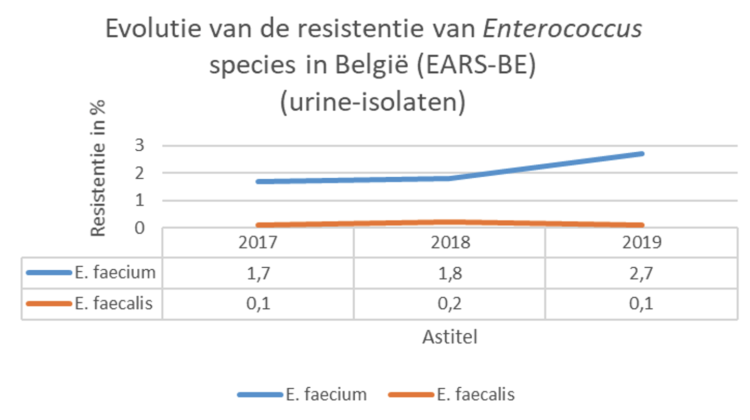
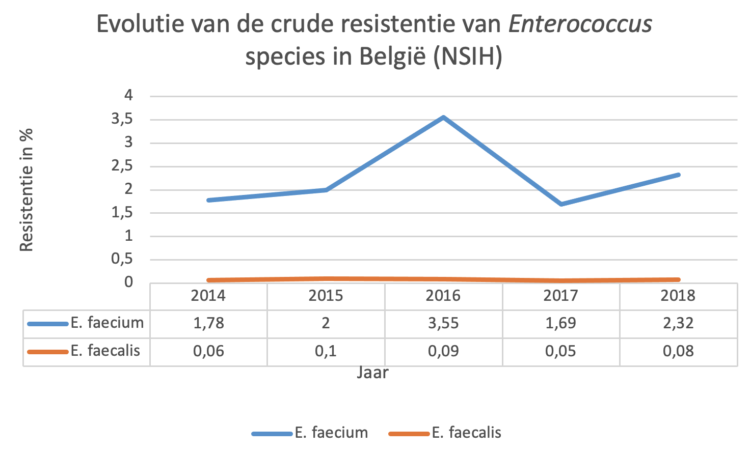
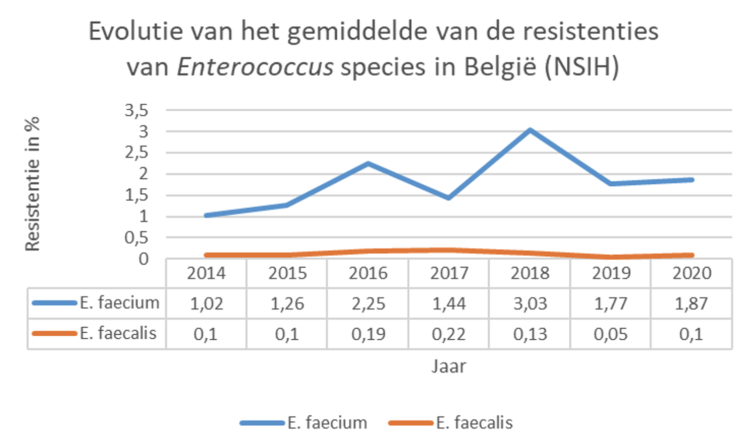
Tussen mei en oktober 2021 werd een bevraging uitgevoerd onder de leden van BICS en het regionaal platform ziekenhuishygiëne Antwerpen bij Belgische infectiepreventie (IP) teams naar de impact van de COVID-19 pandemie op hun functioneren via 10 open vragen.
Volgende 10 vragen werden gesteld:
1. Wat was/is de invloed van COVID-19 op je werk?
2. Heb je nieuwe taken gekregen?
3. Zijn er taken gewijzigd?
4. Zijn er medewerkers bijgekomen?
5. Wat was/is je top 3 van problemen die je tegengekomen bent om de pandemie onder controle te krijgen?
6. Was er voldoende ondersteuning van de dienst arbeidsgeneeskunde bij het opvolgen van besmettingen
bij personeel?
7. Was er ondersteuning van ziekenhuisartsen en management om afdelingen tijdelijk te sluiten?
8. Wie deed contact tracing binnen het ziekenhuis?
9. Kan het agentschap zorg en gezondheid een meerwaarde zijn in ondersteuning?
10. Andere opmerkingen/vragen/ideeën ?
In totaal werden 35 enquêtes ingevuld en de resultaten van deze bevraging maken duidelijk dat IP medewerkers het zwaar te verduren hebben gehad tijdens de pandemie en brengen ook een aantal pijnpunten naar boven over de organisatie van IP in ons land.
Het is duidelijk dat COVID-19 gezorgd heeft voor een enorme werklast bij de IP medewerkers en dat dit een enorme impact heeft gehad op hun functioneren. Het normale werk geraakte totaal op de achtergrond en bepaalde essentiële taken zoals surveillance, registraties, audits en opleidingen konden niet of onvoldoende uitgevoerd worden.
Terwijl in de beginfase van de pandemie de angst heel groot was en iedereen de maatregelen van handhygiëne en correct gebruik van persoonlijke beschermingsmiddelen (PBM) goed opvolgde, daalde die compliance vrij snel na de acute fase. Dit werd nog verstrekt door tegenstrijdige aanbevelingen en richtlijnen van overheden en “experten” waardoor de geloofwaardigheid van het IP team in vraag gesteld werd en het volgen van de richtlijnen moeilijker af te dwingen was. De emoties (zowel bij henzelf als bij de medewerkers, bezoekers en patiënten) zorgde voor een bijkomende stressfactor.
Op de vraag of er nieuwe taken zijn bijgekomen antwoordt het overgrote deel positief. Voor de persoonlijke beschermingsmiddelen moest er gekeken worden naar de kwaliteit, een procedure en opleiding opgesteld worden alsook de normen en certificaten opgevolgd worden en bij stock breuk gezocht worden naar alternatieven of herbruikbaarheid uitgewerkt worden. Ook het beleid naar medewerkers toe in het kader van COVID-19 kwam bij het IP team terecht, zoals testen, quarantaine, contact tracing of vaccinatie. Verder kwam er het outbreak management, isolatiebeleid en procedures en opleidingen bij gerelateerd aan COVID-19 alsook deelname aan de crisis cel. Naar externen toe werd het team het contactpunt naar de eerste lijn voor vragen en adviezen (woon- en zorgcentra, daklozenkwesties, andere collectiviteiten, …) en werd er ook via hen materiaal (PBM en testen) geleverd. Vaak werd er ook een plaatsbezoek afgelegd om de juiste ondersteuning te kunnen bieden en werden de testresultaten opgevolgd indien deze uitgevoerd werden in het ziekenhuis. De bereikbaarheid en een permanente wachtdienst van 7/7 dagen kwam erbij voor sommige IP teams.
Bij de vraag of er taken gewijzigd zijn is het globale antwoord dat de taken zo uitgebreid zijn geworden zonder dat er iets wijzigde aan het takenpakket waardoor er veel werk is blijven liggen zoals surveillance, opvolging van zorgbundels…
Ondanks die enorme toename in het werk is er bij minder dan 50% ook effectief een uitbreiding van het team gekomen en indien dat wel gebeurde was dit vooral in de eerste golf en de periode van de totale lockdown, toen er hulp mogelijk was van mensen waar de normale taken van stil lagen, zoals bepaalde administratieve medewerkers, kwaliteitsmedewerkers of andere. Na deze eerste fase gingen zij terug naar hun normale taken, ondanks het feit dat de werkdruk op dat moment nog zeer hoog was voor het team IP. Bij de groep waar er geen uitbreiding van het team kwam was er soms zelfs in die periode geen vervanging van mensen die langdurig afwezig waren of mensen die met pensioen vertrokken. In het merendeel van de ziekenhuizen werd de hoeveelheid werk opgevangen door een hoog aantal overuren van de medewerkers, wat niet bevorderlijk was/is in de preventie van burn-out in deze zware tijden. Verder werden ook vrijwilligers gezocht en gevonden in gepensioneerde medewerkers die tijdelijk terug kwamen werken.
In een recente publicatie in AJIC (Rebmann et al.) werden data gepubliceerd waarbij 75 IP teams in Amerika bevraagd werden naar hun “challenges” tijdens de COVID-19 pandemie, hier hun top 6:
• Rapidly changing and conflicting guidance
• Insufficient PPE
• Healthcare personnel noncompliance with PPE and infection prevention protocols
• Increase in workload
• Increase in healthcare associated infections
• Lack of infection prevention reco’s for nonacute care settings
Op de vraag naar de top 3 van problemen komen we bij de volgende top 5. Het emotionele aspect bij medewerkers, bezoek en patiënten was vaak zwaar: uitbarstingen, onzekerheid, onveilig gevoel en lakse attitude tegenover de te volgen procedures maakten het werk vaak extra zwaar. Op de tweede plaats kwam de schaarste van materiaal tijdens de eerste golf en dit heeft duidelijk sporen nagelaten. Zowel voor PBM als testmateriaal zorgde dit voor een voortdurend schakelen en zoeken naar alternatieven en aanpassen van procedures en opleidingen, wat zeer tijdrovend was. Ten derde werden richtlijnen vaak aangehaald als een probleem, gebrek aan duidelijke richtlijnen of ontbreken van specifieke richtlijnen voor bepaalde topics of instellingen (zoals psychiatrie, jeugdzorg,…) en de continue aanpassingen van de richtlijnen – die dan nog vaak op een vrijdagnamiddag kwamen – hebben voor heel wat problemen gezorgd. De fase na de eerste golf en lockdown zorgde voor extra druk doordat veel artsen en diensten snel wilden heropstarten, hierbij was hulp van directie en overheid zeer cruciaal. Als laatste zorgden alle bovenstaande problemen ook voor een immense werkdruk bij de teams, in combinatie met te weinig tijd door een te lage bestaffing.
De mogelijke ondersteuning van arbeidsgeneeskunde werd door het merendeel als negatief beantwoord. Dit is wel sterk afhankelijk of de dienst intern of extern is. Vaak was de dienst onbereikbaar waardoor de opvolging sneller opgestart werd vanuit het team IP of waren ze als externe dienst reeds overstelpt met problemen van andere opdrachtgevers. In zeldzame gevallen (16%) werd deze dienst wel ervaren als een hulp en was er een goede samenwerking, alhoewel men toch nog vaak beroep deed op het IP team om de procedures uit te werken in het kader van COVID-19 voor arbeidsgeneeskunde.
Deze problematiek zet zich verder in het antwoord op de vraag wie er contact tracing uitvoerde. Dit werd in bijna alle gevallen uitgevoerd door het team ziekenhuishygiëne, aangevuld met nog extra hulp van andere diensten zoals microbiologie, medische directie, verpleegkundige directie, hoofdverpleegkundigen, interne preventiedienst, kwaliteitsdienst, noodplancoördinator, …
De steun van directie en artsen was voldoende om de bedden-afbouw te implementeren in de beginfase. Maar de druk voor het terug opstarten was wel heel groot, zeker in ziekenhuizen waar artsen niet in dienstverband werken.
Op de vraag naar de rol en meerwaarde van het Agentschap Zorg en Gezondheid waren de antwoorden heel divers. Een kleine groep zag er geen meerwaarde in voor hun ziekenhuis omdat ze zelf best het ziekenhuis kennen en ook sneller kunnen inspelen op problemen zoals outbreaks en ook voor contact tracing sneller te werk kunnen gaan. Maar het Agentschap kan volgens deze groep misschien wel een hulp zijn indien er geen infectiepreventie team aanwezig is in de instelling. Bij een groot aantal is er al een positieve samenwerking geweest met het Agentschap en werd de ondersteuning en reflectie en hulp erg gewaardeerd. Verder worden er opportuniteiten gezien voor dit Agentschap in het aanbieden van tools voor registratie en outbreak management (uitbraakregistratiesysteem zoals GO DATA van de WHO) , normen voor PBM opvolgen en rondsturen, opstellen van richtlijnen en opleidingsmiddelen voor het gebruik van deze PBM. Wat ook wel kan helpen is geen bijkomende registraties op te starten en bestaande registraties zonder rapportering af te schaffen (bv. registratie ambulante patiënten op spoedgevallen – kringverwijzingen zonder resultaat) in een pandemische fase.
Zo kwamen we tot de laatste open vraag waar nog een aantal extra thema’s aangebracht worden. Qua infectiepreventie in België blijven de structuren onduidelijk en is het niet duidelijk waar welke verantwoordelijkheid ligt voor infectiepreventie/ziekenhuishygiëne. Je hebt het regionaal en federaal beleid dat betrokken is, de federale en regionale platformen voor ziekenhuishygiëne (ZHH), Sciensano, de Hoge Gezondheidsraad (HGR) en BICS. Maar de taken binnen deze groepen zijn niet altijd helder. Dit heeft tot gevolg dat er sommige mandatarissen als “experten” opstaan waardoor er soms tegenstrijdige adviezen kwamen rond maskers, testen, isolatie, vaccinatie, …. De registratiedruk nam toe in plaats van te dalen met nieuwe en bijkomende registraties met geen of late feedback van Sciensano van data. Ook de druk rond de beschermingsmaterialen was heel groot en aankoop en verdeling van materiaal was beter nationaal aangepakt net als mogelijk hergebruik. De vroege versoepelingen in de maatschappij, ondanks een zeer hoge werkdruk in de ziekenhuizen, was ook een zware psychologische domper voor de medewerkers in het ziekenhuis en ook voor het team infectiepreventie dat zich al vaak eenzaam had gevoeld tijdens deze pandemie.
Conclusies
De noodzaak van integratie van infectiepreventie en –bestrijding in de gehele gezondheidszorg is duidelijk geworden na deze pandemie. Hiervoor zijn strategieën nodig op alle niveaus van de zorg (eerste lijn, ziekenhuizen, collectiviteiten…) met op maat gemaakte acties en richtlijnen en strategieën voor vroegtijdige opsporing en beheer van infecties. Om dit alles mogelijk te maken moet er een duidelijke structuur rond infectiepreventie opgemaakt worden, een bevoegdheid die nu versnipperd is over verschillende bevoegde instanties. De werking van de verschillende instanties en gemeenschappen (federaal, regionaal, provinciaal) en organen (HGR, Sciensano, BAPCOC, BICS, platform ZHH) die zich bezighouden met infectiepreventie is niet duidelijk en betere afspraken zijn hier nodig.
Doeltreffende communicatie met opstellen van procedures en educatie is heel belangrijk en de kanalen hiervoor moeten nu reeds ingebed worden voor een volgende pandemie.
Ook een duurzaam beleid van materialen met mogelijkheid van hergebruik van materialen en productie in eigen land kan helpen bij een volgende pandemie om dreigende tekorten van beschermingsmaterialen te vermijden.
Ziekenhuishygiëne of IP werd het aanspreekpunt voor veel vragen en/of problemen en werd betrokken bij opleidingen, communicatie, opstellen van procedures en adviezen bij aankoop van de persoonlijke beschermingsmiddelen (PBM), een taak die normaal bij de preventiedienst ligt. Vele nieuwe taken die erbij kwamen voor IP hadden betrekking op de taken die normaal bij de interne preventiedienst horen. Dit kwam vaker voor wanneer deze dienst niet intern was, maar door externe firma’s werd uitgevoerd. Dit had betrekking op contact tracing, vaccinatie en screening van medewerkers, alsook aankoopbeleid van beschermende materialen. Een aanbeveling kan dus zijn om preventiediensten in ziekenhuizen verplicht intern te houden.
IP, alhoewel geen deel uitmakend van de crisiscel in veel ziekenhuizen, werd wel geraadpleegd voor crisisbeslissingen, daarom is IP vast opnemen in de crisiscel in het ziekenhuis wel een aanbeveling naar de toekomst toe.
Uit deze bevraging komt ook naar voor dat de omkadering voor IP in de ziekenhuizen, maar ook in de collectiviteiten, onvoldoende is, en dit zowel naar IP personeel als naar andere omkadering (IT, secretariaat…). Het is duidelijk geworden dat met de huidige bezetting qua infectiepreventie in de zorginstellingen het onmogelijk was om normaal te functioneren en vele essentiële taken zoals surveillance en registraties niet meer uitgevoerd konden worden. Om dit alles mogelijk te maken bij een volgende pandemie is er duidelijk een herfinanciering nodig voor infectiepreventie in de zorginstellingen zodat er voldoende mankracht aanwezig is om alle taken correct uit te voeren.
Dit is reeds verschillende malen eerder in aanbevelingen bij externe audits (ECDC, JCI, NIAZ) naar boven gekomen. België zit ver onder het minimaal aangeraden aantal medewerkers voor IP om de kwalitatieve en kwantitatieve doelstellingen qua infectiepreventie in de Belgische zorginstellingen te waarborgen. Met de opstart van het HOST project vanuit FOD gezondheid kan er een eerste aanzet gegeven worden om de middelen voor IP te verhogen in de ziekenhuizen en onrechtstreeks in de collectiviteiten, maar het moet nog blijken of dit voldoende zal zijn aangezien dit project buiten extra middelen ook extra taken inhoudt.
Referentie
Rebmann T., Alvino R.T, Mazzara R.L., Sandcork
J. Infection preventionists’ experiences during the first nine months of the COVID-19 pandemic: Findings from focus groups conducted with Association of Professionals in Infection Control & Epidemiology (APIC) members.
Am J Infect Control. 2021 Sep;49(9):1093-1098.