Een betrouwbare en veilige veneuze toegang via een centraal veneuze katheter is cruciaal voor patiënten in verschillende klinische settings gaande van parenterale voeding en medicatie tot hemodialyse.1-2 Echter bestaat er steeds een risico op centrale lijn geassocieerde bloedstroominfecties (CLABSI) met verlengde hospitalisatieduur, verhoogde kosten, morbiditeit en mortaliteit van patiënten als gevolg 1-2
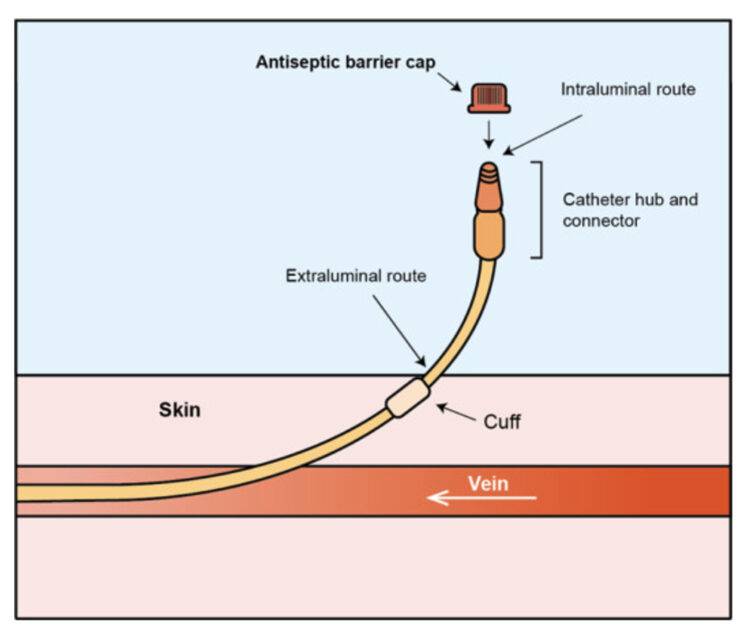
Bij een bloedstroominfectie kunnen pathogenen via een extraluminale of intraluminale weg de bloedbaan bereiken3. De extraluminale contaminatie gebeurt door het binnendringen van micro-organismen via de huid bij het insteekpunt direct in de bloedbaan. Een goede ontsmettingstechniek bij het plaatsen van de katheter en de vervanging van het verband, net zoals het gebruik van een chloorhexidineverband4 kunnen dit voorkomen. De intraluminale route start bij de katheterhub of de naaldloze connector waarlangs micro-organismen kunnen binnendringen. Deze hechten zich vast aan de wand en het interne lumen van de katheter. Zo kan er een biofilm worden gevormd die zich vervolgens kan verspreiden via de bloedbaan. Ter preventie van intraluminale contaminatie moeten katheterhubs worden gedesinfecteerd volgens de procedure, «scrub the hub»of ook wel «actieve desinfectie» genoemd. Dit gebeurt met een compres en desinfecterende vloeistof (alcoholisch) gedurende meer dan 5 seconden, ideaal 15 seconden.5 Gezien de duurtijd en techniek van de ‘scrubbing’ meestal niet omschreven staat in protocols en de compliance dus varieert bij de zorgverstrekkers, is de desinfectie van de hub vaak onvoldoende. Dit alles zorgt voor een groter risico op CLABSI.6
Desinfecterende afsluitdopjes werden ontwikkeld om de variatie qua technieken te omzeilen en hierdoor het aantal CLABSI te reduceren. Deze plastic afsluitdopjes bevatten een foam met desinfecterend product, meestal alcohol 70°, die werkzaam is na 1 minuut. De single-use dopjes worden op de naaldloze connector geschroefd waardoor de toegangspoort zich continu in het desinfecterend product bevindt (passieve desinfectie) en blijft ter plaatse tot de volgende inspuiting/aansluiting of tot maximum 1 week. Na verwijdering mag het dopje niet meer worden hergebruikt. Naast een betere desinfectie wordt de toegangspoort zo afgeschermd van contact of luchtcontaminatie. Er bestaan ook desinfecterende dopjes voor driewegkranen (zie fig.1).
Fig.1 (Bron: Gillis V. 2022)
Deze afsluitdopjes werden reeds in 2002 door Maki 7 naar voor geschoven als veelbelovende methode om de desinfectie van veneuze toegangen te voorzien. In een vitro studie werd aangetoond dat het gebruik van deze desinfectiedopjes, de kolonisatie van de hub vermindert met meer dan 5 Log10 KVE (Kolonievormende eenheden) en zo het risico op een CLABSI kan reduceren6. In 2019 noemde het National Institute of Health and Care Excellence (NICE) desinfecterende afsluitdopjes als een mogelijke interventie om CLABSI te verminderen. Vanwege onvoldoende bewijs werd verder onderzoek aanbevolen om hun klinisch voordeel te beoordelen. Intussen zijn er ettelijke artikels en reviews geschreven over dit onderwerp en toch is nog steeds de actieve desinfectie de aanbevolen methode in de preventiebundel katheterzorg en worden de desinfecterende afsluitdopjes nog niet algemeen gebruikt in onze ziekenhuizen.
Dit artikel heeft als doel een korte impressie te geven van de huidige inzichten in de literatuur.
Methoden
Via Medline, Google Scholar, Web of Science en Cochrane werd met volgende zoekterm ‘Disinfection cap AND central line infections’ gezocht naar recente systematic reviews (2021-2023). Twee meta-analyses 8-9 die de CLABSI-cijfers bij gebruik van desinfecterende afsluitdopjes versus «scrub the hub» vergeleken, werden weerhouden. Er werd ook gekeken naar de doeltreffendheid van de desinfecterende afsluitdopjes in relevante subgroepen (leeftijd, firma, klinische setting), veiligheid, compliance en kosten. Resultaten worden weergegeven als relatief risico (RR) met een 95% betrouwbaarheidsinterval (CI – confidence interval).
Resultaten
De meeste geïncludeerde studies zijn pre/post interventionele studies, maar recent verschenen er ook enkele gerandomiseerde gecontroleerde studies (RCT). Bij Tejada et al.8 werden veertien studies geïncludeerd waarbij twee RCT. Gillis et al 9 includeerden drie RCT’s en twaalf pre/post interventionele studies. De resultaten van het merendeel van de geïncludeerde studies zijn gelijklopend.
Er is een grote heterogeniteit omdat zowel kinderen als volwassenen op intensieve zorgen (IZ) en niet-intensieve zorgen (niet-IZ) en dagoncologie 10 werden geïncludeerd. Dit kan ook te verklaren zijn door de grote spreiding in patiëntenpopulaties waarbij centraal veneuze katheters worden gebruikt.
Ten opzichte van de controlegroep met manuele desinfectie werd er in de interventiegroep met de desinfecterende afsluitdopjes een lager risico op CLABSI gevonden (RR 0.65, 95% CI 0.55-0.76; P<0.00001)9 wat in lijn is met de resultaten van vorige meta-analyses (RR 0.43-0.60)8. Ook in de subgroepen was er een duidelijke daling in de CLABSI-incidentie op te merken, zelfs op intensieve zorg (RR 0.36 , 95% CI 0.15-0.18; P=.02) met dagelijks een groot aantal aansluitmomenten. Bij de niet-intensieve zorgenafdelingen was er een gelijkaardige reductie van 0.63 maar echter niet significant (95%CI 0.33-1.18; P=.15). Dit kan worden verklaard door het relatief lager aantal geïncludeerde studies bij niet-intensieve populaties.
Slechts enkele studies rapporteren over de veiligheid van de desinfecterende afsluitdopjes. In vitro studies 11-12 over Swabcap vonden lekkage van alcohol door het membraan. Echter is de mogelijke klinische betekenis hiervan onbekend; hiervoor is nog verder onderzoek nodig. De Curos™ (3M™) en SwabCap™ (ICU-medical) verschillen in ontwerp (o.a. de flexibiliteit van de foam) en techniek (opdraaien versus opduwen). Het risico op intoxicatie kan verminderd worden door de naaldloze connector te laten drogen aan de lucht, vóór het inspuiten van medicatie of aansluiten van intraveneuze vloeistoffen. Tussen de geïncludeerde studies bleek er geen verschil in reductie van CLABSI tussen de verschillende desinfecterende afsluitdopjes.
Het belang van de naleving (compliantie) bij het gebruik van de desinfecterende afsluitdopjes wordt duidelijk beklemtoond. Alle studies wijzen op het gebruiksgemak en tijdsbesparing t.o.v. de ‘scrub the hub’ methode. De tijdsbesparing wordt erg geapprecieerd door de zorgverstrekkers wat resulteert in een hoge compliantie. Zo vonden Merrill et al. een sterk verband tussen het gebruik van de desinfecterende afsluitdopjes en een daling van het CLABSI-percentage: een stijging van 10% in de naleving resulteerde in een daling van het CLABSI-percentage met 7% (incidentieratio 0,93)14.
Door de kleur van de desinfecterende afsluitdopjes zijn de toegangspoorten duidelijk zichtbaar en is het ook gemakkelijker om de compliantie te monitoren. Er kan een variatie in compliantie zijn, maar educatie, monitoring alsook de beschikbaarheid van strips met desinfecterende afsluitdopjes ter hoogte van de infuusstaanders kunnen de compliantie aanzienlijk verhogen. Dit hebben we zelf kunnen constateren op onze afdelingen intensieve zorg van het UZ Brussel: de ervaren tijdswinst, maar ook de onmiddellijke beschikbaarheid waren belangrijke factoren voor een snelle implementatie en blijvende compliantie.
Kosteneffectiviteit is belangrijk bij de implementatie van nieuw materiaal. De kost van één desinfecterend afsluitdopje is laag, maar verschillende aansluitingen per dag en dit bij alle patiënten met een centrale veneuze katheter, impliceert een aanzienlijke kost. Ondanks verschillen in de kosten-baten analyse tussen de verschillende studies, is er toch een duidelijke impact op de lengte van de hospitalisatie en daaruit volgende kosten.
Heterogeniteit tussen de studies en het hoge risico op bias zijn belangrijke beperkingen bij deze meta-analyses.
Conclusie
De meest recente klinische studies13 blijven het gebruik van desinfecterende afsluitdopjes met passieve maar continue desinfectie ondersteunen. Ondanks de beperkte methodologische kwaliteit van deze studies lijkt het gebruik een effectieve strategie om de CLABSI-incidentie te verminderen. Deze dopjes zijn veilig, worden goed en graag gebruikt door de zorgverstrekkers en zijn bovendien tijdbesparend. Dit is zeker van belang bij de steeds toenemende werklast in de zorg15 waardoor het aantal CLABSI toeneemt.
Ondanks het gebrek aan ondersteunend bewijs in de pediatrische context, gebruiken veel neonatale intensieve zorgeenheden (NICUs) desinfecterende dopjes zonder klinisch significante bijwerkingen te melden. Een onderzoek uitgevoerd door de SHEA Pediatric Leadership Council toonde aan dat een derde (9 van de 27) van de deelnemende NICUs desinfecterende afsluitdopjes gebruikte voor alle toegangspoorten van de intraveneuze toedieningsset bij alle NICU-patiënten 16 .
Gerandomiseerde gecontroleerde klinische studies van hoge kwaliteit en in verschillende patiëntenpopulaties met verschillende infectierisico’s blijven dus nodig om de kosteneffectiviteit definitief duidelijk te stellen en deze maatregel vast op te nemen in de preventiebundels.
Referenties
1. Maki DG, Kluger DM, Crnich CJ. The risk of bloodstream infection in adults with different intravascular devices: a systematic review of 200 published prospective studies. Mayo Clin Proc. 2006 ; 81 : 1159-1171
2. Ruesch S, Walder B, Tramèr MR. Complications of central venous catheters: internal jugular versus subclavian access–a systematic review. Crit Care Med. 2002 ; 30 : 454-460
3.Frasca D, Dahyot-Fizelier C, Mimoz O. Prevention of central venous catheter-related infection in the intensive care unit. Crit Care. 2010 ; 14: 212
4. Mireia Puig-Asensio, Alexandre R. Marra, Christopher A. Childs, Mary E. Kukla, Eli N. Perencevich, Marin L. Schweizer Effectiveness of chlorhexidine dressings to prevent catheter-related bloodstream infections. Does one size fit all? A systematic literature review and meta-analysis ICHE. 2020;, 41, 1388–1395
5. Strategies to Prevent Central Line–Associated Bloodstream Infections in Acute Care Hospitals: Update ICHE. 2014; 35 nr 8
6. Casey AL, Karpanen TJ, Nightingale P, Elliott TSJ. An in vitro comparison of standard cleaning to a continuous passive disinfection cap for the decontamination of needle-free connectors. Antimicrob Resist Infect Control. 2018; 7: 50
7. Menyhay S, Maki D. Disinfection of needleless catheter connectors and access ports with alcohol may not prevent microbial entry: the promise of a novel antiseptic-barrier cap. ICHE. 2006; 27: 23-7
8. Tejada S, Leal-Dos-Santos M, Peña-López Y, Blot S, Alp E, Rello J. Antiseptic barrier caps in central line-associated bloodstream infections: a systematic review and meta-analysis. Eur J Intern Med. 2022; 69: 34-40
9. Gillis VE, Es MJ van, Wouters Y et al. Antiseptic barrier caps to prevent central line-associated bloodstream infections: A systematic review and meta-analysis Am. J. Infect Control 2023; 7: 827-835
10. Milstone AM, Rosenberg C, Yenokyan G, Koontz DW, Miller MR. Alcohol-impregnated caps and ambulatory central-line-associated bloodstream infections (CLABSIs): A randomized clinical trial. ICHE. 2021; 42: 431-439.
11. Sauron C, Jouvet P, Pinard G, Goudreault D, Martin B, Rival B, et al. Using isopropyl alcohol impregnated disinfection caps in the neonatal intensive care unit can cause isopropyl alcohol toxicity. Acta Paediatr. 2015; 104: 489-93
12. Hjalmarsson, LB, Hagberg, J, Schollin, J, Ohlin, A. Leakage of isopropanol from port protectors used in neonatal care—results from an in vitro study. PLoS One 2020; 15
13. Marianne Person ; Jessica Biggs; Elizabeth Ross ; and Margaret Harvey, College of Nursing – The University of Tennessee Health Science Center – Memphis, TN Central Line Associated Blood Stream Infection Prevention with Use of Disinfection Caps: A Scoping Review -2022. Paper
14. Merrill KC, Sumner S, Linford L, Taylor C, Macintosh C. Impact of universal disinfectant cap implementation on central line-associated bloodstream infections. Am J Infect Control. 2014 ; 42 : 1274–1277.
15. Yuefeng Hou,, Leah P Griffin, Kari Ertmer, Stéphanie F Bernatchez, Tarja J Kärpänen, Maria Palka-Santini Effectiveness of of Disinfecting Caps for Intravenous Access Points in Reducing Central Line-Associated Bloodstream Infections, Clinical Utilization, and Cost of Care During COVID-1 ClinicoEconomics and Outcomes Research 2023; 15: 477–486
16. Martha Muller, Kristina A. Bryant, Claudia Espinosa, Jill A. Jones, Caroline Quach, Jessica R. Rindels, Dan L. Stewart, Kenneth M. Zangwill and Pablo J. Sánchez SHEA Neonatal Intensive Care Unit (NICU) White Paper Series: Practical approaches for the prevention of central-line–associated bloodstream infections, ICHE. 2023; 44: 550–564