Inleiding
Ik zal in dit artikel niet alle wetgevingen betreffende de taken van het comité voor ziekenhuishygiëne en de arts- en verpleegkundige-ziekenhuishygiënist behandelen, noch de financiering op bais van het Budget Financiële Middelen (BMF), noch de specifieke wetgeving of de structuur van het verpleegkundig departement.
Het doel van dit artikel is om mijn ervaring en belevenissen als voorzitter van de ABIHH gedurende 10 jaar met u te delen.
De Belgische Vereniging van Verpleegkundigen-Ziekenhuishygiënisten (ABIHH), opgericht in 1974 als een wetenschappelijke vereniging, wijzigde haar statuten in 2011 om een vzw te worden. De huidige leden zijn verpleegkundigen die werkzaam zijn binnen het domein van de ziekenhuishygiëne. Het doel van de vereniging is de bevordering van alle maatregelen, aanbevelingen of activiteiten die betrekking hebben op opleiding, evaluatie, toezicht en wetenschappelijk onderzoek op het gebied van de preventie van zorginfecties.
Het bestuur wordt verzekerd door een uitvoerend comité (voorzitter, vicevoorzitter, penningmeester, secretaris, adjunct-secretaris), bijgestaan door een raad van bestuur, dit alles in overeenstemming met de statuten.
In 2015 werd een nieuw bestuur aangesteld na het aflopen van de mandaten van het uitvoerend comité en de raad van bestuur die op dat moment actief waren. Omdat ik al meerdere jaren lid van de raad van bestuur was, heb ik, na rijp beraad, de functie van voorzitter aanvaard met steun van de bestuursleden. Het was voor mij een eer om dit mandaat op te nemen, ook al hield het nieuwe verantwoordelijkheden in en was alles op vrijwillige basis en onbezoldigd… Al snel stelde ik mezelf de vraag: ‘En, wat nu gedaan?’
Mijn visie op het voorzitterschap was als volgt:
Het voorzitterschap houdt in de eerste plaats in dat men een leider en een katalysator is van de collectieve dynamiek. Het moet de visie en waarden van de ABIHH belichamen, terwijl het tegelijkertijd zorgt voor goed bestuur. Mijn rol bestond erin de inspanningen van de leden te coördineren, de vereniging te vertegenwoordigen bij de partners, en te zorgen voor de verwezenlijking van de gestelde doelen, dit alles door middel van waarden en competenties die mij dierbaar zijn:
– Leiderschap en charisma om de leden te inspireren, te motiveren en te mobiliseren rond een gemeenschappelijk project.
– Luisteren naar de behoeften en ideeën van de leden, evenals het bevorderen van een klimaat van vertrouwen, dialoog en gedeelde verantwoordelijkheid.
– Organisatie en nauwgezetheid, d.w.z. in staat zijn om middelen efficiënt te beheren, activiteiten te plannen en afspraken na te komen.
– Initiatief en dynamiek: Proactief zijn om innovatieve projecten voor te stellen en de vereniging vooruit te helpen.
– Communicatievaardigheden: Zich comfortabel voelen om de vereniging te vertegenwoordigen, weten hoe te communiceren, te overtuigen en partnerschappen aan te gaan.
– Eerlijkheid en integriteit: Handelen met transparantie en ethiek, de statuten respecteren en een voorbeeld zijn voor de leden.
– Aanpassingsvermogen en veerkracht: Weten hoe om te gaan met het onverwachte en bereid zijn om de strategie en de werking indien nodig bij te stellen.
– Welwillendheid en tegelijkertijd een zekere assertiviteit handhaven.
– Doorzettingsvermogen, standhouden tegen alle verwachtingen in.
– Professionaliteit.
Samengevat is een voorzitter van een vereniging een menselijke leider, zowel verbindend als streng, die in staat is de visie van zijn vereniging uit te dragen, terwijl hij de cohesie en betrokkenheid van de leden bevordert.
Mijn strategisch plan zag dus het licht: «De ABIHH voor u, de ABIHH door u», oorspronkelijk voor de duur van het mandaat, maar dat uiteindelijk werd voortgezet tot begin 2025.
Dit plan bestond uit verschillende acties en werd als volgt voorgesteld:
Vertegenwoordiging
Het doel van het vertegenwoordigen van een vereniging is:
– Zichtbaar zijn, vooral tijdens nationale en internationale evenementen (congressen, vergaderingen en diverse werkgroepen, enz.).
– Een sterke wens tot representativiteit binnen andere nationale en internationale verenigingen.
– Het lidmaatschaps- en participatiepercentage van verpleegkundigen-ziekenhuishygiënisten verhogen.
– Een voorkeurspartner of waardevolle partner zijn, zowel intern als extern, voor alle vragen met betrekking tot ziekenhuishygiëne en de preventie en controle van zorginfecties (IPC), met een zekere invloed bijvoorbeeld op het federaal plaform en de regionale plaftormen, als expert in de Hoge Gezondheidsraad, als lid van de redactieraad van Noso info, in samenwerking met de Belgian Infection Control Society (B.I.C.S.) en de federale instanties, enz.
– Het verdedigen van de legitimiteit, geloofwaardigheid, zichtbaarheid en belangen van ons beroep van verpleegkundige-ziekenhuishygiënist, met name tijdens de bespreking van de toewijzing van de IFIC-code (Instituut voor functieclassificatie) voor zowel de verpleegkundige ziekenhuishygiënist als de hoofdverpleegkundige van de dienst infectiepreventie, dit in gezamenlijk overleg met de WIN (Werkgroep Infectiebeheersing van Netwerk Verpleegkunde) (BRAEKEVELD Pedro, VELGHE Yves, De Verpleegkundige-Ziekenhuishygiënist – een bedreigde soort?, Noso Info vol. XXIII nr. 1, 2019) en steun verkrijgen van de AUVB (Algemene Unie van Verpleegkundigen van België) als lid.
– De erkenning van ons beroep, evenals de sleutelrol in de preventie van zorginfecties, wordt vaak gebagatelliseerd door officiële instanties, zo ook onze directies, behalve tijdens de COVID-periode of bij epidemieën. Het heeft ons heel wat moeite gekost om overal aan te kloppen, zodat ons beroep eindelijk naar waarde wordt geschat… verder op te volgen. (VELGHE Yves, De Verpleegkundige Ziekenhuishygiënist in België: een bedreigde soort of een
comeback dankzij de COVID-19 pandemie?, Noso Info vol. XXV nr. 3, 2021).
Informatie
Om informatie effectief over te brengen naar de leden van de vereniging, is het belangrijk om meerdere geschikte communicatiekanalen te gebruiken (e-mail, website, vergaderingen en algemene bijeenkomsten, notulen, Teams-meetings, instant messaging-groepen, …) voor snelle uitwisseling, zowel formeee als informeel.
Het is essentieel dat de leden over duidelijke, transparante en actuele informatie beschikken om hun betrokkenheid, hun gevoel van verbondenheid en hun actieve deelname aan het verenigingsleven te bevorderen. De snelle evolutie van informatie vraagt voortdurend bijzondere aandacht om onze leden up-to-date te houden.
Tijdens mijn ambtstermijn hadden, gezien de technologische evolutie, misschien meer moderne middelen (sociale netwerken: Facebook, Twitter, LinkedIn, etc.) kunnen worden ingezet, maar ik weet dat dit punt door het nieuwe bestuur zeker zal worden opgepakt.
Opleiding
Om een essentiële rol te kunnen spelen in de preventie van infecties en de bevordering van hygiëne binnen onze instellingen, moet de verpleegkundige-ziekenhuishygiënist zijn vaardigheden op het gebied van ‘knowhow’ (technische en operationele competenties) bijwerken en ontwikkelen. Ik vond het ook belangrijk dat onze leden hun vaardigheden op het gebied van ‘soft skills’ (persoonlijke kwaliteiten en attitudes) kunnen ontwikkelen die nodig zijn om de functie van verpleegkundige-ziekenhuishygiënist goed uit te oefenen. Het combineren van geavanceerde technische vaardigheden met persoonlijke kwaliteiten op het gebied van management en leiderschap leek mij onmisbaar.
De opleidingen en uitwisselingen van praktijkervaring tussen de leden (bijv. georganiseerd tijdens plenaire casestudy-sessies) lijken essentiële elementen om de veiligheid en kwaliteit van zorg voor patiënten en zorgverleners in de context van de preventie van zorginfecties te verbeteren. Bovendien vormen deze opleidingen en uitwisselingen ook hefbomen om de infectiepreventie en -controle binnen onze zorginstellingen te versterken. Ze bevorderen een proactieve, samenwerkende benadering die afgestemd is op lokale uitdagingen, wat bijdraagt aan de continue verbetering van de kwaliteit en veiligheid van de zorg.
Hoe heeft zich dit tijdens mijn mandaat concreet vertaald voor een professionele en persoonlijke ontwikkeling?
Opleidingen tijdens plenaire vergaderingen (minimaal 3 per jaar):

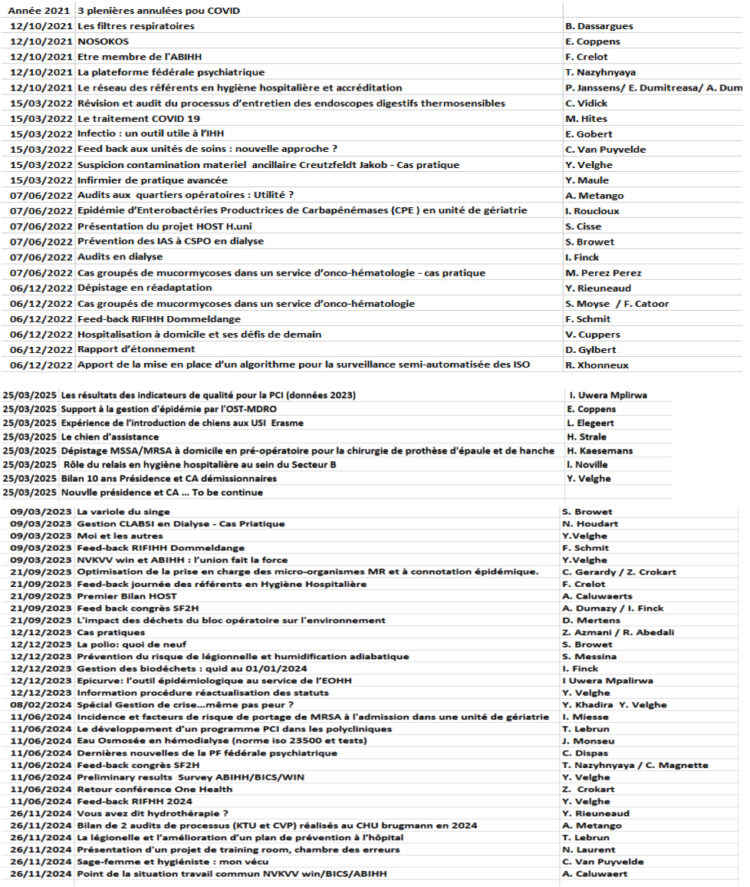
… dat zijn 133 onderwerpen die in 27 plenaire vergaderingen aan bod kwamen.
Inrichting (bij voorkeur één keer om de 2 jaar) van de dagen voor referenten infectiepreventie:
Referentiepersonen zijn onmisbaar binnen de zorgafdelingen om het infectiepreventiebeleid te ondersteunen. Hoewel hun aanwezigheid wordt meegenomen in de kwaliteitsindicatoren voor ziekenhuishygiëne, is het aanwerven en in functie houden van deze personen geen gemakkelijke taak. Hen in de schijnwerpers zetten en waarderen is soms een hele opgave. Ik zou kunnen zeggen dat het organiseren van deze dagen, naast de opleiding en het actualiseren van kennis, ook een gelegenheid biedt om hen te bedanken en om hun motivatie te behouden. (VELGHE Yves, Opleiding referentieverpleegkundigen in het UVC Brugmann: Implementatie van een aanpak of ….. van een hefboom naar verandering?, Noso Info, vol. XVIII nr.2, 2014)

Deelname als spreker(s) en/of moderator(s) aan de Internationale Franstalige Bijeenkomsten (R.I.F.)
Onze vereniging heeft altijd het merendeel van de onderwerpen voor deze bijeenkomsten voorgesteld en sinds 2016 zijn deze telkens geselecteerd. (VELGHE Yves, XXVIIIe Internationale Franstalige Bijeenkomst van Verpleegkundigen gespecialiseerd in hygiëne en infectiepreventie, Noso Info vol. XXVIII nr. 2, 2024)
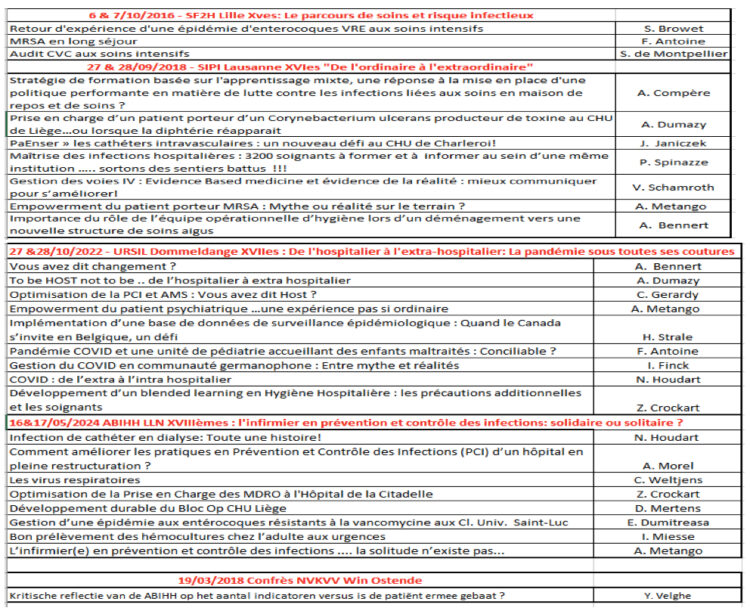
Uitnodiging
Andere zorgprofessionals (arbeidsarts, spoedverpleegkundigen, jurist, psycholoog, projectmanager, verpleegkundig kader, laboranten, Nederlandstalige collega’s, …) hebben de kans gekregen om onderwerpen voor te stellen tijdens onze plenaire vergaderingen.
Een oorspronkelijke intentie was ook om bepaalde andere beroepen, die evenzeer betrokken zijn maar minder in de schijnwerpers staan binnen het kader van de preventie van zorginfecties (paramedici, kinesisten, logistiek verantwoordelijken …), aan het woord te laten, evenals andere verpleegkundige verenigingen (AFIU, ASTER, AFISO, …) en andere eerstelijnszorgverleners (WZC, thuiszorg, …), maar helaas kon dit niet worden gerealiseerd.
De oprichting van de HOST-projecten hield in dat hun vertegenwoordigers hun activiteiten ook aan alle leden konden voorstellen tijdens de plenaire vergaderingen, wat soms leidde tot debatten.
Daarnaast is er een grote stap gezet richting de wereld van het verpleegkundig onderwijs door in onze statuten op te nemen dat een verpleegkundige-ziekenhuishygiënist uit het onderwijsveld lid van de raad van bestuur kan worden.
Deelname
Het lidmaatschap binnen onze beroepsvereniging houdt in dat men actief deelneemt aan de activiteiten van de ABIHH om de doelstellingen te ondersteunen en bij te dragen aan de ontwikkeling ervan (herinner u onze leuze ‘De ABIIHH voor u, de ABIHH door u’).
Een deel van deze deelname is al behandeld onder het onderdeel ‘Opleiding’, maar dit omvat ook deelname aan vergaderingen en bijeenkomsten (bijwonen van ontmoetingen om projecten, het beleid en de koers van de vereniging te bespreken), waarbij dient opgemerkt te worden dat de gemiddelde deelname aan plenaire vergaderingen slechts 50% bedraagt …. De redenen voor de afwezigheden zijn divers, maar vooral gerelateerd aan een (te) drukke werkagenda, andere dringende prioriteiten, soms een weigering door de verpleegkundige directie (slechts één vrijgestelde verpleegkundige-ziekenhuishygiënist per plenaire vergadering en instelling), privéomstandigheden, ….
Betrokkenheid
De voorzitter is niet de enige die zich betrokken voelt. Ook van de leden wordt verwacht dat zij – naast de betrokkenheid als spreker en/of moderator – onderstaande taken opnemen:
– bijdragen aan activiteiten en projecten (deelname aan de organisatie of uitvoering van evenementen, trainingen, conferenties of andere initiatieven).
– het jaarlijks lidgeld op tijd betalen. Dit lijkt misschien onbeduidend, maar het betekent extra werk voor onze penningmeester, die regelmatig herinneringen moet sturen. Daarom werd besloten dat, wanneer het lidgeld niet
betaald is, de toegang tot de website en de uitnodigingen voor plenaire vergaderingen en andere activiteiten stopgezet worden … de verantwoordelijkheid van ieder individu.
– zich vrijwillig inzetten voor het bestuur (cfr. onze statuten), wat niet altijd gemakkelijk is geweest, vooral in 2019 bij de samenstelling van het Uitvoerend Comité (UC) en de Raad van Bestuur (RB).
– zoeken naar sponsors.
– delen van documenten/fiches/procedures.
– beantwoorden van veelgestelde vragen tussen leden.
– het ter beschikking stellen van lokalen (bij voorkeur gratis) aan de ABIHH voor plenaire vergaderingen. Voorheen werden we gratis ontvangen in de lokalen van een farmaceutisch bedrijf. Deze verandering heeft een
aanzienlijke impact gehad op de kosten van de vereniging.
– deelnemen aan bevragingen/audits voorgesteld door de ABIHH.
– artikels schrijven en publiceren, onder andere in Noso info.
Deze betrokkenheid verschilt van persoon tot persoon, van generatie tot generatie. De balans tussen werk en privé is niet vanzelfsprekend, net zoals het zich belangeloos inzetten voor een vereniging niet aan iedereen gegeven is.
Op basis van onderstaande tabel zal onze vereniging een heel andere samenstelling kennen bij het vertrek van de ‘babyboomers’, waarvan ik er één ben. Een echte herbezinning van ieder individu over zijn of haar betrokkenheid zal cruciaal zijn voor het overleven van onze vereniging.

Toch kunnen deze intergenerationele relaties binnen onze vereniging worden beschouwd als een troef om de kennisoverdracht, het delen en het waarderen van ervaringen te bevorderen. De meer ervaren leden brengen hun levenservaring, expertise en wijsheid in, terwijl de jongere leden openheid van geest, digitale vaardigheden en hernieuwde energie kunnen bieden. Wederzijds leren en elkaar verrijken, zowel bij activiteiten, projecten als in het beheer van de vereniging, is van essentieel belang. Door een goede intergenerationele integratie en een inclusieve, dynamische omgeving vol uitwisseling te stimuleren (zie Innovatie), lijkt de toekomst van ABIHH verzekerd.
Samenwerking
Dit is een meer dan belangrijk element op strategisch niveau. Zoals het gezegde luidt: „Alleen ga je sneller, samen ga je verder.”
Mijn bedoeling was om onze samenwerking uit te breiden op nationaal niveau (scholen voor verpleegkunde, WIN Netwerk Verpleegkunde (het voormalige NVKVV), Belgian Infection Control Society, FOD, federale en regionale platformen voor ziekenhuishygiëne, …) en internationaal niveau (Luxemburg – Union des Responsables des Soins Infirmiers du Luxembourg / Zwitserland – Spécialistes Infirmiers Prévention de l’Infection / Frankrijk – SF2H, Société Française d’Hygiène Hospitalière / Canada – Association des Infirmières en Prévention des Infections ).
Scholen voor verpleegkunde
De samenwerking tussen onze beroepsvereniging en de scholen voor verpleegkunde is uitermate nuttig om de theoretische en praktische opleidingen op het gebied van preventie van zorginfecties te versterken (bijvoorbeeld: betrokkenheid bij de dagen gewijd aan infectiepreventie en -controle aan HELMo (Haute Ecole Libre Mosane) om toekomstige verpleegkundigen voor te bereiden op een veiligheidscultuur.
Dankzij onze veldervaring en de actualisering van onze expertise hebben onze plenaire vergaderingen bijgedragen aan de verrijking van de inhoud van de onderwijsprogramma’s van de docenten in infectiepreventie.
Een volgende stap zou zijn geweest om samen met de docenten interactieve hulpmiddelen, handleidingen of modules te ontwikkelen om toekomstige verpleegkundigen bewust te maken van de uitdagingen van infectiepreventie.
Daarnaast helpen docenten, met hun specifieke vragen en opmerkingen met betrekking tot de praktische opvolging van studenten op het terrein, de verpleegkundige-ziekenhuishygiënist om realistisch blijven.
In samenwerking met twee van hen, zal onze praktijkgerichte reflectie u meer informatie verschaffen. Zie hiervoor het artikel gepubliceerd in dit nummer van Noso Info (VERSCHUEREN Sophie, ZANINI Fabrice, VELGHE Yves, Infectiepreventie zoals gezien door studenten verpleegkunde en infectiepreventie in de praktijk: Verschillen en gelijkenissen tussen theoretisch onderwijs en de praktijk).
WIN Netwerk Verpleegkunde (voormalig NVKVV)
Hoewel we internationale samenwerkingen op Franstalig niveau ontwikkeld hebben, wilde ik ook een nationale samenwerking met onze Nederlandstalige collega’s opzetten. Omdat ik tweetalig ben, werden al snel contacten gelegd, niet alleen tussen onze verenigingen, maar ook op persoonlijk vlak.
Als lid van de NVKVV WIN werd ik uitgenodigd als spreker tijdens hun jaarlijkse congres (https://www.netwerkverpleegkundemagazine.be/nieuwseditie-mei-2017/) en kon ik profiteren van hun praktijkervaringen in de Vlaanderen. Het feit dat onze praktijken in infectiepreventie identiek zijn, is geruststellend. Dit geldt echter niet voor de opleiding tot verpleegkundige-ziekenhuishygiënist, zodat sommige van hun verpleegkundigen-ziekenhuishygiënisten zich inschreven voor onze interuniversitaire certificering in infectiepreventie en ziekenhuishygiëne. Dit roept dan ook de vraag op van een gemeenschappelijke certificering… of wie weet, één enkele nationale certificering in de toekomst? Deze samenwerking heeft recent geleid tot onze wens om in 2026 een gezamenlijke studiedag te organiseren met de BICS.
Een gezamenlijk dossier was de herziening van onze functiebeschrijving, dat gezamenlijk verdedigd werd tijdens de IFIC-discussies (SNOEIJ Thomas, VELGHE Yves, Het IFIC en de sectorale functieomschrijving 6162 – verpleegkundige-ziekenhuishygiënist: wat is nieuw?, Noso Info vol. XXV, nr. 4, 2021)
Algemene Unie van Verpleegkundigen van België
De ABIHH woont de vergaderingen en besprekingen bij die verband houden met het verpleegkundig beroep. Dit lidmaatschap bij de AUVB heeft onder andere mogelijk gemaakt om zich als ABIHH te positioneren door samen met andere beroepsverenigingen van verpleegkundigen in beroep te gaan tegen het koninklijk besluit van 20 september 2023 waarin de lijst van verpleegkundige technische verstrekkingen met betrekking tot de basisverpleegkundige, evenals de uitoefeningsvoorwaarden daarvan, werd vastgesteld; en – het beroep tegen het koninklijk besluit van 14 april 2024 dat het koninklijk besluit van 20 september 2023 wijzigde betreffende de lijst van verpleegkundige technische verstrekkingen met betrekking tot de basisverpleegkundige, evenals de uitoefeningsvoorwaarden daarvan.
Federaal plaform en regionale platformen ziekenhuishygiëne
Verschillende van onze leden nemen daaraan actief deel. Mijn wens zou zijn dat ABIHH, via haar voorzitter, volwaardig lid kan zijn van het Federaal platform en niet slechts als genodigde. De reflectie hierover moet nog worden verdergezet.
In samenwerking met Dr. Leen Popleu, heb ik de gelegenheid gehad om de oprichting van het tiende regionale platform ziekenhuishygiëne, specifiek voor een psychiatrische setting, te initiëren.
Hoge GezondheidsRaad
In veel werkgroepen met betrekking tot de herziening van aanbevelingen zijn verpleegkundigen-ziekenhuishygiënisten van de ABIHH actief. Dankzij hun dagelijkse praktijk, houden deze updates van aanbevelingen rekening met de realiteit op het terrein.
Sciensano: kwaliteitsindicatoren ziekenhuishygiëne
2025 is een jaar van herbezinning over de kwaliteitsindicatoren, zowel qua inhoud als vorm. De aanwezigheid van verpleegkundigen-ziekenhuishygiënisten bij deze reflecties maakt het mogelijk om te anticiperen op toekomstige veranderingen en om tegelijkertijd actief mee vorm te geven aan die veranderingen.
FOD (https://overlegorganen.gezondheid.belgie.be/nl/materiaal-voor-ipc)
Betrokkenheid bij de evaluatie van de IPC-programma’s in België (CALUWAERTS An, BOGAERT MICLAUS Camelia, LAURENT Christine, SNOEIJ Thomas, VELGHE Yves, Survey Report: Evaluation of the Belgian IPC Programme, oktober 2024. https://overlegorganen.gezondheid.belgie.be/sites/default/files/content/evaluation_ipc.pdf
De evaluatie en actualisering van de situatie op het terrein was meer dan noodzakelijk om onze praktijken en de middelen die worden toegewezen en zullen worden toegewezen aan de kwaliteit en veiligheid van de patiëntenzorg kritisch te herzien.
Op internationaal niveau
De actualisering van onze samenwerkingsovereenkomst (ABIHH/SF2H/SIPI/URSIL/AIPI), de organisatie van internationale Franstalige bijeenkomsten (RIF) en onze uitwisseling van praktijken benadrukken de diversiteit van de functie van verpleegkundige-ziekenhuishygiënist binnen deze verschillende verenigingen.
België was het gastland van deze bijeenkomsten in 2024. Ik had altijd gezegd dat ik het voorzitterschap zou beëindigen, zodra dit evenement afgerond en succesvol was. Een bron van trots voor mij, maar ook voor de Raad van Bestuur en het Uitvoerend Comité. Nogmaals dank aan hen voor hun inzet en professionalisme.
Een mogelijke volgende overweging zou kunnen zijn om nieuwe collega’s uit Noord-Afrika, Centraal-Afrika, Roemenië, … te betrekken.
Ik zal dit hoofdstuk « Samenwerking » afsluiten door te benadrukken dat het noodzakelijk is om een proactieve, duidelijke, gestructureerde en respectvolle benadering te hanteren ten aanzien van regelgeving en culturele aspecten, allemaal factoren die essentieel zijn om effectieve samenwerkingen op nationaal en internationaal niveau te doen slagen.
De relatie en samenwerking tussen onze vereniging en bedrijven gespecialiseerd in infectiepreventie en -controle.
Mogelijk een meer gevoelig punt: het is niet altijd eenvoudig, gezien de Mdeon-regelgeving (administratieve last) en de openbare aanbestedingen (de samenwerking moet op een transparante manier worden beheerd om elk belangenconflict te vermijden). Niettemin is deze samenwerking essentieel om up-to-date te blijven, geïnformeerd te worden over nieuwigheden, afstand te kunnen nemen ten opzichte van de verschillende aangeboden producten, onvervulde behoeften te identificeren, onderzoek te ondersteunen en de ontwikkeling van innovatieve producten te vergemakkelijken. Maar, laten we het niet verbloemen, ook om onze verschillende activiteiten financieel te ondersteunen. Het zoeken van sponsoring is onder andere een taak die aan de voorzitter is toevertrouwd.
Innovatie
Al snel heb ik voorgesteld om bepaalde vakgebieden die wij niet beheersen uit te besteden aan andere professionals (bv. accountant voor de goedkeuring van de rekeningen en de belastingaangifte, advocatenkantoor voor de actualisering en indiening van de statuten, webbeheerder voor onze website, evenementenbureau voor de RIF, …).
Het creëren van een nieuw logo voor de ABIHH stelde alle leden in staat om mee te kiezen en zich ermee te identificeren. De 6 pijlers voor IPC (infectieuze agentia, reservoir, uitgangspoort, overdrachtswijze, ingangspoort, ontvankelijke gastheer) zijn hierin terug te vinden. Het idee van beweging naar boven brengt dynamiek en belichaamt de evolutie van ons beroep. De verwijzing naar een vlam komt overeen met onze motivatie en gedrevenheid.
Voor

Na

De rol van de voorzitter van een vereniging is essentieel om jonge verpleegkundigen-ziekenhuishygiënisten te motiveren en een stimulerende, geruststellende en hoopvolle omgeving te creëren, maar ook om de ‘ervaren’ leden uit hun comfortzone te halen, niet door hun praktijken met betrekking tot infectiepreventie in vraag te stellen, maar door hen bewust te maken van de vaardigheden die verband houden met management en leiderschap. Het één kan niet zonder het ander als men een IPC-beleid binnen de eigen instelling wil implementeren. Dit werd geconcretiseerd tijdens plenaire vergaderingen door:
– het opzetten van uitwisseling van ervaringen en lessen getrokken uit vroegere ervaringen, positief of negatief (‘lessons learned’)
– het organiseren van workshops over een probleemstelling
– het geven van spreektijd aan nieuwe leden in de vorm van een uitdaging, namelijk een onderwerp voorstellen tijdens plenaire sessies in hun eerste jaar lidmaatschap, een aanpak waar iedereen baat bij heeft.
Hoewel alle leden elkaar helpen via dit ondersteuningsnetwerk, is meer aandacht voor de begeleiding van nieuwkomers in de functie nuttig. De voorzitter moet een empathische, motiverende en faciliterende leider zijn, die een positieve sfeer creëert waarin jonge verpleegkundige-ziekenhuishygiënist zich gesteund, gewaardeerd en geïnspireerd voelen om hun professionele toekomst met vertrouwen op te bouwen. Dit punt zal door de nieuwe raad van bestuur verder worden opgevolgd in het kader van de invoering van een mentorprogramma (meterschap/peterschap).
Op het niveau van de RIF die in 2024 in Louvain-la-Neuve werd georganiseerd, hebben we ervoor gekozen Justine Henin uit te nodigen voor de opening van de bijeenkomsten. Onze gedachte was een parallel te trekken tussen het parcours van een kampioen en dat van een verpleegkundige-ziekenhuishygiënist (een persoon die veelal alleen in het (werk)veld, maar die een team nodig heeft om vooruit te komen).
Organisatie van specifieke activiteiten: bezoeken aan farmaceutische bedrijven, plenaire sessie in het Afrikamuseum, voortzetting van een plenaire sessie door het bezoek aan de kerstmarkt in Brussel.
Gebruik van digitale technologieën: In 10 jaar tijd heeft hun evolutie een belangrijke sprong gemaakt die we helaas niet genoeg hebben benut (andere prioriteiten, gebrek aan expertise, …). De uitrol van online platformen voor permanente opleiding, het delen van goede praktijken en communicatie tussen leden, de implementatie van mobiele applicaties, het gebruik van kunstmatige intelligentie … zijn verschillende aspecten waarmee in de toekomst rekening gehouden moet worden. Een positief aspect van de COVID-crisis was echter het gebruik van videoconferenties, wat tijdswinst en een grotere deelname mogelijk maakte.
Toekomst van ons beroep …. mijn visie
Ik heb hierboven al verschillende punten behandeld, maar ik wil toch ook nog de aandacht vestigen op andere elementen die ik belangrijk acht om te weten:
– De relatie en samenwerking tussen de verpleegkundige ziekenhuishygiënist en de arts-ziekenhuishygiënist. Hun complementariteit, hun regelmatige communicatie en uitwisseling, hun werk binnen een multidisciplinair team, hun wederzijds respect voor elkaars competenties, hun synergieën met andere actoren in de gezondheidssector (directie, technici, managers, …), … zijn allemaal elementen die bijdragen aan de consistentie bij de uitvoering van maatregelen om gemeenschappelijke doelstellingen op het gebied van infectiepreventie en -bestrijding te bereiken.
– De relatie tussen de verpleegkundige-ziekenhuishygiënist en de verpleegkundige directie. In de huidige context wordt de verpleegkundige directie uitgenodigd om de specifieke expertise van de verpleegkundige-ziekenhuishygiënist te erkennen, een werkomgeving te bevorderen waar de communicatie vlot verloopt en initiatieven te ondersteunen die gericht zijn op het verbeteren van de veiligheid van
patiënten en personeel. Een constructieve relatie berust op een duidelijk begrip van ieders verantwoordelijkheden, regelmatige uitwisselingen van informatie en een gezamenlijke bereidheid om doelstellingen op het gebied van volksgezondheid en kwaliteit/veiligheid van de zorg te bereiken.
– De relatie met de kwaliteitscel lijkt op middellange termijn onmisbaar, gezien onze gemeenschappelijke doelstellingen (zorg van hoge kwaliteit en in alle veiligheid) (CIVET Nathalie, VELGHE Yves, Wanneer het Team voor ziekenhuishygiëne en de Cel Kwaliteit in het UVC Brugmann (Brussel) de handen in elkaar slaan ten gunste van de patiënt, Noso Info vol. XXIX N°1, 2025)
Samengevat: de verpleegkundige-ziekenhuishygiënist 2.0 zal een gezondheidsprofessional zijn die gespecialiseerd is in het voorkomen van infecties en het bevorderen van ziekenhuishygiëne. Hij/zij zal volledig gebruikmaken van digitale hulpmiddelen en technologische innovaties om zijn/haar praktijken te optimaliseren. Het zal een innovatieve, verbonden en proactieve professional zijn die technologie integreert om infectiepreventie te versterken en de kwaliteit van de zorg te verbeteren. … en ik hoop ook een professional die door iedereen naar waarde wordt geschat (niet alleen in tijden van crisis), zowel wat betreft zijn/haar functie, positie binnen het verpleegkundig departement, evenals zijn/haar verloning (IFIC-classificatie). Ik hoop dat de ABIHH het pad verderzet dat al begonnen is en dat waarschijnlijk nog een lange weg te gaan heeft.
Conclusie
Na tien jaar als voorzitter van de vereniging was het voor mij tijd om de fakkel door te geven aan een nieuw, dynamisch en betrokken team.
Toen ik het voorzitterschap opnam, was ik me bewust van de verantwoordelijkheden en het vrijwilligerswerk dat bij deze functie hoort, maar eerlijk gezegd had ik de omvang onderschat, vooral als je het goed wil doen en je 100% wil inzetten zonder te letten op de werkuren. Maar was mijn opdracht in wezen niet om ervoor te zorgen dat de vereniging zou (over)leven, zelfs als dat meer organisatorische inspanning vergt?
Dit mandaat was een intense ervaring, gekenmerkt door zowel het overwinnen van obstakels als het vieren van successen. De rol als voorzitter vergde een aanzienlijke inzet van mij, maar bood ook momenten van grote voldoening en verrijkende ontmoetingen. Het hoofd bieden aan de EBOLA- en COVID-crises, was één van de grootste uitdagingen. Deze momenten waren niet altijd gemakkelijk, maar dankzij de inzet van de leden, de hulp van de Raad van Bestuur en het Uitvoerend Comité, en een strikte aansturing van de operationele teams voor ziekenhuishygiëne, konden we ons aanpassen en onszelf in vraag stellen, soms ten koste van goede praktijken… een paradox! Deze ervaringen hebben onze veerkracht en ons vermogen om in tegenspoed samen te werken versterkt.
Wat onze successen betreft, ben ik trots te kunnen zeggen dat we veel projecten gerealiseerd hebben (RIF, dag van de referenten, IFIC-dossier, nationale en internationale samenwerkingen, lidmaatschap van veel nieuwe leden, betrokkenheid op verschillende niveaus, …). Deze projecten hebben de vereniging geholpen meer zichtbaarheid en impact te verkrijgen, zich zowel structureel als in haar missie te ontwikkelen, waardoor de weg geëffend werd zodat het nieuwe team (raad van bestuur en uitvoerend comité) dit werk kan voortzetten en uitbreiden. Ik hoop een solide basis voor de toekomst te hebben gelegd.
Ik wil mijn diepe dank betuigen aan het uitvoerend comité en de raad van bestuur voor hun inzet, hun onvoorwaardelijke steun en het vertrouwen. Zij hebben deze ervaringen mogelijk gemaakt tijdens mijn voorzitterschap.
Ik wil ook alle leden van harte bedanken voor hun motivatie en bereidheid om hun professioneel en persoonlijk ontwikkelingsplan voort te zetten.
En last but not least, dank aan mijn directie van het UMC Brugmann voor hun steun en voor het mogelijk maken dat ik dit mandaat als voorzitter van de ABIHH gedurende 10 jaar kon vervullen.
Deze ervaring zal een gedenkwaardige fase in mijn leven blijven, rijk aan lessen en ontmoetingen. Als lid van de vereniging zal ik met belangstelling de toekomstige projecten blijven volgen en de vereniging ondersteunen.
Slotwoord: Misschien zal ik op mijn grafsteen zetten: « Hier rust een toegewijde verpleegkundige-ziekenhuishygiënist, onvermoeibare verdediger van de preventie van zorginfecties. Zijn inzet als voorzitter van de ABIHH heeft anderen gemotiveerd en waarschijnlijk bijgedragen aan het redden van patiëntenlevens. Moge zijn nagedachtenis de nieuwe generaties hygiënisten inspireren. P.S. Vergeet niet uw handen te wassen nadat u uw bloemen hebt neergelegd » 😉
Dank aan iedereen voor deze gedeelde tien jaren… en aarzel niet om de ABIHH te blijven steunen.