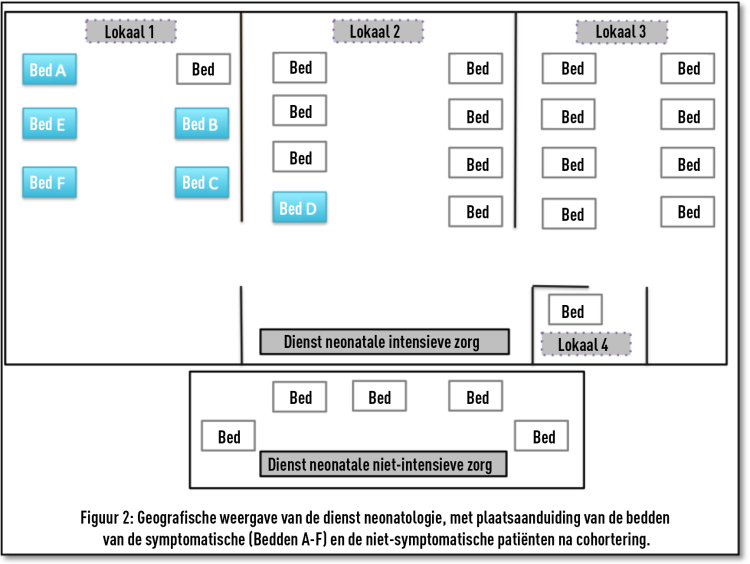
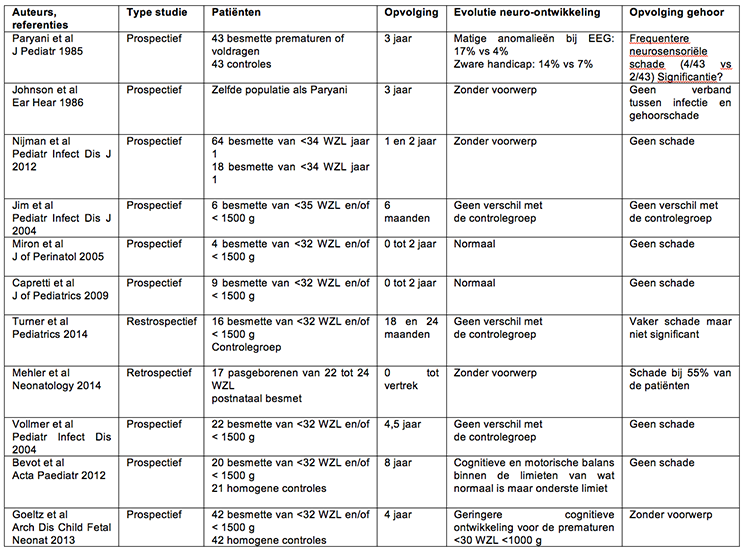
Janota J., Sebkova S., Visnovska M., Kudlackova J., Hamplova D., Zach J.
Hand hygiene with alcohol hand rub and gloves reduces the incidence of late onset sepsis in preterm neonates.
Acta Paediatrica 2014 June 27
Deze studie evalueert de impact op de incidentie van laattijdige sepsis (LOS) van een handhygiëneprotocolbestaande uit een het wassen van de handen, het gebruik van een hydroalcoholische oplossing en het dragen van handschoenen bij de zorgverlening aan prematuren geboren na 31 weken zwangerschap. Alle baby’s geboren tussen 32 weken +0 en 36 weken +6 zwangerschapsleeftijd die op de dienst neonatale intensieve zorg verbleven werden geïncludeerd. Gedurende de 7 eerste maanden werd een handhygiëneprotocol gevolgd bestaande uit het wassen van de handen en het gebruik van een hydroalcoholische oplossing (“hydroalcoholische periode”). Tijdens de volgende 7 maanden bestond het protocol uit het wassen van de handen, het gebruik van een hydroalcoholische oplossing en het dragen van handschoenen (“handschoenperiode”). Respectievelijk 111 en 89 patiënten maakten deel uit van de groepen “hydroalcoholische oplossing” en “handschoenen”. Uit de resultaten is gebleken dat 5 patiënten gediagnosticeerd werden met een totaal van 6 episodes van LOS in de groep hydroalcoholische oplossing en de LOS-incidentie tijdens deze periode bedroeg 2,99/1000 hospitalisatiedagen en 54,1/1000 opnames. Tijdens de handschoenperiode werd geen enkele LOS-patiënt gediagnosticeerd (significante daling P= 0,028).
De toepassing van een handhygiëneprotocol bestaande uit een het wassen van de handen, het gebruik van een hydroalcoholische oplossing en het dragen van handschoenen beperkt aanzienlijk de LOS-incidentie bij prematuren en de resultaten doen vermoeden dat dit tot een duurzame verbetering van het aantal infecties kan leiden.
Durand S., Batista Novais A.R., Mesnage R., Combes C., Didelot M.N., Lotthé A., Filleron A., Baleine J., Cambonie G.
Validation of nosocomial infection in neonatology: A new method for standardized surveillance.
American Journal of Infection Control 2014 June
Ziekenhuisinfecties (Nis) zijn de belangrijkste oorzaak van mortaliteit en morbiditeit bij prematuren. We stellen een nieuwe methode voor om Nis in de eenheden neonatale intensieve zorg te detecteren en te confirmeren. Gedurende twee jaar werden de pasgeborenen op een eenheid neonatale intensieve zorg van een universitair ziekenhuis met een geboortegewicht < 1500 gr of met een zwangerschapsleeftijd (ZL) < 33 weken prospectief geïncludeerd. Het elektronische systeem voor het voorschrijven van geneesmiddelen (CPOE) genereert een waarschuwing wanneer antibiotica minstens 5 dagen na elkaar worden voorgeschreven en deze gevallen werden door een expertengroep getoetst aan de internationale aanbevelingen.
461 pasgeborenen werden geïncludeerd met een gemiddelde ZL van 30 weken (26- 32 weken) en een gemiddeld gewicht van 1270 gr (950-1600). Het CPOE-systeem heeft 158 gevallen gemeld van potentiële Nis; 85,1 % werd geklassificeerd als een echte Nis en 14,9 % werd als vals positief beschouwd. De incidentie en de kathetergeassocieerde nosocomiale septicemieën bedreogen respectievelijk 21,9 % en 10,8 per 1000 centrale katheterdagen. ZL≤ 28 weken (Odds ratio: 2,18: 95% betrouwbaarheidsinterval 1,2-4) en meer dan 7 centraal veneuze katheterdagen ( Odds ratio: 1,47; 95% betrouwbaarheidsinterval,1,3-1,7) zijn onafhankelijke variabelen die geassocieerd worden met het risico op een nosocomiale septicemie.
We leiden daaruit af dat de combinatie van het CPOE-systeem en een multidisciplinaire toetsing de nauwkeurigheid van de Nis-registratie in een neonatale intensieve zorgeenheid kunnen verbeteren.
Helder O.K., Brug J., van Goudoever J.B., Looman C.WS., Reiss I.K., Kornelisse R.F.
Sequential hand hygiene promotion contributes to a reduced nosocomial bloodstream infection rate among very low-birth weight infants: An interrupted time series over a 10-year period.
Een blijvende goede naleving van de voorschriften m.b.t. handhygiëne (HH) is nodig om het aantal nosocomiale septicemieën (NBSIs) te verminderen. Na verloop van tijd daalt de naleving echter meestal. We hebben de gevolgen op lange termijn bestudeerd van opeenvolgende interventies voor de promotie van HH. Eenobservationele studie met onderbroken tijdsreeksen werd uitgevoerd bij kinderen met een zeer laag geboortegewicht (VLBW). De interventies bestonden uit een opleidingsprogramma, boodschappen die via de screensaver werden verspreid en de organisatie van een week rond infectiepreventie met een initiatie over efficiënt handschoengebruik.
Tussen 1 januari 2002 en 31 december 2011 werden een totaal van 1964 kinderen met een VLBW bestudeerd. Het aantal kinderen met minstens 1 NBSI daalde van 47,6 % tot 21,2 % (P<0,01) en het aantal NBSIs per 1000 patiëntdagen daalde van 16,8 naar 8,9 (P<0,01). Vóór de interventie was het aantal NBSIs per 1000 patiëntdagen sterk toegenomen met 0,74 per kwartiel (95% betrouwbaarheidsinterval [CI] 0,27-1,22). Na de eerste interventie volgde een significante daling van NBSIs van -1,27 per kwartiel (95% CI van -2,04 tot -0,49). Na de volgende interventies was de tendens neutraal. Het aandeel van coagulase-negatieve stafylokokken en Staphylococcus aureus als ziekteverwekker daalde significant over de tijd. We leiden daaruit af dat het opeenvolgendepromoties van HH tot een blijvende daling van het aantal NBSI’s kan leiden.
Padula M.A., Dewan M.L., Shah S.S., Padula A.M., Srinivasan L., McGowan A.L., Mahoney K.R., Harris M.C.
Risk Factors Associated with Lab-confirmed Bloodstream Infections in a Tertiary Neonatal Intensive Care Unit.
Septicemieën (BSI) blijven de belangrijkste oorzaak van mortaliteit en morbiditeit bij kinderen die worden opgenomen op eenheden voor intensieve neonatale zorgen (NICUs). Op het ogenblik van de evaluatie van en vermoeden van BSI, zijn de tekens soms aspecifiek. We hebben een poging gedaan om de klinische tekens en risicofactoren te bepalen die geassocieerd zijn met een labo-geconfirmeerde bloedbaaninfectie bij kinderen met een laattijdige septicemie in een NICU van een universitair ziekenhuis. Deze prospectieve cohortstudie includeerde kinderen die ouder zijn dan drie dagen en die in een NICU niveau 4 werden opgenomen van juli 2006 tot oktober 2009, en voor wie een bloedkweek was afgenomen wegens vermoeden vansepticemie . Clinici hebben de aanwezige klinische tekens op het ogenblik van de kweek gedocumenteerd. Labo-geconfirmeerde BSI werd gedefinieerd volgens de criteria van het National Healthcare Safety Network. Multivariate analyses werden uitgevoerd op basis van een logistisch regressiemodel met random effects680 episodes van vermoeden van BSI bij 409 kinderen werden geïncludeerd . Enterael contrasstoft gedurende de 48 voorafgaande uren is de belangrijkste risicofactor voor een labogeconfirmeerde BSI (Odds ratio: 9,58 [95% betrouwbaarheidsinterval: 2,03 – 45,19]), gevolgd door de aanwezigheid van een centraal veneuze katheter. Apneu en hypotensie zijn de daarmee sterkst geassocieerde aanwezige tekens.
We leiden daaruit af dat een recente blootstelling aan enterale contraststof geassocieerd wordt met een verhoogde Odds ratio voor de ontwikkeling van een BSI bij kinderen die in een NICU van een universitair ziekenhuis. Apneu en hypotensie zijn de sterkst geassocieerde klinische infectietekens.
Hooven T.A., Polin R.A.
Healthcare-associated infections in the hospitalized neonate: a review.
Early Hum Dev 2014 March; 90 Suppl 1: S4-6
Zorggeassocieerde infecties in de eenheden neonatale intensieve zorg verlengen de hospitalisatieduur en de kosten aanzienlijk en zorgen voor tal van andere nadelige gevolgen, waaronder sterfte. De relatief hoge prevalentie van zorggerelateerde infecties bij pasgeborenen is secundair aan de immaturiteit van het immuunsysteem van de pasgeborene, de nood aan frequente invasieve procedures en een over het algemeen langere verblijfsduur. Centrale kathetergerelateerde septicemieën (CLABSI) zijn de meest voorkomende vorm van zorggerelateerde infectie met de coagulasenegatieve Staphylococcus species (CONS) als vaakst aangetroffen micro-organisme. De interpretatie van de kweekresultaten bij het vermoeden van een zorggerelateerde infectie kan bemoeilijkt worden door de mogelijkheid dat het opgespoorde micro-organisme een commensale contaminant is dan wel een eigenlijke bron van infectie. Dit is zeker het geval bij een positieve CONS bloedkweek tijdens de evaluatie van een vermoeden van CLABSI. Dit artikel geeft een overzicht van de epidemiologie, de diagnose, de preventie en de behandeling van zorggerelateerde infecties in de eenheden neonatale intensieve zorg.
Klinger G., Carmeli I., Feigin E., Steinberg R., Levy I.
Compliance with Surgical Antibiotic Prophylaxis Guidelines in Pediatric Surgery.
Eur J Pediatr Surg 2014 March 28
De richtlijnen m.b.t. heelkundige antibioticaprofylaxe (AP) wegen de nood aan het vermijden van infecties af tegen de risico’s op bijwerkingen van de geneesmiddelen. Wij willen evalueren in welke mate gevolg wordt gegeven aan de aanbevelingen inzake AP.
Een retrospectieve studie werd uitgevoerd in een pediatrisch medisch centrum. Daarbij werden patiënten geïncludeerd tussen 0 en 18 jaardie gedurende de periode van 1 jaar (2008-2009) een zuiver-gecontamineerde heelkundig ingreep onderingenwaarvoor AP vereist is. De naleving van een bundel van 4 aanbevelingen werd geëvalueerd . Risicofactoren van het niet-naleven werden geïdentificeerd aan de hand van uni- en multivariate analyses. Uit de resultaten blijkt dat AP toegediend werd aan 239 van de 247 patiënten (96,8 %). Bij 16 van de 247 patiënten (6,5 %) werd volledig gevolg gegeven aan de aanbevelingen voor AP. De naleving van de voorschriften met betrekking tot het juiste antibioticum, dosis, tijdstip en duur van de behandeling bedroeg respectievelijk 97,1%, 52,2%, 31,9% en 35,9%. Uit een multivariate analyse is gebleken dat een foutief tijdstip geassocieerd is met een leeftijd die hoger of gelijk is aan 4 jaar (P=0,002), dringende heelkunde (P= 0,0018), het toedienen van de AP door het chirurgisch departement (P=0,0001) en heelkunde tijdens de nacht (P=0,015). Een foute dosis AP wordt geassocieerd met de aanwezigheid van comorbiditeiten (P=0,006). Geen enkele risicofactor wordt in verband gebracht met een foute duur van de AP.
We hebben vastgesteld dat slechts in een gering aantal gevallen volledig gevolg werd gegeven aan de aanbevelingen voor AP. AP zou enkel in het operatiekwartier mogen toegediend worden . Er is nood aan een grotere bewustwording over de aanbevelingen inzake AP.
Tsai M.H., Chu S.M., Hsu J.F., Lien R., Huang H.R., Chiang M.C., Fu R.H., Lee C.W., Huang Y.C.
Risk factors and outcomes for multidrug-resistant Gram-negative bacteremia in the NICU.
Pediatrics 2014 February 133(2):e322-9
Deze studie evalueert de risicofactoren van een antibioticatherapie en de gevolgen van bacteriëmieën met multiresistente (MDR) gram-negatieve bacillen (GNB) bij patiënten die in NICU zijn opgenomen. In een cohortstudie van 8 jaar werden episodes van bacteriëmie met MDR GNB vergeleken met een groep patiënten met een bacteriëmie met niet MDR GNB .
Van de 1106 bacteriëmieën zijn er 393 (35,5 %) veroorzaakt door GNB 70 (18,6 %) door een MDR stam. Het meest frequente resistentiemechanisme is de productie van ß-lactamase (67,1 %), vooral bij Klebsiella pneumoniae (59,6 %). De onafhankelijke risicofactoren van het verwerven van MDR GNB zijn voorafgaande blootstelling aan cephalosporins, een antibioticum van de derde generatie (Odds ratio [OD]: 5,97; 95% betrouwbaarheidsinterval [CI] 2,37 – 15,8; P<0,001) en carbapenems (OR:3,60; 95 % CI: 1,26 – 10,29; P=0,17), en een onderliggende nieraandoening (OR: 7,08; 95 % CI: 1,74 – 28,83; P=0,006). Patiënten met een bacteriëmie met MDR GNB hadden meer kans op een onaangepaste initiële antibioticatherapie (72,9 % vs 7,8 %; P<0,001), infectieuze complicaties (21,4 % vs 10,5 %; P=0,011) en een hoger globaal sterftecijfer (28,6 % vs 10,5 %;P<0,001). Onafhankelijke risicofactoren voor de globale mortaliteit zijn de aanwezigheid van infectieuze complicaties na de bacteriëmie (OR: 3,16; 95 % CI: 1,41 – 7,08: P=0,005) en een onderliggende secundaire pulmonaire hypertensie met of zonder cor pulmonale (OR:6,19; 95 % CI: 1,88 – 20,31; P=0,003).
We leiden daaruit af dat MDR GNB goed is voor 18,6 % van alle GNB bacteriëmieën op de NICU-eenheid, vooral bij patiënten die voorafgaand een breedspectrum antibiotherapie hadden gekregen en bij patiënten met een onderliggende nieraandoening. Het meest frequente resistentiemechanisme is de productie van breedspectrum ß-lactamase (ESBL). Pasgeborenen met een MDR GNB hebben vaker de neiging om infectieuze complicaties te ontwikkelen die onafhankelijk geassocieerd zijn met een globaal hoger mortaliteitscijfer.
Scheithauer S., Trepels-Kottek S., Hafner H., Keller D., Ittel T., Wagner N., Heimann K., Schoberer M., Schwarz R., Haase G., Waitschies B., Orlikowsky T., Lemmen S.
Healthcare worker-related MRSA cluster in a German neonatology level III ICU: a true European story.
Int J Hyg Environ Health 2014 March; 217(2-3): 307-11
We hebben een cluster van 8 nieuwe MRSA-gekoloniseerde pasgeborenen in een ICU onderzocht en stellen hier info voor over zowel de moleculaire kenmerken van de stammen, als over het proces om de bron te identificeren, waarbij de impact van MRSA-kolonisatie bij HCWs bekeken werd. Uit de moleculaire kenmerken van de stammen is een enkele familie gebleken, met name het spa-type 127, een type dat hoogst uitzonderlijk is in Duitsland. Omgevingsstalen en de screenings van de ouders van de gekoloniseerde pasgeborenen waren negatief. Uit de screening van het zorgpersoneel bleek daarentegen dat een werknemer (HCW:1/134), die deel uitmaakte van een recent aangeworven groep Roemeense HCWs , gekoloniseerd was met de stam spa-type 127. Verdere screenings hebben vervolgens MRSA opgespoord bij 9/51 Roemeense HCWs (18 %) en 7/9 (14 % van het totaal) isolaten vertoonden hetzelfde moleculaire beeld als het indexgeval (spa/PFGE type). Alle dragers werden met succes gedekoloniseerd, waarna geen enkel ander geval bij een patiënt meer opgedoken is. Sindsdien maakt een screeningsprogramma voor alle nieuwe werknemers deel uit van ons infectiecontrolebeleid. We concluderen dat MRSA-gekoloniseerde HCWs de bacterie binnen het ziekenhuis kunnen overdragen. Aangezien HCWs afkomstig uit hoog endemische regio’s mogelijks gekoloniseerd zijn, kunnen ze een risico vormen voor de patiënten.
Osvald E.C., Prentice P.
NICE clinical guideline: antibiotics for the prevention and treatment of early-onset neonatal infection
Arch Dis Child Educ Pract Ed 2014; 99; 98-100
Informatie over de huidige aanbevelingen:
Een vroegtijdige neonatale infectie, die wordt gedefinieerd als infectie die binnen de 72 uur na de geboorte optreedt, is een belangrijke oorzaak van mortaliteit en morbiditeit en wordt meestal veroorzaakt door de Streptococcus van groep B (GBS). De aanbevelingen van het National Institute for Health and Clinical Excellence (NICE) : “Antibiotica in geval van vroegtijdige neonatale infectie op neonatologie: antibiotica voor de behandeling en preventie van een infectie op neonatologie” is gepubliceerd in augustus 2012. Deze hebben tot doel prematuren met een infectierisico te identificeren, een snelle behandeling promoten voor prematuren bij wie een infectie wordt vermoed en de blootstelling aan antibiotica vermijden voor kinderen die geen vroegtijdige neonatale infectie hebben opgelopen. Deze aanbevelingen zijn opgesteld door het National Collaborating Centre for Women’s and Children’s Health.
Vorige aanbevelingen: er zijn geen eerdere gedetailleerde nationale aanbevelingen voor het beheer van vroegtijdige septicemieën bij pasgeborenen. Het “Royal College of Obstetricians and Gynaecologists” heeft in 2003 aanbevelingen gepubliceerd (geactualiseerd in 2012), die gericht zijn op de preventie van GB, waarin een aantal aspecten van het beheer van vroegtijdige septicemieën bij pasgeborenen aan bod komen.