Inleiding
De Amerikaanse richtlijnen van de Centers for Disease Control and Prevention (CDC) adviseren om perifere katheters bij volwassenen niet frequenter dan elke 72-96 uur te vervangen ter preventie van flebitis. De CDC kon in 2011 nog geen aanbevelingen doen betreffende het vervangen van perifere katheters bij volwassenen enkel indien klinisch geïndiceerd, tenzij dan bij kinderen (1).
Nochtans vermeldde de Hoge Gezondheidsraad (HGR) in de algemene Belgische aanbevelingen ter preventie van intravasculaire infecties al in 2000 dat “het risico en voordelen van het routinematig herplaatsen van de katheter moeten afgewogen worden tegenover het risico op mechanische complicaties en de beschikbaarheid van een alternatieve plaats. De keuze van het materiaal en de vervangingsfrequentie zijn aan elke patiënt aangepast. Het intravasculair materiaal wordt steeds verwijderd zodra de klinische indicatie daartoe vervalt”. In de specifieke aanbevelingen vermeldt de HGR dan weer dat bij volwassenen een korte perifeer veneuze katheter gewoonlijk na 72 uur wordt verwijderd om het risico van tromboflebitis en infectie te minimaliseren. Indien geen andere toegangsweg voorhanden is, kan een perifere veneuze katheter langer dan 3 dagen ter plaatse gelaten worden (2).
De Nederlandse Werkgroep Infectie Preventie (WIP) adviseert om de perifere katheters niet routinematig te verwijderen, maar wel onmiddellijk bij de geringste tekenen van flebitis. Een maximale verblijfsduur wordt niet vermeld. De WIP argumenteert dit advies op basis van het ontbreken van publicaties van gerandomiseerde onderzoeken waaruit blijkt dat routinematige vervanging van perifeer-veneuze infuuskatheters infectie of flebitis voorkomt (3). Dit advies komt overeen met dat van de Amerikaanse Infusion Nurses Society (4).
In 2015 publiceerde de The Cochrane Collaboration een update van de review van gerandomiseerde gecontroleerde studies waarbij klinisch geïndiceerde vervanging versus routinematige vervanging van perifere katheters werd vergeleken. De review vond geen evidentie om vervanging van perifere katheters om de 72-96 uur te verantwoorden (5).
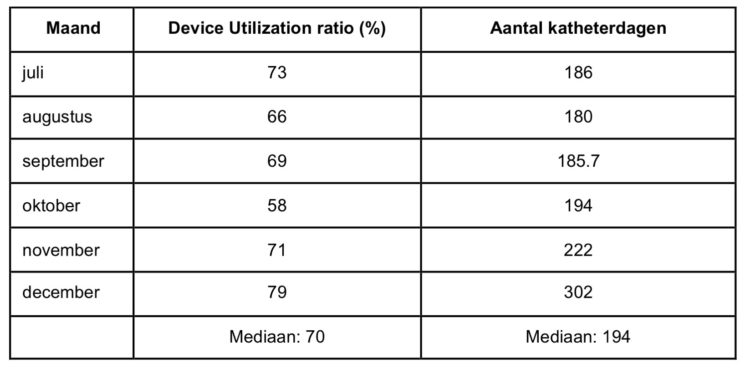
Aangezien ook volgens de UZA-procedure de perifere katheters om de 96 uur moeten vervangen worden, werd besloten om de verlenging van de verblijfsduur te evalueren na goedgekeuring in het comité voor ziekenhuishygiëne van 26 november 2009.
Materiaal en methoden
Twee verpleegafdelingen (cardiologie en gastro-enterologie) waren bereid om vanaf augustus 2014 tot en met april 2016 een nieuw protocol toe te passen waarbij een perifere katheter enkel zou worden verwijderd bij beginnende symptomen van flebitis of bij het vervallen van de indicatie voor een katheter. Tijdens deze periode werden alle patiënten geregistreerd waarbij een perifere katheter werd geplaatst. Hierbij werd gevraagd om per patiënt een registratieformulier in te vullen met vermelding van insertiedatum, datum van optreden flebitis, datum van verwijdering van de katheter, type en diameter van de katheter, al of niet gebruik van citraat om te locken, enz. De verwerking en aanvulling van ontbrekende gegevens gebeurde door het team ziekenhuishygiëne.
Voor de berekening van de significantie werd gebruik gemaakt van de chi-kwadraattoets (significantieniveau <.05).
Resultaten
a) Patiëntengegevens
In totaal konden van 214 patiënten met een perifere katheter gegevens verzameld worden. Het betroffen overwegend cardiologische patiënten (n= 193) doordat de registratie op gastro-enterologie vroegtijdig werd stopgezet omwille van organisatorische redenen.
Van 143 patiënten konden demografische gegevens verzameld worden: 85 mannen en 58 vrouwen met een gemiddelde leeftijd van 66,5 jaar (range: 29-94 jaar).
b) Kathetergegevens
Van de 214 patiënten werd bij 203 patiënten (94,9%) een perifere veiligheidskatheter type Nexiva® geplaatst; bij 11 (5,1%) andere patiënten betrof het een ander type veiligheidskatheter of ontbrak de informatie.
De gemiddelde verblijfsduur van de katheters bedroeg 5,3 dagen (range: 0-23 dagen); mediaan: 5 dagen; interquartile range (IQR): 5 dagen. Bij de berekening werd de dag van de insertie beschouwd als dag 0 en dus niet meegeteld in de berekening van de verblijfsduur uitgedrukt in aantal dagen.
Van 161 katheters werd ook de diameter (in Gauge) geregistreerd (tabel 1).
Tabel 1: Verdeling van de katheters volgens Ddiameter, studie rond verblijfsduur van katheters, UZA.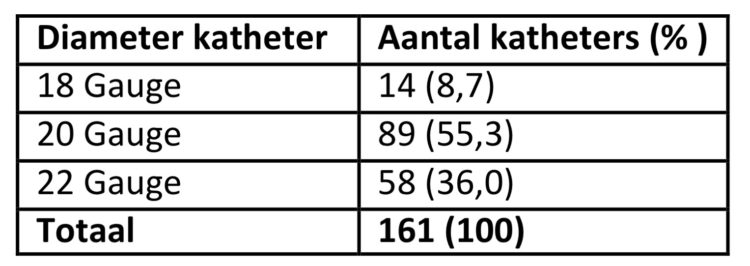
c) Flebitis
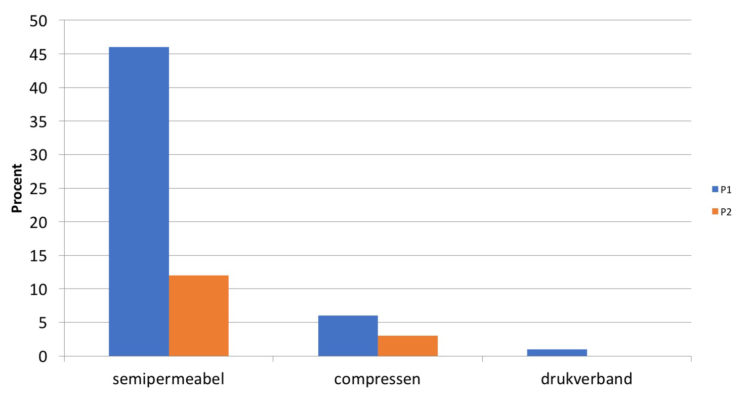
Van de 214 geobserveerde patiënten werden bij 35 (16,4%) patiënten symptomen van flebitis geregistreerd. Tabel 2 vermeldt de aard van de symptomen die op (beginnende) flebitis wezen.
Tableau 2 : Nature des symptômes indiquant une phlébite (naissante), étude relative à la durée de maintien des cathéters, UZA.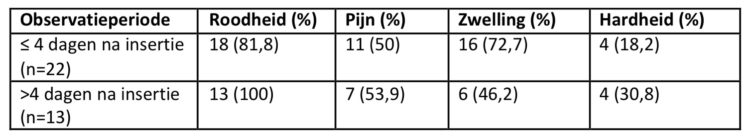
In grafiek 1 wordt in functie van de verblijfsduur van de katheter de incidentie van flebitis weergegeven.
Grafiek 1: Incidentie van flebitis, studie rond verblijfsduur van katheters, UZA.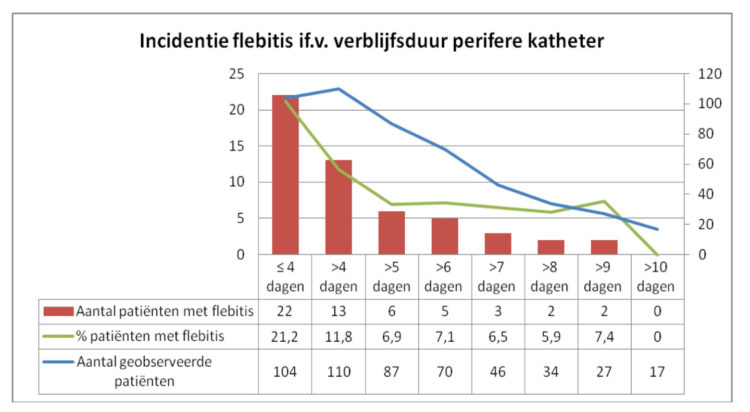
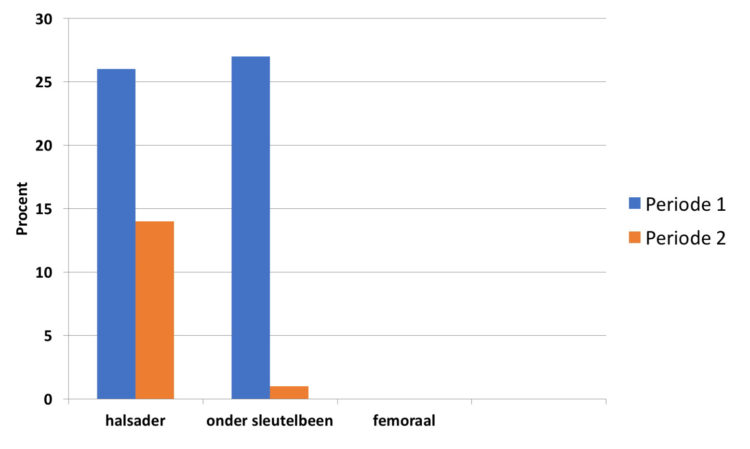
In tabel 3 wordt de incidentie van flebitis weergegeven i.f.v. de lokalisatie van de katheter.
Tabel 3: Incidentie flebitis i.f.v. lokalisatie, studie rond verblijfsduur van katheters, UZA.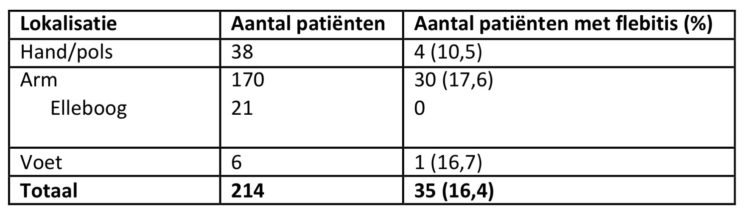
In tabel 4 wordt van de 161 katheters, waarvan ook de diameter van de katheter werd geregistreerd, de incidentie van flebitis weergegeven i.f.v. de diameter van de katheter.
Tableau 4 : Incidence de la phlébite en fonction du diamètre du cathéter, étude relative à la durée de maintien des cathéters, UZA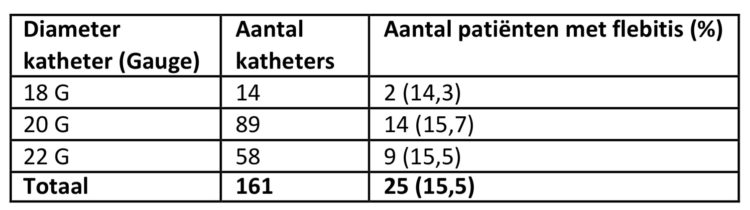
In tabel 5 wordt de incidentie van flebitis weergegeven i.f.v. het al of niet toepassen van een citraatlock.
Tabel 5: Incidentie van flebitis i.f.v citraatlock , studie rond verblijfsduur van katheters, UZA.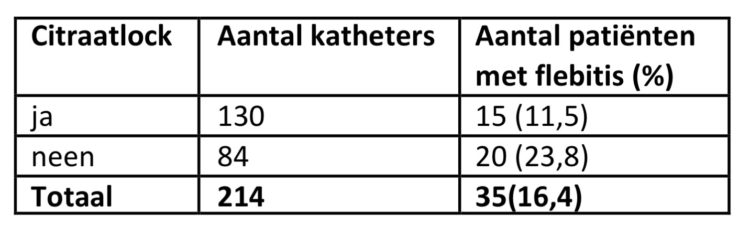
In tabel 6 wordt de incidentie van flebitis weergegeven in functie van de verblijfsduur en in functie van het al dan niet aanwezig zijn van een citraatlock.
Tabel 6: Incidentie flebitis bij katheters met een citraatlock i.f.v. de verblijfsduur, studie rond verblijfsduur van katheters, UZA.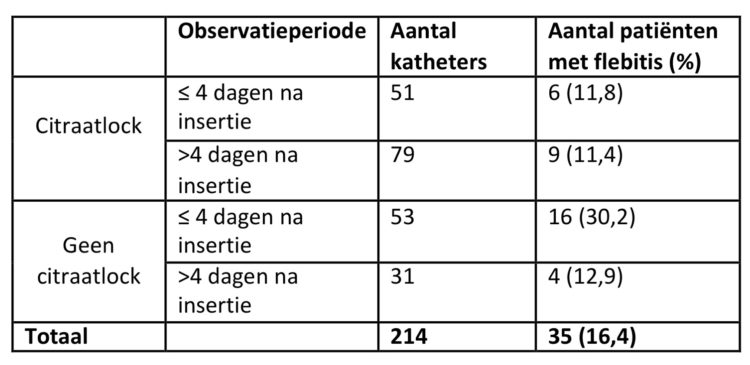
Gemiddelde verblijfsduur van katheters met citraatlock bedroeg 5,8 dagen (0-20); mediaan: 5 dagen; IQR:4 dagen.
In tabel 7 wordt weergegeven hoeveel katheters werden uitgespaard door de katheters niet meer routinematig te verwijderen.
Tabel 7: Aantal uitgespaarde katheters, studie rond verblijfsduur van katheters, UZA.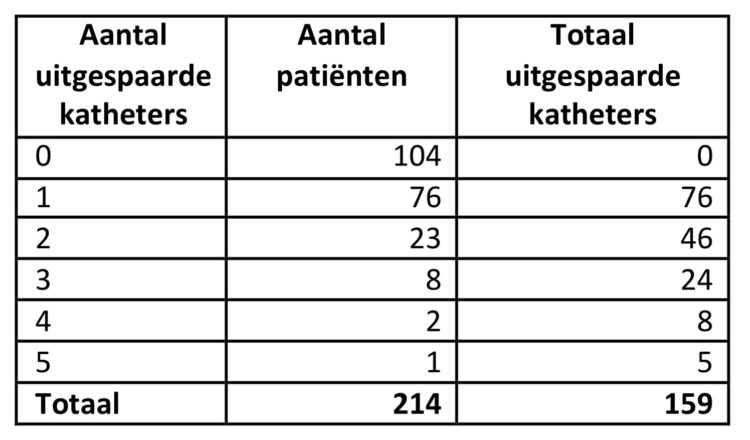
Bespreking
Het grootse risico op flebitis doet zich voor in de periode van dag 0 tot en met dag 4. Roodheid werd het meest frequent geregistreerd als symptoom onafhankelijk van de verblijfsduur. Bij een verblijfsduur van de katheter van minder dan 5 dagen ontwikkelden 21,2 % van de patiënten een flebitis. Patiënten die in deze periode nog geen flebitis ontwikkelden liepen een beduidend lager risico om alsnog een flebitis door te maken: 11,8% of een risico dat 44,3% lager is (p=0,06).
De aanwezigheid van een citraatlock lijkt een beschermend effect te hebben: van de 130 patiënten met een citraatlock ontwikkelden er 11,5% een flebitis versus 23,8% zonder citraatlock (p=0,018). Het verschil in incidentie van flebitis is het grootst bij katheters die minder dan 5 dagen ter plaatse blijven (11,8% versus 30,2%). Ook in een studie van Viale et al (6) werd een verlaagd risico op flebitis bij gebruik van heparinelocks aangetoond.
Wanneer enkel de katheters met een citraatlock werden bestudeerd, is er geen verschil in percentage patiënten dat flebitis ontwikkelde in functie van de verblijfsduur (11,8% binnen de vier dagen na insertie versus 11,4% langer dan 4 dagen na insertie).
Het is onduidelijk of het locken op zich een beschermend effect heeft tegen het ontwikkelen van flebitis. Immers precies bij patiënten waar frequent intraveneuze medicatie werd toegediend (bijvoorbeeld om de 4 uur) en waarbij dus frequente manipulaties werden uitgevoerd werd enkel gespoeld met fysiologisch water. Mogelijks verhogen frequente manipulaties met mechanische irritatie van de venen het risico om een flebitis te ontwikkelen.
Er kon geen verband worden aangetoond tussen de diameter van de katheter en het risico op flebitis, wat overeenkomt met de bevindingen in andere studies (7). Wel blijkt er een iets lager risico bij patiënten waar de katheter in de hand of pols (10,5%) werd geplaatst versus de andere zones van de arm (met uitzondering van de elleboogplooi) (≥16,7%).
Bij toepassing van de vervangingsfrequentie om de 4 dagen zouden er voor de 214 bestudeerde patiënten in totaal 263 katheters gebruikt geweest zijn. Door de verlenging van de verblijfsduur werden echter 159 katheters uitgespaard, wat overeenkomt met een besparing van 60,5%.
Geëxtrapoleerd naar het gehele ziekenhuis betekent dit op basis van het verbruik in 2014 een besparing van 36.421 katheters wat een bedrag van 118.987 euro vertegenwoordigt.
In werkelijkheid is de besparing wellicht nog groter aangezien enkel rekening gehouden werd met de Nexiva®-katheter en niet met een andere veiligheidskatheter die in het operatiekwartier wordt gebruikt; deze laatste katheter heeft meestal wel een kortere verblijfsduur (bv. na chirurgie in dagopname) zodat de impact op mogelijke besparing beperkter is.
Deze studie heeft zijn beperkingen aangezien er geen rekening werd gehouden met de aard van de toegediende intraveneuze farmaca noch met de onderliggende pathologie (zoals diabetes) van de patiënt. Een andere beperking betreft het feit dat de registratie gebeurde door de verpleegkundigen van de betrokken verpleegafdelingen, met mogelijk een onderrapportering van flebitis. Er werd daarom door het team ziekenhuishygiëne een ad random validatie gedaan van 21 registratieformulieren door middel van een steekproef. Hierbij werd enkel het item “aanwezigheid van symptomen van flebitis” gecontroleerd in het medisch en verpleegkundig dossier. De steekproefgrootte (10%) werd bepaald op basis van de instructies van de International Library of Measures (ILoM). De overeenkomst bedroeg 95,2%, waardoor de resultaten als betrouwbaar kunnen beschouwd worden.
Conclusie
Het verlengen (> 96 uur) van de verblijfsduur van perifere katheters verhoogt het risico op flebitis niet. Het grootste risico voor de patiënt doet zich immers voor in de periode vóór 96 uur (4 dagen).
Als conclusie kunnen we verwijzen naar de publicatie van Webster et al (5) waarbij het vervangen van perifere katheters, enkel indien klinisch geïndiceerd, kan overwogen worden. Deze aanpak zou een belangrijke besparing impliceren en bespaart de patiënten onnodige pijn door routinematig katheters te vervangen in afwezigheid van klinische indicaties. Om echter complicaties gerelateerd aan perifere katheters te beperken moet de insteekplaats dagelijks en per shift geïnspecteerd worden en moet de katheter onmiddellijk worden verwijderd bij tekens van inflammatie, extravasatie, verstopping of wanneer de indicatie voor een katheter vervalt.
Referenties
1. Centers for Disease Control and Prevention. Guidelines for the Prevention of Intravascular Catheter-Related Infections, 2011.
2. Conseil supérieur de la Santé. Recommandations relatives à la prévention des infections nosocomiales. Soins aux patients. Octobre 2000.
3. Werkgroep Infectie Preventie. Flebitis en bloedbaaninfecties door intraveneuze infuuskatheters. Rédaction : avril 2010. Ajout : octobre 2010. Révision : avril 2015.
4. Infusion Nurses Society. Infusion Nursing. Standards of Practice. Journal of Infusion Nursing, 34, 1S; janvier/février 2011.
5. Webster J, Osborne S, Rickard CM, New K. Clinically-indicated replacement versus routine replacement of peripheral venous catheters. Cochrane Database of Systematic Reviews 2015, Issue 8. Art. No.: CD007798. DOI: 10.1002/14651858.CD007798.pub4.
6. Viale P, Colombini P, Pagani L. Safety of short-term peripheral intravenous catheters (PIC) left in place for longer than recommended. Poster P15.06 at the 5th International Conference of the Hospital Infection Society, 2002.
7. Salgueiro Oliveira A, Veiga P, Parreira P. Incidence of phlebitis in patients with peripheral intravenous catheters: The influence of some risk factors. Australian Journal of Advanced Nursing, 2013; 30 (2):32-39.