Lionel Pineau, Caroline Radix, David J. Weber
Comparison of the sporicidal activity of a UV disinfection process with three FDA cleared sterilants .
American Journal of Infection Control 50 (2022) 1316−1321
Background: Endocavitary probes are semi-critical devices and must undergo, at least, high level disinfection (HLD) between uses. Therefore, they should be high level disinfected between uses (i.e., with a product/process that kills all forms of microbial life; bacteria, fungi, mycobacteria, and virus, and in some countries, a demonstrated potential for sporicidal activity). In this study, the sporicidal activity of three common Food and Drug Administration cleared sterilants (CIDEX OPA Solution, SPOROX II Sterilizing and Disinfection Solution and CIDEX Activated Dialdehyde Solution) was compared with the sporicidal activity of an ultraviolet disinfection technology (Hypernova Chronos, Germitec) against Bacillus subtilis ATCC 19659 spores spread on silicone flat carriers in the presence of inorganic and organic soil.
Results: The results indicate that the UV disinfection process presented within a 35 seconds exposure time a sporicidal efficacy substantially higher than the chemical sterilants used according to manufacturer instructions for HLD.
Conclusion: This study demonstrated that even if it cannot be tested/approved as a sterilant according to AOAC 966.04, the UV unit is much more effective than usual Food and Drug Administration approved chemical HLD products to kill spores in real use conditions. This finding questions the relevancy of evaluating product efficacy within extended conditions giving results that could mislead users to select the most effective HLD product/process for the reprocessing of their medical devices.
Cori L. Ofstead, Abigail G. Smart, Krystina M. Hopkins, Harry P. Wetzler
The utility of lighted magnification and borescopes for visual inspection of flexible endoscopes.
American Journal of Infection Control 51 (2023) 2−10
Introduction: Infections have been linked to damaged or contaminated endoscopes with visible defects. Endoscope processing standards and guidelines state endoscopes should be visually inspected every time they are used. This study evaluated a new visual inspection program using magnification and borescopes in an endoscopy department that had not previously utilized these tools.
Methods: Site personnel were given visual inspection tools and training before systematically examining fully processed endoscopes twice during a 2-month period. A risk assessment protocol was used to determine whether endoscopes required recleaning, repair, or other action. Findings were documented using log sheets, photographs, and videotapes.
Results: Visible damage and residue or debris were observed in 100% of 25 endoscopes at both assessments, and 76% required repair. Defects at baseline included scratches (88%); channel shredding or peeling (80%); adhesive band disintegration (80%); residual soil or debris (white 84%; black 68%; brown 40%; yellow/green 36%; and orange/red 8%); retained fluid (52%); and dents (40%). Findings were similar at follow-up.
Discussion/Conclusions: Visual inspection with magnification and borescopes identified actionable defects that could interfere with processing effectiveness in 100% of endoscopes. Infection preventionists have a critical role to play in supporting processing personnel now that standards, guidelines, and manufacturer instructions recommend enhanced visual inspection of every endoscope, every time.
B. Casini , A.M. Spagnolo, M. Sartini, B. Tuvo, M. Scarpaci, M. Barchitta, A. Pan, A. Agodi, M.L. Cristina
Microbiological surveillance post-reprocessing of flexible endoscopes used in digestive endoscopy: a national study
Journal of Hospital Infection 131 (2023) 139e147
Introduction: Microbiological surveillance of endoscopes is a safety measure for verifying the quality of reprocessing procedures and identifying contaminated devices, but duodenoscope-related outbreaks are still reported. Aim: To assess the effectiveness of duodenoscope reprocessing procedures in Italy.
Methods: Between December 2019 and April 2020, data obtained from microbiological surveillance post-reprocessing in 15 Italian endoscopy units were collected. Sampling was carried out after reprocessing or during storage in a cabinet. In keeping with international guidelines and the Italian position paper, the micro-organisms were classified as highconcern organisms (HCOs) and low-concern organisms (LCOs).
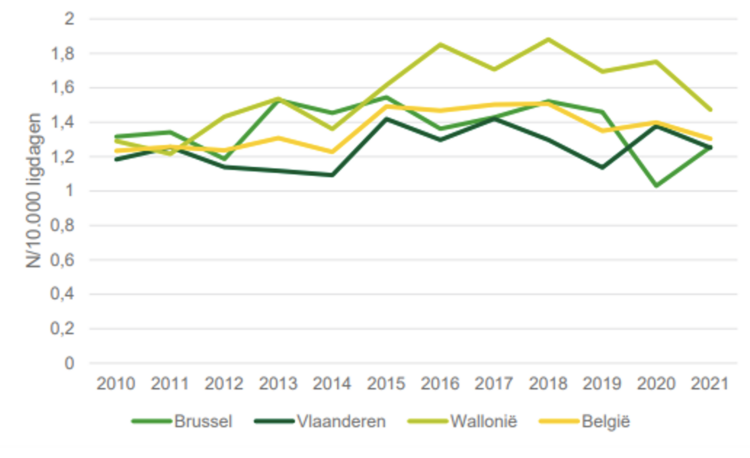
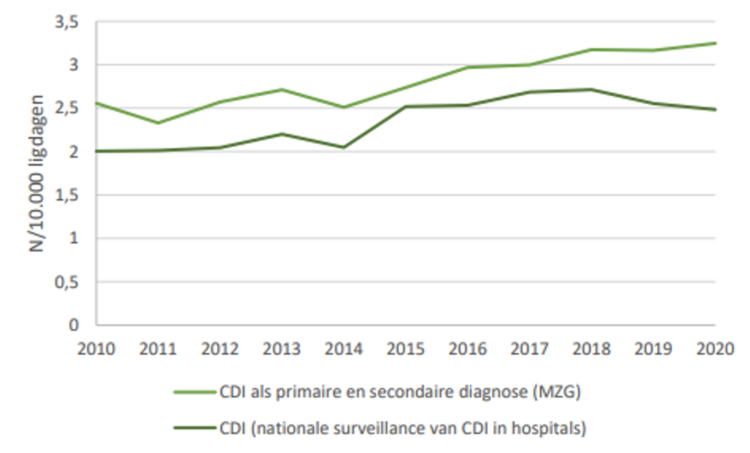
Findings: In total, 144 samples were collected from 51 duodenoscopes. Of these, 36.81% were contaminated: 22.92% were contaminated with HCOs and 13.89% were contaminated with LCOs [2.08% with an LCO load of 11e100 colony-forming units (CFU)/device and 0.69% with an LCO load of >100 CFU/device]. The contamination rate was 27.5% in samples collected after reprocessing, 40% in samples collected during storage in a cabinet that was compliant with EN 16442:2015 (C-I), and 100% in samples collected during storage in a cabinet that was not compliant with EN 16442:2015 (NC-I). The respective HCO rates were 15.00%, 27.27% and 66.67%. Correlation between LCO contamination and storage time was demonstrated (Spearman’s rho¼0.3701; P¼0.0026). The Olympus duodenoscope TJFQ180V demonstrated the lowest rate of contamination (29.82%), although the contamination rate was 100% for duodenoscopes stored in an NC-I cabinet.
Sandra N. Bulens, Hannah E. Reses, Uzma A. Ansari, Julian E. Grass, Clayton Carmon, Valerie Albrecht, Adrian Lawsin, Gillian McAllister, Jonathan Daniels, Yeon-Kyeng Lee, Sarah Yi, Isaac See, Jesse T. Jacob, Chris W. Bower, Lucy Wilson, Ghinwa Dumyati, Rebecca Tsay, Erin C. Phipps, Wendy Bamberg, Sarah J. Janelle, Zintars G. Beldavs, P. Maureen Cassidy, Marion Kainer, Daniel Muleta, Jacquelyn T. Mounsey, Alison Laufer-Halpin, Maria Karlsson, Joseph D. Lutgring, Maroya Spalding Walters
Carbapenem-Resistant enterobacterales in individuals with and without health care risk factors —Emerging infections program, United States, 2012-2015.
American Journal of Infection Control 51 (2023) 70−77
Background: Carbapenem-resistant Enterobacterales (CRE) are usually healthcare-associated but are also emerging in the community.
Methods: Active, population-based surveillance was conducted to identify case-patients with cultures positive for Enterobacterales not susceptible to a carbapenem (excluding ertapenem) and resistant to all thirdgeneration cephalosporins tested at 8 US sites from January 2012 to December 2015. Medical records were used to classify cases as health care-associated, or as community-associated (CA) if a patient had no known health care risk factors and a culture was collected <3 days after hospital admission. Enterobacterales isolates from selected cases were submitted to CDC for whole genome sequencing.
Results: We identified 1499 CRE cases in 1194 case-patients; 149 cases (10%) in 139 case-patients were CA. The incidence of CRE cases per 100,000 population was 2.96 (95% CI: 2.81, 3.11) overall and 0.29 (95% CI:0.25, 0.35) for CA-CRE. Most CA-CRE cases were in White persons (73%), females (84%) and identified from urine cultures (98%). Among the 12 sequenced CA-CRE isolates, 5 (42%) harbored a carbapenemase gene.
Conclusions: Ten percent of CRE cases were CA; some isolates from CA-CRE cases harbored carbapenemase genes. Continued CRE surveillance in the community is critical to monitor emergence outside of traditional health care settings.
Pınar Y. Gulhan, Peri M. Arbak, Ali N. Annakkaya, Ege G. Balbay, Oner A. Balbay
An assessment of post-COVID-19 infection pulmonary functions in healthcare professionals
American Journal of Infection Control 50 (2022) 1125−1132
Background: The medium- and long-term effects of COVID-19 infection on pulmonary function are still unknown. The present study aimed to investigate the pulmonary functions in healthcare professionals who had persistent complaints after contracting COVID-19 and returning to work.
Methods: The study included COVID-19-infected healthcare professionals from the Duzce University Medical € Faculty Hospital who volunteered to participate. Medical histories, medical records, pulmonary function tests, the diffusing capacity of the lungs for carbon monoxide (DLCO) test, and the 6-minute walk test (6MWT) were used to collect data from all participants.
Results: The study included 53 healthcare professionals, with an average age of 38 § 10 years (min: 24 years and max: 71 years), including 29 female (54.7%) and 24 male (45.3%) participants. Of the participants, 22.6% were smokers, 35.8% (19 individuals) had comorbidities, and 17% (9 individuals) were hospitalized. The mean length of stay was 9 § 4 days (mean § standard deviation). The most prevalent symptoms were weakness (88.7%), muscle aches (67.9%), inability to smell/taste (60.4%), headache (54.7%), fever (45.3%), cough (41.5%), and shortness of breath (37.7%). The mean time to return to work after a positive polymerase chain reaction (PCR) test for COVID-19 was 18 § 13 days. The average time among post-disease pulmonary function, 6MW, and DLCO tests was 89 § 36 days (min: 15 and max: 205). The DLCO level decreased in 39.6% (21) of the participants. Female participants had a significantly higher rate of decreased DLCO levels than male participants (25% vs. 55.2%, P = .026). DLCO levels were significantly higher in participants with longterm persistent complaints (P = .043). The later the time to return to work, the lower the DLCO value (r = 0.290 and P = .035). The 6MWT distance was positively correlated with hemoglobin and lymphocyte levels at the time of the disease onset and negatively correlated with D-dimer levels. The most prevalent symptoms during the control visits were shortness of breath/effort dyspnea (24.6%), weakness (9.5%), and muscle aches (7.6%). .
Conclusion: Significant persistent complaints (47.2%) and low DLCO levels (39.6%) were observed in healthcare professionals during control visits at a mean time of 3 months after the COVID-19 infection. Symptoms and spirometry measurements, including DLCO, may be helpful in the follow-up of healthcare professionals who contracted COVID-19. Further comprehensive studies with long-term follow-up periods are required.
Kimberly B. Wilson, Lauren Satchell, Sarah A. Smathers, Lauren F. Le Goff, Susan E. Coffin
The power of feedback: Implementing a comprehensive hand hygiene observer program
American Journal of Infection ControlVolume 51, Issue 2, February 2023, Pages 142-148
Background: Hand hygiene (HH) is a fundamental component of infection prevention within all healthcare settings. We implemented a hospital-wide program built on overt HH observation, real-time feedback, and thematic analysis of HH misses.
Methods: A robust observer training program was established to include foundational training in the WHO’s My Five Moments of HH. Observational data from 2011 to 2019 were analyzed by unit, provider type, and thematic analyses of misses.
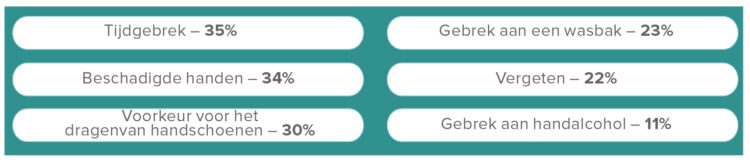
Results: During the study period, we conducted 160,917 hospital-wide observations on 29 units (monthly average of 1,490 observations). Institutional compliance remained above 95% from 2013 to 2019. Thematic analysis revealed “touching self” and “touching phone” as common, institution-wide reasons for HH misses.
Discussion: Overt observations facilitated communication between HH program and healthcare staff to better understand workflow and educate staff on HH opportunities. This program is an integral part of the Infection Prevention team and has been deployed to collect supplemental data during clusters and outbreaks investigations.
Conclusion: In addition to having rich HH data, successes of this program, include increased awareness of IPC practices, enhanced communication about patient safety, enriched dialog and feedback around HH misses, and relationship building among program observers, unit staff and leaders
Robert Garcia, Sue Barnes, Roy Boukidjian, Linda Kaye Goss, COHN-S, Maureen Spencer, Edward J. Septimus, Marc-Oliver Wright, Shannon Munro, Sara M. Reese, Mohamad G. Fakih, Charles E. Edmiston, , Martin Levesque
Recommendations for change in infection prevention programs and practice
American Journal of Infection Control 50 (2022) 1281−1295
Fifty years of evolution in infection prevention and control programs have involved significant accomplishments related to clinical practices, methodologies, and technology. However, regulatory mandates, and resource and research limitations, coupled with emerging infection threats such as the COVID-19 pandemic, present considerable challenges for infection preventionists. This article provides guidance and recommendations in 14 key areas. These interventions should be considered for implementation by United States health care facilities in the near future.
N. Demeersseman, V. Saegeman, V. Cossey, H. Devriese, A. Schuermans
Shedding a light on ultraviolet-C technologies in the hospital environment
Journal of Hospital Infection 132 (2023) 85e92
Ultraviolet (UV)-C light for disinfection has experienced a surge in popularity since the outbreak of COVID-19. Currently, many different UV-C systems, with varied properties that impact disinfection performance, are available on the market. Therefore this review aims to bundle the available information on UV-C disinfection to obtain an overview of its advantages, disadvantages, and performance-influencing parameters. A literature search was performed using the snowball search method in Google Scholar and PubMed with the following keywords: UV-C disinfection, UV-C dose, UV-C light source, UV-C repair mechanism, UV-C photoreactivation, and UV-C disinfection standards. The main parameters of UV-C disinfection are wavelength, dose, relative humidity, and temperature. There is no consensus about their optimal values, but, in general, light at a high dose and a spectrum of wavelengths containing 260 nm is preferred in an environment at room temperature with low relative humidity. This light can be generated by mercury-vapour, light-emitting diode (LED), pulsed-xenon, or excimer lamps. Multiple factors are detrimental to disinfection performance such as shadowing, a rough surface topography, a high level of contamination, repair mechanisms, and the lack of standardization. Also, there are health and safety risks associated with the UV-C technology when used in the proximity of people. UV-C disinfection systems have promising features and the potential to improve in the future. However, clarifications surrounding the different parameters influencing the technologies’ effectiveness in hospital environment are needed. Therefore UV-C disinfection should currently be considered for low-level rather than high-level disinfection.