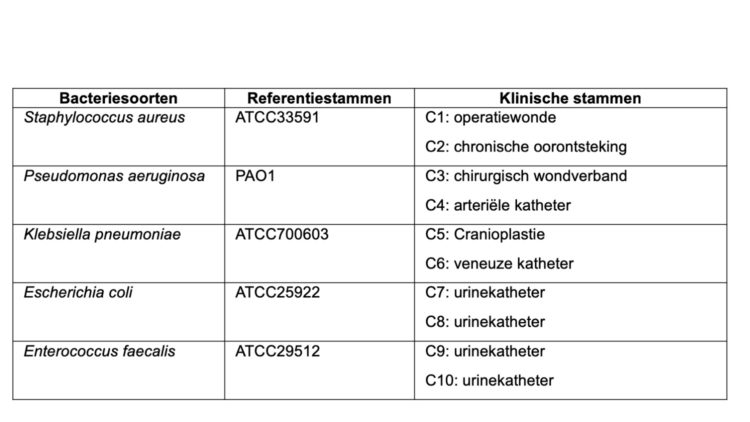
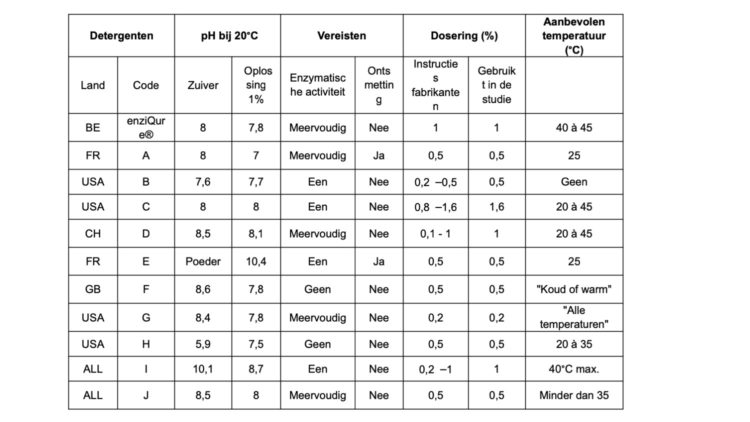
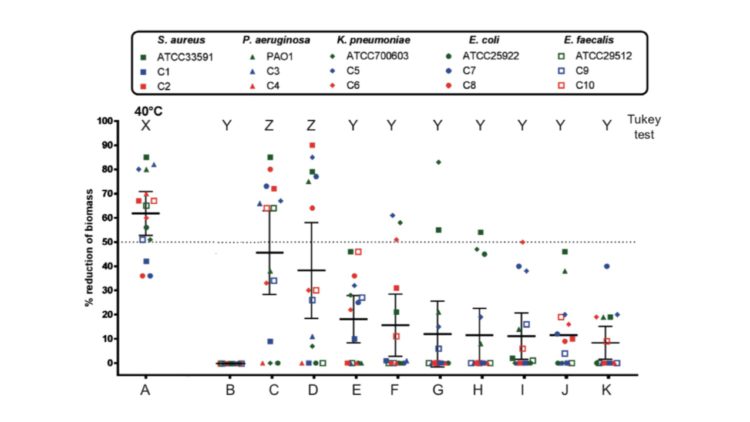
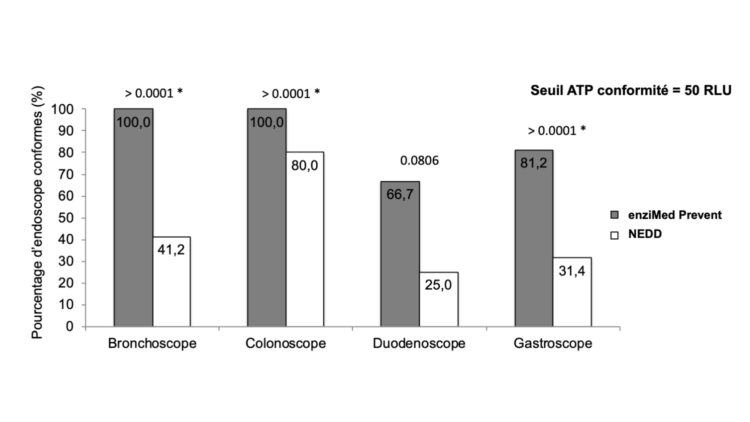
I. Proloog
De ziekenhuishygiëne in België startte officieel met het Koninklijk Besluit (KB) van 24 april 1974. Het KB verplichtte namelijk alle ziekenhuizen om een comité voor ziekenhuishygiëne (CZH) op te richten met het bijhouden van een register waarin de door het comité getroffen maatregelen werden opgenomen (KB van 24 april 1974 houdende aanvulling van het KB van 23 oktober 1964 tot bepaling van de normen die door de ziekenhuizen en hun diensten moeten worden nageleefd).
Ook met het technisch en medisch operationeel worden van het toenmalige Akademisch Ziekenhuis Antwerpen (nu Universitair Ziekenhuis Antwerpen (UZA)) in 1979 werd onmiddellijk een “infectiecomité” opgericht.
Al tijdens de eerste vergadering van het comité voor ziekenhuishygiëne in 1979 werd door het toenmalige hoofd van het labo microbiologie gewezen op de belangrijke rol die voor de aanstelling van een “verpleegkundige-hygiënist” kan worden weggelegd. De aanstelling van een dergelijke verpleegkundige was op dat ogenblik echter niet haalbaar.
Het zou nog 10 jaar duren vooraleer de eerste verpleegkundige-ziekenhuishygiënist samen met een geneesheer-ziekenhuishygiënist in het UZA zou worden aangesteld. De aanleiding hiervoor was het KB van 7 november 1988 waarin bepaald werd dat deze functies in de ziekenhuizen werkzaam moeten zijn om de hygiëne te bevorderen.
II. De eerste stappen als verpleegkundige-ziekenhuishygiënist
Mede door mijn expertise met HIV en AIDS werd ik op 1 januari 1989 door het directiecomité van het UZA aangeduid om de functie waar te nemen van verpleegkundige-ziekenhuishygiënist (VK-ZHH). Mijn ervaring met de HIV-problematiek dateerde al van het begin jaren ‘80 in het Instituut voor Tropische Geneeskunde (ITG) waar ik als verpleegkundige sinds 1979 werkzaam was. De transfer van de hospitalisatie van de “Kliniek Leopold II” van het ITG naar het UZA (inclusief overname van patiënten en personeel) in 1987 betekende immers een verhoogde aanwezigheid van “seropositieve” patiënten in het UZA, waar het UZA-personeel toen heel onwennig op reageerde. Zo werd namelijk door bepaalde artsen (gelukkig tevergeefs) voorgesteld om deze patiënten een gekleurde armband te laten dragen zodat ze bij een medisch-technisch onderzoek gemakkelijk herkenbaar zouden zijn. Het onderwerp “AIDS” zou niet voor niets mijn eerste voordracht in het UZA worden (1,2,3,4,5).
Enkel gewapend met een balpen en een bureauonderlegger en een stapel verslagen van het CZH, kreeg ik als eerste opdracht van het CZH om de procedure “Reiniging, ontsmetting en sterilisatie” op punt te stellen. Een gemeenschappelijke PC die nog moest opgestart worden met een floppydisk en met enkel een tekstverwerkingsprogramma verving gedeeltelijk de klassieke typmachine. Wanneer ik na enkele maanden versterking krijg van een collega zal het ontwerpen van procedures door haar in een stroomversnelling komen. Diverse procedures zagen begin de jaren 90 het licht zoals preventie prikongevallen, isolatieprocedures, maatregelen bij de bereiding en toediening van cytostatica, zoneprocedures, enz. Terwijl mijn collega eerder procedureel werkte, werd ik toegevoegd aan het labo microbiologie waar ik me onder supervisie van het hoofd labo microbiologie zou toeleggen op de registratie van (nosocomiale) infecties. Concreet betekende dit dat de ziekenhuishygiënisten op drie verschillende locaties in het ziekenhuis waren gehuisvest.
Eind 1989 vroeg ik aan de voorzitter van het CZH om de nodige voorzieningen te overwegen om de werking van ziekenhuishygiëne te optimaliseren zoals een gemeenschappelijke werkruimte voor de ziekenhuishygiënisten met het noodzakelijke meubilair en abonnementen op vakliteratuur. Ook een computer stond op het verlanglijstje die voldoende capaciteit moest hebben voor tekstverwerking en voor de registratie van infecties/kolonisaties en die bovendien aangesloten was op de centrale computer om op die manier gemakkelijk labogegevens op te vragen. Pas in 1992 zal de registratie van infecties/kolonisatie een boost krijgen dankzij het hoofd van het labo microbiologie die o.a. wees op het belang van informaticavoorzieningen (“automatiseringen”) om op een degelijke manier ziekenhuishygiëne te kunnen bedrijven. Ook het opvragen van niet-microbiologische patiëntengegevens (zoals hematologische bloedresultaten), dat tot dan telkens een toelating van de hoofdgeneesheer vereiste, zou stilaan vergemakkelijkt worden door bureaucratische (dixit hoofd labo microbiologie in 1992) regels af te schaffen.
Om aan de wettelijke vereisten te voldoen volgde het team ziekenhuishygiëne de opleiding ziekenhuishygiëne aan de UIA (nu UA) van 1989-1991. De opleiding was toen gezamenlijk met verpleegkundigen, artsen en apothekers.
III. De surveillances
De eerste jaren op het labo microbiologie werden gekenmerkt door het zo optimaal mogelijk registreren van nosocomiale infecties/kolonisaties. Tevens werden een aantal specifieke kiemen als “markers” van problemen geselecteerd, ongeacht of ze voldeden aan de toen geldende definities van multiresistentie (met uitzondering van MRSA): Pseudomonas aeruginosa, Serratia marcescens, MRSA en Xanthomonas maltophilia (nu Stenotrophomonas maltophilia) en Acinetobacter species. De continue samenwerking met de afdeling informatica (ICT) zou de werking van ziekenhuishygiëne de volgende jaren in belangrijke mate bepalen (zie verder).
Het opzoeken van nieuwe gevallen van infecties/kolonisaties van hogergenoemde kiemen moest aanvankelijk dagelijks manueel, kiem per kiem, via het laboprogramma en op een PC van het labo (die eerst “vrij” moest zijn) gebeuren. Aangezien een PC met een grafisch programma nog niet beschikbaar was, werd gebruik gemaakt van ruitjespapier om de gegevens visueel voor te stellen (figuur 1, 2 en 3).
Figuur 1
Figuur 2
Figuur 3
Daarnaast werd ook gebruik gemaakt van fiches die in een metalen fichehouder (type Valrex®) tegen de muur was bevestigd (figuur 4), waarbij we voor elke kiem een unieke kleur van fiche hadden gekozen. Ook nadat we beschikten over een grafisch programma bleek de voorstelling van de gegevens onoverzichtelijk.
Figuur 4

De samenwerking met de geneesheer-ziekenhuishygiënist maakte dat een aantal registraties werd uitgebreid zoals de registratie van postoperatieve wondinfecties (POWI). Hierdoor konden we al in 1991 aantonen dat o.a. de surveillance na ontslag de incidentie van POWI in belangrijke mate beïnvloedde (6,7). Maar eveneens de toepassing van nieuwe preventieve maatregelen zoals het preoperatief ontharen met een clipper, het preoperatief wassen van de patiënt en het toepassen van nieuwe technieken in de cardiochirurgie hadden een gunstige invloed op de incidentie van POWI (zie verder).
In de loop der jaren zou de surveillance van infecties worden verfijnd door te focussen op multiresistente micro-organismen (MDRO) met toepassing van de definitie van multiresistentie zoals werd bepaald door Sciensano in de nationale surveillances.
In samenwerking met het labo microbiologie werd een werkwijze afgesproken om belangrijke MDRO onmiddellijk aan de ziekenhuishygiënisten op papier te melden zodat kort op de bal kon gespeeld worden om patiënten te isoleren en/of te dekoloniseren. Niet zelden schoven de laboranten de papieren meldingen ’s avonds onder de deur van ons bureel, zodat we de volgende morgen onmiddellijk aan de slag konden gaan (figuur 5).
Deze methode zou later worden vervangen door een emailbericht naar de ziekenhuishygiënisten en zou een standaard onderdeel worden van één van de verschillende “steps” bij de analyse van de labostalen.
Figuur 5

Vrij snel zou ICT dagelijks een uitgeprinte lijst kunnen produceren die we zelf op de afdeling ICT moesten ophalen. Het resulteerde jaarlijks in 10 cm-dikke classeurs waarin het kettingpapier met de laboresultaten kon bewaard worden (figuur 6).
Figuur 6.

Doordat aanvankelijk het takenpakket van de ziekenhuishygiënisten niet duidelijk afgebakend was, leidde dit tot surveillance-activiteiten die strikt genomen tot het terrein van de preventiedienst of het labo microbiologie behoorden. Concreet ging het om de registratie van accidentele bloedcontacten (“prikaccidenten”), de aangifte in het kader van de peillaboratoria en het documenten van de verminderde gevoeligheid (“antibioticaresistentie”) van in het UZA geïsoleerde micro-organismen. Pas in 2022 werden deze registraties toegewezen aan respectievelijk de preventiedienst en de klinisch biologen van het labo microbiologie. Mede door deze registraties werd wel een gestandaardiseerde methodologie beschreven om de antibioticaresistentie te bepalen. Deze methodologie zal vanaf 1994 jaarlijks worden gehanteerd voor de bepaling van de antibioticaresistentie(8). De gebruikte software hiervoor was bij de start dBase III, nadien dBase IV om uiteindelijk over te schakelen naar Access. Alvorens de microbiologische gegevens met de antibiogrammen automatisch konden worden geleverd, werd nog gebruikt gemaakt van diskettes die maandelijks door het labo microbiologie aan het TZHH werden bezorgd.
Op het vlak van accidentele bloedcontacten kon dan weer door deze registraties aangetoond worden dat door de introductie van veiligheidsmaterialen (zoals veiligheidsvleugelnaalden en -poortkatheters) het aantal prikaccidenten kon worden verminderd (9,10). Ook op vlak van insulinepennen en glucometers konden acties ondernomen worden om het aantal prikaccidenten met deze instrumenten te beperken (11,12,13). Evengoed konden we documenteren hoeveel accidentele bloedcontacten er over meerdere jaren met bloedoverdraagbare aandoeningen (HIV, HCV en HBV) waren geweest, met gelukkig geen enkele seroconversie bij het personeel (14,15).
Wanneer in 2003 het team van ziekenhuishygiëne (TZHH) versterkt wordt met een VK-ZHH die het Accessprogramma van MS Office goed beheerste, zal dit snel resulteren in een “home-made”-registratiesysteem. Het programma liet toe om op één scherm per patiënt een overzicht te geven van de historiek van hospitalisaties, de isolatiestatussen, MDRO en dekolonisaties voor MRSA. Het systeem is anno 2022 nog steeds in gebruik omdat de integratie hiervan in het elektronisch patiëntendossier (EPD) pas in een latere fase is gepland.
Navigator en het Vlaamse kwaliteitsdecreet
Het Vlaamse kwaliteitsdecreet van 1997 voorzag enkele verplichte thema’s waaronder het thema ziekenhuisinfecties. Voor dit thema werden POWI, nosocomiale primaire sepsis (SEP) en ventilator geassocieerde pneumonie (VAP) weerhouden. Voor deze registraties raadde men aan om gebruik te maken van bestaande registratiesystemen van het toenmalige Wetenschappelijk Instituut voor Volksgezondheid. Eind 1998 werden door het TZHH enkele kritische bedenkingen bezorgd aan de Administratie Gezondheidszorg, waarbij gewezen werd op de haalbaarheid van de registratie van POWI omwille van het arbeidsintensieve karakter. Hierdoor zouden bestaande surveillance-activiteiten mogelijks worden afgebouwd, zoals bv. de registratie van MDRO. In de daaropvolgende omzendbrief van de Administratie Gezondheidszorg in 1999 werd vervolgens vermeld dat er in tegenstelling tot de andere verplichte thema’s, in het jaar 1999 nog geen indicatormeting voor het thema ziekenhuisinfecties diende te gebeuren. Vanaf januari 2000 zal gestart worden met de indicatormeting van POWI. Hiervoor werden eind 1999 door het TZHH de noodzakelijke contacten gelegd met diverse diensten, ten einde op de meest efficiënte manier gegevens i.v.m. POWI in de orthopedie te kunnen verzamelen (operatiekwartier, informaticadienst, alle verpleegeenheden met orthopedische patiënten en de raadpleging).
In 2003 verschijnt een nieuw Vlaams kwaliteitsdecreet dat een integratie was van de afzonderlijke kwaliteitsdecreten van de sectoren gezondheidszorg en welzijnszorg en trad in voege in 2004. Er moest in 2004 niet meer geregistreerd worden zoals bepaald door het vorige kwaliteitsdecreet van 1997. Wel moest elk ziekenhuis een evaluatie maken van het gevoerde beleid in de periode 1997-2004 en moest er vervolgens in 2004 nagedacht worden over het te voeren kwaliteitsbeleid in 2005.
Er werd beslist om in het UZA de registraties van POWI en infecties op INZO in 2004 verder te zetten.
Aangezien er in het kader van “Navigator” (figuur 7) ook al gegevens vanaf 2004 voor het domein “infecties” werden verzameld (MRSA, verbruik handalcohol) konden deze indicatoren ook gebruikt worden voor het kwaliteitsdecreet. Navigator was een indicatorsysteem van het Centrum voor Ziekenhuis- en Verplegingswetenschap voor de continue bewaking en verbetering van de klinische en organisatorische kwaliteit van de zorg.
Figuur 7

Puntprevalentieonderzoeken
In 1991 werd een eerste puntprevalentiestudie uitgevoerd naar urineweginfecties. Deze werd in 2004 herhaald. De belangrijkste bevinding was de gestegen prevalentie t.o.v. 1991. Het was de aanleiding om het belang van het toepassen van het gesloten urinedrainagesysteem nogmaals bij de verpleegkundigen te benadrukken (zie verder).
Op initiatief van het hoofd labo microbiologie werd samen met het TZHH in 1996 een puntprevalentieonderzoek uitgevoerd, waarbij alle patiënten op een bepaalde dag werden gescreend op aanwezigheid van VRE. In totaal werden 335 patiënten gescreend. Van de gehospitaliseerde patiënten bleek 11,8% VRE-positief, terwijl 24,1% van de dialyse-patiënten VRE-positief was. Hoewel de prevalentie bij dialyse-patiënten hoger was, was het verschil met de gehospitaliseerde patiënten niet significant. Uit het onderzoek bleek ook de invloed van het type monster: uit 16,9 % van de stoelgangstalen werd VRE geïsoleerd tegenover 5,7% uit rectale wissers. Het hoge percentage VRE-positieve patiënten kon mogelijks verklaard worden door de gebruikte aanrijkingstechniek in het labo (16).
In juni 2010 namen we deel aan een pilootstudie van een Europese puntprevalentiestudie van zorggerelateerde infecties en antibioticagebruik in acute ziekenhuizen (Point Prevalence Survey on Health Care Associated infections and Antibiotic Use). Deze studie op initiatief van het European Centre for Disease Prevention and Control (ECDC) werd in België georganiseerd door de Belgian Antibiotic Policy Coordination Committee (BAPCOC) met wetenschappelijke ondersteuning van het WIV. Uit deze pilootstudie bleek o.a. de proportie van patiënten met een nosocomiale infectie in het UZA op INZO hoger was in vergelijking met de andere deelnemende Belgische en Europese ziekenhuizen. Hetzelfde gold voor de proportie patiënten op INZO met antibioticatherapie. Pneumonie werd als belangrijkste diagnose van nosocomiale infectie in het UZA (vnl. op INZO) geregistreerd. In 2011 zullen we vervolgens ingaan op de uitnodiging van de overheid om vrijwillig deel te nemen aan het Belgische luik van deze PPS die dan bedoeld is voor alle ziekenhuizen in België.
Surveillances van CLABSI en CAUTI
In het kader van de Magnet®-accreditatie (zie verder) werd in 2013 beslist om de kathetergeassocieerde urineweginfecties (CAUTI) en de centrale-lijngeassocieerde bloedstroominfecties (CLABSI) als “nurse sensitive quality indicators” op te volgen.
Hiervoor was het noodzakelijk dat er gegevens beschikbaar waren per patiënt over het type katheter en tevens over de verblijfsduur ervan. Medio 2013 slaagt ICT erin om aan het TZHH maandelijks een Excel-lijst te bezorgen met deze noodzakelijke gegevens die we konden koppelen aan de administratieve en microbiologische gegevens van de patiënten in de database van ziekenhuishygiëne. Vervolgens werden op de geselecteerde patiënten de CDC-definities van CAUTI en CLABSI toegepast om zo de incidentie per 1000 katheterdagen en per afdeling te bepalen. Op die manier konden maandelijks de incidenties van CLABSI en CAUTI aan de verpleegeenheden bezorgd worden via het BI-center (zie verder) met grafische en numerieke weergave van de resultaten. Tenslotte dienden verbeteracties uitgevoerd te worden door de verpleegeenheden wanneer de incidentie gestegen was boven de streefwaarde.
In 2017 wordt een CAUTI-bundel ontwikkeld en wordt het “HOUDINI”-principe ingevoerd, een tool om te bepalen of de aanwezigheid van een blaaskatheter nog geïndiceerd is.
In 2019 wordt ziekenhuisbreed actie gevoerd om Foleysonden correct te fixeren (figuur 8). De “Grip Lok® Foley catheter securement device” wordt vanaf dan het standaard fixatiesysteem. Daarnaast voerden de referentieverpleegkundigen audits uit om na te gaan of Foleysonden correct werden gefixeerd.
Figuur 8

Op vlak van CLABSI werd eveneens een katheterbundel ontwikkeld en werd net als voor de blaaskatheters een uniform katheterfixatiesysteem ingevoerd, aangezien verschillende types in gebruik waren met soms foutief gebruik. Om het aantal centrale lijnen te verminderen zal daarnaast door de anesthesisten meer geopteerd worden voor Midlinekatheters.
IV. De surveillances georganiseerd door Sciensano
a) WHOCARE
Zoals hoger al werd aangehaald werd met de jaren de inbreng van ICT steeds belangrijker. Naast de al vermelde surveillances zullen ook de surveillances georganiseerd door het toenmalige Instituut voor Hygiëne en Epidemiologie (IHE) (daarna Wetenschappelijk Instituut voor Volksgezondheid (WIV) en vervolgens Sciensano) de nodige computerinfrastructuur vereisen. In 1992 kregen we in dit verband een programma “Whocare” aangeboden door het IHE, aangeleverd op een floppydisk en waarvoor een PC met 505 RAM en 6 MB vrije ruimte (!) noodzakelijk was en met DOS als besturingssysteem. Het programma was bedoeld voor de surveillance van POWI en SEP (figuren 9 en 10).
Figuur 9

Figuur 10

Het gebruik van deze software werd in 1999 gestopt.
b) NSIH (Nationale Surveillance van Infecties in de Hospitalen)
Vanaf 2000 zullen we deelnemen aan de surveillances van SEP en POWI via programma’s van het WIV zelf waarbij ondertussen het Windows-besturingssysteem werd gebruikt (NSIHwin). De export van data anno 2000 gebeurde echter nog via een diskette die naar het WIV via de post werd opgestuurd (figuur 11). Nadien zal ook het versturen via email van de geëxporteerde gegevens mogelijk worden.
Figuur 11

Voor de surveillance van MRSA werd vanaf 1994 tot 2007 nog gebruik gemaakt van papieren registratieformulieren die per post naar het WIV dienden opgestuurd te worden. In 2006 zal het WIV starten met het uitwerken van een web-based versie voor deelname aan de MRSA-surveillance waardoor online gegevens konden geleverd worden en feedback kon opgevraagd worden (NSIHweb). Deze online-registratie zal vervolgens ook mogelijk worden voor SEP, handhygiëne, Clostridium difficile (CDIF) en antibiotica.
In 2012 werd het SEP-protocol aangepast (vnl. met betrekking tot huidcontaminanten) zodat de data van de periode vóór 2012 echter niet meer correct konden worden vergeleken.
De infectieregistratie op intensieve zorgen (INZO) volgens het HELICS-protocol (SEP, PNEU, UWI) gebeurde door de artsen zelf. Vanaf 1997 tot 2000 werd hiervoor nog de verouderde versie van het programma onder DOS gebruikt (SINERGIZ). De papieren registratieformulieren werden wekelijks door het TZHH verzameld om vervolgens de data in het registratieprogramma in te brengen. Daarna werd overgeschakeld naar “Helics.Win.Net” (Access). In 2001 werd echter voor het inputten van de registratiegegevens de hoge workload voor het secretariaat van INZO aangeklaagd dat ondertussen het inputten van de data van het TZHH had overgenomen. Mede door de gebruiksonvriendelijkheid van de software van het WIV werd de deelname aan deze surveillance uiteindelijk stopgezet. In het kader van de JCI-accreditatie (zie verder) werd nog wel de surveillance van ventilator geassocieerde pneumonieën (VAP) op INZO verdergezet.
Vanaf 2011 wordt ook de CPE-surveillance aan de reeks surveillances toegevoegd. Het doorsturen van de data was echter omslachtig waarbij eerst een specifiek document via de site van het WIV moest gedownload en vervolgens per post opgestuurd worden. Het opsturen van surveillancegegevens per post werd trouwens ook voor andere MDRO toegepast gehanteerd, om nadien versturing via email mogelijk te maken. De CPE-surveillance via een meldingsformulier wordt in 2016 gestopt en toegevoegd aan de surveillance van resistente bacteriën.
In 2017 is er opnieuw een wijziging, namelijk de surveillance via HD4DP (healthdata for data providers) voor SEP en CDIF; nadien zal ook het ingeven van de kwaliteitsindicatoren mogelijk worden. Voor de verwerking van de eigen resultaten maakten/maken we enerzijds gebruik van de download in Healthdata en anderzijds van de analyses van de ingegeven data via healthstat.be.
Terwijl de deelname aan hoger vermelde surveillances aanvankelijk vrijblijvend was, zal de MRSA-surveillance met het KB van 2006 verplicht worden. Met het KB van 2007 werd naast registratie van MRSA ook registratie van CDIF een verplichte component. Dit moest nog steeds aangevuld worden met minstens één protocol naar keuze uit volgende lijst: pneumonieën en bacteriemieën in de eenheden intensieve zorg, septicemieën over het hele ziekenhuis, infecties van de operatiewonden en multiresistente Enterobacteriaceae. In 2015 werd de verplichting aangepast: verplichte registratie van MRSA en SEP, Gram-negatieve MDRO, kwaliteitsindicatoren en keuze uit een aanvullend protocol: CDIF, VRE, POWI, pneumonieën en bacteriemieën in de eenheden intensieve zorg.
c) Epinet™
Naast de surveillances van zorginfecties namen we in 2003 ook deel aan de registratie van accidentele bloedcontacten Hierbij werd gebruik gemaakt van een programma aangeboden door het WIV, een “light” versie van het Amerikaanse Epinet™. Hoewel de deelname vrijblijvend was, drong de voorzitter van het CZH er in 2003 op aan om aan het proefproject deel te nemen. We zouden bovendien in 2006-2007 ook deelnemen aan een onderrapporteringsstudie waardoor aangetoond werd dat (op nationaal niveau) door meer dan 45% van het personeel een prikaccident niet werd gemeld. De nationale surveillance van accidentele bloedcontacten zal echter in 2008 door het WIV worden stopgezet zodat de meest recente Belgische gegevens dateren van 2007. Specifiek met betrekking tot het operatiekwartier publiceerden we samen met het WIV een artikel in Noso-info waarbij de nationale surveillancegegevens besproken werden samen met de preventieve maatregelen(17).
d) EARS-BE/EARSnet
Vanaf 2009 start de deelname aan de dataverzameling voor België (EARS-BE) in het kader van de The European antimicrobial resistance surveillance network (EARSnet). Hierbij werden de labogegevens verzameld van een reeks bacteriën waaronder Klebsiella pneumoniae, Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa, Enterococcus faecium, Enterococcus faecalis en Streptococcus pneumoniae. Mede door de coronacrisis werd deze surveillance omwille van de werkbelasting vanaf 2021 stopgezet.
V. Neo-Kiss
Voor de surveillance op de Neonatal Intensive Care Unit (NICU) had de afdeling geopteerd voor “Neo-Kiss”. Het is een surveillancesysteem van nosocomiale infecties bij neonaten met een geboortegewicht < 1500 g (VLBWI = very low birth weight infants), dat ontwikkeld werd in Duitsland (KISS = Krankenhaus-Infektions-Surveillance-System).
Deelname aan deze surveillance laat toe om zich te benchmarken met de Duitse database met gegevens van meer dan 200 NICUs. In 2012 hadden in België 11 van de 19 NICUs deelgenomen. Bij de surveillance werden de nosocomiale infectie m.b.t. centrale en perifere katheters en bij invasieve (intubatie) en niet-invasieve beademing (langs de neus, zonder intubatie) geregistreerd.
Gegevens met betrekking tot SEP werden door het TZHH aan de verantwoordelijke arts van de NICU maandelijks doorgegeven en werden door het TZHH eveneens gebruikt voor de nationale surveillance (NSIH), mits aanpassing aan het NSIH-protocol (18).
VI. Surveillance van de handhygiëne
a) Nationale campagnes handhygiëne
Vanaf 2005 zal het TZHH telkens ingaan op uitnodigingen om deel te nemen aan de nationale campagnes handhygiëne. Hierbij werden data verzameld m.b.t. gebruik van handalcohol, de basisvereisten handhygiëne en de compliantie met de indicaties voor handhygiëne. De gegevens werden online ingebracht in het programma van het WIV (NSIHWeb2), waarna het WIV de data van de deelnemende ziekenhuizen verwerkte. In 2022 zou de migratie van NSIHweb2 naar Healthdata gerealiseerd worden. Daarnaast werden tijdens de voorbije jaren in het kader van de campagnes ook hulpmiddelen voor de bevordering handhygiëne door de overheid aangeboden zoals badges “U bent in goeie handen”, een e-learning module, UV-lamp voor controle handtechniek, enz. Tenslotte waren er ook thematische campagnes zoals patient empowerment of de preventie van kathetergerelateerde bloedbaaninfecties
b) Manifest schone handen
Tijdens observaties uitgevoerd midden 2005 in het kader van de nationale campagne handhygiëne, werd geconstateerd dat slechts 35 % van de verpleegkundigen volledig compliant was met de basishouding (juwelenvrije handen). Daarom werd in het najaar van 2005 door de directeur patiëntenzorg en het TZHH een nieuwe verbeteractie i.v.m. handhygiëne gelanceerd. Een “manifest” werd ter ondertekening voorgelegd aan alle medewerkers van het verpleegkundig departement (figuur 12). De bedoeling was om hiermee de betrokkenheid met de handhygiëne te verhogen. Verder werd de beschikbaarheid van handalcohol geoptimaliseerd en werd aan de verpleegeenheden feedback gegeven over het verbruik van handalcohol en de observaties van de basishouding en compliantie. Aansluitend op deze verbeteractie richtte de hoofdgeneesheer een schrijven naar alle artsen waarin gesteld werd dat de richtlijnen voor het verpleegkundig departement eveneens van toepassing zijn voor de artsen.
De combinatie van de nationale campagne handhygiëne en een eigen campagne om de compliantie van de handhygiëne te verhogen, resulteerde in een toename van het verbruik van handalcohol en een verbetering van de basishouding. Hoewel er geen causaal verband met de campagne kon worden aangetoond, werd wel een daling van de nosocomiale incidentie van MRSA vastgesteld ((PDF) Manifest «schone handen» in het (researchgate.net)).
Figuur 12: Manifest “schone handen” in het UZA

c) Responsabilisation du patient
Nog vóór de thematische campagne over patient empowerment (zie hoger), hadden we in 2014 al onderzoek gedaan rond dit thema, waarbij patiënten rechtstreeks werden bevraagd. Hieruit bleek o.a. dat ongeveer de helft (49%) van de respondenten vond dat patiënten wel betrokken zouden moeten worden in het aanspreken van gezondheidsmedewerkers op handhygiëne. Nochtans zou slechts 24% van de respondenten een arts rechtstreeks aanspreken indien deze geen handhygiëne zou toepassen. Ook andere gezondheidswerkers zouden in dat geval slechts door 33,5 % van de respondenten worden aangesproken(19). Daarnaast werden er patiënten geïnterviewd om de patiëntenfolder over handhygiëne te evalueren; hieruit bleek dat de folder onvoldoende gekend was (20).
d) SATURN (Impact of Specific Antibiotic Therapies on the prevalence of hUman host ResistaNt bacteria)
Door het hoofd INZO wordt in 2011 het initiatief genomen om deel te nemen aan het Europese Saturn-project. Hierbij was het de bedoeling om het effect van twee verschillende antibioticastrategieën te bepalen (cycling en mixing) op de prevalentie van resistente bacteriën in 10 INZO’s. Voor dit project diende men ook data te verzamelen m.b.t. handhygiëne op INZO. Voor het UZA zorgde het TZHH voor deze noodzakelijke data.
e) VIP2 (Vlaams Indicatorenproject voor Patiënten en Professionals)
Tenslotte was er ook nog het VIP², dat de kwaliteit van zorg in de Vlaamse algemene ziekenhuizen meet. De deelname aan VIP2 betekende echter een belangrijke tijdsinvestering (4 dagen), aangezien o.a. de basisvereisten van handhygiëne ook in enkele andere ziekenhuizen moesten geobserveerd worden en waarvan de resultaten in NSIHweb moesten ingebracht worden. Vanaf en mede als gevolg van de coronacrisis werd de deelname aan dit project stopgezet.
f) Semmelweis handhygiënescanner
De Semmelweis handhygiënescanner (figuur 13) is een mobiel toestel om op interactieve wijze de handhygiëne te trainen. Binnen enkele seconden ziet de gezondheidswerker of de handen goed ontsmet zijn en waar de slecht ontsmette zones op de handen zich precies bevinden.
In 2017 stelde het TZHH voor om deze handhygiënescanner aan te kopen.
In samenwerking met ICT werd gezorgd voor een realtime koppeling met de personeelsgegevens. De scanner werd de voorbije jaren al op diverse afdelingen gestationeerd waardoor het personeel de kans kreeg om gedurende enkele dagen de handhygiëne te trainen.
Figuur 13

VII. ICT en de communicatie van hygiënemaatregelen
Door o.a. de nationale handhygiënecampagnes vanaf 2005 werden diverse acties ondernomen om hygiënemaatregelen te communiceren. Hierbij werd gebruik gemaakt van digitale schermen in bijvoorbeeld de inkomhal of op de afdelingen zelf, zodat bezoekers en patiënten gewezen worden op het belang van handhygiëne.
Deze vorm van communicatie bleek ook tijdens de coronacrisis een handig middel om noodzakelijke maatregelen snel te communiceren en zo nodig aan te passen.
Bij de communicatie van surveillanceresultaten naar de UZA-medewerkers komt ook ICT om de hoek kijken. Sinds enkele jaren zijn een hele reeks indicatoren zoals ook deze van ziekenhuishygiëne via een zogenaamd BI-center (Business intelligence Center) op elke PC te raadplegen (figuur 14). Het betreft o.a. de maandelijkse resultaten per afdeling en voor heel het ziekenhuis van de CAUTI, CLABSI, POWI en de handhygiënecompliance.
Figure 14

VIII. ICT en het beheersen van zorginfecties
Tot en met 2001 werd gebruik gemaakt van MRSA-stickers (figuur 15) die in het patiëntendossier werden gekleefd zodat men bij heropname onmiddellijk de nodige maatregelen kon nemen. Deze aanpak bleek in de praktijk echter niet te werken. Bovendien werden de stickers soms op de buitenkant van het toen nog papieren patiëntendossier gekleefd waardoor de vertrouwelijkheid van medische gegevens in het gedrang kon komen.
Figuur 15

Vandaar dat in 2002 met de dienst informatica en de dienst patiëntenadministratie overeengekomen werd om een automatisch meldingssysteem te creëren.
Concreet betekende dit dat elke nieuwe MRSA-patiënt door het TZHH aan de patiëntenadministratie via mail werd doorgegeven die de MRSA-lijst aanvulde. Deze namenlijst werd gekoppeld aan een bepaalde boodschap, die zo neutraal mogelijk werd gehouden om te vermijden dat dit tot enige stigmatisatie aanleiding zou geven. De boodschap die er op het scherm verscheen voor de persoon die de patiënt inschreef was:«Opvolging door ziekenhuishygiëne. Ziekenhuishygiënisten verwittigen (na de kantooruren: wacht directie patiëntenzorg)».
Na de kantooruren werd de wacht directie patiëntenzorg verwittigd door diegene die de patiënt inschreef. De boodschap «opvolging door ziekenhuishygiëne» betekende dat de betrokken patiënt diende opgenomen te worden in een eenpersoonskamer om medische redenen en dat nog diezelfde dag tot screening moest worden overgegaan (20).
Deze manier van werken resulteerde echter in tal van telefoons van consultaties en afdelingen die meer info wensten over de te nemen maatregelen. Doordat bovendien meerdere manuele acties hiervoor moesten gebeuren, zoals het aanvullen van de namenlijst door de patiëntenadministratie, bleek na verloop van tijd deze werkwijze niet accuraat.
Na enkele jaren werd daarom een nieuw alarmeringssysteem ontwikkeld op basis van codes die door het TZHH in het ziekenhuisinformatiesysteem (ZIS) werden ingebracht. Het betekende dat naast MRSA vanaf dan ook voor andere MDRO met name VRE en CPE en sinds 2020 ook voor COVID-positieve patiënten een alarmering kon worden gemaakt. Elke code werd vanaf dan gekoppeld aan de te nemen maatregelen die bij consultatie of opname moet worden genomen en de maatregelen werden bovendien bij inschrijving automatisch afgeprint. Om de status van de patiënt te visualiseren werden specifieke iconen ontwikkeld die in het elektronisch dossier en op de digitale patiëntenoverzichten werden weergegeven (figuur 16). Het aantal telefonische oproepen kon in vergelijking met het oorspronkelijke alarmeringssysteem drastisch verminderd worden.
Om met MRSA-gekoloniseerde patiënten bij opname vroegtijdig te detecteren werd in 2014 besloten om het verpleegkundig assessment in het elektronisch medisch dossier aan te passen. Er werd namelijk voorzien dat wanneer een patiënt veearts of veehouder was of verbleven had in de voorbije zes maanden in een andere zorginstelling er een pop-up verscheen om de patiënt te screenen op MRSA. Later zal ook de screening voor CPE hieraan toegevoegd worden. Met de invoering van het vernieuwde EPD in 2021 werd de pop-up vervangen door een automatisch order om de patiënt te screenen.
Figuur 16

IX. De impact van de milleniumbom
Met het naderen van het jaar 2000 namen de geruchten over de dreigende millenniumbom toe. Volgens doemdenkers zouden computers en computergestuurde apparaten het laten afweten. De kern van het probleem was dat de data maar met 2 cijfers in programma’s werden geschreven (1999 was bijvoorbeeld 99), waarbij het jaar 2000 als 1900 zou worden geïnterpreteerd. Al in 1998 werd een projectgroep in het UZA opgestart om deze problematiek aan te pakken. Ook voor de werking van ziekenhuishygiëne kon er een mogelijke impact zijn aangezien heel wat surveillancegegevens werden ingebracht in een Access-programma van Microsoft, waarbij niet alle versies compatibel met het jaar 2000 bleken te zijn. De overstap naar andere versies was dan ook nodig en er werd aangeraden om zoveel mogelijk 4 cijfers voor de jaartallen te gebruiken.
X. Endemieën, Outbreaks (epidemieën) en pandemieën
In de voorbije 30 jaar werd het UZA, wellicht zoals ook andere ziekenhuizen, niet gespaard van de nodige grote of kleine outbreaks (infecties met een epidemische verheffing). De oorzaak van een outbreak kon echter niet altijd achterhaald worden wat soms tot de nodige frustraties leidde. Van een aantal outbreaks, die verder worden beschreven, kon wel een duidelijke of vermoedelijke oorzaak worden aangewezen of kon de outbreak beheerst worden door het nemen van een reeks maatregelen
a) Legionellose
Legionellose was sinds 1988 endemisch in het UZA. Het jaar 1989 werd bij de start van de activiteiten van de ziekenhuishygiënisten beheerst door een verhoogde incidentie van Legionella pneumophila-pneumonieën. We kregen al snel de opdracht om dagelijks een aantal mogelijke risicofactoren voor deze pneumonieën bij INZO-patiënten te registreren, maar er kon geen duidelijke risicofactor worden aangewezen. Dankzij connecties tussen het ITG en de CDC werd besloten om medewerkers van de CDC in te schakelen om de oorzaak van de pneumonieën te achterhalen. Het zou resulteren in een intensieve zoektocht naar risicofactoren waarbij de CDC-medewerkers enkel met potlood en papier minutieus de stapels kaften van patiëntendossiers, microfilms en radiologische foto’s doorworstelden. Het was een eerste beeld van de manier waarop epidemiologisch onderzoek werd bedreven, namelijk met veel geduld en op heel punctuele wijze. De oorzaak bleek uiteindelijk een te lage watertemperatuur en waarbij het wassen aan de wastafel een belangrijke risicofactor was voor legionellose voor immuungecompromitteerde patiënten; het wassen in bed daarentegen bleek een beschermende factor (22, 23,24,25).
b) Burkholderia cepacia
In 1995 werden we gealarmeerd door het labo microbiologie dat er meerdere bloedkweken positief waren met Burkholderia cepacia. De betrokken patiënten waren allemaal opgenomen op de afdeling cardiologie en hadden allemaal een hartkatheterisatie ondergaan. Hierdoor rees het vermoeden dat de oorzaak wellicht in het kathlab moest gezocht worden, waardoor besloten werd de activiteiten op deze afdeling tijdelijk te stoppen. Een epidemiologisch onderzoek werd gestart waarbij uiteindelijk het verdunnen van heparine-oplossing op de afdeling cardiologie als risicofactor kon worden aangewezen. De heparine werd namelijk verdund met een 5%-glucoseoplossing die uit een infuuszak van 1 liter werd opgetrokken; deze infuuszak werd bewaard op kamertemperatuur gedurende de hele dag in de buurt van een wastafel in de verpleegpost. De glucose-oplossing bevatte dezelfde stam van B. cepacia waarmee in totaal zeven patiënten werden geïnfecteerd. Deze bevindingen zouden resulteren in een dringende extra vergadering van hoofdverpleegkundigen om te wijzen op het gevaar van dergelijke praktijken en de noodzaak om gebruik te maken van unidosis steriele oplossingen voor het maken van intraveneuze verdunningen. Deze outbreak maakte meteen ook duidelijk dat de bron slechts per toeval kan ontdekt worden: de bewuste infuuszak op de afdeling was al in de afvalzak beland, maar kon toch nog net voor de afvalophaling gerecupereerd worden en bevatte nog voldoende vloeistof voor microbiologische analyse (26).
c) Een collectieve voedselinfectie op een verpleegafdeling
In oktober 1999 meldde de hoofdverpleegkundige van een verpleegafdeling aan het TZHH een collectieve gastro-enteritis bij het personeel. De infectie was vermoedelijk ontstaan na het eten van tiramisu, die door één van de verpleegkundigen was bereid op basis van rauwe eieren. In totaal werden tien personeelsleden en acht familieleden van het personeelslid ziek. Bij twee personeelsleden was de coprokultuur positief voor Salmonella species. Rauwe eieren waren toen een frequente oorzaak van gemelde voedselinfecties in Vlaanderen. Deze collectieve voedselinfectie toonde nogmaals het risico van rauwe eieren in gerechten aan. De eieren voor bereiding van de tiramisu waren gekocht in een supermarkt, waar ze op kamertemperatuur werden bewaard (27).
d) Een mini-outbreak met MRSA op de NICU
Hoewel het voorkomen van MRSA op de NICU zeldzaam was, werd toch in 2002 een mini-outbreak met nosocomiale MRSA van hetzelfde clonale type bij drie patiënten waargenomen. De meest waarschijnlijke manier waarop MRSA op de afdeling was geïntroduceerd was via een MRSA-positieve moeder. Deze laatste bleek als gezondheidswerker in een woonzorgcentrum te werken (28).
e) Kakkerlakken
Outbreakonderzoek beperkte zich niet alleen tot de klassieke micro-organismen. Ook ongediertebestrijding kreeg onze aandacht en zou pas in 2019 aan de preventiedienst en een externe firma in ongediertebestrijding worden toegewezen. Een atypische outbreak in dit verband deed zich voor in 2003-2004 waarbij een patiënt kakkerlakken via zijn bagage in het ziekenhuis binnenbracht. Hierdoor werden telkens kakkerlakken waargenomen op meerdere afdelingen waar deze patiënt werd gehospitaliseerd (29).
f) Vancomycine-resistente enterokokken (VRE)
Een VRE-outbreak op hematologie (2014-2015) kon beheerst worden door een combinatie van maatregelen. De VRE-screening werd uitgebreid door screening van feces en rectale bemonsteringen bij alle patiënten die op de epidemische afdeling waren opgenomen. Daarnaast werd screening op VRE-dragerschap uitgevoerd om op die manier onbekende gekoloniseerde patiënten op te sporen bij opname en dit op wekelijkse basis en bij ontslag. Tenslotte werden de VRE-positieve patiënten in contactisolatie geplaatst, werden de patiëntenkamers dagelijks gereinigd en ontsmet en werden de VRE-positieve patiënten dagelijks gewassen met disposable antimicrobiële washandjes (30,31).
g) VIM-Pseudomonas aeruginosa
Tijdens de COVID-pandemie werd in 2021 op de cohorte-COVID-INZO in het UZA een belangrijke stijging van de incidentie van VIM-Pseudomonas aeruginosa geregistreerd. Na analyse van het antibioticumverbruik kon een verhoogd gebruik van antibiotica alvast worden uitgesloten. Het cohorteren van COVID-19-patiënten waarbij niet altijd de standaardvoorzorgsmaatregelen correct werden gerespecteerd, zoals het tijdig wisselen van handschoenen, kon mogelijks de oorzaak geweest zijn van kruisbesmettingen. Door het invoeren van een aantal bijkomende voorzorgsmaatregelen kon het aantal infecties/kolonisaties beheerst worden. In de praktijk betekende dit dat een extra isolatiejas werd gedragen bovenop de persoonlijke beschermingsmiddelen (PBM) en die gewisseld moest worden tussen elke patiënt en werd het belang van het tijdig wisselen van handschoenen benadrukt. Aangezien er een verband kon gelegd worden met VIM-Pseudomonas aeruginosa geïsoleerd uit de sifons op INZO, werd een gebruik van leidingwater zo veel mogelijk vermeden en werd overgegaan tot het dagelijks desinfecteren van de sifons. Het probleem van wastafels was in 2005 op INZO ook al eens de oorzaak van een verhoogde incidentie van Sphingomonas paucimobilis (32).
XI. Voorbereiden op “hoogst besmettelijke ziekten” en/of opkomende infectieziekten (“New Emerging Infectious Diseases”)
Hemorragische koorts-virussen (HKV) kwamen in december 2000 onder de aandacht toen bekend werd dat het militair ziekenhuis (Neder-over-Heembeek), dat zich eerder had geëngageerd om in te staan voor de nodige voorzieningen inzake transport, opname en behandeling van patiënten besmet met HKV, zich vanaf 1 februari 2000 had teruggetrokken. Het ITG, dat ook partner was van deze overeenkomst, vestigde de aandacht van de minister hierop. In het kader van de bestaande UZA/ITG-overeenkomst vroeg de toenmalige afgevaardigd bestuurder van het UZA om een procedure uit te werken die de opvang van patiënten met HKV regelt. Een multidisciplinaire werkgroep werd vervolgens opgericht met de ziekenhuishygiënisten, ITG en spoedopname (SPO). Het zou resulteren in een reeks actiepunten zoals het opstellen van een procedure met betrekking tot de labo-diagnostiek in het ITG van de vier HKV (Lassavirus, Margburgvirus, Ebolavirus en Congo-Krimvirus). Bedoeling was om tot een snelle diagnose (binnen de 48 tot 78 uur) te komen. Tevens werd een procedure van voorzorgsmaatregelen opgesteld door het TZHH bij de behandeling van met HKV-besmette labostalen en de voorzorgsmaatregelen bij de verzorging van patiënten met (vermoeden van) HKV.
Een epidemie in 2014 in enkele Afrikaanse landen bracht de HKV opnieuw onder de aandacht. Procedures werden verfijnd zoals de aan- en uitkleedprocedure van PBM. Aanvankelijk was voorzien dat dergelijke patiënten op de verpleegafdeling tropische geneeskunde (of indien nodig op INZO) zouden opgenomen worden, maar uiteindelijk werd een aparte “high level isolation unit” (HLIU) voorzien (fysiek los van het ziekenhuis) (figuur 17) voor de opvang van deze patiënten onder supervisie van een rampencoördinator. In 2014 was er op ministerieel niveau nog steeds discussie over een “ebolacentrum” in het militair hospitaal van Neder-Over-Heembeek. Dat belette niet dat door de medische component van defensie vanaf dan periodieke oefeningen met het UZA werden georganiseerd, waarbij gesimuleerd werd dat een besmette patiënt vanuit Zaventem via een ambulance van defensie naar de HLIU van het UZA werd overgebracht (figuur 18).
Figuur 17

Figuur 18

Naast Ebola kwamen ook voorheen onbekende infectieziekten onder de aandacht door de problematiek van SARS in 2003 en later MERS-CoV in 2012 en influenza A H7/N9 in 2013. Specifieke richtlijnen voor de medewerkers werden opgesteld zoals case definitions en de te nemen voorzorgsmaatregelen.
Naar aanleiding van SARS in 2003 werd er beslist om een werkgroep op te richten om de SARS-richtlijnen in het UZA te uniformiseren. In deze werkgroep waren afgevaardigden van de betrokken diensten vertegenwoordigd (INZO, SPO, tropische geneeskunde). Er werden tevens drie mobiele units aan de dienst SPO voorzien voor opvang van (vermoedelijke) SARS-patiënten.
In 2009 werd gevreesd voor een pandemie met de Mexicaanse griep of varkensgriep (H1N1) (figuur 19). Tijdens de zomer 2009 werden door het CZH nodige afspraken voor een influenza –rampenplan gemaakt, zoals triage patiënten en personeel, hospitalisatie patiënten, inzetbaarheid personeel, vaccinatie en communicatie. Vooral het aspect communicatie was een actiepunt voor het TZHH. De infectie bleek meestal vrij mild te verlopen zodat de pandemie door de WHO in de zomer van 2010 werd afgeblazen. Het aanvankelijke UZA-pandemieplan was al in oktober 2009 niet meer helemaal van toepassing, zoals de aankoop van een temperatuurscanner.
Figuur 19 (Source : De Morgen, 27 avril 2009)

In oktober 2011 werd melding gemaakt van een “panresistente” kiem bij een patiënt opgenomen op INZO die vanuit een ziekenhuis in Kreta was getransfereerd. Deze patiënt bleek drager te zijn van een multiresistente kiem die nadien algemeen bekend zou worden als een carbapenemase producerende enterobacteriacea (CPE). Reeds eerder waren er nationale richtlijnen rondgestuurd waarin gesteld werd dat patiënten, getransfereerd vanuit een ziekenhuis uit een risicogebied, bij opname moest geïsoleerd en gescreend worden. Gezien de impact van de epidemie in het Maaslandziekenhuis Rotterdam werd er niet gewacht op de officiële teksten van de overheid en werden de bestaande richtlijnen van het WIV nog eens verspreid. Daarnaast werden acties ondernomen op het vlak van schoonmaak, handhygiëne, isolatiebeleid…
Ook bleken sommige hoofdverpleegkundigen alert te reageren bij opname van patiënten die vanuit een Aziatisch ziekenhuis werden opgenomen (screening, isolatie). Omwille van haalbaarheid werd er beslist om de risicogroepen af te bakenen (bv. afkomstig uit Azië en/of Midden-Oosten) en werd bepaald hoe deze risicogroepen via de SPO het gemakkelijkst konden getraceerd worden. Het jaarlijks aantal nieuwe patiënten met deze CPE zou in 2017 oplopen tot 44 (nosocomiaal en niet-nosocomiaal).
In 2018 voegde de WHO een nieuwe ziekte toe aan de lijst met de meest gevreesde ziekten “disease X”, die niet bestond maar wel zou kunnen komen…
XII. Nieuwe werkwijzen en medische hulpmiddelen
Het TZHH heeft in de loop van de jaren een belangrijke rol gespeeld in het aanpassen van procedures en het invoeren van nieuwe medische hulpmiddelen waarvan in de literatuur aangetoond was dat ze een belangrijke bijdrage konden zijn ter preventie van infecties. Enkele hiervan worden verder beschreven.
a) Handhygiëne
De meest belangrijke aanpassing in de eindeloze reeks van procedures was wellicht deze van handhygiëne. Al in 1994 publiceerde het TZHH een artikel waarin de voordelen van handalcohol uitgebreid werden beschreven (33). Het gebruik van handalcohol vond dan ook al vrij vroeg ingang in het UZA als standaard voor de handhygiëne (34). Nochtans werd echter in die periode door de Hoge Gezondheidsraad (HGR) nog het klassieke wassen van de handen met water en zeep gepromoot (figuur 20).
Figuur 20 (Brochure Campagne Handhygiëne (1991) gebaseerd op de richtlijnen van de HGR).
De overschakeling van “home made” handalcohol naar commerciële handalcohol
Aanvankelijk werd gebruik gemaakt van huisgemaakte handalcohol die in de centrale apotheek van het ziekenhuis werd gemaakt. Voor de relatief kleine ronde recipiënten van 250 ml werden zelfs op maat gemaakte metalen inox houders vervaardigd (figuur 21).
Figuur 21

Eind 2007 werd beslist om over te schakelen naar commerciële producten die tevens voldeden aan respectievelijk de norm EN1500 voor de hygiënische en EN12791 voor de chirurgische handontsmetting. Dit betekende ook dat de kleine metalen houders allemaal moesten vervangen worden aangezien de recipiënten van de commerciële handalcohol niet pasten in de kleine metalen houders. Een gigantische klus voor de technische dienst om in alle patiëntenkamers, consultatieruimtes, toiletten, enz. de nieuwe houders te plaatsen en/of de oude te vervangen. Er werd van de gelegenheid gebruik gemaakt om de houders te hangen in de patiëntenkamers i.p.v. op de gang naast de deur van de patiëntenkamer. In 2001 werd er immers door de bevoegde brandweerdienst op gewezen dat de gangen als evacuatiewegen moesten beschouwd worden en dus vrij moesten zijn van bijkomende obstakels die mogelijks een gevaar konden betekenen.
Chirurgische handontsmetting
Pas in 2003 zal een proefproject met de chirurgische handalcohol (ter vervanging van het wassen van de handen met ontsmettende zeep) op het OK gestart worden. Sommigen chirurgen drongen er echter op aan om de ontsmettende zepen te behouden omdat de huid met alcohol te droog zou worden. Het CZH adviseerde toen om de ontsmettende zepen enkel te voorzien voor chirurgen die inderdaad huidproblemen met handalcohol zouden ondervinden. De nadelige effecten van handalcohol waren mogelijks te wijten aan het niet volledig laten opdrogen van de alcohol alvorens men de handschoenen aantrok (35).
Alcoholvrije handrubs
Aangezien bij een beperkte groep van personeelsleden met chronische huidproblemen de handalcohol te irriterend werkte, bleven huidproblemen soms aanslepen waardoor ook de compliance van de handhygiëne daalde. Men heeft dan ook de neiging om geen handdesinfectie meer toe te passen. Sporadisch kwamen deze personeelsleden naar het TZHH of arbeidsgeneeskunde om een dergelijk huidprobleem te melden. In 2010 werd de markt verkend voor een alcoholvrij alternatief in samenspraak met de arbeidsgeneeskundige dienst. De daarop volgende jaren zal het aanbod aan alcoholvrije producten regelmatig wijzigen doordat bepaalde merken hetzij van de markt verdwenen, hetzij dat nieuwe producten verschenen (36).
b) Naaldloze connectoren (NC)
In april 2000 werd er een dienstnota verspreid over het gebruik van NC in het UZA. Er werd toen gesteld dat een dergelijke naaldloos systeem niet meer mocht gebruikt worden. NC waren namelijk zonder goedkeuring door de materialencommissie op een afdeling in gebruik waarbij deze foutief werden gebruikt. Er werd beslist dat slechts na grondige evaluatie het CZH in de toekomst eventueel een gunstig advies zou verlenen om NC te gebruiken. In de loop van de volgende jaren werd door verpleegkundigen regelmatig de vraag gesteld wanneer deze NC opnieuw in gebruik mochten worden genomen.
Het invoeren van deze NC zou echter nog jaren worden uitgesteld ondanks de druk vanuit verschillende firma’s en het gebruik ervan in andere ziekenhuizen. Het bleek uiteindelijk een goede beslissing toen rapporten verschenen vanaf 2006 over een verhoogde incidentie van bloedstroominfecties bij gebruik van bepaalde types NC (met positieve vloeistofverplaatsing). Pas in 2017 werd er na positief advies vanuit het CZH beslist door de werkgroep katheterzorg om de NC ziekenhuisbreed in te voeren. NC zouden vanaf 2018 standaard gebruikt worden bij alle perifere en centraal veneuze katheters, nadat duidelijk was aan welke technische kenmerken deze moesten voldoen (zoals doorzichtig, neutrale vloeistofverplaatsing en split septum).
c) Dekolonisatie en opvolging MRSA
In 2009 werden In het UZA verschillende stappen genomen om de resultaten van de MRSA-dekolonisatie te verbeteren en beter op te volgen. De overstap van het enkel dekoloniseren van gekende positieve sites naar een volledig schema (neus, keel- en huidbehandeling) gaf een eerste verbetering, waarbij het percentage patiënten met een eerste negatieve controlescreening verhoogde na een eerste dekolonisatiebehandeling. De invoering van een elektronisch dekolonisatieschema had verder een beperkte verbetering van het dekolonisatie-effect tot gevolg. De invoering van antibacteriële washandjes en shampoocaps verhoogde nogmaals het succespercentage van de dekolonisatiebehandeling (37).
d) Aanpassing van isolatieprocedures
In 1999 werd de isolatieprocedure aangepast aan de Amerikaanse richtlijnen (1996), aangezien bleek dat de UZA-procedure onvolledig was op gebied van indicaties en onduidelijk in gebruik (bv. isolatie noodzakelijk indien multiresistente kiem in urine?). In de oorspronkelijke procedure werd de onvolledigheid omzeild door naast de vermelde indicaties te vermelden “andere situaties in overleg met de ziekenhuishygiënist”. Ook het gebruik van het ontsmettingsmiddel voor de terminale ontsmetting werd herzien en werd het empirisch gebruik van voorzorgsmaatregelen en de definitie van een multiresistente kiem verduidelijkt. De term “bronisolatie” zal vanaf dan ook ingang vinden.
In 2007 wordt de isolatiekaart opnieuw aangepast: pictogrammen worden toegevoegd en de mogelijke voorzorgsmaatregelen die men kan aanduiden worden uitgebreid. Vooraf ingevulde voorbeeldkaarten in functie van de wijze van overdracht en/of micro-organisme zouden later via het documentbeheerssysteem (“DocBase”) en een zogenaamde “infectietool” kunnen geraadpleegd worden. De infectietool was het resultaat van intense samenwerking vanaf 2016 tussen de preventiedienst en ziekenhuishygiëne om te komen tot een digitaal programma op het UZA-intranet waar per kiem de nodige info over transmissiewegen, voorzorgsmaatregelen, enz. werd gegeven; tevens werden linken toegevoegd naar interne procedures in DocBase.
Met het invoeren van een vernieuwd EPD in 2021 werd het invullen van een isolatiekaart gedigitaliseerd waarbij de voorzorgsmaatregelen automatisch werden ingevuld in functie van de geselecteerde indicatie.
Isolatie van ESBL-positieve patiënten
Alle ESBL-positieve patiënten werden tot eind 2006 verpleegd in een eenpersoonskamer met toepassing van de isolatievoorschriften, waarbij er geen onderscheid werd gemaakt tussen risico- en niet-risicodiensten. Medio 2007 werden door de Belgian Infection Control Society (BICS) de ESBL-richtlijnen voorgesteld. Het CZH besliste om vanaf 01/07/2007 de ESBL-positieve patiënten enkel nog te isoleren op risicodiensten (INZO, onco-hematologie, NICU, pneumologie/tropische geneeskunde en nefrologie). Verder werd op de risicodiensten een onderscheid gemaakt tussen Escherichia coli ESBL en non-E. coli ESBL wat betreft al of niet isoleren. Dit betekende dat ook op risicodiensten patiënten met E. coli ESBL niet meer werden geïsoleerd, tenzij er sprake was van een cluster met deze bacterie (op basis van antibiogram). Na vier jaar werd het gewijzigde isolatiebeleid geëvalueerd. Hieruit bleek dat na vier jaar er 150 ESBL-positieve patiënten conform het nieuwe isolatiebeleid niet meer geïsoleerd moesten worden op niet-risicodiensten. Bovendien had het gewijzigde isolatiebeleid geen stijging van de nosocomiale incidentie tot gevolg van E. coli ESBL en Klebsiella species ESBL op niet-risicodiensten. Mogelijks was er bovendien een overschatting van het aantal nosocomiale gevallen aangezien er bij opname niet systematisch werd gescreend op aanwezigheid van ESBL-positieve bacteriën (38,39,40).
Vanaf 2015 werden door toepassing van nieuwe EUCAST-richtlijnen (The European Committee on Antimicrobial Susceptibility Testing) door het labo geen ESBL-positieve stalen meer gerapporteerd. Als gevolg hiervan werd de isolatieprocedure aangepast waarbij enkel nog het antibiogram als criterium gold om patiënten al of niet te isoleren (conform de definitie van MDRO van Sciensano). Voor deze MDRO werd verder dezelfde strategie als voor ESBL’s gehanteerd, namelijk het maken van een onderscheid tussen risico- en niet-risicodiensten en E. coli en non-E. coli.
Protectieve (of omgekeerde) isolatie
De CDC had reeds in 1983 deze vorm van isolatie niet meer opgenomen in de “Guideline for Isolation Precautions in Hospitals”. De efficiëntie van protectieve isolatie ter preventie van infecties was immers noch voor transplantatiepatiënten, noch voor patiënten met granulocytopenie bewezen. Nochtans werden orgaantransplantatiepatiënten in het UZA postoperatief verder in protectieve isolatie geplaatst. In 2012 wordt aan de lokale raad voor transplantatie gevraagd om de procedure van isolatie van transplantatiepatiënten te herbekijken en zo nodig aan te passen. De belangrijkste aanpassing zou uiteindelijk het beperken van de duur van isolatie in de post-transplantatiefase (tot max. 1 week) worden.
Op de afdeling hematologie verbleven zwaar immuungecompromitteerde patiënten tot 2000 in piepkleine, met glas afgeschermde ruimten, waar net genoeg plaats was voor een luchtfilter, bed, tafel en toiletstoel. Dergelijke kamers werden ten onrechte ook wel “steriele kamers” genoemd. Ook beschikte de afdeling hematologie nog over een aparte keuken op de afdeling om zgn. “steriele” voeding klaar te maken; het belette niet dat in het midden van de jaren 80 er patiënten gecontamineerd werden met Aspergillus die vrij kwam bij het openen van voorverpakte peper. Tot 1998 werd bovendien al het linnen, bedpannen/urinaals en plastic eetgerei gesteriliseerd voor beenmergtransplantatie (BMT)patiënten. Er waren hiervoor nochtans geen wetenschappelijke argumenten, zodat na meerdere overlegmomenten met de afdeling hematologie deze werkwijze uiteindelijk werd afgeschaft. In de besprekingen werden ook de nadelige aspecten van de gassterilisatie met ethyleenoxide (EO) betrokken.
In 2000 werd de afdeling hematologie gerenoveerd en kwam er een definitief einde aan het concept van de kleine “steriele” kamers waar patiënten soms langdurig in moesten verblijven. Er werd namelijk geopteerd voor twee luchtfilters (HEPA-filters, klasse H13 met een filtercapaciteit van > 99,95%) in het plafond van elke patiëntenkamer. Als bijkomende maatregel werd een luchtgradiënt toegepast om binnendringen van stofdeeltjes en micro-organismen op de afdeling te vermijden. Er werd namelijk een lichte overdruk gecreëerd in de kamer ten opzichte van de gang van de verpleegafdeling. Eenzelfde overdruk is er ten opzichte van de gang en de rest van het ziekenhuis. De hele verpleegafdeling is door middel van een sas van de rest van het ziekenhuis afgesloten. Door deze verbouwingen werd het aantal “steriele” kamers van zes naar 20 uitgebreid (op een totaal van 29 bedden) (41).
e) Preoperatieve voorbereiding van de patiënt
Reeds in 1999 adviseerde de CDC om voor het preoperatief ontharen een tondeuse (clipper) te gebruiken i.p.v. een klassiek scheermesje. Een andere aanbeveling betrof het preoperatief wassen/douchen van de patiënt met een ontsmettende zeep, hoewel deze laatste aanpak controversieel was. Deze CDC-aanbevelingen vonden op advies van het TZHH vanaf 2001 ook ingang in het UZA.
In combinatie met deze voorbereidingen werd specifiek in de cardiochirurgie een minder invasieve operatieve techniek gebruikt, waarbij de vena saphena endoscopisch werd gepreleveerd (VasoView®-techniek). Het resulteerde in een significante daling van de incidentie van POWI van 2,95% in 1992 naar 0,43% in 2001 (42).
f) Afwasbare toetsenborden en aanwijsapparaten
Bij de opstart van een elektronisch patiëntendossier op INZO en NICU (Patiënt Data Management Systeem (PDMS)/Metavision) in 2007, werd er gekozen om de standaard afwasbare toetsenborden te gebruiken die al in het UZA in gebruik waren aan de PDMS- bedsite werkstations. Deze toetsenborden hadden echter het nadeel dat er zich nog altijd vuil onder de toetsen kon ophopen. Om te reinigen moest het toetsenbord bovendien uit de patiëntenbox verwijderd worden, wat bij isolaties voor problemen zorgde. Als gevolg hiervan werden de toetsenborden niet regelmatig gereinigd. In 2003 start daarom het TZHH met ICT een project om een beter alternatief te zoeken. Verschillende toetsenborden werden getest in de praktijk waarbij een perfect glad oppervlak en een goede aanslag van de toetsen de belangrijkste kwaliteitseisen waren. Uiteindelijk werd een toetsenbord weerhouden dat aan deze eisen voldeed (figuur 22).
Figuur 22

In 2006 werden de toer- en zorgkarren op de verpleegafdelingen met een laptop uitgerust. Naar aanleiding hiervan adviseerde het TZHH om afwasbare en ontsmetbare toetsenborden en aanwijsapparaten (muis, trackball,…) te gebruiken indien deze bedoeld waren om te gebruiken in een klinische omgeving (bedsite, in het OK, op patiëntenkamers, toerkarren en verzorgingskarren). Aanvankelijk werd een afwasbare plastic cover gebruikt om over het toetsenbord te bevestigen, maar deze aanpak bleek uiteindelijk niet te voldoen (43).
g) Nieuwe afnametechniek van hemoculturen
Het TZHH volgde de contaminatiegraad van hemoculturen vanaf 1989 maandelijks op.
In 1999 werd een nieuwe procedure van kracht om de contaminatiegraad te verkleinen. Zo werden de afdelingen voorzien van gesteriliseerde hemocultuurkapjes zodat deze niet meer hoefden ontsmet te worden vóór gebruik. Tevens werd een zogenaamde «Safety-Lok™ Blood Collection Set» (figuur 23) in gebruik genomen waarbij de vleugelnaald reeds voorzien was met een voorgemonteerde adapter; hierdoor werd manipulatie met de handen beperkt. Bijscholingssessies over de preventie van contaminatie van hemoculturen werden georganiseerd.
Figuur 23
De gevoerde acties hadden een gunstige invloed op de contaminatiegraad van de hemoculturen. In vergelijking met 1998 was er in 2000 een statistisch significante daling van de contaminatiegraad.
h) Endoscopen
In 1995 wordt een inventaris gemaakt van de soorten endoscopen (flexibele en rigide) die in het ziekenhuis in gebruik waren. Tevens werd nagegaan op welke manier deze werden gereinigd en gedesinfecteerd. Het was nog de periode van manuele reiniging en ontsmetting waarbij elke medische discipline hiervoor een ander desinfectiemiddel gebruikte (alcohol 70%, Sekusept Forte 2 à 3%, Gigasept 2%, Aletex-28 en HAC 1%). Er bleek ook geen uniformiteit qua contacttijden. Qua technische voorzieningen was er enkel extra ventilatie aanwezig bij het uitvoeren van bronchoscopies om de glutaaraldehydedampen af te zuigen.
In 1996 beschikken de betrokken diensten over de richtlijnen hoe de endoscopen moesten gereinigd en gedesinfecteerd worden na gebruik. Er moesten echter nog tal van problemen opgelost worden zoals investeren in extra endoscopen zodat de contacttijden konden gerespecteerd worden, het installeren van ventilatievoorzieningen op OK en gastro-enterologie om de glutaaraldehydedampen af te zuigen en het installeren van een “waterpost” voor steriel water om de scopen na desinfectie te spoelen.
Gezien de problematiek en de hoge kostprijs van steriel water wordt in 1997 een werkgroep opgericht om tot een oplossing te komen. Het zal resulteren in de aankoop van automatische was- en desinfectie-automaten voor de gastro-enterologie in 1997. Nadat hiermee de nodige ervaring werd opgedaan worden in 1999 ook voor de desinfectie van bronchoscopen automatische was- en desinfectieautomaten in gebruik genomen.
Voor de andere scopen (bv. transoesophagale echocardiografiesonden) zal eerst nog verder manuele high-level-desinfectie met glutaaraldehyde toegepast worden om uiteindelijk over te schakelen naar chloordioxide (ClO2). Ook voor de desinfectie van rectale en vaginale endoscopen zal uiteindelijk in 2018 naar chloordioxide worden overgeschakeld omdat herhaalde sterilisatiebeurten de probes beschadigden. Gezien de hoge kostprijs van de ClO2-desinfectie wordt in 2020 gestart met een goedkoper en tegelijk gebruiksvriendelijker en efficiënt alternatief d.m.v. ontsmettende doekjes.
i) Gesloten urinedrainagesysteem
Het invoeren van het gesloten urinedrainagesysteem stuitte in 1999 op kritiek. De urinezakken met kraantje die aan het bed van de patiënt moesten leeggemaakt worden, werd als “onhygiënisch” ervaren. De aankoop van het nieuwe type was echter onvoorbereid gebeurd. Er deden zich na de overschakeling diverse problemen voor zoals lekkage, onnauwkeurige gradatie, geurhinder… Hierdoor werd tijdelijk terug overgeschakeld op de oorspronkelijke urinecollectors. Slechts na bespreking in de Medische Materialen Commissie (MMC) en na diverse types uitgetest te hebben, was uiteindelijk het gesloten urinedrainagesysteem een feit.
j) Katheterslot (lock) en flushen van katheters met fysiologisch water
In de werkgroep katheterzorg werd in 2016 beslist om katheters voortaan enkel nog te spoelen en te locken met fysiologisch water. Het vervangen van heparine-oplossing door fysiologisch water werd door de verpleegkundigen positief onthaald. Heparine moest immers niet meer verdund worden en er werden bovendien kant-en-klare spuiten met fysiologisch water voorzien om te gebruiken voor het flushen van katheters en voor een katheterslot.
k) Dieren in het ziekenhuis
In een advies van 2005 oordeelde de Hoge Gezondheidsraad (HGR) dat de toegang van gezelschapsdieren tot acute verzorgingsinstellingen moest worden verboden behoudens gemotiveerd tegenadvies van het CZH. Naar aanleiding hiervan werd door het CZH van het UZA in 2005 een procedure goedgekeurd i.v.m. het toelaten van assistentiehonden in het ziekenhuis. De procedure bleek bij de onthaalmedewerkers echter onvoldoende gekend zodat de dieren de toegang werd geweigerd. Ook was een speciaal hondenhok voorzien aan de SPO om deze honden tijdelijk onder te brengen, maar zou uiteindelijk hiervoor nooit gebruikt worden. Een werkgroep werd in 2008 opgericht om de procedure te herwerken en dit zou resulteren in een aangepaste procedure in 2009. Er werd o.a. een brochure gemaakt die aan het onthaal van het ziekenhuis ter beschikking was (figuur 24).
Figuur 24

Op 01/01/2014 trad het gewijzigde Vlaams Decreet houdende de toegankelijkheid van publieke plaatsen voor personen met een assistentiehond, in werking. Naar aanleiding hiervan werd de minister van volksgezondheid door de voorzitter van de Belgian Assistance Dog Federation (BADF) gewezen op het feit dat assistentiehonden nog altijd uit heel veel ziekenhuizen werden geweerd. In het UZA was ondertussen in het voorjaar van 2014 de procedure herwerkt. Het doel van deze gewijzigde procedure was om afspraken vast te leggen betreffende de locaties in het UZA waar wel of niet assistentiehonden toegelaten werden en onder welke voorwaarden, en deze conform de vigerende regelgeving en adviezen hieromtrent.
l) Heater-cooler
In 2006 werd naar aanleiding van een audit door het TZHH een reeks hygiënische aanbevelingen geformuleerd met betrekking tot het gebruik van een heater-cooler.
Wanneer de HGR in 2016 een advies formuleert i.v.m. de preventie van risico’s op besmetting met Mycobacterium chimaera bij het gebruik van een heater-cooler werd ook de procedure in het UZA geëvalueerd. In een werkgroep met het hoofd van de perfusionisten, preventie-adviseur, technische dienst, TZHH,… werd in 2017 een nieuwe versie van de procedure uitgewerkt. Zo werd bepaald op welke manier en in functie van het type toestel het water moest worden behandeld en werden afspraken gemaakt qua staalnames voor kweek van M. chimaera.
XIII. In onbruik geraakte materialen en methoden
a) Formaldehyde-desinfectie (Aseptor® en Formovap®)
De Aseptor® was een gesloten kamer voor formaldehyde-desinfectie (figuur 25) en bevond zich in de gang tussen het operatiekwartier en INZO. Het was een geautomatiseerd proces dat niet kon onderbroken worden, tenzij bij onvoldoende formaldehydeconcentratie. Een cyclus duurde 10 uur waarvoor 500 ml formol en 140 ml ammoniak (voor neutralisatie) werd gebruikt. Na de cyclus dienden de toestellen/meubilair manueel gereinigd te worden wegens neerslag van ammoniak op metalen delen (wit poeder). De Aseptor® werd gebruikt voor het ontsmetten van beademingstoestellen, verwarmingsmatrassen en scopietoestellen van het OK. Voor de afdeling hematologie ging het over boeken, tijdschriften en PC’s van patiënten, terwijl het voor INZO en de NICU over al het materiaal ging van een patiëntenbox waarin een patiënt onder isolatievoorschriften werd verpleegd (bed, nachtkastje, apparatuur, couveuses, enz.).
Er werden geen controles d.m.v. bio-indicatoren uitgevoerd, zodanig dat men geen zicht had op het ontsmettend vermogen van de Aseptor®.
Figuur 25 (Bron: British Journal of Anesthesiae, 1972; Volume 44, n°8: 7)

In 1987 was al besloten om een gelijkaardige ontsmetting van patiëntenkamers, operatiezalen, enz. d.m.v. de zogenaamde Formovap® niet meer toe te passen. Er werd toen gesteld dat het ontsmetten van ruimtes waarin patiënten onder isolatievoorschriften werden verpleegd (bv. TBC) op een veilige manier kon gebeuren door het schrobben met een antiseptische oplossing (bv. Velicin® forte).
In de literatuur werd beschreven dat toxische residuen van formaldehyde konden voorkomen op incubators, beademingstoestellen, enz. met daarbij een carcinogeen vermogen. Formaldehyde zou bovendien bepaalde materialen aantasten (plastic, rubber). De Aseptor® stond tevens op de lijst van zgn. “unnötige und unsinnige Desinfektionsmanahmen (Daschner F. Hygiene, Müllreduktion und Umweltschutz in Kliniken, 1988).
Op advies van het team TZHH werd beslist om de Aseptor® af te schaffen en alternatieve methodes van desinfectie toe te passen zoals beschreven door de CDC in 1994.
b) Clinitronbedden
Bij de start van het team ZHH in 1989 was er in het UZA een Clinitronbed (figuur 26) in gebruik ter preventie van decubitus. Het principe berustte op het kunstmatig maken van drijfzand (microsferen), waarop de patiënt bleef liggen. De methode was zeer duur en kon slechts verkregen worden via een speciale procedure. Er waren bovendien ook hygiënische bedenkingen: zo moest het bed «stand by» op de uitleencentrale op een constante temperatuur van 24°C gehouden worden en bij een aanvraag werd het bed opgewarmd tot 36°C. Deze opwarmingsperiode duurde ongeveer 6 uren. Het loodzware bed diende vervolgens naar de aanvragende verpleegeenheid gebracht te worden. De microsferen waren bedekt met een filterlaken dat na gebruik of bij bevuiling moest vervangen worden. Mogelijke lichaamsvochten konden in de microsferen terechtkomen; bovendien moest het gebruik van zepen en zalven vermeden worden omdat deze de microsferen konden aantasten. Omdat kruisinfecties door gebruik van een dergelijk bed niet konden uitgesloten worden werd op advies van het TZHH het gebruik van het bed stopgezet.
Figuur 26: (Bron: Elkin et al., 2000).
c) Gassterilisatie en hersterilisatie of hergebruik van medische hulpmiddelen
De gassterilisatie d.m.v. ethyleenoxide (EO) werd in het UZA vanaf 1998 omwille van milieu- en arbeidshygiënische redenen gestopt en werd uitbesteed aan de externe firma Griffith. Het volume aan materialen dat aan de firma Griffith voor gassterilisatie werd aangeboden, was in het najaar van 1999 al drastisch gereduceerd. Er werd toen door de centrale sterilisatieafdeling (CSA) een lijst opgemaakt van artikelen die voor gassterilisatie in aanmerking kwamen (265 verschillende artikelen). Op basis van registraties bleek dat toch nog 17 % van het aangeboden materiaal niet voor hergebruik geschikt was; het grootste gedeelte hiervan betrof materiaal dat niet was gebruikt (bv. niet-gebruikte disposables waarvan de verpakking geopend werd). Qua terminologie werd er een duidelijk onderscheid gemaakt tussen “hergebruik” en “hersterilisatie”: in het eerste geval betrof het materialen die bij de patiënt werden gebruikt; in het tweede geval ging het om materialen die gedesteriliseerd werden zonder dat ze effectief bij de patiënt werden gebruikt (geopende verpakking of verstreken vervaldatum).
Anno 2022 zullen in het UZA enkel nog de EFO-katheters van het kathlab (voor elektrofysiologisch onderzoek van het hart) hergebruikt worden. Naar aanleiding van het KB van 12 mei 2021 tot uitvoering van de wet van 22 december 2020 betreffende de medische hulpmiddelen (BS 19.05.2021) werd samen met het UZ Leuven en het Jessa Ziekenhuis Hasselt een consultancybureau ingeschakeld om de praktische en financiële aspecten van reprocessing van deze katheters te analyseren. Er werd uiteindelijk beslist om reprocessing verder uit te voeren. Hiervoor moet de kwaliteit van de hergebruikte katheters door een onafhankelijk notified body beoordeeld worden of aan de wettelijke vereisten wordt voldaan. Verder moet reprocessing aan het Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten (FAGG) worden doorgegeven, moet het dossier goedgekeurd worden en tenslotte moet de CSA ook nog volgens een ISO- norm functioneren.
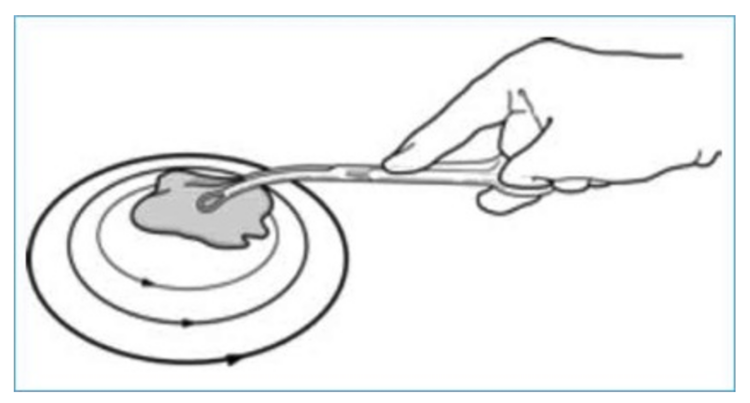
d) Circulair ontsmetten
Een aantal studies waren suggestief dat de huidontsmetting (bv. vóór het plaatsen van een katheter) d.m.v.de zogenaamde “back-and-forth”- techniek (heen- en weergaande frictie) effectiever was dan het circulair ontsmetten in het reduceren van de huidflora (figuren 27 en 28). Op basis hiervan werd besloten om het circulair ontsmetten als techniek te verlaten en de “back-and-forth”- techniek vanaf 2019 te promoten via lessen aan de referentieverpleegkundigen ziekenhuishygiëne.
Figures 27 et 28 (Source : Lynne Kerrigan, 2018)

e) Zonekledij
In 2002 werd de zonekledij in het UZA geïnventariseerd, waarbij groene zonekledij werd gebruikt op het operatiekwartier en de transplantafdeling, blauwe op de NICU en gele op stomatologie, kathlab, reproductieve geneeskunde en gastro-enterologie Er werden in het verleden door het CZH echter slechts twee zoneprocedures goedgekeurd, namelijk deze voor het operatiekwartier (inclusief bevallingskwartier) en de NICU.
Er konden echter geen wetenschappelijke argumenten aangehaald worden ter preventie van ziekenhuisinfecties om zonekledij in andere “zones” te verantwoorden. Bovendien was er toen ook nog de sterk gestegen linnenkost (40 à 50% stijging). Er werd daarom beslist om de zonekledij (met uitzondering van de zonekledij op het operatiekwartier en de NICU) af te schaffen.
XIV. Afvalbeleid
Uit een rondvraag in 1997 bleek er geen uniformiteit op de afdelingen te bestaan wat het verzamelen van risicohoudend medisch afval betrof. Niet alle diensten beschikten bovendien over de juiste containers. Daarnaast werden tot 1996 naaldencontainers met schroefdeksel gebruikt die aanleiding gaven tot prikaccidenten. Het was toen niet uitzonderlijk dat er in zorginstellingen gerecupereerde plastic flessen of bidons werden gebruikt om scherpe voorwerpen in te verzamelen, zoals blijkt uit een illustratie uit 1989 (figuur 29) (2).
Ook eigen onderzoek bij zelfstandige thuisverpleegkundigen toonde aan dat in die periode onvoldoende veiligheidsmaatregelen ter preventie van prikongevallen werden genomen (44,45).
Vanaf 1996 worden in het UZA specifieke naaldencontainers in gebruik genomen met klepdeksel en uitsparingen in het bovenvlak om naalden af te draaien of te haken.
Figuur 29 (Bron: Herman Vanvinckenroye, ITG (1989).

De wijze waarop met medisch afval moest worden omgegaan was tot 1997 in Vlaanderen onduidelijk. Er was al wel een afvalstoffendecreet van 1981 waarin medisch afval als een bijzondere afvalstof werd geclassificeerd, maar de uitvoeringsbesluiten zouden pas in 1997 en 2003 verschijnen (46,47,48).
XV. Visitaties en accreditaties
a) Toezicht door het Vlaams Agentschap Zorg en Gezondheid

In de jaren negentig was er jaarlijks een aangekondigd bezoek van de adjunct-inspecteur van de Gezondheidsinspectie Antwerpen om in het kader van het “Toezicht op de milieuvergunning en de profylaxe van besmettelijke ziekten”, de activiteiten te overlopen. Hierbij werd telkens schriftelijk een overzicht bezorgd van de activiteiten en realisaties op vlak van ziekenhuishygiëne. Het Vlaams agentschap Zorg en Gezondheid neemt op 9 juli 2008 ten aanzien van het bij KB van 2007 opgelegde ‘register van beslissingen’ het standpunt in dat – ten einde de adviezen van het CZH kracht bij te zetten – alle beslissingen moesten worden geacteerd in een register volgens een standaard sjabloon. Vervolgens moesten ze als advies overgemaakt worden aan de directeur en beschikbaar zijn voor inzage door de arts-inspecteur van het Agentschap.
De Vlaamse overheid besliste om vanaf juli 2012 het toezicht op de algemene ziekenhuizen anders te organiseren. Zo werden twee vormen van toezicht onderscheiden, namelijk het systeem- en het nalevingstoezicht. Het systeemtoezicht bestaat uit een ziekenhuisbrede doorlichting op het vlak van structuren, processen, kwaliteitssystemen, interne controle… (het vroegere visitatiemodel dus). Bij het nalevingstoezicht gebeurt het toezicht gespreid in de tijd, is onaangekondigd en is opgebouwd rond zorgtrajecten. Ziekenhuizen die zich willen laten accrediteren hoeven het arbeidsintensieve visitatiemodel niet meer te doorlopen. Dit betekende concreet dat ook het UZA – dat in een accreditatietraject (JCI (Joint Commission International)) was ingestapt of de accreditatie al behaalde – systematisch werd vrijgesteld van het systeemtoezicht. Ook het UZA was eind 2012 gestart met de voorbereidingsfase voor de JCI-accreditatie (49).
b) JCI-accreditatie

Na de voorbereidingsfase werd het UZA in 2015 als een van de eerste ziekenhuizen in België geaccrediteerd door JCI. In 2018 behaalde het UZA voor de tweede keer het kwaliteitslabel van JCI.
De inbreng van het TZHH was hierbij cruciaal. Een belangrijk hoofdstuk in de JCI-standaard is immers “Prevention and Control of Infections” (PCI). Het hoofdstuk bevat 11 normen met per norm aan aantal meetbare elementen (in totaal een 80-tal meetbare elementen). Onder andere heel wat beleidsdocumenten dienden opgemaakt te worden en procedures moesten geüpdatet worden om te voldoen aan de vereiste kwaliteitseisen.
C) Magnet®-erkenning

In 2017 behaalde het UZA de Magnet®-erkenning voor de erkenning van de kwaliteit van verpleegkundige zorgen. Hiervoor worden gegevens verzameld met betrekking tot de incidenties van CLABSI en CAUTI en worden deze om de drie maanden geregistreerd in een centrale databank van kwaliteitsindicatoren (“National database of nursing quality indicators”) van de American Nurse Association. De CLABSI en CAUTI, zoals ook de valincidenten, decubitus… zijn immers in deze Magnet®-erkenning als belangrijke verpleegkundige kwaliteitsindicatoren opgenomen (“nurse sensitive quality indicators”).
XVI. Voorzorgsmaatregelen bij verbouwingen
Tijdens verbouwingen in 1998 en 1999 op de NICU, werden al een aantal voorzorgsmaatregelen toegepast zoals het compartimenteren van de zones waar verbouwingen bezig waren. Tevens werd ervaring opgedaan met mobiele luchtfilters. Zo werd tijdens de verbouwingen op de NICU het effect nagegaan op de aerogene emissie van Aspergillus spp. in de nabijheid van patiënten. Het in gebruik nemen van de mobiele luchtfilters veroorzaakte op alle locaties, behalve in het administratief gedeelte en medium care, een significante daling van de Aspergillus spp. emissie (50,51,52,53).
In 2002 werd beslist dat immuungecompromitteerde patiënten, ter preventie van aspergillose, een FFP2-masker moesten dragen in zones met verbouwingen. Het jaar daarop werden de voorzorgsmaatregelen uitgebreid waarbij ook aan externe firma’s richtlijnen bij verbouwingen werden gegeven.
Wanneer in 2006 blijkt dat de gemaakte afspraken niet altijd worden nagekomen wordt extra info gegeven aan artsen, de hoofdverpleegkundigen en de dienst intern patiëntentransport.
In 2012 werd een nieuwe procedure van kracht waarbij op voorstel van het hoofd technische dienst, een risico-index bij verbouwingen werd bepaald op basis van de aard van de aanwezige patiënten en de aard van de werken. Naar aanleiding hiervan werden de hoofdverpleegkundigen nogmaals geïnstrueerd over de te nemen voorzorgsmaatregelen tijdens verbouwingswerken. Ook werden bijkomende maatregelen beslist zoals een test met een kleefmat die het stof beter vasthield en aankoop van een extra mobiele luchtfilter, gezien de veelheid aan verbouwingswerken. Vanaf dan zal o.a. standaard een checklist aan de werven worden uitgehangen die tijdens controles door het TZHH en de technische dienst kan gehanteerd worden (figuur 30).
Figuur 30: checklist, plakmat en luchtdecontaminatietoestel aan een werf

XVII. Tegen de stroom in
Het aanpassen van nieuwe werkwijzen stuitte soms op kritiek vanuit het werkveld. Zie hiervoor bijvoorbeeld de eerder beschreven introductie van de chirurgische handontsmetting.
a) De “witte OK-schort”
Een ander voorbeeld hiervan was het voorstel vanuit het CZH in 2010 om de (witte) overjas af te schaffen die artsen en verpleegkundigen van het OK moesten dragen wanneer ze het operatiekwartier verlieten. Het was/is in de meeste ziekenhuizen de gewoonte dat de medewerkers van het operatiekwartier (OK) een witte overjas aantrekken over hun OK-kledij wanneer zij het OK verlaten tijdens bijvoorbeeld de lunchpauze. Ook in het UZA gold tot 2010 deze huisregel. In heel het ziekenhuis werden daarom in 1995 op strategische plaatsen posters (figuur 31) gehangen met vermelding van de richtlijnen in verband met OK-zonekledij. Er werd namelijk vanuit gegaan dat buiten het OK de (groene) OK-kledij kon besmet geraken. Verschillende pogingen om deze af te schaffen stuitten telkens op weerstand van het OK zelf. Uiteindelijk kon in 2010 een consensus worden bereikt om deze witte overjassen af te schaffen. Op ziekenhuishygiënisch vlak leek het voor sommige medewerkers een stap achteruit, maar de beslissing werd genomen op basis van literatuuronderzoek. Er zijn immers geen studies die aantonen dat het dragen van een dergelijke overjas bij het verlaten van het OK bijdraagt tot de preventie van zorginfecties. De enige argumenten pro overjas die werden aangehaald, hadden betrekking op “lokale discipline en esthetiek”, maar die werden door het CZH als onvoldoende beschouwd om nog langer deze procedure te handhaven. Het afschaffen van de overjas was bovendien kostenbesparend en de OK-medewerkers zelf konden tijdens de hete julimaand van 2010 opgelucht (of verlucht?) naar het restaurant! De schorten werden tenslotte dikwijls te lang gedragen alvorens te laten wassen. In dit verband kan ook nog de uitspraak van het toenmalige hoofd van het labo microbiologie begin de jaren ‘90 vermeld worden dat men door het dragen van een dergelijke schort de kiemen op de werkkledij ging “cultiveren” door de warmte …
Naast de afschaffing van de witte schorten werden ook de plastic schoenhoezen afgeschaft die men als niet-OK-medewerker moest aantrekken bij het betreden van het operatiekwartier. Deze werkwijze gaf trouwens meer nadelen dan voordelen, aangezien de handen bij het aantrekken van de hoezen ernstig konden gecontamineerd worden.
Figuur 31
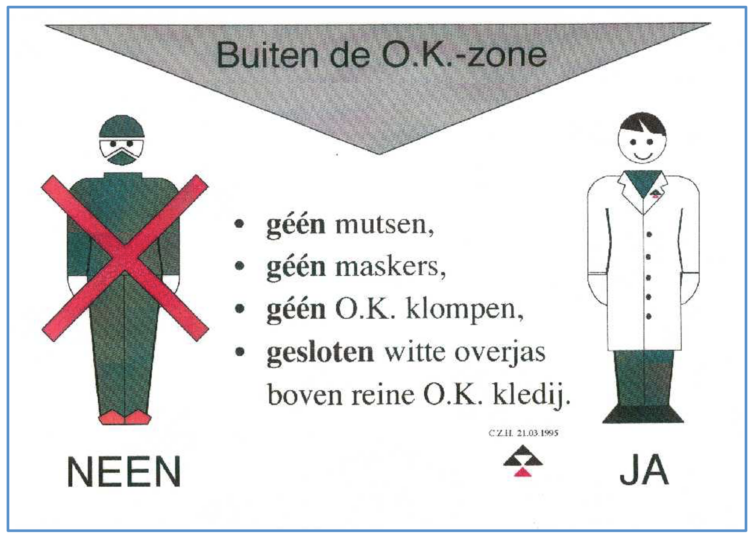
b) Met het patiëntenbed tot in de operatiezaal
Ook vanuit de overheid kwam er soms kritiek. Zo werd de werkwijze door de visitatiecommissie van de Vlaamse Overheid in 2007 aangeklaagd dat met het patiëntenbed tot in de operatiezaal werd gereden. Volgens de auditor diende men in de kritieke zone het aantal micro-organismen in de lucht steeds zo laag mogelijk te houden. Het manipuleren van matrassen en beddengoed kon onmogelijk stroken met een dergelijke richtlijn. De auditor adviseerde om samen met het comité ziekenhuishygiëne deze werkwijze kritisch te herevalueren. De richtlijnen dienden dan opgenomen te worden in het reglement van inwendige orde. In een reactie op de tekortkoming vermeld in het auditverslag, werden door het TZHH de nodige argumenten (o.a. refererend naar de Nederlandse WIP en de Britse His-Working Party) aangehaald om de werkwijze te behouden. Wel werd de werkwijze verfijnd door te specificeren dat het bedlinnen moet verschoond zijn op de dag van de operatie.
c) Verzorgend wassen (“Wassen zonder water”)
Genuanceerder was de invoering van het concept verzorgend wassen in 2009. Hoewel deze werkwijze zowel op vlak van infectiepreventie als tijdsinvestering een voordeel was, was toch nog bijna 16% van de verpleegkundigen hiervan geen voorstander, terwijl bijna door 27% van de verpleegkundigen de maatregel ervaren werd alsof patiënten onvoldoende werden gewassen in vergelijking met water en zeep (54,55).
Naar aanleiding van publicaties over de gunstige impact op de incidentie van o.a. bloedstroominfecties werd in 2014 beslist om op INZO over te schakelen naar antimicrobiële washandjes met chloorhexidine 2% (CHX) als actief ingrediënt. Deze overschakeling kaderde in het zogenaamde Europese R-GNOSIS-project (Ecological Effects of Decolonisation Strategies in Intensive Care).
Figuur 32

Vanaf de periode dat IZ-patiënten dagelijks met CHX 2%-washandjes werden gewassen, werd een opmerkelijke daling van de incidentie van CLABSI en MDRO op IZ waargenomen. Deze daling was wellicht multifactorieel aangezien enerzijds het leidingwater als potentiële bron van pathogenen werd uitgeschakeld en anderzijds bijkomende maatregelen ter preventie van CLABSI werden ingevoerd (56,57).
d) Geen handschoenen bij MDRO
Een casus in het UZA in juni 2005 illustreerde dat het belang van handschoenen als middel ter preventie van overdracht van micro-organismen ter discussie kon gesteld worden. Naar aanleiding van een MRSA-epidemie op een verpleegafdeling werd nl. besloten om bij contact met de MRSA-patiënten geen handschoenen meer te dragen (tenzij bij contact met lichaamsvochten en chemotherapeutica). De beslissing werd genomen op het ogenblik dat op de betrokken afdeling 11 MRSA-patiënten aanwezig waren (op een totaal van 23). Wel werd de nadruk gelegd op het belang van handhygiëne met handalcohol. Ondanks het feit dat noch door artsen noch door verpleegkundigen handschoenen werden gedragen, werden in de daaropvolgende weken geen bijkomende MRSA-patiënten op de afdeling gevonden, ondanks wekelijkse screening van alle aanwezige patiënten.
Het niet dragen van handschoenen bij MDRO zou nadien de standaard worden in het UZA. Hiermee gingen we regelrecht in tegen de algemeen geldende aanbevelingen zoals deze van de HGR. Nochtans meenden we dat er, op basis van literatuuronderzoek en observaties van handhygiëne in de praktijk, voldoende argumenten waren om eerder de nadruk te leggen op handontsmetting dan op het dragen van handschoenen (58,59).
e) Verlengen van de verblijfsduur van perifere katheters
Tot 1994 mocht een perifere katheter maximum 72 uur ter plaatse blijven. Vanaf 1994 werd de verblijfsduur van perifere katheters in het UZA verlengd naar 96 uur. De richtlijnen van de HGR vermeldden toen nog dat een perifere katheter om de 48 à 72 uur moest vervangen worden. In 2019 wordt na een interne studie en op basis van publicaties beslist om de verblijfsduur opnieuw aan te passen. Uit de interne studie bleek namelijk dat het grootste risico op flebitis zich voordeed in de periode vóór 96 uur. Een perifere katheters diende vanaf 2019 enkel vervangen te worden indien klinisch geïndiceerd, wat een belangrijke besparing impliceerde en het bespaarde de patiënten onnodige pijn door routinematig katheters te vervangen in afwezigheid van klinische indicaties (60).
XVIII. De materialencommissie
In 2007 verschenen er twee KB waarin enerzijds wordt vermeld dat het TZHH voor ziekenhuishygiëne de hygiëneaspecten bij ziekenhuisactiviteiten zoals de aankoop van materialen moet opvolgen en anderzijds dat het comité voor medisch materiaal o.a. moet samengesteld zijn uit een geneesheer- en een VK-ZHH (61). In het UZA was al sinds begin de jaren ‘90 een VK-ZHH actief betrokken bij de aankoop van medische hulpmiddelen (MH) zoals spuiten, naalden, driewegkranen, enz.
Vanaf 1993 werd een procedure opgemaakt i.v.m. het uittesten van MH voor het verpleegkundig departement. Deze procedure bleek op termijn niet te voldoen aangezien toch nog regelmatig MH in gebruik werden genomen zonder het doorlopen van de afgesproken testprocedure (zie hoger de NC). Daarom werd in 2008 met de directie facilitaire diensten en de hoofdapotheker de nodige afspraken gemaakt om illegale circuits voor het uittesten van materialen of illegale aankoopcircuits uit te sluiten.
Concreet betekende dit dat nieuwe producten die niet de officiële testprocedure hadden doorlopen nooit konden worden aangekocht.
In hetzelfde jaar wordt ook een zgn. testteamvergadering (TTV) opgericht waarin een VK-ZHH actief betrokken wordt zoals bij de verslaggeving van de vergaderingen. De vergadering zou uiteindelijk uitgroeien tot een vorm van werkgroep van de materialencommissie. De VK-ZHH zal de volgende jaren in overleg met de aankoopdienst mee beslissen over het opstellen of verlengen van nieuwe contracten met firma’s waarbij de kennis van Europese normeringen met de jaren aan belang zal toenemen.
In 1989 was er van Europese normeringen voor MH echter amper sprake, tenzij dan voor PMB zoals ademhalingsmaskers of “respirators” die conform de Europese regelgeving 89/686/EEG moesten zijn en voorzien zijn van een CE-label met een registratienummer.
De keuze voor een bepaald merk van MH werd dan ook bepaald door eigen testresultaten en/of Amerikaanse normen (ASTM) indien beschikbaar. Op de verpakking van chirurgische handschoenen die in die periode werden aangeboden door fabrikanten, ontbrak meestal essentiële informatie (figuur 33). Door de Europese richtlijn 93/42/EEG komt hierin stilaan verandering en worden heel wat producten als medische hulpmiddelen («medical devices») beschouwd waardoor ze moesten voorzien zijn van een CE-label. De volgende jaren zullen de normeringen elkaar opvolgen of komen er wijzigingen aan al bestaande. Voorbeelden hiervan zijn: EN 455-1:1993 voor onderzoekshandschoenen, EN 13795:2004 voor chirurgisch afdekmateriaal en operatiekleding of EN 14683:2005 voor chirurgische maskers (gewijzigd door EN 14683:2014) (62,63,64,65,66).
Figure 33
Ook voor het opvolgen van het uittesten van materialen zal de VK-ZHH een belangrijke rol vervullen. Maar eveneens het zoeken naar alternatieve materialen bij stockbreuken zal door de VK-ZHH samen met de aankoopdienst en het centraal magazijn tijdens de coronacrisis in 2020 tot een hoogtepunt komen.
XIX. Ontsmettingsmiddelen
Net zoals voor MH zal ook het belang van de kennis van Europese normeringen met betrekking tot ontsmettingsmiddelen met de jaren toenemen Zo verscheen in 2006 de norm EN 14885:2006 “Chemische desinfectantia en antiseptica”. Deze norm geeft een overzicht van de beschikbare normen die toelaten om de werkzaamheid van een ontsmettingsmiddel te bepalen. De norm zal in de daaropvolgende jaren meermaals worden gewijzigd. In 2013 treedt ook de “EU biocidal products Regulation 528/2012” in werking waardoor verduidelijkt wordt welk ontsmettingsmiddel als een biocide ofwel als een medisch hulpmiddel moet worden beschouwd.
De gebruikte ontsmettingsmiddelen in het ziekenhuis zijn in de loop van de voorbije jaren meermaals gewijzigd. Toxische producten voor ontsmetting van MH of de omgeving zoals glutaaraldehyde of fenolderivaten werden vervangen door minder schadelijke producten. Zo werd in het UZA tot 2002 voor de terminale ontsmetting van isolatiekamers nog Velicin® forte (fenolderivaat) en Sekusept® Forte (glutaaraldehyde) voor de ontsmetting van bepaalde instrumenten gebruikt. In 2005 werd als standaard ontsmettingsmiddel voor de omgeving en MH een product op basis van isopropyl-tridecyl-dimethylammonium weerhouden, waarvan de LD50 (>2000 mg/kg) 10 x hoger was dan het tot dan toe gebruikte product op basis van glucoprotamine. Ook werd gedacht aan het gebruiksgemak en werd er gelijktijdig met de overschakeling voor geopteerd om alle afdelingen te voorzien van automatische doseerpompen; hierdoor konden fouten in de verdunning of verspilling van het ontsmettingsmiddel door te hoge dosering vermeden worden.
Het gebruik van natriumhypochloriet (“eau de Javel”) voor ontsmetting bij o.a. Clostridioides difficile werd vervangen door unidoses verpakte perazijnzuur. Hoewel javel uit eigen onderzoek geen problemen gaf op vlak van arbeidshygiëne, werd het product zo veel mogelijk uit het ziekenhuis gebannen omwille van milieuhygiënische redenen. Daarnaast waren er ook klachten over de geurhinder vanwege de patiënten (67,68).
Daarnaast werd ook de dosering van een aantal en ontsmettingsmiddelen aangepast. Dat was in 1999 o.a. het geval met CHX in water (HAC) dat toen nog standaard voor de ontsmetting van materialen op de afdelingen werd gebruikt; de concentratie werd nl. verhoogd van 1% naar 3,5%. In het kader van de “central line bundle” werd voor het ontsmetten van de aanprikplaats in 2003 de concentratie CHX in alcohol verhoogd van 0,5% naar 2%. In 2002 wordt dan voor de preoperatieve huidontsmetting beslist om op polyvidone jodium (PVP-I) in alcohol over te schakelen ter vervanging van de tot dan toe gebruikte waterige oplossing.
In 2006 werd in het UZA binnen de werkgroep wondzorg een formularium “Reiniging en ontsmetting van wonden” opgesteld. Hierbij werd het aantal soorten ontsmettingsmiddelen gelimiteerd. Zo werd eosine niet meer als ontsmettingsmiddel weerhouden. Aangezien eosine echter een geregistreerd geneesmiddel is, dat door een arts kon worden voorgeschreven (bv. voor diabetische voetwonden), werd wel een beperkte hoeveelheid eosine in unidosis in de apotheek behouden.
Van de weerhouden ontsmettingsmiddelen werd zo veel mogelijk geopteerd voor producten in unidosis om het risico op contaminatie van ontsmettingsmiddelen op waterbasis te beperken. In de jaren tachtig waren immers meerdere pseudo-epidemieën (vals-positieve hemoculturen) gedocumenteerd met Burkholderia (Pseudomonas) cepacia in het UZA die het gevolg waren van gecontamineerde busjes (250 ml) CHX 0,5% in water. Binnen de werkgroep wondzorg worden ook de indicaties voor ontsmetting van wonden vastgelegd. Zo worden primair gesloten chirurgische wonden niet meer ontsmet maar enkel nog gereinigd.
In de procedure “Ontsmettingsstoffen” zal vanaf 2007 duidelijk worden bepaald wat de houdbaarheidstermijn is na eerste gebruik van een ontsmettingsmiddel. Deze procedure werd in 2013 uitgebreid met verzorgingsproducten en zal vanaf dan jaarlijks in overleg met de hoofdapotheker geüpdatet worden.
Alle gebruikte ontsmettingsmiddelen in het ziekenhuis worden vanaf 2011 jaarlijks geïnventariseerd in samenspraak met de milieucoördinator. Als gevolg van het KB van 08/05/2014 betreffende het op de markt aanbieden en het gebruiken van biociden wordt bovendien vanaf 2016 nagegaan welke producten er tot het gesloten circuit behoren (69).
In 2015 wordt op budget van ziekenhuishygiëne een mobiel verneveltoestel aangekocht voor ruimtedesinfectie met waterstofperoxide 12%. Vanaf dan zal het toestel door de schoonmaakdienst aangewend worden voor ontsmetting van isolatiekamers na verblijf van een patiënt met o.a. MRSA, CDIF, VRE, CPE en tenslotte ook Sars-CoV-2.
Bij stockbreuken of stopzetting van productie van ontsmettingsmiddelen werd het TZHH al meermaals in het verleden om advies gecontacteerd. Het meest recent was dit o.a. in 2020 voor de ontsmettende washandjes voor prematuren (Stellisept®) die niet meer in België werden verdeeld of in 2022 voor chloramine 0,5% als gevolg van schaarste van de basisproducten bij de producent.
XX. Samenwerking met Nederlandse ziekenhuizen
In 1994 was er een eerste contact tussen het TZHH van het UZA en cardiologen uit Vlissingen om cardiochirurgische patiënten vanuit Nederland naar het UZA te verwijzen. Op dat ogenblik was er echter weinig aanbod van Nederlandse patiënten zodat verdere afspraken werden onderbroken. In december 1999 zochten enkele ziekenhuizen uit Breda en het UZA naar een oplossing door het maken van duidelijke richtlijnen ten aanzien van overplaatsingen van neonaten vanuit het UZA naar de ziekenhuizen in Breda en vice versa. Hierbij werd uitgegaan van de lage incidentie van MRSA in het UZA en het bestaan van isolatievoorschriften om MRSA-verspreiding tegen te gaan. Voor de Nederlandse ziekenhuizen in Breda waren deze gegevens een reden om afwijkend van het Nederlandse beleid ten aanzien van overnames uit buitenlandse ziekenhuizen, een aangepast beleid te maken voor heropnames van neonaten uit het UZA. Een protocol werd uitgewerkt en geïmplementeerd. De problematiek van de Nederlandse cardiologische patiënten komt in 2001 opnieuw ter sprake als gevolg van een tekort aan Nederlandse cardiologen. Al vlug werden in het voorjaar van 2001 afspraken gemaakt met de ziekenhuizen in Vlissingen en Goes, niet alleen ten aanzien van cardiologische patiënten en neonaten, maar ook ten aanzien van alle ICU/CCU patiënten van alle specialismen. Een protocol werd opgesteld waarbij het protocol van het Ignatius Ziekenhuis in Breda als leidraad gold. Nadien werden ook afspraken gemaakt tussen het UZA en het Ziekenhuis Ruwaard in Spijkenissen, het Ikazia Ziekenhuis in Rotterdam, Het Franciscus Ziekenhuis in Roosendaal en het Albert Schweizerziekenhuis in Dordrecht. In de media werd omstreeks 2002 gesproken over “medische immigratie” of “ziekenhuistoerisme”. Hiermee werd het fenomeen omschreven waarbij buitenlandse patiënten omwille van onvoldoende opvangcapaciteit in eigen land hun toevlucht zochten in Belgische ziekenhuizen. Uiteindelijk zal enkel de samenwerking met het ziekenhuis in Vlissingen/Goes gedurende jaren stand houden om tenslotte als gevolg van de coronacrisis uit te doven (70,71).
XXI. IRIS (Project Infectie Risico Scan)
Figure 34

Het betreft een interregionaal project met Belgische en Nederlandse ziekenhuizen. Een Infectiepreventie RIsico Scan (IRIS) is een methode van surveillance welke proces- en uitkomstmaten op het gebied van infectiepreventie, zowel kwalitatief als kwantitatief, in kaart brengt. In het UZA werd deze scan uitgevoerd in 2017 en 2018 op vier verschillende afdelingen gedurende twee maanden. De IRIS geeft een totaalbeeld van de afdeling op gebied van infectiepreventie.
In het kader hiervan werd een prevalentie-onderzoek (van darmkolonisatie met MDRO) op de vier verpleegafdelingen uitgevoerd. Van de geïncludeerde patiënten werden naast administratieve gegevens ook gegevens verzameld met betrekking tot antibioticagebruik, aanwezigheid van blaas- en intravasculaire katheters, McCabe-score, vorig verblijf in een andere (buitenlandse) zorginstellingen en al of niet opgenomen in eenpersoonskamer met eigen sanitair. Naast deze patiëntgebonden indicatoren werden ook afdelingsgebonden indicatoren verzameld: omgevingsverontreiniging, gegevens m.b.t. handhygiëne en kledij en structuurvoorwaarden (beschermingsmiddelen, bedpanspoeler…).
De gegevens werden ingegeven in het IRIS-programma en werden extern verwerkt.
XXII. Audits op de afdelingen
In 2006 werd een werkgroep “proper ziekenhuis” opgericht, waarbij o.a. gefocust werd op publiek toegankelijke plaatsen (inkomhal, toiletten) en stockeren van schoonmaakmateriaal. Naast het TZHH maakten ook de technische dienst, preventiedienst, directeur patiëntenzorg, communicatiedienst en facilitaire dienst deel uit van deze werkgroep.
In het kader van de veiligheidsweek en het project “proper ziekenhuis”, nam het TZHH het jaar daarop in samenspraak met de directeur patiëntenzorg, het initiatief om op een aantal willekeurig gekozen verpleegafdelingen audits uit te voeren. Tijdens deze onaangekondigde bezoeken van de ziekenhuishygiënisten werden diverse aspecten die met orde, netheid en hygiëne te maken hadden onder de loep genomen. De betrokken diensten kregen hierover feedback zodat ze de nodige verbeteracties konden uitvoeren.
In aanloop naar de JCI-accreditatie werden zgn. “facilitaire rondes” met technische dienst, directie patiëntenzorg en TZHH georganiseerd. Hier lag de focus op de scheiding “vuil” en “proper” op de verpleegafdelingen (bv. geen verzorgingsproducten in de spoelruimte). Het zal uitmonden in een procedure “De tien propere geboden”.
De checklist voor de audits die al in 2007 door het TZHH was uitgewerkt krijgt in 2016 een nieuw jasje waarbij de controles ter plaatse via een “tracerapp van ziekenhuishygiëne” op een tablet konden worden geregistreerd en waarbij deze in real time naar een dashboard werden doorgestuurd zodat de resultaten (scores) op intranet voor iedereen toegankelijk werden.
Op voorstel van de JCI-auditors werd een matrix van alle afdelingen opgesteld en werd per afdeling bepaald wanneer en met welke frequentie de audit zou worden uitgevoerd. Deze vorm van audit werd omwille van het arbeidsintensieve karakter in samenspraak met de kwaliteitsdienst afgebouwd.
De focus van het TZHH kwam eerder te liggen op controles van de omgeving d.m.v. ATP-metingen.
In 2018 werd een werkgroep “tertiair karton” opgericht bestaande uit het TZHH en betrokkenen van apotheek, magazijn, kwaliteitsdienst en aankoopdienst. De bedoeling was om de aanwezigheid van tertiair karton op de afdelingen te verminderen. De focus lag hierbij op de apotheek en het centrale magazijn van waaruit heel wat materialen naar de afdelingen werden getransporteerd. Hierbij werden de transportkarren op regelmatige basis gecontroleerd op aanwezigheid van tertiair karton. In 2019 werd de doelstelling gehaald (>90% tertiair karton afwezig) t.o.v. de nulmeting van 70%.
Naast hoger vermelde audits werden samen met de facilitaire dienst ook nog audits uitgevoerd met betrekking tot het linnenbeheer (inclusief externe wasserij), de centrale keuken (externe cateraar) en melkkeuken.
XXIII. Voedingsmiddelenhygiëne
In 2002 verschijnt er een advies van de HGR betreffende neonatale infecties veroorzaakt door Enterobacter sakazakii. Naar aanleiding hiervan werd een werkgroep opgericht om de toepassing van het HACCP-principe bij de bereiding van melkvoeding te evalueren (zowel in de centrale melkkeuken als decentraal op de afdelingen). De werkgroep bestond uit vertegenwoordigers van het TZHH, NICU en dieetafdeling. Het zal resulteren in aangepaste werkwijzen bij de bereiding, transport en bewaring; ook de problematiek van borstvoeding werd behandeld. Daarnaast werden periodisch ook audits uitgevoerd op de betrokken afdelingen. De werkgroep zal tot 2009 actief blijven en in 2010 geïntegreerd worden in de werkgroep voedselveiligheid en –hygiëne waarin ook de externe cateraar en de facilitaire dienst zetelen.
In 2018 werd door het Federaal Agentschap voor de Veiligheid van de Voedselketen (FAVV) voor de eerste keer een audit uitgevoerd op een willekeurig gekozen afdelingskeuken van een verpleegeenheid in het UZA. Voordien beperkte een audit van het FAVV zich tot de centrale keuken van het ziekenhuis. Deze uitgebreidere audit was de aanleiding om de procedure over voedselveiligheid op een verpleegeenheid te verfijnen(72).
XXIV. Ongediertebestrijding
In 1999 werd door het TZHH en de preventiedienst een eerste ongediertebestrijdingsplan opgemaakt. Tot eind 2019 was er echter nog onduidelijkheid wie er verantwoordelijk was voor de bestrijding van ongedierte, nl. de preventiedienst, facilitaire dienst of ziekenhuishygiëne. Uiteindelijk wordt in 2020 beslist om met de firma in ongediertebestrijding een nieuw contract af te sluiten zodat interventies ook tijdens de weekends mogelijk werden en dus sneller kon ingegrepen worden. De melding van ongedierte overdag diende via de preventiedienst te gebeuren.
In het verleden werd bij aanwezigheid van ongedierte telkens het TZHH gecontacteerd waarbij in overleg met de preventiedienst de interventies werden besproken (73,74).
a) Vlooien
Bij de bouw van het UZA in 1979 werd er gekozen voor vast tapijt (“tapis plain”) in de centrale inkomhal van het ziekenhuis. Vooral in de zomermaanden meldde het administratief personeel, dat werkzaam was in ruimten met vast tapijt, echter regelmatig problemen van vlooienbeten. De eitjes van vlooien werden vermoedelijk via schoeisel het ziekenhuis binnengebracht. De behandeling gebeurde met een insecticide dat door de preventiedienst werd beheerd. Naar aanleiding van deze problematiek adviseerde het TZHH in 1999 om bij de verbouwing van de inkomhal niet meer te opteren voor vast tapijt.
b) Maden
Aangezien er in een autopsiezaal ook autopsies in opdracht van het parket werden uitgevoerd (gerechtelijke geneeskunde) deden zich in 1999 de eerste voorvallen met maden voor. De bestrijding hiervan werd toegewezen aan de firma in ongediertebestrijding..
c) Vliegende insecten
De aanwezigheid van deze insecten werd het meest gemeld. Een voorval met fruitvliegjes op de afdeling hematologie noodzaakte de afdeling om geen fruit, meegebracht door bezoekers, meer toe te laten. Het fruit werd namelijk te lang in de patiëntenkamer bewaard met een plaag van fruitvliegjes tot gevolg.
Andere insecten zoals lieveheersbeestjes en vliegen vonden hun oorsprong in de bekisting van rolluiken of zonnewering zodat interventies door de technische dienst nodig waren. Indien mogelijk werd op advies van het TZHH in de ruimte verneveling met een insecticide toegepast d.m.v. het Nocospray®-toestel. Deze methode werd sinds 2018 ook toegepast in patiëntenkamers waar patiënten met schurft waren opgenomen.
d) Kakkerlakken
Al sinds 1994 heeft het UZA een contract met een verdelgingsbedrijf om in bepaalde zones van het ziekenhuis preventief op te treden. Deze aanpak heeft er toe geleid dat er gedurende meerdere jaren geen kakkerlakken meer werden gesignaleerd. Tot er in 2003 toch kakkerlakken door meerdere afdelingen werden gemeld. De oorzaak bleek een patiënt te zijn die de kakkerlakken via zijn bagage in het ziekenhuis had binnenbracht (zie hoger).
e) Ratten en muizen
De bestrijding van ratten en muizen werd toegewezen aan de externe verdelgingsfirma waarbij gewerkt werd met bloklokaas in doosjes (die enkel met een sleutel te openen zijn). Het lokaas werd/wordt om de twee maanden gecontroleerd en ververst. Door de firma werd al in 1999 een garantie van een knaagdierenvrije situatie gegeven.
Nochtans werd het TZHH in 2007 gecontacteerd omwille van rattenkeutels in de centrale keuken. Nader “onderzoek” wees uit dat om olijfpitten ging …
f) Bedwantsen
Wanneer in 2019 er bedwantsen door de verpleegafdeling pediatrie worden gemeld, zal in overleg met de preventiedienst een procedure worden opgemaakt waarin bepaald werd hoe men bedwantsen kan herkennen, wie er moet gecontacteerd worden (preventiedienst) en welke voorzorgen er moeten genomen worden (zoals isolatie, raadgevingen aan patiënt en familie). Er werd tevens bepaald dat er op eigen initiatief geen insecticide mag gebruikt worden maar dat de bestrijding uitsluitend door een extern ongediertebestrijdingsfirma mag gebeuren aangezien de bedwantsen heel hardnekkig zijn.
XXV. Referentieverpleegkundigen-ziekenhuishygiëne
Naar aanleiding van het KB van 2007 wees de Directeur-Generaal van de Organisatie gezondheidszorgvoorzieningen erop dat het uitbouwen van een netwerk van referentieverpleegkundigen ziekenhuishygiëne zeer waardevol is. Het jaar daarop werkte het TZHH een opleidingsprogramma uit om de eerste referentieverpleegkundigen intern op te leiden. Hun taakinhoud zal echter niet beperkt blijven tot aspecten van ziekenhuishygiëne maar in overleg met de directie patiëntenzorg uitgebreid worden tot alle aspecten van patiëntveiligheid. De benaming zal bijgevolg wijzigen in “referentieverpleegkundige hygiëne en patiëntveiligheid”. Tevens werd ook een competentieprofiel opgesteld. Er worden anno 2022 vier overlegmomenten met deze referentieverpleegkundigen georganiseerd waarop telkens diverse topics m.b.t. ziekenhuishygiëne worden behandeld.
XXVI. Het Regionaal Platform Ziekenhuishygiëne Antwerpen
In 1992 richtte de dienst ziekenhuishygiëne van het A.Z. St-Jan (Brugge) een regionale werkgroep op met de bedoeling om de krachten van verschillende West-Vlaamse ziekenhuizen te bundelen om nosocomiale infecties te voorkomen en te bestrijden. In 1997 werden onder impuls van Prof. H. Goossens (UZA/UA) de krijtlijnen vastgelegd van een werkgroep ziekenhuishygiëne regio Antwerpen naar analogie met het Brugse initiatief.
De ziekenhuizen van de provincie Antwerpen werden vervolgens aangeschreven. Op 6 oktober 1997 vond een eerste vergadering plaats met 46 aanwezigen. Al tijdens de eerste vergadering werden werkgroepen opgericht waaraan ook het TZHH van het UZA in de loop van de volgende jaren zal deelnemen zoals deze van medisch afval en afvalbeheer, legionellapreventie, endoscopen, prionen en handschoenen.
Deelname van het ziekenhuishygiëneteam aan de vergaderingen van het regionaal platform werd één van de kwaliteitsindicatoren voor ziekenhuishygiëne.
XXVII. Delen van ervaring en kennis
In de voorbije (meer dan) 30 jaar zijn er tal van publicaties en abstracts van de hand van het TZHH verschenen in zowel internationale als nationale tijdschriften. Ook enkele boeken over ziekenhuishygiëne werden in de periode 2000-2006 uitgegeven. Het behoorde immers tot de opdrachten van een universitair ziekenhuis om ervaring en kennis zo breed mogelijk te delen. Daarnaast werden ook vele voordrachten en lessen in scholen, zorginstellingen, aan thuisverpleegkundigen en op congressen/symposia gegeven.
Het overgrote deel van de publicaties is wellicht verschenen in “Noso-info”. Hoewel deze publicaties enkel in het Nederlands en Frans verschenen sloten we ons hier, weliswaar onbewust, aan bij de kritiek die door sommigen geuit werd op de verengelsing van de academische wereld: als de meeste artikelen nl. in het Engels worden uitgegeven, betekent dat ook dat men het Nederlands (of Frans) niet meer geschikt acht voor de wetenschap en sluiten we die informatie deels af voor wie alleen of vooral Nederlands (Frans) spreekt (aldus Freek Van de Velde, professor neerlandistiek (KU Leuven) in De Morgen 23/03/2022).
XXVIII. Slot
Wellicht zijn een aantal ziekenhuishygiënische topics niet of slechts beperkt aan bod gekomen. Meer dan 30 jaar ervaring met betrekking tot ziekenhuishygiëne laat zich dan ook niet gemakkelijk samenvatten in enkele bladzijden. Maar uit al het voorgaande zal wel duidelijk zijn dat ziekenhuishygiëne bedrijven een dynamische, gevarieerde job is met veel contacten, afwisseling en multidisciplinair overleg (74).
Heel wat van de besproken onderwerpen vonden ook hun neerslag in publicaties waarvan op aanvraag een digitale versie kan bekomen worden via het mailadres fvanlaer@telenet.be.
Met dank aan mijn vroegere collega’s: Regina, Jean-Paul, Frieda, Kurt, Miel en aan het huidige TZHH: Hilde, Elise en Hannelore.
XXIX. Referenties
1. Van Laer F., Gillisjans F. Zorg dragen voor AIDS-patiënten. De rol van de verpleegkundige. Hera (Nieuwsbrief van het Interprovinciaal AIDS-coördinaat),1991;3:22-24.
2. Van Laer F. Behoedzame zorg. De verpleging van AIDS-patiënten. Een terugblik. Hera (Tijdschrift voor AIDS-preventiewerkers),1989;1:14-17.
3. Van Laer F. Hygiëne en preventie in de huiskamer. Hera,1989;4:3.
4. Van Laer F. Hiv- en aids-patiënten. Specifieke zorgen bij hiv-geïnfecteerden. Thuiszorg Nieuwsbrief, 1999;17:1-3.
5. Van Laer F. Hiv- en aids-patiënten. Preventiemaatregelen. Thuiszorg Nieuwsbrief, 1999;18:1-4.
6. Sion J.P., Van Laer F. Observation of surgical site infections in orthopaedics until after discharge. Abstract n° F5/3 at the 3rd International Conference of the Hospital Infection Society, Londen 1994.
7. Van Laer F., Sion J.P., Nuyts R. Postoperatieve wondinfecties op orthopedie. De invloed van follow-up na ontslag. Tijdschrift voor Hygiëne en Infectiepreventie,1994;1:14-18.
8. Van Laer F, Goossens H, Jansens H, Ieven M. Cijfers antibioticaresistentie. Methodologische problemen bij de berekening. Tijdschrift voor Hygiëne en Infectiepreventie, 1999;4:101-104.
9. Frank Van Laer, Elke Coenen. De impact van veiligheidsvleugelnaalden op de incidentie van prikongevallen in het UZA. Noso-info, 2017; 21(4): 2-4.
10. Frank Van Laer, Tim Mertens. Prikaccidenten met Huberpuntnaalden in het Universitair Ziekenhuis Antwerpen (UZA). Noso-info, 2020; 24(4): 2-4.
11. Knaepkens L, Van Laer F. Preventie van prikongevallen bij gebruik van een insuline-injectiepen (Prévention des accidents par piqûre lors de l’utilisation d’un stylo d’injection pour insuline). Noso-info,2008;12(4):2-4.
12. Van Laer F. De problematiek van de insuline-injectiepennen – Aanvulling. Noso-info, 2009;13(3):2-3.
13. F. Van Laer. Glucometer-lancetten en –prikpennen. Risico’s voor de gezondheidswerker en de patiënt (Lancettes et stylos autopiqueurs de glucomètre. Risque pour le personnel de santé et le patient). Noso-info, 2010;14(1):2-6.
14. Van Laer F, Roelandt R, Coenen E. Letter to the editor. Occupational risk of blood-borne viruses in healthcare workers. Infection Control and Hospital Epidemiology, 2002;23:712.
15. F. A. Van Laer , E. Coenen , H. Jansens. Occupational risk of blood-borne viruses in healthcare workers: a 20-year surveillance. Antimicrobial Resistance and Infection Control 2019, 8(Suppl 1):148. Poster session P220.
16. Ieven M, Vercauteren, Descheemaeker P, Van Laer F, Goossens H. Comparison of Direct Plating and Broth Enrichment Culture for Detection of Intestinal Colonization by Glycopeptide-Resistant Enterococci among Hospitalized Patients. Journal of Clinical Microbiology, 1999; 37(5): 1436-1440.
17. Leens E, Van Laer F. Accidentele bloedcontacten in het operatiekwartier (Accidents exposant au sang au bloc opératoire). Noso-info, 2006;10(3):4-9.
18. Frank Van Laer. CLABSI-definities in de neonatologie. Noso-info, 2019; 23(4): 5-7.
19. F. Van Laer, D. Verhelst, H. Jansens, E. Goovaerts. Patiënt empowerment. Is de patiënt er klaar voor? Noso-info, 2015; 19(1): 2-6.
20. Frank Van Laer, Filip Bosschaerts, Philippe Prosperi, Ann Segers, Hilde Jansens, Emiel Goovaerts. Evaluatie van de patiëntenfolder over handhygiëne in het UZA. (Evaluation de la brochure patient concernant l’hygiène de mains à l’UZA) Noso-info, 2012;16(1): 4-5.
21. Jansens H, Van Laer F, Ieven M, Goossens H. Evaluation of an early warning system for methicillin-resistant Staphylococcus aureus. Abstract 147 at the 13th annual scientific meeting of the Society for Healthcare Epidemiology of America, 2003, Arlington, Virginia.
22. Van Laer F, Jansens H, Claeys R, Goossens H. Legionellose. Surveillance na een outbreak. Het Belgische Ziekenhuis, 1998;4:38-41.
23. Frank Van Laer, Hilde Jansens, Emiel Goovaerts. Surveillance van legionellose na een outbreak. Noso-info, 2013; 17(4): 10-14.
24. Frank Van Laer , Hilde Jansens , Emiel Goovaerts. Surveillance van legionellose in een universitair ziekenhuis tussen 1984 en 2013. Vlaams Infectieziektebulletin, 2014;5: 4-7.
25. Van Laer F. Het nieuwe Vlaamse legionellabesluit. Noso-info, 2007;11(3):17-18.
26. Van Laer F., Raes D., Vandamme P., Lammens C., Sion JP., Vrints C., Snoeck J., Goossens H. An outbreak of Burkholderia cepacia with septicemia on a cardiology ward. Infection Control and Hospital Epidemiology, 1998;19:112-113.
27. Van Laer F. Een collectieve voedselinfectie op een verpleegafdeling. Epidemiologisch Bulletin van de Vlaamse Gemeenschap, 2001;36:2-4.
28. Jansens H, Van Laer F, Ieven M, Lammens C, Goossens H. A mini-outbreak of methicillin-resistant Staphylococcus aureus infections in a neonatal intensive care unit. Abstract 171 at the 13th annual scientific meeting of the Society for Healthcare Epidemiology of America, 2003, Arlington, Virginia.
29. Van Laer F. Een patiënt bracht kakkerlakken mee in zijn bagage (Le patient amenait des cafards dans ses bagages). Noso-info, 2004; 13 (3): 2-3.
30. H Jansens, F Van Laer , E Goovaerts , K Loens. Successful control of vancomycin-resitant enterococci outbreak in a hematology unit. Antimicrobial Resistance and Infection Control 2015, 4(Suppl 1):P199.
31. Frank Van Laer, Hilde Jansens, Emiel Goovaerts. Beheersing van een uitbraak van vancomycine resistente enterokokken op een hematologische afdeling in het UZA. Noso-info, 2016; 20(2): 2-4.
32. Frank Van Laer, Elise Van Cauwenberg, Hilde Jansens. Welke impact van de COVID-19-pandemie op de incidentie van zorginfecties in het UZA? Noso-info, 2021;25(1): 2-3.
33. Van Laer F., Claeys R. Controversen i.v.m. handhygiëne. Handalcohol versus water en zeep. Verpleegkundigen en Gemeenschapszorg,1994;5:157-159.
34. Frank Van Laer, Hilde Jansens. Kommentaar op het abstract van D. Pittet in Noso-info vol IV n°4, 2000, pg 18. Multiresistente bacteriën en ziekenhuishygiëne. Noso-info, 2001;5(2):12.
35. Frank Van Laer. Chirurgische handontsmetting. Noso-info, 2007;11(2):11.
36. Frank Van Laer. Alcoholvrije handrubs (Solutions désinfectante pour les mains sans alcool). Noso-info, 2010; 14(2): 11.
37. E. Goovaerts, F. Van Laer, H. Jansens. Resultaten van het gewijzigd MRSA-dekolonisatiebeleid in het Universitair Ziekenhuis Antwerpen. Noso-info, 2013; 17(2): 2-6.
38. Van Laer F, Jansens H, Goovaerts E, Goossens H. Epidemiologie van ESBL-producerende micro-organismen in het Universitair Ziekenhuis Antwerpen (UZA) (Epidémiologie des germes producteurs de betalactamase à spectre étendu à l’Universitair Ziekenhuis Antwerpen (UZA)). Noso-info, 2006;10(2):8-11.
39. H. Jansens E. Goovaerts F. Van Laer. Evaluation of the implementation of a change in isolation precautions for extended-spectrum betalactamase producing Enterobacteriaceae (ESBL-E). The Journal of Hospital Infection, 2010; 76(Supplement 1): S56. Poster session P17.14.
40. Frank Van Laer, Hilde Jansens, Emiel Goovaerts. De incidentie van ESBL-positieve Enterobacteriaceae. Vier jaar na toepassing van de BICS-richtlijnen. (L’incidence des entérobactéries productrices de BLSE quatre ans après l’application des directives du BICS). Noso-info, 2012; 16(2): 2-4.
41. Frank Van Laer, Hilde Jansens, Karin Bal, Steven Van Eester. Preventie en surveillance van aspergillose bij hematologische patiënten in het Universitair Ziekenhuis Antwerpen (UZA). Noso-info, 2019; 23(1): 5-8.
42. Frank Van Laer, Kurt De Maeyer, Hilde Jansens, Inez Rodrigus. De invloed van gewijzigde pre- en peroperatieve procedures op de incidentie van postoperatieve wondinfecties in de cardiochirurgie. Gastpresentatie op de 2de NSIH-dag. WIV, Brussel. Endoscopische chirurgie (wiv-isp.be).
43. Van Laer F. Hygiënisch omgaan met klavieren en aanwijsapparaten (muizen) (Manipulation hygiénique des claviers et dispositifs de pointage (souris). Noso-info,2009; 13(2): 2-4.
44. Van Laer F A. Compliance with universal precautions among self-employed home-care nurses. Archives of Public Health, 1996;54,243-249.
45. Van Laer F, Vanherck M-J. Preventie van bloedoverdraagbare aandoeningen door Vlaamse zelfstandige thuisverpleegkundigen. Een vergelijking van twee studies. (Prévention des affections transmissibles par voie sanguine auprès des infirmiers à domicile indépendants flamands. Une comparaison de deux études). Noso-info, 2006;10(1):12-14.
46. Van Laer F., Sion J.P. Ziekenhuisafval. Een poging tot rationele benadering van specifiek ziekenhuisafval. Tijdschrift voor Hygiëne en Infectiepreventie,1993;1:15-20.
47. Van laer F. Verwarring omtrent ziekenhuisafval. V.B.V.K.-tijdschrift,1993;juli/aug.:2-3.
48. Van Laer F. Afvalbeheer in een rustoord en/of RVT. Verpleegkundig Kader, 1999;4:23-25.
49. Frank Van Laer, Hilde Jansens. Van visitatie naar accreditatie. Noso-info, 2013;17(2):7-8.
50. Mahieu L, De Dooy J, Van Laer F, Jansens H. Emissie van Aspergillus species tijdens verbouwingswerken op de dienst Neonatologie van het Universitair Ziekenhuis Antwerpen. Epidemiologisch Bulletin van de Vlaamse Gemeenschap, 2000;31:1-5.
51. Mahieu L, De Dooy J, Van Laer F, Jansens H, Ieven M. Surveillance van de emissie van Aspergillus species tijdens verbouwingswerken op de dienst Neonatologie van het Universitair Ziekenhuis Antwerpen. Noso-info, 2000;1:2-7.
52. Mahieu LM, De Dooy JJ, Van Laer FA, Jansens H, Ieven MM. A prospective study on factors influencing aspergillus spore load in the air during renovation works in a neonatal intensive care unit. Journal of Hospital Infection, 2000;45:191-197.
53. Frank Van Laer. Luchtdecontaminatie zonder HEPA-filtratie, Noso-info, 2008; 12(2):1-2.
54. Frank Van Laer. Eenmalig te gebruiken geïmpregneerde washandjes. Ervaringen in het UZA, Noso-info, 2016;20(3):12-17.
55. F. Van Laer, Hilde Jansens, Emiel Goovaerts. Gecontamineerde geïmpregneerde washandjes voor eenmalig gebruik (Contamination des gants de toilette imprégnés à usage unique) Noso-info, 2012;16(1): 4-5.
56. Frank Van Laer, Elise Van Cauwenberg, Hilde Jansens. Eenmalig te gebruiken chloorhexidine-geïmpregneerde washandjes. Impact op MDRO en CLABSI bij patiënten op de intensieve zorgenafdeling van het UZA. Noso-info, 2020;24(2): 2-5.
57. F. A. Van Laer, E. Van Cauwenberg, H. Jansens. Effect of daily chlorhexidine bathing on hospital acquired infection in intensive care units. Antimicrobial Resistance and Infection Control 2019, 8(Suppl 1):O41
58. Van Laer F. Aanvullingen bij de keuze van wegwerphandschoenen. Noso-info, 2002;6(4):22.
59. Van Laer F, Jansens H, Goovaerts E. Onderzoekshandschoenen: vloek of zegen? (Gants de protection: malédiction ou bénédiction?) Noso-info, 2005;9(4):17-20.
60. Frank Van Laer, Hilde Jansens, Emiel Goovaerts. Evaluatie van het verlengen van de verblijfsduur van korte perifere katheters. Noso-info, 2017;21(3): 7-10.
61. Frank Van Laer. Materialenkennis en ziekenhuishygiëne. Noso-info, 2015;19(2): 8-11.
62. Van Laer F, Haxhe JJ. Maskers: welke, wanneer en hoe? (Des masques: lesquels, quand et comment?). Noso-info, 2003;7(2):4-7.
63. Van Laer F. De Europese norm EN 13795 voor chirurgisch afdekmateriaal en operatiekleding (Normes européennes EN 13795 des champs chirurgicaux et des vêtements de quartier opératoire: Mise en conformité). Noso-info, 2004;8(4):13-14.
64. Van Laer F. Chirurgische maskers (Masques chirurgicaux). Noso-info, 2005;9(2):15-17.
65. Van Laer F. Graad van bescherming van beschermingspakken tegen biologische agentia. Noso-info, 2014, Vol XVIII, n°4: 5-6. Van Laer F. Degré d’efficacité des combinaisons de protection contre les agents biologiques. Noso-info, 2014;18(4):5-6.
66. Frank Van Laer. Isolatieschorten conform EN 13795, EN 14126, AATCC 42, of ASTM F 1670?. Noso-info, 2016;20(2):11-13.
67. Van Laer FA, Verdyck R, Jansens H, Coenen E. Disinfectants Containing Chlorine: An Occupational Hazard? Infect Control Hosp Epidemiol 2008;29:474–474.
68. Van Laer FA, Verdyck R, Jansens H, Coenen E. Chloorhoudende ontsmettingsmiddelen en arbeidsveiligheid, Noso-info, 2008;12(2):1-2.
69. Frank Van Laer. Biociden van het gesloten circuit. Noso-info,2021;25(3):5-7.
70. Van Mier M, Van Laer F. MRSA zonder grenzen. Tijdschrift voor Hygiëne en Infectiepreventie, 2003;2:31-34.
71. Van Laer F, Van Mier M. MRSA zonder grenzen. (MRSA sans frontières). Noso-info, 2003;7(2):12-16.
72. Van Laer F. Zilvervisjes [brief]. The Belgian Pest Control Magazine, 1996;6:9.
73. Van Laer F, Verdijck R, Jansens H. Ongediertebestrijding. Een ongediertebestrijdingsplan in een universitair Ziekenhuis. Tijdschrift voor Hygiëne en Infectiepreventie, 2001;2:38-40.
74. Hoe ziekenhuishygiëne in dertig jaar evolueerde. Netwerk verpleegkunde, 2022, nr.3:19-21.
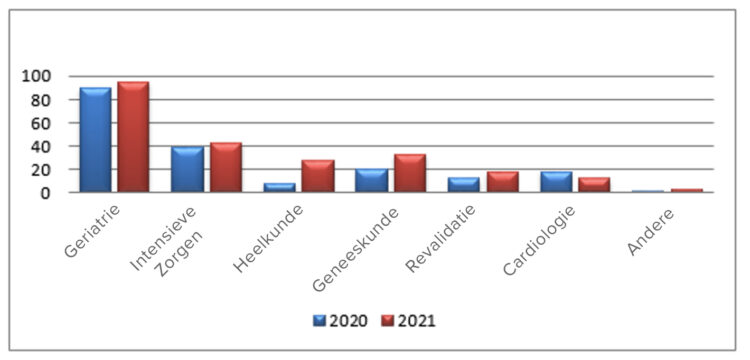
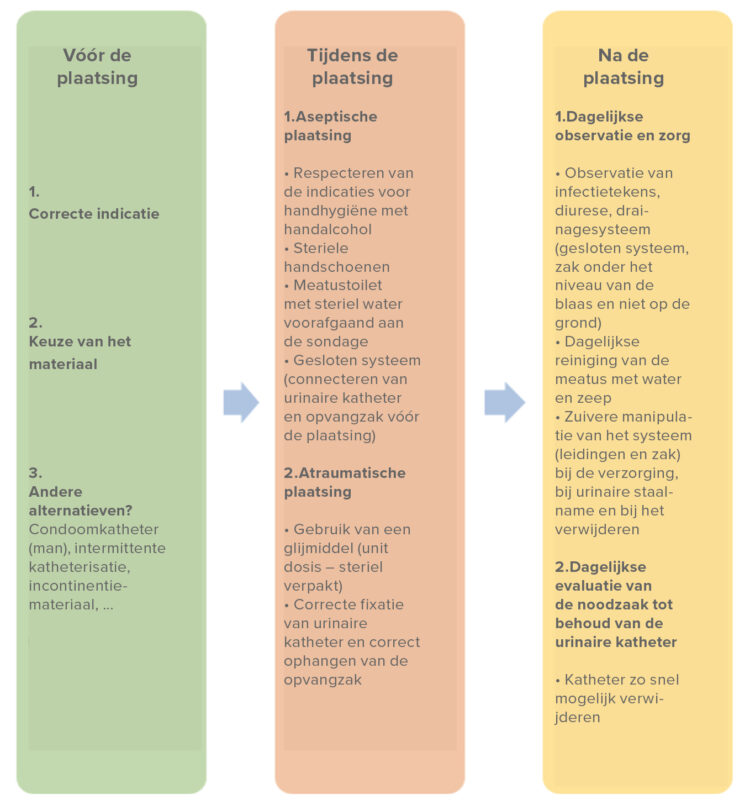
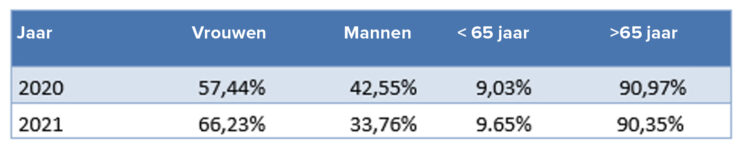

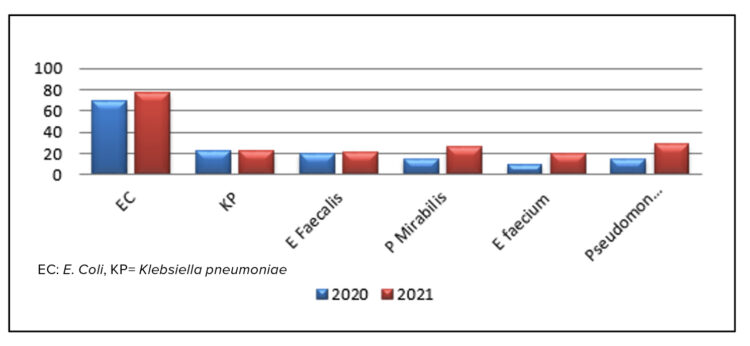
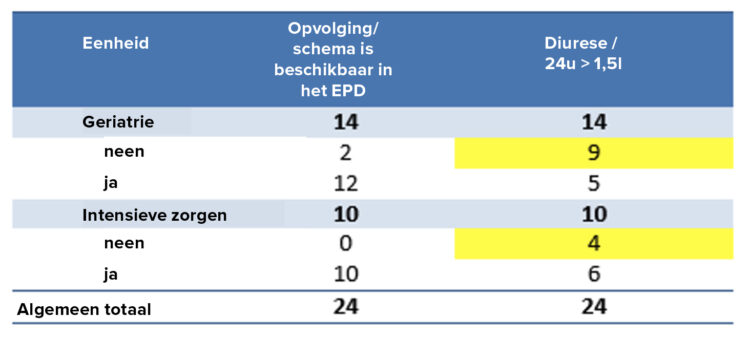
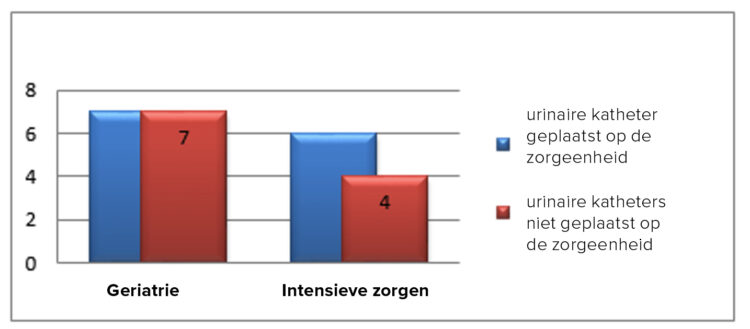
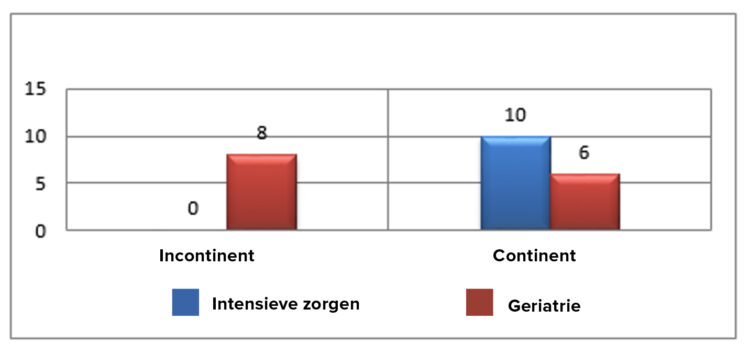

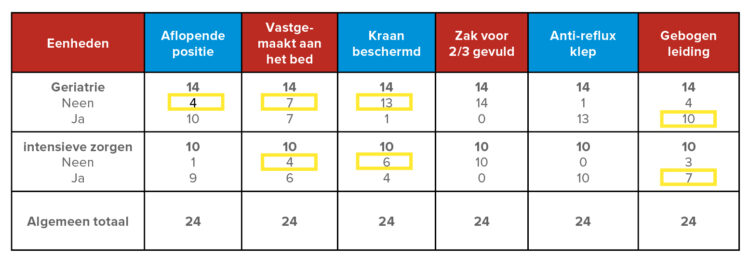
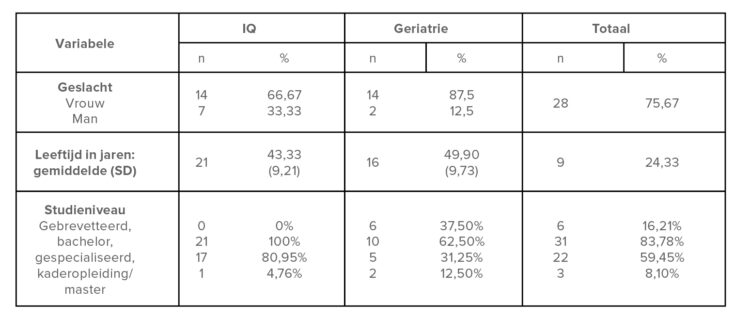















































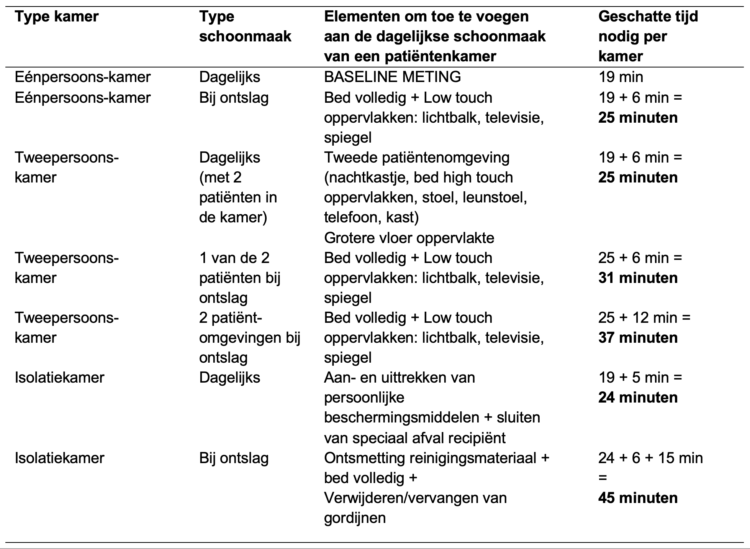
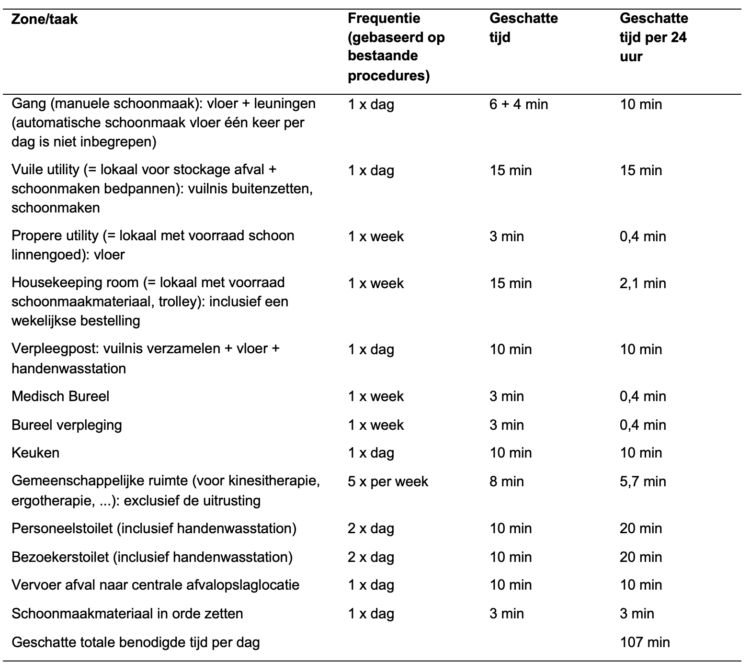




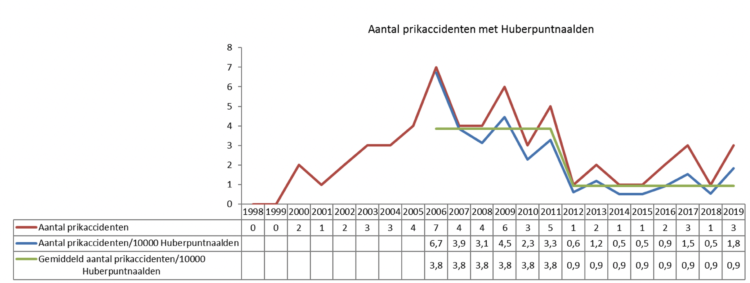
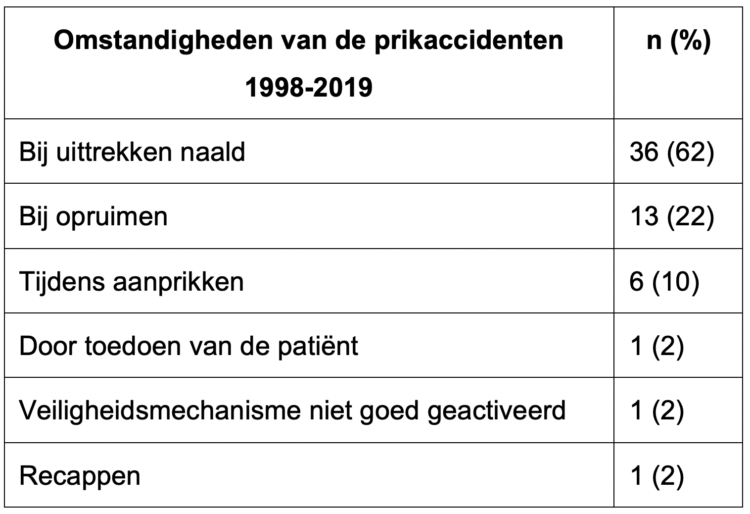




 “Animal-assisted interventions” (AAI), waarbij gebruik gemaakt wordt van huisdieren, is de laatste jaren steeds populairder geworden.
“Animal-assisted interventions” (AAI), waarbij gebruik gemaakt wordt van huisdieren, is de laatste jaren steeds populairder geworden.