Joseph Meletiadis, Maria Siopi, Bram Spruijtenburg, Panagiota-Christina Georgiou, Maria Kostoula, Sophia Vourli, Frantzeska Frantzeskaki, Elisabeth Paramythiotou, Jacques F Meis, Iraklis Tsangaris Spyros Pournaras.
Candida auris fungaemia outbreak in a tertiary care academic hospital and emergence of a pan-echinocandin resistant isolate, Greece, 2021 to 2023.
www.eurosurveillance.org
After the start of the COVID-19 pandemic, a rapid rise in reported numbers and wide geographic spread
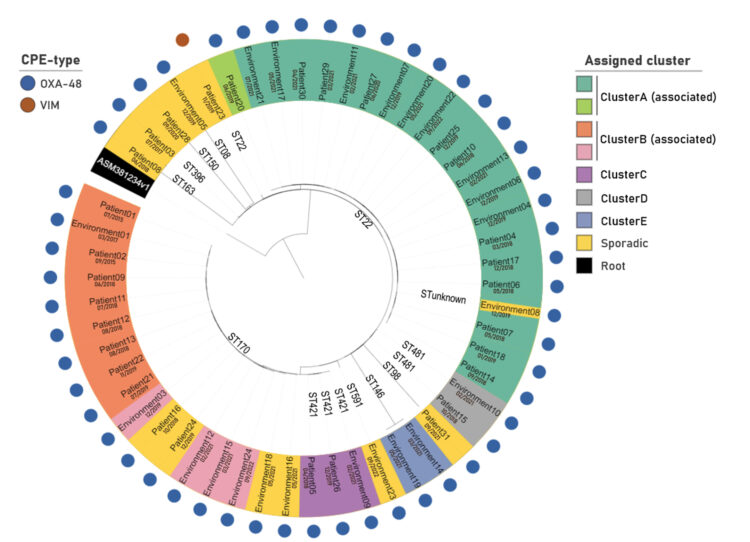
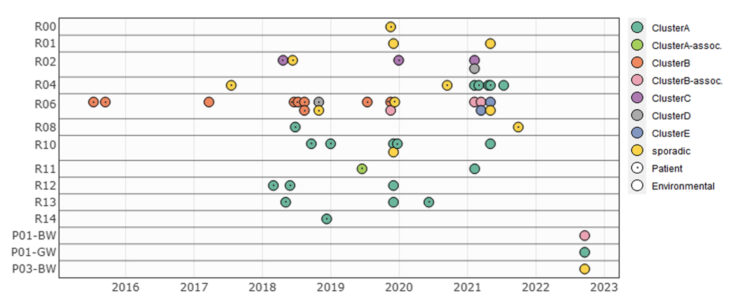
of Candida auris-related invasive infections has been observed globally. However, the contemporary epidemiology of C. auris fungaemias in Greece remains unknown. An outbreak of C. auris bloodstream infections has been ongoing for almost 3 years in a Greek tertiary care academic hospital, with 89 C.auris-driven episodes appearing in five waves every 6–7 months following peaks in colonisation rates by 3–4 months. All isolates clustered in clade I and were genetically related, 84% were fluconazole-resistant and all were non-resistant to amphotericin B and echinocandins, except one pan-echinocandin-resistant isolate (FKS1S639F mutant) recovered from a patient on empiric therapy with anidulafungin. Notably, C.auris was in 2023 the most prevalent (34%) cause of candidaemia in our hospital. The accelerated and longterm transmission dynamics of C. auris fungaemia underscore the need for rigorous infection control measures, while antifungal stewardship is warranted to contain the selection of echinocandin-resistant isolates.
Eelco FJ Meijer, Andreas Voss
Should all hospitalized patients colonised with Candida auris be considered for isolation ?
www.eurosurveillance.org
Candida auris is an emerging pathogenic yeast causing nosocomial infections coupled with high mortality mainly in fragile people. It is considered a serious global health threat and classified as critical fungal pathogen on the World Health Organization (WHO) fungal priority pathogens list and listed on the WHO Global research agenda for antimicrobial resistance [1,2]. The organism’s implications for patients and healthcare systems are high because of its potential for rapid resistance development and transmission within and between healthcare settings. The latter is furthered by the fact that C. auris is difficult to detect under routine laboratory conditions. In addition, decolonisation of patients is challenging and mortality rates in those infected are high..
Mara Cristina Ribeiro Furlan, Adriano Menis Ferreira, Larissa da Silva Barcelos, Marcelo Alessandro Rigotti,Alvaro Francisco Lopes de Sousa, Aires Garcia dos Santos Junior, Denise de Andrade, Margarete Teresa Gottardo de Almeida and da Silva Barreto5
Evaluation of disinfection of surfaces at an outpatient unit before and after an intervention program
Furlan et al. BMC Infectious Diseases, 19 :355, 2019.
Background
Cleaning and disinfection processes must be improved so that there is a reduction in environmental contamination of frequent-contact surfaces. The objective of this study was to evaluate cleaning and disinfection of surfaces at a specialized healthcare unit after an intervention program..
Methods
Exploratory, longitudinal, and correlational study carried out in a medium-complexity clinic. Two hundred and forty samples from five surfaces were collected during three phases: diagnosis; implementation of an intervention program; and evaluation of immediate and long-term effects. In total, 720 evaluations were made, performed through three monitoring methods: visual inspection; adenosine triphosphate bioluminescence assay (ATP); and aerobic colony count (ACC). The Wilcoxon, Mann-Whitney, and Fisher’s Exact tests were run to analyze data statistically.
Results
Cleaning and disinfection of surfaces were not being performed properly in most cases. Failure rates of surfaces reached 37.5 and 100% when the ATP and ACC procedures were used, respectively. However, after an intervention program, an improvement occurred. Success rates increased by 43.96% (ATP) and 12.46% (ACC) in phase I, by 70.6% (ATP) and 82.3% (ACC) immediately after interventions, and by 76.52% (ATP) and 85.76% (ACC) two months after the changes, showing that the program was effective.
Conclusion
The present study reveals that implementing intervention actions with a cleaning and healthcare team brings benefits to prevent the spread of pathogenic agents through frequently touched hospital surfaces.
Swee Siang Wong, Cheng Hua Huang, Chiu Chu Yang, Yi Pei Hsieh, Chen Ni Kuo, Yi Ru Chen and Li Ching Chen.
Reducing health care-associated infectionsby implementing separated environmental cleaning management measures by using disposable wipes of four colors
Wong et al. Antimicrobial Resistance and Infection Control, 7: 34, 2018.
Background
Environmental cleaning is a fundamental principle of infection control in health care settings. We determined whether implementing separated environmental cleaning management measures in MICU reduced the density of HAI.
Objectives
We performed a 4-month prospective cohort intervention study between August and December 2013, at the MICU of Cathay General hospital. We arranged a training program for all the cleaning staff regarding separated environmental cleaning management measures by using disposable wipes of four colors to clean the patients’ bedside areas, areas at a high risk of contamination, paperwork areas, and public areas. Fifteen high-touch surfaces were selected for cleanliness evaluation by using the adenosine triphosphate (ATP) bioluminescence test. Then data regarding HAI densities in the MICU were collected during the baseline, intervention, and late periods.
Results
A total of 120 ATP readings were obtained. The total number of clean high-touch surfaces increased from 13% to 53%, whereas that of unclean high-touch surface decreased from 47% to 20%. The densities of HAI were 14.32‰ and 14.90‰ during the baseline and intervention periods, respectively. The HAI density did not decrease aftert he intervention period, but it decreased to 9.07‰ during the late period.
Conclusion
Implementing separated environmental cleaning management measures by using disposable wipes of four colors effectively improves cleanliness in MICU environments. However, no decrease in HAI density was observed within the study period. Considering that achieving high levels of hand-hygiene adherence is difficult, improving environmental cleaning is a crucial adjunctive measure for reducing the incidence of HAIs.
Jason P. Burnham, Emily R. Shives, David K. Warren, Jennifer H. Han, Hilary M. Babcock, CDC Prevention Epicenters Program
Assessment of percent positive agreement between fluorescent marker and ATPase for environmental cleaning monitoring during sequential application in an intensive care unit.
Am J Infect Control 2019 nv 16, 48(4) : 454–455
Terminal room cleaning is of critical importance to prevent pathogen transmission, but the optimal cleaning effectiveness assessment modality is still being investigated. We sequentially compared cleanliness assessment agreement between a fluorescent marker and an adenosine triphosphate bioluminescence method, finding no significant differences between modalities.
Ying-Chun Chen RN, Hui-Mei Huang RN, Pei-Yi Lin RN, Zhi-Yuan Shi MD
Comparing visual inspection and performance observation for evaluation of hospital cleanliness
Am J Infect Control, 2021 nov, 49 : 1511−1514
Background
Environmental cleaning is an effective measure to prevent infections. However, performance observation has been rarely delineated. This study aimed to compare correlations among visual inspection, performance observation, and effectiveness by using adenosine triphosphate bioluminescence (ATP bioluminescence) as a comparator to find out which method is better to assess hospital cleanliness. .
Methods
This prospective study was conducted at a medical center from April 2019 to October 2020. Seven high-touch surfaces were evaluated during and after terminal cleaning by performance observation, visual inspection, and ATP bioluminescence..
Results
The scores by performance observation, visual inspection, and ATP were 55.4%, 87.5%, and 26.6% after cleaning. The correlations between performance observation and visual inspection and between performance observation and ATP interpretation were weak positive (’ = 0.300, 0.324, P < .001). No correlation was between the visual inspection and ATP interpretation (’=0.137). The median of ATP readings was lower in “compliant” group by performance observation and “clean” group by visual inspection than “not compliant” group and “not clean” group (P < .001).
Conclusions
Performance observation combined with ATP would be preferred to include to audit cleanliness on high-risk surfaces. Visual inspection would be a rapid and time-saving assessment tool on low-risk surfaces..
Brett G. Mitchell, Alexandra McGhie, Greg Whiteley, Alison Farrington, Lisa Hall, Kate Halton, Nicole M. White
Evaluating bio-burden of frequently touched surfaces using Adenosine Triphosphate bioluminescence (ATP): Results from the Researching Effective Approaches to Cleaning in Hospitals (REACH) trial.
Infection, Disease & Health, 2020 Aug, 25 : 168-174
Background : Environmental cleaning is an important approach to reducing healthcare-associated infection. The aim of this short research paper is to describe changes in the efficacy of post-discharge cleaning by examining the amount of bio-burden on frequent touch points (FTPs) in patient areas, using a validated Adenosine Triphosphate (ATP) bioluminescence sampling method. In so doing, we present findings from a secondary outcome of a recent trial, the Researching Effective Approaches to Cleaning in Hospitals (REACH) study.
Methods : The REACH study used a prospective, stepped-wedge randomised cluster design. Cross sectional ATP sampling was conducted at three of the 11 participating hospitals. At each hospital, during the control and intervention phase of the study, six Frequent Touch Points (FTPs) were sampled: toilet flush, bathroom tap, inside bathroom door handle, patient call button, over bed tray table, and bed rails.
Results : Across the three hospitals, 519 surfaces in 49 rooms (control phase) and 2856 surfaces in 251 rooms (intervention phase) were sampled. Bedroom FTP cleaning improved across all three hospitals. The cleaning of bathroom FTPs was generally high from the outset and remained consistent throughout the whole study period. Average cleaning outcomes for bathroom FTPs were consistently high during the control period however outcomes varied.
Marc Verhougstraete, Emily Cooksey, Jennifer-Pearce Walker, Amanda M. Wilson, Madeline S. Lewis, Aaron Yoder, Gabriela Elizondo-Craig, Munthir Almoslem,Emily Forysiak, Mark H. Weir.
Impact of terminal cleaning in rooms previously occupied by patients with healthcare-associated infections
Plos One, 10 : 1-14, 2024
Healthcare associated infections (HAIs) are costly but preventable. A limited understanding of the effects of environmental cleaning on the riskiest HAI associated pathogens is a current challenge in HAI prevention. This project aimed to quantify the effects of terminal hospital cleaning practices on HAI pathogens via environmental sampling in three hospitals located throughout the United States. Surfaces were swabbed from 36 occupied patient rooms with a laboratory-confirmed, hospital- or community-acquired infection of at least one of the four pathogens of interest (i.e., Acinetobacter baumannii (A. baumannii), methicillin resistant Staphylococcus aureus (MRSA), vancomycin resistant Enterococcus faecalis/faecium (VRE), and Clostridioides difficile (C. difficile)). Six nonporous, high touch surfaces (i.e., chair handrail, bed handrail, nurse call button, desk surface, bathroom counter near the sink, and a grab bar near the toilet) were sampled in each room for Adenosine Triphosphate (ATP) and the four pathogens of interest before and after terminal cleaning. The four pathogens of interest were detected on surfaces before and after terminal cleaning, but their levels were generally reduced. Overall, C. difficile was confirmed on the desk (n = 2), while MRSA (n = 24) and VRE (n = 25) were confirmed on all surface types before terminal cleaning.
After cleaning, only MRSA (n = 6) on bed handrail, chair handrail, and nurse call button and VRE (n = 5) on bathroom sink, bed handrail, nurse call button, toilet grab bar, and C. difficile (n = 1) were confirmed. At 2 of the 3 hospitals, pathogens were generally reduced by >99% during terminal cleaning. One hospital showed that VRE increased after terminal cleaning, MRSA was reduced by 73% on the nurse call button, and VRE was reduced by only 50% on the bathroom sink. ATP detections did not correlate with any pathogen concentration.
This study highlights the importance of terminal cleaning and indicates room for improvement in cleaning practices to reduce surface contamination throughout hospital rooms.