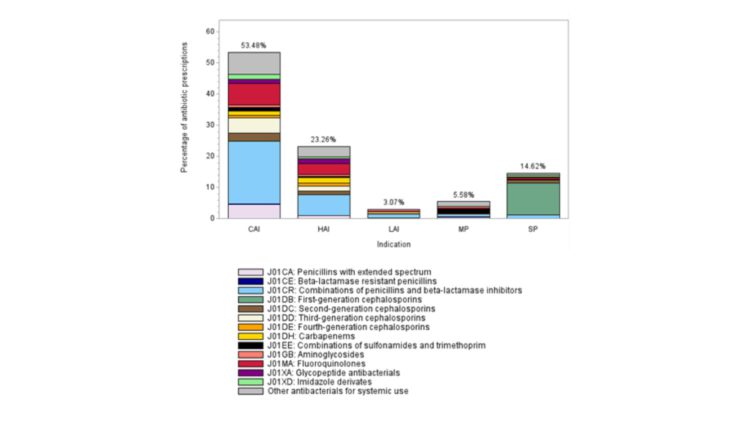
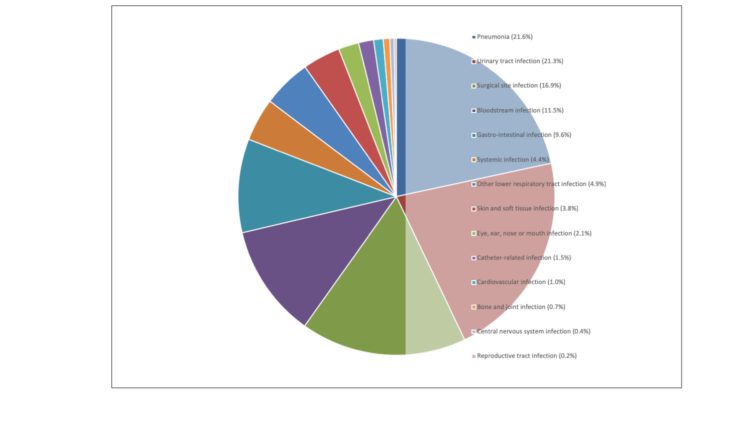
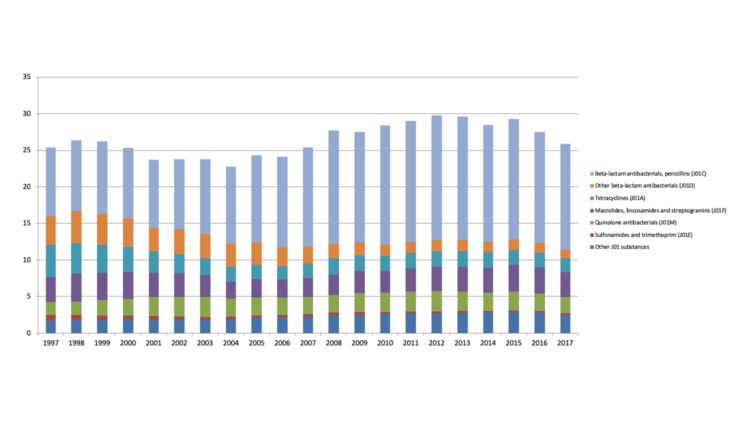
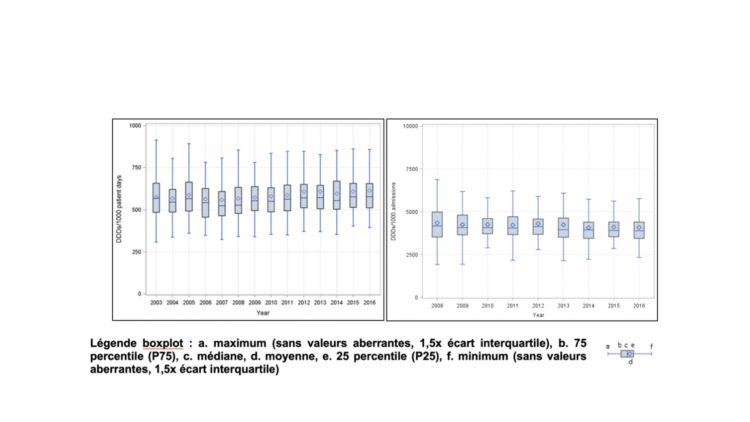
Résumé
En quelques années, Candida auris s’est muée dans le monde entier en une cause d’épidémies hospitalières difficile à maîtriser. L’identification de ce pathogène opportuniste est souvent problématique. Le germe est en outre fréquemment résistant à plusieurs agents antifongiques. La première infection isolée recensée en Belgique remonte à 2016. Une récente évaluation réalisée par Sciensano a cependant démontré que de nombreux laboratoires n’affichaient toujours pas une performance adéquate en matière d’identification et de déclaration de C. auris. L’incidence croissante à l’échelle mondiale requiert une meilleure familiarisation des microbiologistes et cliniciens avec les difficultés liées à l’identification, à la maîtrise des infections et au traitement de cette levure.
Introduction
C’est en 2009 que C. auris. a été découverte au Japon et en Corée du Sud et considérée comme une nouvelle espèce. Cette levure fut identifiée pour la première fois dans des études de surveillance sur la résistance antifongique d’espèces étroitement liées à Candida haemulonii (1,2). Les isolats, tous cultivés dans les exsudats de patients souffrant d’otite moyenne, ont été baptisés auris (Lat. « oreille »). Cette espèce est tombée dans une obscurité relative jusqu’en 2011, lors de la parution d’un premier rapport sur une série de candidémies, à nouveau en Corée du Sud(3). Dans les années qui suivirent sont apparus les premiers cas d’infections opportunistes invasives en Asie du Sud (2013) (4), au Moyen-Orient (2014) (5), en Afrique du Sud (2014) (6) et en Amérique du Sud (2016) (7). Fréquemment, les isolats étaient erronément initialement identifiés comme C. haemulonii et une résistance au fluconazole a toujours été remarquée. La première série de cas signalés en Europe (en 2016) concernait deux épidémies hospitalières indépendantes : une en Grande-Bretagne et une en Espagne. (8,9). Plus de 50 et 140 patients étaient respectivement impliqués. Depuis lors, deux épidémies supplémentaires ont été signalées en Grande-Bretagne et la levure a également été identifiée dans différents autres pays européens (10). Nous avons récemment décrit un premier cas isolé en Belgique, constaté chez un patient provenant du Koweït(11). L’expansion mondialement visible de C. auris reste en large mesure incomprise. Une analyse de phylogénétique démontre une montée récente et simultanée de quatre clones phylogénétiques sur différents continents tels que Afrique du Sud, Amérique du Sud, Asie de l’Est et Asie du Sud (12). Dans ces régions, la levure est endémique, mais le réservoir naturel et les facteurs favorisant cette récente montée demeurent incertains(13). Des études rétrospectives de collections d’isolats cliniques confirment que la levure était très rare avant 2010. Son absence antérieure dans la clinique n’est donc pas le simple fruit d’une erreur d’identification(12). La diffusion et l’établissement dans des zones non endémiques semblent reposer sur une capacité de persistance inhabituelle chez des porteurs asymptomatiques et dans l’environnement hospitalier (8). Une récente évaluation de laboratoires cliniques organisée par Sciensano (évaluation de qualité externe, avril 2018) a mis au jour un nombre alarmant d’erreurs d’identification d’un échantillon en aveugle et un manque de familiarisation des personnes interrogées avec les implications pour l’hygiène hospitalière(14). Dans ce texte, nous allons brièvement expliquer des aspects importants du diagnostic, de la politique d’hygiène hospitalière et du traitement.
Identification
Dans une évaluation en aveugle menée auprès de 145 laboratoires cliniques belges au début de 2018, 40 % des laboratoires interrogés n’ont pas réussi à procéder à une identification correcte de cette levure (14). Les difficultés d’identification de C. auris à l’aide de méthodes de routine sont connues(15). Dans le cas des systèmes biochimiques, on parle d’erreurs d’identification variées, souvent spécifiques à l’appareil(16). Le système Vitek 2 YST ID, fréquemment utilisé en Belgique (version 7.01) (bioMérieux, Marcy-L’Etoile, France), identifie de manière cohérente les isolats en tant que Candida haemulonii ou, plus rarement, C. duobushaemulonii. Vu que ces espèces étroitement liées sont caractérisées par un profil biochimique unique, une différenciation devrait être en principe possible sur plusieurs des systèmes existants. bioMérieux a lancé début 2018 une nouvelle version de bibliothèque pour la plateforme YST ID (version 8.01), grâce à laquelle quelques laboratoires interrogés (8 sur les 36 utilisateurs Vitek) sont parvenus à une identification correcte de la souche envoyée. D’autres systèmes d’identification des levures, comme le BD Phoenix (BD-Diagnostics, Sparks, M.D., États-Unis) et le MicroScan (Beckman Coulter, Pasadena, C.A., États-Unis) ne sont à ce jour pas adaptés pour l’identification.
Nombre de laboratoires utilisent la spectrométrie de masse MALDI-TOF pour les identifications routinières de levures. Deux systèmes sont disponibles sur le marché : Bruker Biotyper (Bruker Daltonics, Brême, Allemagne) et Vitek MS (bioMérieux, Marcy-l’Etoile, France). Les spectres de référence de C. auris sont disponibles depuis quelques années déjà dans les bibliothèques research-use only (RUO) des deux systèmes. Dans une première étude de validation limitée de ces bibliothèques RUO, dix isolats C. auris ont été identifiés de manière fiable par les deux appareils(17). Dans l’évaluation belge, la souche a cependant été pour une partie importante d’utilisateurs MALDI-TOF MS à l’origine d’erreurs d’identification ou d’échecs d’identification (assortis de scores de fiabilité inadéquatement bas). Vitek MS, tant en mode RUO qu’en mode CE-IVD, peut être à l’origine d’erreurs d’identification de C. auris en tant que C. haemulonii ou, plus rarement, en tant que C. lusitaniae (16,18). Lorsque, pour le Biotyper, aucune erreur d’identification n’a été décrite, il est apparu, pour certaines souches de C. auris, qu’il était incapable d’obtenir des identifications assorties d’un score de fiabilité adéquat (notamment pour certaines souches provenant du Moyen-Orient) (11,19,20). La performance de systèmes MALDI-TOF dépend du degré de similitude entre les spectres mesurés et les spectres de référence dans la bibliothèque de référence. Pour C. auris, il existe d’importantes différences spectrales entre les souches appartenant à différents clones géographiques, ce qui explique probablement la performance aléatoire des systèmes MALDI-TOF(21). Tant Bruker que bioMérieux fournissent depuis l’été 2018 des bibliothèques cliniquement validées (approuvées par CE-IVD et la FDA) pour l’identification de C. auris.
Concernant la surveillance belge, environ 90 % des laboratoires cliniques utilisent un système MALDI-TOF ou la plateforme Vitek pour l’identification de la levure. Moyennant actualisation des bibliothèques de référence concernées, C. auris pourra donc être correctement identifiée dans la plupart des laboratoires belges. Les utilisateurs des autres systèmes biochimiques doivent être familiarisés avec les potentielles erreurs d’identification de C. auris sur leur système. La réidentification d’isolats conservés, identifiés au préalable en tant que C. haemulonii (ou des espèces apparentées) peut également s’avérer utile à des fins épidémiologiques.
Aspects cliniques
L’identification correcte de C. auris a des implications cliniques majeures, au vu de l’insensibilité pratiquement universelle des isolats au fluconazole, encore souvent utilisé de manière empirique pour la candidémie (22). Cette espèce présente également un potentiel de résistance acquise aux autres azoles (par ex. voriconazole : dans 15 à 50 % des isolats, MIC > 1 mg/L), à l’amphotéricine B (10 à 35 %, MIC > 1 mg/L), et aux échinocandines (< 10 %, MIC > 2 mg/L) (12,23,24). Dans une étude portant sur 54 isolats d’origine géographique différente, 41 % étaient résistants à deux classes d’agents antifongiques. Deux isolats étaient résistants aux azoles, échinocandines et à l’amphotéricine B (12). Dans une autre étude, des isolats cliniques avec pan-résistance acquise ont été signalés (25). Cette multirésistance potentielle rend dès lors une bonne maîtrise des infections cruciale.
Pour le traitement empirique de cas d’infection par C. auris, des échinocandines sont recommandées en attendant un fongigramme. Pour les infections urinaires, ou lorsque le système nerveux central est également impliqué, l’amphotéricine B ou la 5-fluorocytosine est préconisée (22). En sa qualité de pathogène opportuniste, C. auris est exclusivement pathogène en présence de certains facteurs de risque chez l’hôte. Ils sont identiques à ceux des infections systémiques avec d’autres espèces de Candida. Les patients ont souvent des comorbidités importantes et un cathéter urinaire ou intravasculaire a fréquemment été impliqué, tout comme une thérapie antibactérienne ou antifongique antérieure a été suivie (26). Une étude a démontré que le chiffre de mortalité général dans une population avec candidémie à C. auris était comparable à celui observé pour C. glabrata (27).
Aspects de l’hygiène hospitalière
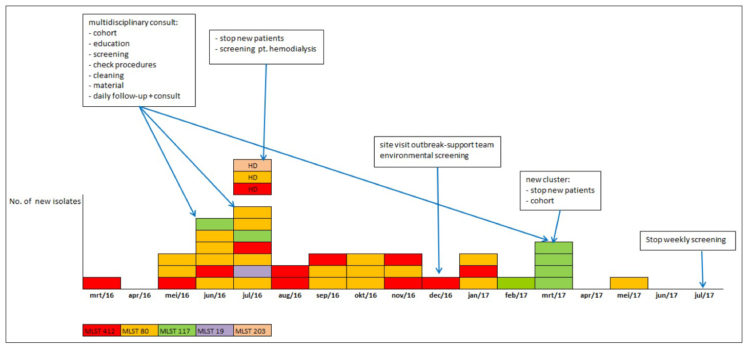
Des épidémies clonales ont occasionnellement été signalées pour diverses espèces de Candida(28). Des épidémies à C. auris semblent cependant uniques en termes d’ampleur (très étendues voire des épidémies clonales multicentriques) et de tendance à la persistance (10,29). Le caractère persistant de l’épidémie susmentionnée a récemment été décrit dans un centre tertiaire espagnol (9). Au bout d’un an, plus de 150 patients avaient été impliqués (cas cliniques et patients colonisés). En dépit de la mise en œuvre de mesures strictes, l’épidémie semble prendre une forme endémique : deux ans après son apparition, des patients nouvellement colonisés continuent d’être identifiés. Le potentiel de provocation d’épidémies hospitalières est peut-être trop méconnu des microbiologistes belges. Seuls 28 (des 145) laboratoires ont admis avoir envoyé la souche à un laboratoire de référence pour raisons épidémiologiques. Seuls 2 des 85 laboratoires interrogés ayant identifié C. auris ont admis (dans un champ de texte libre) que des mesures d’isolation devraient être mises en œuvre (Dr K. Vernelen, données non publiées). Vu que la question sur l’isolation ou d’autres mesures d’hygiène hospitalière n’a pas été posée explicitement, ce chiffre est probablement une sous-estimation.
Les déterminants d’une diffusion efficace de cette espèce dans l’environnement hospitalier et sa colonisation sont encore mal compris. Dans les cas cliniques, une colonisation étendue de l’environnement immédiat du patient a été constatée (9,30). Des études expérimentales ont prouvé la persistance de cellules viables sur des surfaces en plastique sèches pendant plus de deux semaines (une propriété partagée avec C. parapsilosis) (31). Des données in vitro démontrent quant à elles une insensibilité relative de C. auris (et de C. glabrata et C. albicans) aux dérivés de l’ammonium quaternaire (en comparaison à la mort cellulaire obtenue pour le MRSA) (32). Dans l’épidémie espagnole, un prélèvement de culture de murs de chambres de patients nettoyés avec des dérivés de l’ammonium est restée positive à C. auris (9). Lors d’une épidémie britannique dans une unité de soins intensifs, des thermomètres axillaires colonisés sont apparus être un facteur causal (33). La contamination de surfaces (et de matériel médical) semble donc jouer un rôle important dans la diffusion nosocomiale et la persistance (9,34,35). Le CDC recommande l’utilisation d’un désinfectant avec activité sporicide (36).
Les patients asymptomatiques peuvent rester colonisés pendant un très long moment et par conséquent provoquer une contamination soutenue de l’environnement et/ou d’autres patients. Dans le cas du patient de notre centre, nous avons constaté un portage persistant pendant au moins 18 mois à compter de l’infection aigüe (11). Le CDC et d’autres instances recommandent des précautions de type contacts pour tous les patients infectés ou colonisés avec C. auris (22). Le respect des prescriptions de l’hygiène des mains reste indispensable pour éviter la transmission par les professionnels des soins de santé et la colonisation de ces derniers (30,35). L’identification de la colonisation peut se faire par le biais de prélèvements de culture au niveau de l’aine et des aisselles, les sites les plus fréquemment colonisés(36). Des schémas de décolonisation à base de chlorhexidine et éventuellement de nystatine per os se sont montrés efficaces chez différents patients (mais pas tous) (22,35,37).
Les infections dans des zones non endémiques ne présentent pas toujours un lien avec une transmission dans une région endémique. Les premiers patients en Grande-Bretagne et aux États-Unis n’avaient pas voyagé dans des zones endémiques des souches C. auris concernées (comme vérifié à l’aide d’un typage moléculaire) (30,38,39). Six des sept premiers isolats américains font partie de deux clusters clonaux, chacun lié à un hôpital commun aux États-Unis. (39). On sait peu de choses à propos du rôle d’éventuels réservoirs et de la transmission dans la communauté. Une étude britannique n’a identifié la colonisation avec C. auris que dans 1 des 2 246 patients nouvellement admis examinés(30). Il est vraisemblable que la transmission nosocomiale dans les pays non endémiques reste le principal mode de transmission. L’ECDC recommande uniquement l’examen et l’isolation préventive de patients provenant d’hôpitaux étrangers où C. auris a été détecté ou y ayant été récemment admis (40). Le dossier de reprise du patient dans notre centre ne fait nullement mention du risque qu’il soit porteur de C. auris. La prudence est donc de mise pour tous les patients qui sont entrés en contact avec des soins de santé dans les zones à risque.
Suite à l’attention internationale croissante accordée à cette levure montante, un « risk assessment group » belge a été créé. Il a formulé les avis suivants.
Recommandations du Risk Assesment Group (RAG) belge Candida auris. (14)
• Toutes les variétés de Candida non-albicans invasives
doivent être identifiées au niveau de l’espèce, en fonction du démarrage d’une thérapie antifongique correcte et d’éventuelles mesures d’isolation nécessaires. Lors de problèmes d’identification, des isolats peuvent être envoyés au Centre National de Référence pour les Mycoses (NRCM).
• Les hôpitaux confrontés à une épidémie de C. auris (deux cas présentant un lien potentiel en termes de temps, lieu et personne) sont invités à contacter l’Outbreak Support Team (OST). Il est possible de la contacter par le biais de l’inspection de santé provinciale.
• Les conseils consultatifs pour l’hygiène hospitalière doivent veiller à la mise en œuvre et au respect de mesures d’identification de contamination environnementale fongique et des mesures spécifiques pour la décontamination environnementale dans les unités de soins intensifs.
• Voici les éléments clés de la prévention et de la maîtrise d’infections :
oDépistage de spécimens cliniquement significatifs dans les environnements hospitaliers à risque élevé et auprès de patients présentant un risque élevé
oMesures de prévention et de maîtrise des infections générales pour l’environnement et le matériel médical (par ex. : isolation stricte, décolonisation, dépistage étendu, nettoyage régulier de l’environnement du patient et du matériel médical)
oRespect des prescriptions en matière d’hygiène des mains
oTraitement adéquat des déchets et linges potentiellement contaminés
oAntifungal stewardship
Références :
1. Satoh K, Makimura K, Hasumi Y, Nishiyama Y, Uchida K, Yamaguchi H. Candida auris sp. nov., a novel ascomycetous yeast isolated from the external ear canal of an inpatient in a Japanese hospital. Microbiol Immunol. 2009 Jan;53(1):41–4.
2. Kim M, Shin JH, Sung H, Lee K, Kim E, Ryoo N, et al. Candida haemulonii and Closely Related Species at 5 University Hospitals in Korea: Identification, Antifungal Susceptibility, and Clinical Features. Clin Infect Dis. 2009 Mar 15;48(6):e57–61.
3. Lee WG, Shin JH, Uh Y, Kang MG, Kim SH, Park KH, et al. First Three Reported Cases of Nosocomial Fungemia Caused by Candida auris. J Clin Microbiol. 2011 Sep;49(9):3139–42.
4. Chowdhary A, Sharma C, Duggal S, Agarwal K, Prakash A, Singh PK, et al. New Clonal Strain of Candida auris, Delhi, India: New Clonal Strain of Candida auris, Delhi, India. Emerg Infect Dis. 2013 Oct;19(10):1670–3.
5. Emara M, Ahmad S, Khan Z, Joseph L, Al-Obaid I, Purohit P, et al. Candida auris Candidemia in Kuwait, 2014. Emerg Infect Dis. 2015 Jun;21(6):1091–2.
6. Magobo RE, Corcoran C, eetharam S, Govender NP. Candida auris-Associated Candidemia, South Africa. Emerging Infectious Diseases. 2014;20(7):1250–1.
7. Calvo B, Melo ASA, Perozo-Mena A, Hernandez M, Francisco EC, Hagen F, et al. First report of Candida auris in America: Clinical and microbiological aspects of 18 episodes of candidemia. J Infect. 2016 Oct;73(4):369–74.
8. Schelenz S, Hagen F, Rhodes JL, Abdolrasouli A, Chowdhary A, Hall A, et al. First hospital outbreak of the globally emerging Candida auris in a European hospital. Antimicrob Resist Infect Control. 2016 Dec;5(1).
9. Ruiz-Gaitan A, Moret AM, Tasias-Pitarch M, Aleixandre-Lopez AI, Martínez-Morel H, Calabuig E, et al. An outbreak due to Candida auris with prolonged colonization and candidemia in a tertiary care European hospital. Mycoses. 2018 Jul;61(7):498–505.
10. Kohlenberg A, Struelens MJ, Monnet DL, Plachouras D, The Candida auris survey collaborative group. Candida auris: epidemiological situation, laboratory capacity and preparedness in European Union and European Economic Area countries, 2013 to 2017. Eurosurveillance. 2018 Mar 29;23(13).
11. Dewaele K, Frans J, Smismans A, Ho E, Tollens T, Lagrou K. (In press) First case of Candida auris infection in Belgium in a surgical patient from Kuwait. Acta Clin Belg.
12. Lockhart SR, Etienne KA, Vallabhaneni S, Farooqi J, Chowdhary A, Govender NP, et al. Simultaneous Emergence of Multidrug-Resistant Candida auris on 3 Continents Confirmed by Whole-Genome Sequencing and Epidemiological Analyses. Clin Infect Dis. 2017 Jan 15;64(2):134–40.
13. Chowdhary A, Sharma C, Duggal S, Agarwal K, Prakash A, Singh PK, et al. New Clonal Strain of Candida auris, Delhi, India. Emerg Infect Dis. 2013 Oct;19(10):1670–3.
14. Sciensano. Definitief globaal rapport Micro/Sero/Para Enquête 2018/2. M/14905 Candida auris (hemocultuur) [Internet]. 2018 [cited 2018 Oct 14]. Available from: https://www.wiv-isp.be/QML/activities/external_quality/rapports/_down/microbiologie/2018/2018-02-MICROBIO-N.pdf
15. Chowdhary A, Sharma C, Meis JF. Candida auris: A rapidly emerging cause of hospital-acquired multidrug-resistant fungal infections globally. Hogan DA, editor. PLOS Pathog. 2017 May 18;13(5):e1006290.
16. Centers for Disease Control and Prevention. Recommendations for Identification of Candida auris. In: Candida auris, Fungal Diseases [Internet]. 2018 [cited 2018 Aug 31]. Available from: https://www.cdc.gov/fungal/candida-auris/recommendations.html
17. Mizusawa M, Miller H, Green R, Lee R, Durante M, Perkins R, et al. Can Multidrug-Resistant Candida auris Be Reliably Identified in Clinical Microbiology Laboratories? Warnock DW, editor. J Clin Microbiol. 2017 Feb;55(2):638–40.
18. Ruiz-Gaitán A, Moret AM, Tasias-Pitarch M, Aleixandre-López AI, Martínez-Morel H, Calabuig E, et al. An outbreak due to Candida auris with prolonged colonisation and candidaemia in a tertiary care European hospital. Mycoses. 2018 Jul;61(7):498–505.
19. Pekard-Amenitsch S, Schriebl A, Posawetz W, Willinger B, Kölli B, Buzina W. Isolation of Candida auris from Ear of Otherwise Healthy Patient, Austria, 2018. Emerg Infect Dis. 2018 Aug;24(8):1596–7.
20. Desoubeaux G, Bailly É, Guillaume C, De Kyvon M-A, Tellier A-C, Morange V, et al. Candida auris in contemporary mycology labs: A few practical tricks to identify it reliably according to one recent French experience. J Mycol Médicale. 2018 Jun;28(2):407–10.
21. Kathuria S, Singh PK, Sharma C, Prakash A, Masih A, Kumar A, et al. Multidrug-Resistant Candida auris Misidentified as Candida haemulonii: Characterization by Matrix-Assisted Laser Desorption Ionization–Time of Flight Mass Spectrometry and DNA Sequencing and Its Antifungal Susceptibility Profile Variability by Vitek 2, CLSI Broth Microdilution, and Etest Method. Warnock DW, editor. J Clin Microbiol. 2015 Jun;53(6):1823–30.
22. Jeffery-Smith A, Taori SK, Schelenz S, Jeffery K, Johnson EM, Borman A, et al. Candida auris: a Review of the Literature. Clin Microbiol Rev. 2017 Nov 15;31(1):e00029-17.
23. Chowdhary A, Prakash A, Sharma C, Kordalewska M, Kumar A, Sarma S, et al. A multicentre study of antifungal susceptibility patterns among 350 Candida auris isolates (2009–17) in India: role of the ERG11 and FKS1 genes in azole and echinocandin resistance. J Antimicrob Chemother. 2018 Apr 1;73(4):891–9.
24. Arendrup MC, Prakash A, Meletiadis J, Sharma C, Chowdhary A. Comparison of EUCAST and CLSI Reference Microdilution MICs of Eight Antifungal Compounds for Candida auris and Associated Tentative Epidemiological Cutoff Values. Antimicrob Agents Chemother. 2017 Jun;61(6).
25. Rhodes J, Abdolrasouli A, Farrer RA, Cuomo CA, Aanensen DM, Armstrong-James D, et al. Genomic epidemiology of the UK outbreak of the emerging human fungal pathogen Candida auris. Emerg Microbes Infect. 2018 Dec; 7(1).
26. Sears D, Schwartz BS. Candida auris: An emerging multidrug-resistant pathogen. Int J Infect Dis. 2017 Oct;63:95–8.
27. Rudramurthy SM, Chakrabarti A, Paul RA, Sood P, Kaur H, Capoor MR, et al. Candida auris candidaemia in Indian ICUs: analysis of risk factors. J Antimicrob Chemother. 2017 Jun;72(6):1794–801.
28. Pfaller MA. Nosocomial Candidiasis: Emerging Species, Reservoirs, and Modes of Transmission. Clin Infect Dis. 1996 May 1;22(Supplement_2):S89–94.
29. Kim M, Shin JH, Sung H, Lee K, Kim E, Ryoo N, et al. Candida haemulonii and Closely Related Species at 5 University Hospitals in Korea: Identification, Antifungal Susceptibility, and Clinical Features. Clin Infect Dis. 2009 Mar 15;48(6):e57–61.
30. Schelenz S, Hagen F, Rhodes JL, Abdolrasouli A, Chowdhary A, Hall A, et al. First hospital outbreak of the globally emerging Candida auris in a European hospital. Antimicrob Resist Infect Control. 2016 Dec;5(1).
31. Welsh RM, Bentz ML, Shams A, Houston H, Lyons A, Rose LJ, et al. Survival, Persistence, and Isolation of the Emerging Multidrug-Resistant Pathogenic Yeast Candida auris on a Plastic Health Care Surface. Diekema DJ, editor. J Clin Microbiol. 2017 Oct;55(10):2996–3005.
32. Cadnum JL, Shaikh AA, Piedrahita CT, Sankar T, Jencson AL, Larkin EL, et al. Effectiveness of Disinfectants Against Candida auris and Other Candida Species. Infect Control Hosp Epidemiol. 2017 Oct;38(10):1240–3.
33. Eyre DW, Sheppard AE, Madder H, Moir I, Moroney R, Quan TP, et al. A Candida auris Outbreak and Its Control in an Intensive Care Setting. N Engl J Med. 2018 Oct 4;379(14):1322–31.
34. Piedrahita CT, Cadnum JL, Jencson AL, Shaikh AA, Ghannoum MA, Donskey CJ. Environmental Surfaces in Healthcare Facilities are a Potential Source for Transmission of Candida auris and Other Candida Species. Infect Control Hosp Epidemiol. 2017 Sep;38(09):1107–9.
35. Biswal M, Rudramurthy SM, Jain N, Shamanth AS, Sharma D, Jain K, et al. Controlling a possible outbreak of Candida auris infection: lessons learnt from multiple interventions. J Hosp Infect. 2017 Dec;97(4):363–70.
36. Centers for Disease Control and Prevention. Recommendations for Infection Prevention and Control for Candida auris. In: Candida auris, Fungal Diseases [Internet]. 2018 [cited 2018 May 20]. Available from: https://www.cdc.gov/fungal/candida-auris/c-auris-infection-control.html
37. Ku TSN, Walraven CJ, Lee SA. Candida auris: Disinfectants and Implications for Infection Control. Front Microbiol. 2018 Apr 12;9.
38. Rhodes J, Abdolrasouli A, Farrer RA, Cuomo CA, Aanensen DM, Armstrong-James D, et al. Genomic epidemiology of the UK outbreak of the emerging human fungal pathogen Candida auris. Emerg Microbes Infect. 2018 Dec;7(1).
39. Vallabhaneni S, Kallen A, Tsay S, Chow N, Welsh R, Kerins J, et al. Investigation of the First Seven Reported Cases of Candida auris, a Globally Emerging Invasive, Multidrug-Resistant Fungus—United States, May 2013–August 2016. Am J Transplant. 17(1):296–9.
40. European Centre for Disease Prevention and Control. Candida auris in healthcare settings – Europe – first update, 23 April 2018. Stockholm: ECDC; 2018.










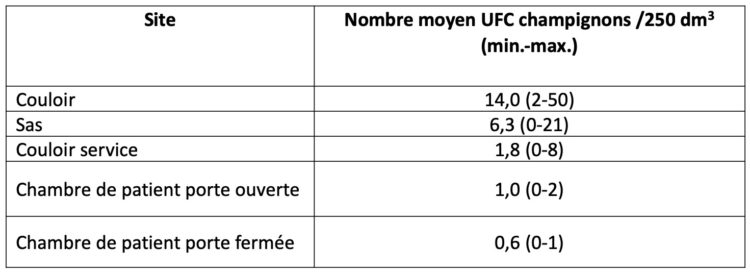
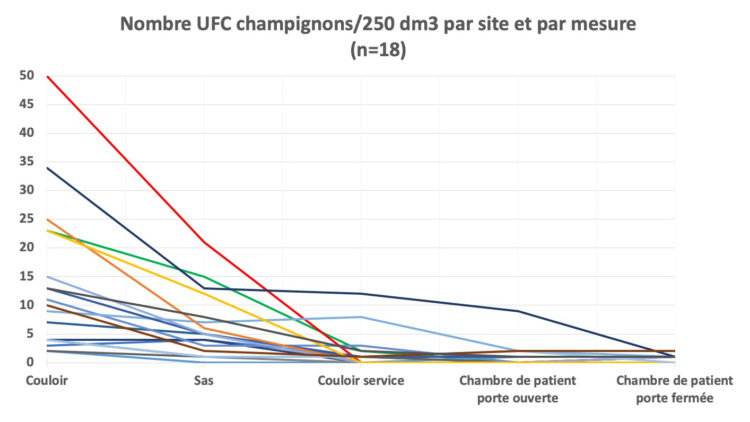
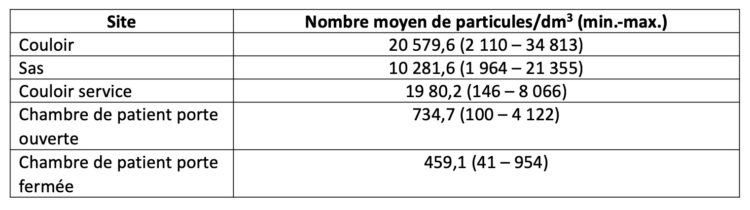
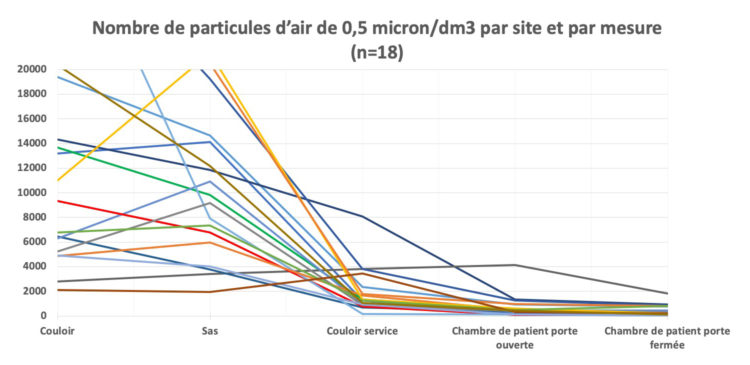
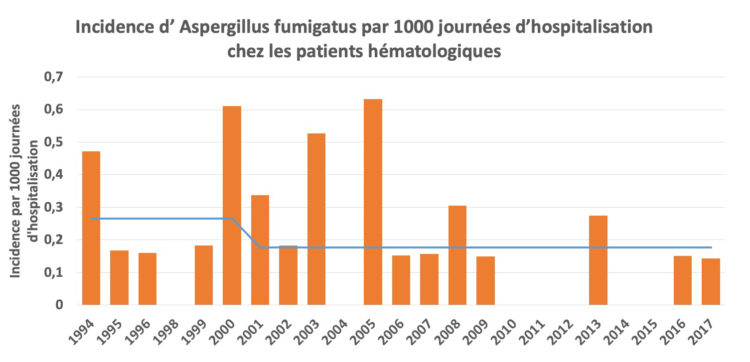
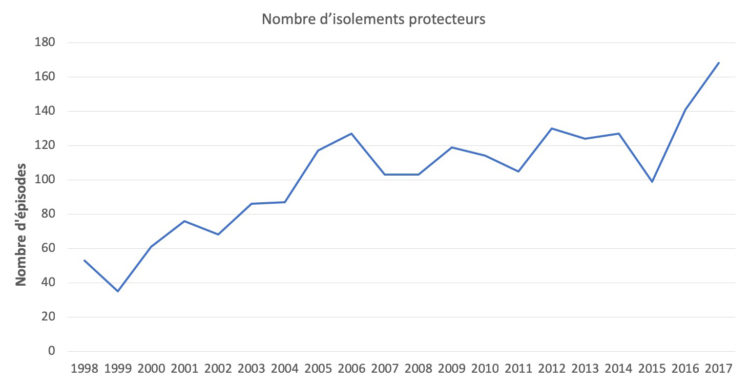
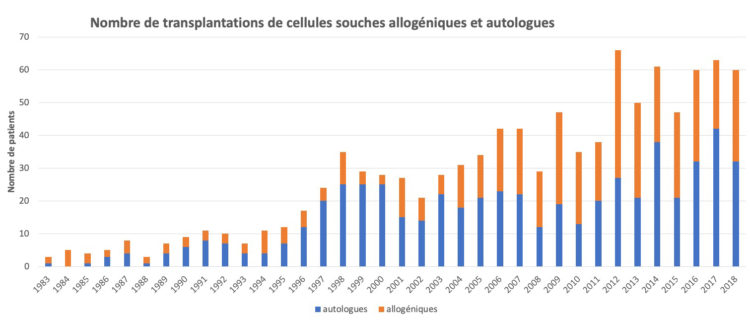
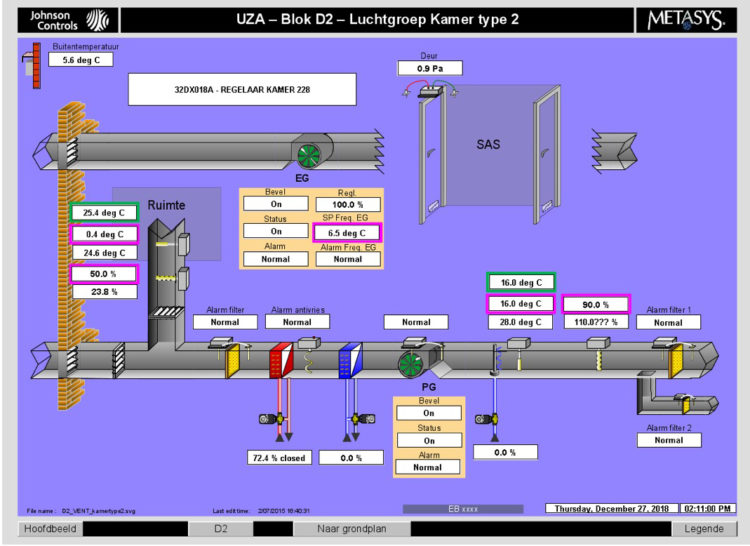



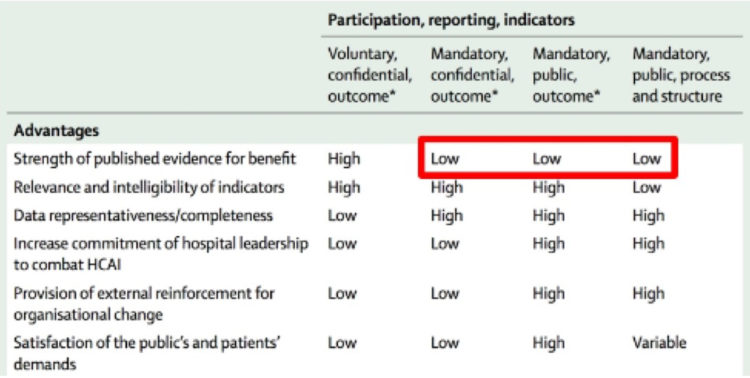
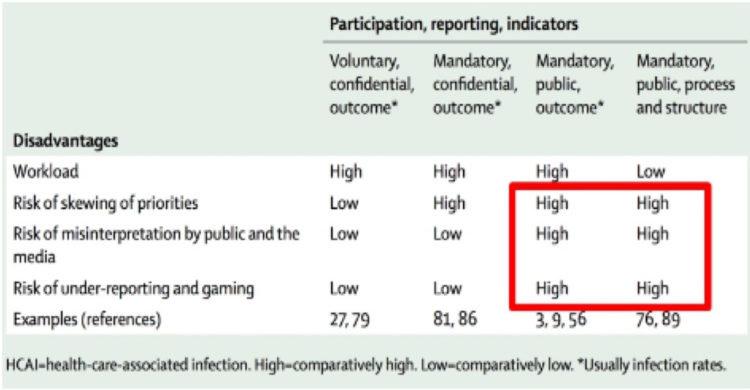
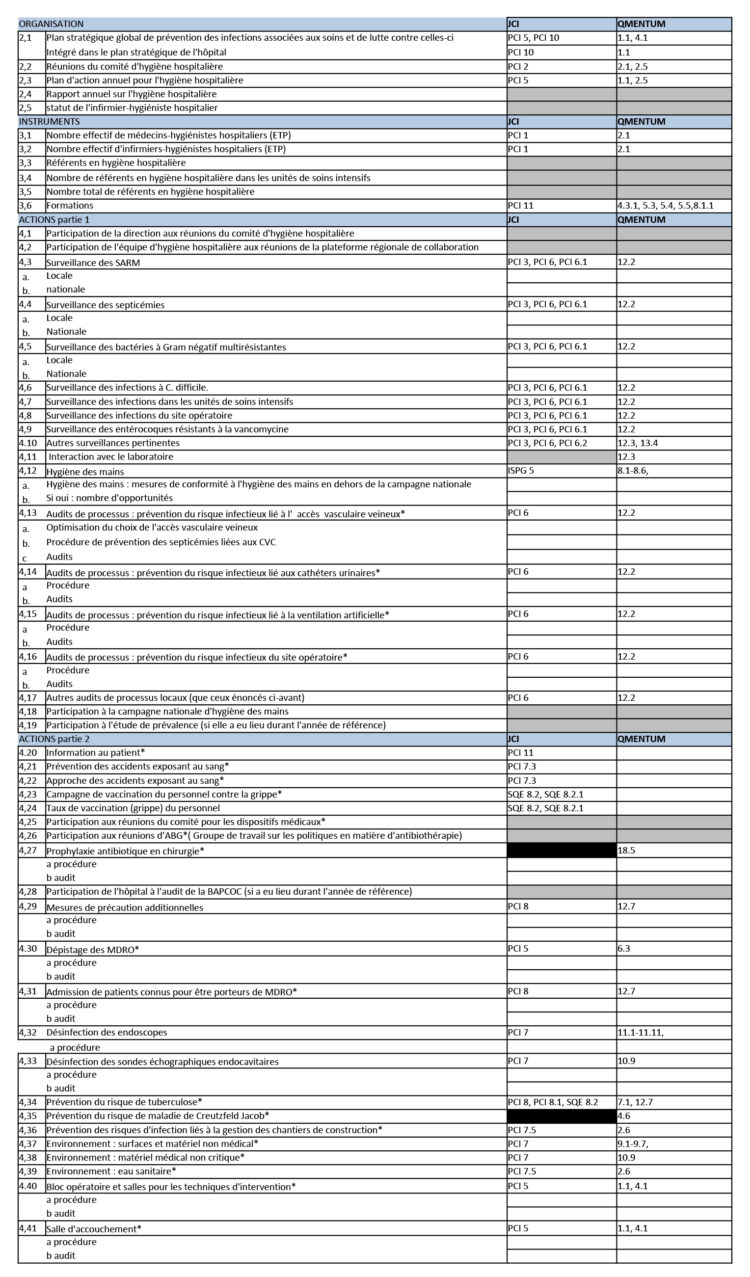
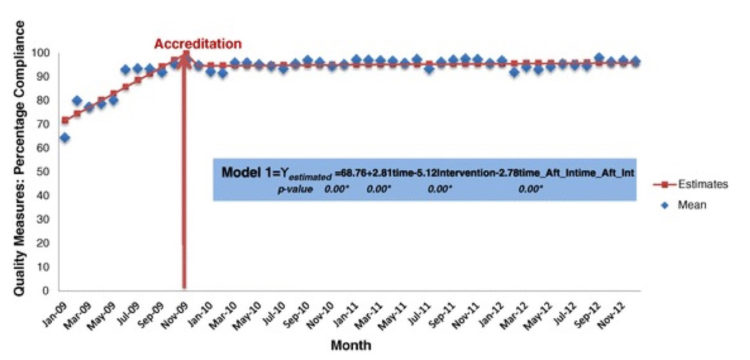
 Les hôpitaux flamands ont volontairement opté massivement pour l’accréditation par une organisation externe indépendante (JCI ou NIAZ). Au moyen de traceurs, les auditeurs examinent la façon dont les professionnels font leur travail en mettant notamment l’accent sur l’hygiène et la prévention des infections. Quiconque fournit à ces organismes une qualité démontrable n’a pas besoin que le gouvernement lui impose des contraintes administratives et réglementaires. L’accréditation n’est un but en soi pour aucun hôpital flamand. C’est juste un outil, un instrument pour fournir de bons soins.
Les hôpitaux flamands ont volontairement opté massivement pour l’accréditation par une organisation externe indépendante (JCI ou NIAZ). Au moyen de traceurs, les auditeurs examinent la façon dont les professionnels font leur travail en mettant notamment l’accent sur l’hygiène et la prévention des infections. Quiconque fournit à ces organismes une qualité démontrable n’a pas besoin que le gouvernement lui impose des contraintes administratives et réglementaires. L’accréditation n’est un but en soi pour aucun hôpital flamand. C’est juste un outil, un instrument pour fournir de bons soins.