Résumé
Contexte : les infections nosocomiales restent un problème de taille au sein de la plupart des unités de soins intensifs (USI). La non-observance par le personnel clinique de l’hygiène des mains accroît la prévalence de maladies évitables. Nous faisons un rapport sur le résultat de la campagne d’hygiène des mains belge nationale menée de 2005 à 2015, l’accent portant sur les unités de soins intensifs.
Méthodes : grâce à la grille d’observation normalisée de l’Organisation mondiale de la santé (OMS), des équipes de prévention des infections formées ont mesuré l’observance des directives en matière d’hygiène des mains par le biais d’une observation directe. Les opportunités d’hygiène des mains ont été comptabilisées et les épisodes effectifs d’hygiène des mains classés comme aucune hygiène des mains, hygiène des mains avec eau et savon ou hygiène des mains à l’aide d’une solution hydro-alcoolique. Avant et après une campagne de sensibilisation d’un mois, il a à chaque fois été procédé à des mesures tous les deux ans. L’observance a été stratifiée par indication et par type de professionnel de la santé et calculée sous la forme d’un pourcentage du nombre d’épisodes d’hygiène des mains avec eau et savon ou avec solution hydro-alcoolique, divisée par le nombre d’opportunités.
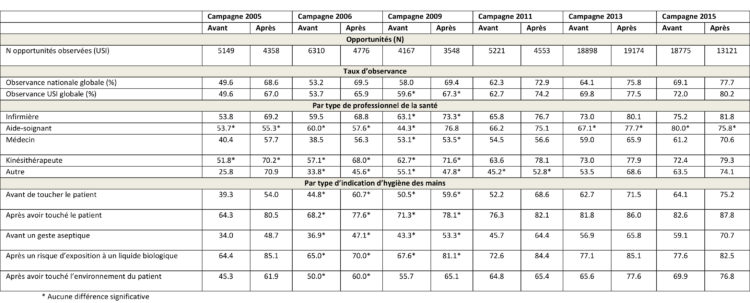
Résultat : un total de 108 050 opportunités d’hygiène des mains ont été décelées dans les USI pendant cette période. L’observance de l’hygiène des mains a considérablement augmenté de 49,6% avant la campagne de 2005 à 72,0% avant la campagne de 2015. Pendant la même période, l’observance après la campagne est passée de 67,0% à 80,2%. Le nombre d’opportunités constatées a considérablement augmenté en présence d’un feed-back automatisé.
Conclusions : dans les unités de soins intensifs belges, l’observance de l’hygiène des mains s’améliore avec le temps, même si des campagnes consécutives assorties d’un feed-back immédiat sont nécessaires pour atteindre et maintenir un taux d’observance élevé.
Mots-clés : observance de l’hygiène des mains, infections nosocomiales, unités de soins intensifs
Contexte
Pendant plusieurs années, il est apparu que l’observance de l’hygiène des mains était essentielle à la prévention d’infections nosocomiales (1,2). Les patients admis dans une unité de soins intensifs (USI) sont gravement malades et leur immunité souvent compromise. Ils nécessitent dès lors d’importants soins, dont des traitements invasifs, une ventilation mécanique, des cathéters veineux, et un suivi plus complexe que les patients d’autres services (3).
En Europe, c’est dans les unités de soins intensifs que la prévalence des infections nosocomiales est la plus importante (4-7). En Belgique, au moins 6 à 7% des patients hospitalisés contractent chaque année une infection nosocomiale (5,8). Selon l’enquête de prévalence menée par le Centre européen pour la prévention et le contrôle des maladies en 2011, la prévalence des infections nosocomiales dans les USI belges était de 20,3% (4). Les résultats nationaux du contrôle des infections nosocomiales dans les unités de soins intensifs entre 2001 et 2014 ont démontré que les patients des unités de soins intensifs étaient de plus en plus âgés, souffrant de maladies graves conformément à leur Simplified Acute Physiology Score II (score simplifié de la physiologie aigüe ou SAPS II) et une majorité d’entre eux étant traités à l’aide d’agents antimicrobiens. Les résultats de 2014 démontrent que le score SAPS II moyen pour les patients admis dans les USI est supérieur à 20, ce qui implique une augmentation de la durée de séjour à l’hôpital, des taux d’infection, des frais d’hospitalisation et de la mortalité. (9). Cela étant dit, il est essentiel de souligner la promotion de bonnes pratiques d’hygiène des mains dans les environnements de soins, et tout particulièrement les USI.
La Belgique est l’un des pays pionniers ayant mis en œuvre l’initiative «Un soin propre est un soin plus sûr» de l’OMS en 2005 (10) en lançant une campagne d’hygiène des mains nationale intitulée « Vous êtes en de bonnes mains ». Ces campagnes sont soutenues par la plate-forme fédérale de prévention et de contrôle des infections (FPIPC) et la Commission belge de coordination de la politique antibiotique (BAPCOC), grâce à des financements du gouvernement fédéral belge, et sont organisées par un groupe de travail multidisciplinaire.
Nous présentons ici le résultat de la campagne d’hygiène des mains nationale organisée en Belgique de 2005 à 2015, axée sur les unités de soins intensifs.
Méthodologie
Des campagnes de promotion de l’hygiène des mains dans les hôpitaux belges sont organisées depuis 2005. La participation des hôpitaux à ces campagnes s’effectuait sur une base volontaire. Pour chaque hôpital de soins aigus participant, à tout le moins des données d’observation dans l’USI devaient être fournies.
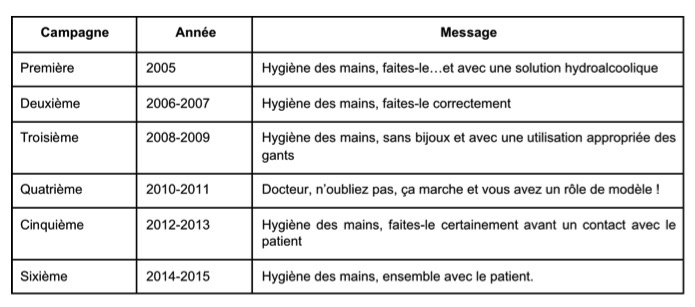
La campagne belge est multimodale, faisant appel à différents supports (posters, rappel dans les salles, sessions de formation pour les professionnels de la santé (PS), éducation des patients et clips vidéo) (8). Chaque campagne véhiculait un message spécifique inspiré des résultats de la campagne précédente, et avait pour but d’améliorer l’observance de l’hygiène des mains (Tableau 1).
Tableau 1 : Evolution des messages de la campagne d’hygiène des mains belge dans les hôpitaux
Les équipes de prévention des infections (PI) des hôpitaux participants étaient en charge de la mise en œuvre de la campagne au sein de leur établissement. Des mesures pour chaque campagne étaient effectuées avant et après une période de sensibilisation d’un mois. Les périodes d’observation avant et après les campagnes s’étendaient toujours sur un mois pour toutes les campagnes, sauf pour la sixième campagne pour laquelle la période d’observation était de 2 mois et trois semaines pré-campagne et 2 mois post-campagne, en raison de la crise Ebola.
À l’aide d’une grille d’observation standardisée, des équipes de prévention des infections formées ont mesuré l’observance des directives d’hygiène des mains par une observation directe. Les données liées à l’observance de l’hygiène des mains ont été encodées dans NSIHwin (application MS Access) jusqu’à la quatrième campagne. Dès la cinquième campagne, les données étaient encodées directement à l’aide d’appareils mobiles ou de grilles d’observation développées conformément aux directives de l’OMS (11) dans un outil en ligne protégé par mot de passe (NSIHweb II) avec feed-back en temps réel aux hôpitaux (12). Les données analysées ici concernent uniquement les USI avec plus de 150 opportunités observées par période d’observation.
Les opportunités d’hygiène des mains ont été comptabilisées et les épisodes effectifs d’hygiène des mains ont été classés comme aucune hygiène des mains, hygiène des mains avec eau et savon ou hygiène des mains à l’aide d’une solution hydro-alcoolique. Si les deux procédures de désinfection étaient appliquées, il était question d’hygiène des mains à l’aide d’une solution hydro-alcoolique. L’observance a été stratifiée à l’aide des cinq moments définis par l’OMS où l’hygiène des mains est indispensable dans les soins de santé (avant de toucher un patient, après avoir touché un patient, avant un geste aseptique, après un risque d’exposition à un liquide biologique, après avoir touché l’environnement du patient) (10) et par type de PS (infirmières, infirmières auxiliaires, médecins, physiothérapeutes, autres) et calculée comme pourcentage du nombre d’épisodes d’hygiène des mains avec eau et savon ou avec solution hydro-alcoolique, divisée par le nombre d’opportunités. Les résultats ont été transmis par chaque hôpital participant sous la forme d’une moyenne pondérée, ajustant dès lors le nombre varié d’opportunités observées entre hôpitaux. Toutes les données ont été traitées et analysées à l’aide du logiciel SAS 9. La comparaison des taux d’observance entre périodes et groupes a été réalisée à l’aide du test Wilcoxon Signed Rank où une valeur p bilatérale de <0,05 est considérée comme statistiquement significative.
Résultats
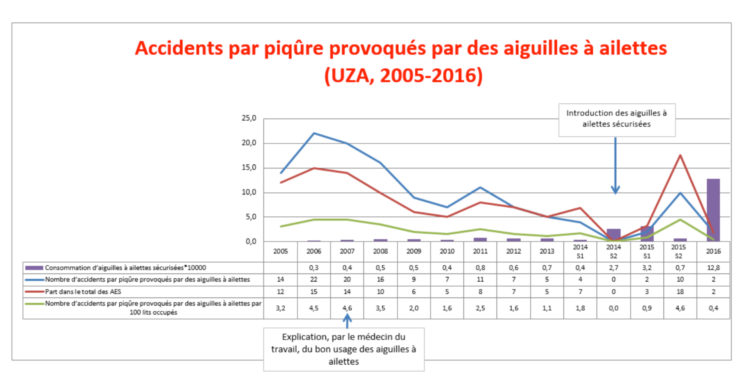
Au fil des ans, le nombre d’hôpitaux fournissant des données d’USI contenant plus de 150 opportunités observées est passé de 22 (environ 17%) à 69 (51%) avant la campagne et de 19 (environ 15%) à 54 (40%) après la campagne (Fig. 1).
Fig. 1 : Évolution du nombre d’opportunités au fil du temps, telles qu’enregistrées par les unités de soins intensifs (USI) des hôpitaux participant aux campagnes d’hygiène des mains belges.
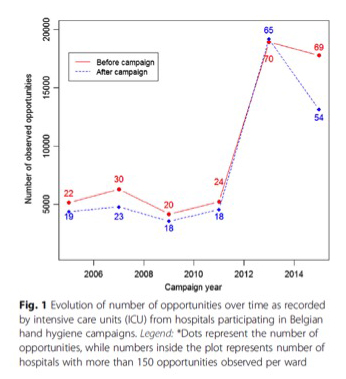 Légende : *les points représentent le nombre d’opportunités, alors que les nombres à l’intérieur du tracé représentent le nombre d’hôpitaux avec plus de 150 opportunités observées par unité
Légende : *les points représentent le nombre d’opportunités, alors que les nombres à l’intérieur du tracé représentent le nombre d’hôpitaux avec plus de 150 opportunités observées par unité
Pré-campagne, post-campagne
Nombre d’opportunités observées.
Des données précises concernant le nombre d’hôpitaux possédant des unités de soins intensifs sont uniquement disponibles à partir de 2011. Le nombre d’opportunités observées est également passé de 5 149 à 18 775 pré-campagne et de 4 358 à 13 121 post-campagne (Tableau 1).
Le nombre le plus élevé d’opportunités a été enregistré en 2013, portant le nombre total d’opportunités observées à 108 050 sur les 6 campagnes (Fig. 1).
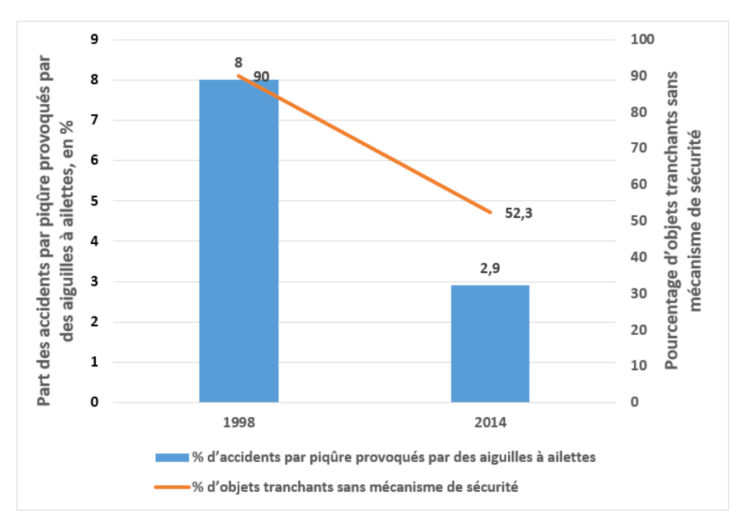
L’observance globale de l’hygiène des mains (moyenne pondérée de tous les hôpitaux ayant plus de 150 opportunités par USI) a augmenté considérablement (P < 0,05) pour les campagnes de 2005, 2006, 2011, 2013 et 2015 (fig. 2 et Tableau 2). Même si l’on a constaté une augmentation de 59,6 à 67,3 % pendant la campagne de 2009, elle n’était pas statistiquement significative. L’observance nationale a également augmenté au fil du temps avant et après les campagnes, confirmant donc la nécessité d’un rappel continu et de l’importance de répétition de campagnes (Tableau 2).
Fig.2 : Taux d’observance de l’hygiène des mains (%) de 2005 à 2015 dans les unités de soins intensifs belges (USI) participant à des campagnes d’hygiène des mains
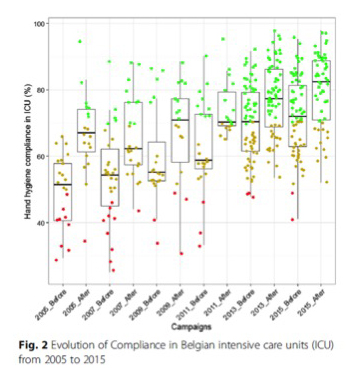 Les taux d’observance ont également augmenté au fil du temps pour tous les types de PS, les meilleures performances ayant été enregistrées pour les infirmières (81,8%). L’observance des médecins s’est améliorée de manière significative à partir de 2011 et s’est stabilisée aux alentours de 60% même si elle était significativement inférieure (p < 0,001) à celle des infirmières pendant toutes les campagnes. Aucune différence notable n’a été enregistrée au niveau de tous les PS pendant la campagne de 2009 (Tableau 2).
Les taux d’observance ont également augmenté au fil du temps pour tous les types de PS, les meilleures performances ayant été enregistrées pour les infirmières (81,8%). L’observance des médecins s’est améliorée de manière significative à partir de 2011 et s’est stabilisée aux alentours de 60% même si elle était significativement inférieure (p < 0,001) à celle des infirmières pendant toutes les campagnes. Aucune différence notable n’a été enregistrée au niveau de tous les PS pendant la campagne de 2009 (Tableau 2).
Comme pour les professionnels de la santé, on a assisté à une augmentation de l’observance de toutes les indications de l’OMS concernant l’hygiène des mains au fil des ans. Cette augmentation a toujours été principalement portée par l’indication après avoir touché un patient et après un risque d’exposition à un liquide biologique en comparaison à avant de toucher un patient et avant un acte propre ou invasif. Une augmentation statistiquement significative a été observée lors des campagnes de 2005, 2011, 2013 et 2015 (Tableau 2). La comparaison de l’observance entre les indications avant et les indications après dans les périodes de campagne a prouvé que l’observance après avoir touché le patient était nettement plus élevée que l’observance avant de toucher le patient (p > 0,0001).
Discussion
L’observance de l’hygiène des mains, combinée à d’autres mesures de prévention des infections, réduit considérablement le taux d’infections associées aux soins et plus particulièrement dans les unités de soins intensifs où les soins sont complexes et nécessitent d’étroits contacts avec les patients (13,14). En Belgique, la prévalence dans les hôpitaux de l’infection associées aux soins à Staphylococcus aureus résistant à la méticilline (n-MRSA) a significativement diminué depuis le début des campagnes d’hygiène des mains de 2005, passant de 4 n-MRSA/1000 admissions à 1,2 n-MRSA/1000 admissions en 2014 (15). Même si ce repli ne peut être totalement attribué aux campagnes, leur impact ne peut être occulté. En 2014, la prévalence de pneumonies, d’infections du sang et de pneumonie acquise sous ventilation mécanique contractées dans une USI, sur la base d’un groupe de 13 hôpitaux belges, était en moyenne de 6,7 pneumonies et 1,9 infection du sang par 1000 par jours-patients. Ces indicateurs de résultat obligatoires et autres optionnels ne figurant pas dans les rapports constituent une baisse par rapport aux années précédentes (9).
En comparant l’effet de toutes les campagnes au fil du temps, on obtient une hausse de l’observance de l’hygiène des mains sur le court et le long termes, soulignant l’importance d’une répétition régulière de campagnes au fil du temps, comme d’autres études l’ont démontré (2, 8).
L’augmentation drastique du nombre d’opportunités observées en 2013 et l’atteinte du taux d’observance de 70 % pourraient s’expliquer par l’introduction d’un outil en ligne gratuit pour l’encodage des données avec feed-back en temps réel aux hôpitaux. On a toutefois assisté à un repli du nombre d’opportunités en 2015. On pourrait l’expliquer par l’épidémie d’Ebola en Afrique, qui a été source d’une charge de travail supplémentaire pour les équipes de prévention des infections en Belgique au niveau de la préparation. Les taux d’observance de l’hygiène des mains étaient nettement plus élevés après avoir touché le patient qu’avant de toucher le patient, impliquant donc que les PS n’ont tendance à laver leurs mains que lorsqu’ils estiment qu’elles sont sales ou qu’ils tentent de se protéger plutôt que de protéger les patients, comme d’autres études l’ont déjà démontré (8,16).
De manière cohérente lors des six campagnes, on constate une différence d’observance notable entre les infirmières et les médecins, les infirmières enregistrant toujours de meilleurs résultats que les médecins avant et après les campagnes. Ce résultat n’est pas différent de celui enregistré dans les autres pays européens (16-18) mais aussi dans des pays hors Europe, comme l’Australie ou la Corée (7, 19, 20). L’observance nationale en Belgique et dans d’autres pays européens s’est améliorée depuis 2005 et s’est stabilisée aux alentours de 70% (16, 21). Différentes études ont été menées pour comprendre l’attitude des professionnels de la santé par rapport au respect de l’hygiène des mains, et les résultats indiquent que la moins bonne observance de la part des médecins ne peut être liée à un manque de connaissance des recommandations nationales ou internationales ni au nombre d’opportunités d’hygiène des mains mais présente plus probablement un lien avec les difficultés à initier un changement de comportement auprès des médecins (19). Le message de la quatrième campagne se concentrait sur le rôle d’exemple des médecins.
Même si les infirmières ont continué d’enregistrer de meilleurs résultats, une amélioration significativement durable et marquée a été enregistrée au niveau des médecins pour la première fois à partir de la quatrième campagne. Le faible taux d’observance des médecins est un problème global. En Australie par exemple, en 2014, après avoir constaté les mêmes problèmes, les médecins ont été ciblés dans une campagne ayant pour slogan « doctor, do you have a moment ? », et l’observance des médecins était supérieure à 61 %.
À l’instar d’autres pays, la Belgique fait appel à une observation directe avec feed-back en temps réel pour permettre aux prestataires de soins d’améliorer leur observance. En effet, même en faisant abstraction de l’effet Hawthorne (il s’agit de la tendance qu’ont les personnes à changer leur comportement en présence d’un observateur) (22), qui pourrait être considéré comme un handicap pour notre étude, l’observation directe offre une image claire des erreurs typiques et laisse place à un feed-back de la part de l’observateur. Une étude menée en 2015 en Allemagne a démontré que sous observation, les PS pratiquaient 21 fois l’hygiène des mains sous observation, contre 8 en l’absence d’observation (18). Une autre étude menée au Brésil un an plus tôt a démontré un taux d’observance élevé de 92% sous observation (23).
Nos données ont également fait état d’une augmentation progressive de l’observance au fil du temps, et plus particulièrement à partir de la cinquième campagne, lors de laquelle la barre des 70% a été franchie. On pourrait attribuer cette progression à l’introduction de l’outil en ligne offrant un feed-back en temps réel à l’hôpital et aux services. Une étude menée en 2013 en Belgique dans les USI à propos de l’impact d’un audit et du feed-back sur la prévention des infections liées aux cathéters centraux a démontré que les résultats étaient les meilleurs là où les infirmières participaient une fois par semaine à une réunion de feed-back (24). Cette étude soutient dès lors nos résultats selon lesquels un feed-back sous forme visuelle combiné à des présentations orales est essentiel à l’amélioration de l’observance et la lutte contre les infections nosocomiales.
Conclusions
L’on peut en conclure que l’observance de l’hygiène des mains dans les unités de soins intensifs belges s’améliore au fil du temps, même si des campagnes répétées s’avèrent nécessaires pour atteindre et maintenir un niveau d’observance élevé. De plus, l’utilisation d’un outil en ligne offrant un feed-back en temps réel, combiné à un soutien politique et financier du Service public fédéral belge, a contribué au succès des campagnes, qui ont joui d’un taux de participation élevé et ont augmenté les opportunités observées et donc l’observance.
Remerciements
Nous aimerions remercier tous les membres du groupe de travail sur la campagne d’hygiène des mains : Anne Simon (présidente) (AS), Francine De Meerleer, David De Wandel, Roger Haenen, Aldo Spettante, Patricia Taminiau, An Willems (AW), Leen Popleu, Sylvanus Fonguh (SF), Boudewijn Catry (BC) et Annie Uwineza
Financement
Les campagnes nationales destinées à améliorer l’observance de l’hygiène des mains dans les hôpitaux belges sont financées par le gouvernement fédéral belge.
Disponibilité des données et des matériaux
Les données étayant les résultats de la présente étude sont disponibles auprès des auteurs, sur demande raisonnable et avec l’autorisation du groupe de travail sur l’hygiène des mains.
Contributions des auteurs
SF a procédé à l’analyse et a rédigé le manuscrit, AW, BC et AS ont participé à la rédaction du manuscrit. Tous les auteurs ont lu et approuvé le manuscrit final.
Intérêts concurrents
Les auteurs déclarent ne pas avoir d’intérêts concurrents.
Accord relatif à la publication
Non applicable
Approbation déontologique et accord relatif à la participation
Non applicable
Institut scientifique de la santé publique, Belgique, rapport de feed-back sur la surveillance nationale des infections acquises dans les unités de soins intensifs, indicateurs 2014. http://www.sih.be/download/hi_fbc_nat_2014_12Nov2015_124653.pdf. Consulté le 27 juin 2016.)
Tableau 2 : Taux d’observance de l’hygiène des mains (%) de 2005 à 2015 dans les unités de soins intensifs belges (USI) participant aux campagnes d’hygiène des mains