Wang C.C., Prather K.A., Sznitman J., Jimenez J.L., Lakdawala S.S., Tufekci Z., Marr L.C.
Airborne transmission of respiratory viruses
Science, 2021 373 (6558), 659-664.
Abstract
The COVID-19 pandemic has revealed critical knowledge gaps in our understanding of and a need to update the traditional view of transmission pathways for respiratory viruses. The long-standing definitions of droplet and airborne transmission do not account for the mechanisms by which virus-laden respiratory droplets and aerosols travel through the air and lead to infection. In this Review, we discuss current evidence regarding the transmission of respiratory viruses by aerosols-how they are generated, transported, and deposited, as well as the factors affecting the relative contributions of droplet-spray deposition versus aerosol inhalation as modes of transmission. Improved understanding of aerosol transmission brought about by studies of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection requires a reevaluation of the major transmission pathways for other respiratory viruses, which will allow better-informed controls to reduce airborne transmission.
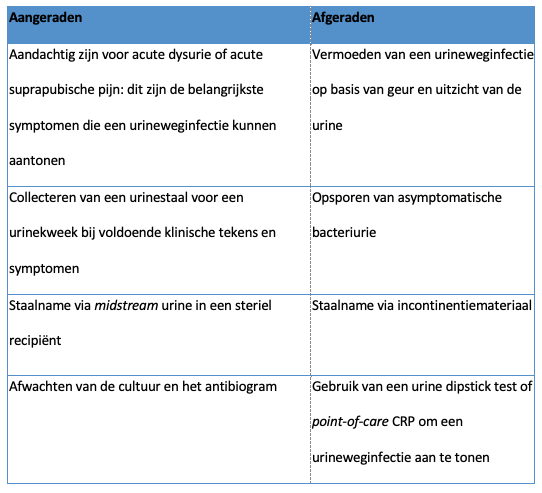
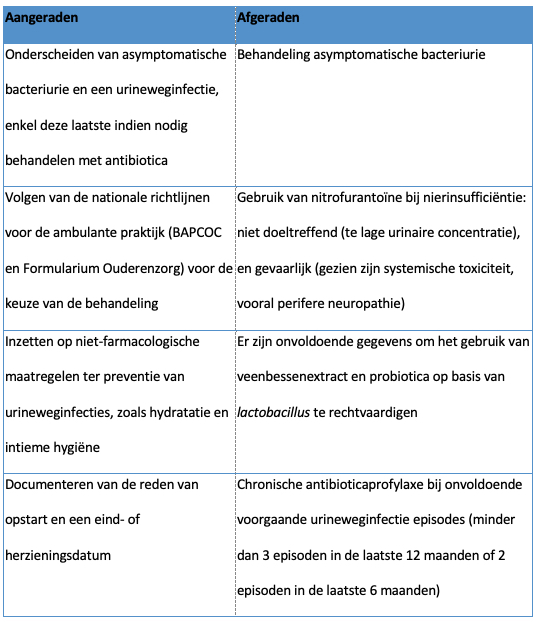
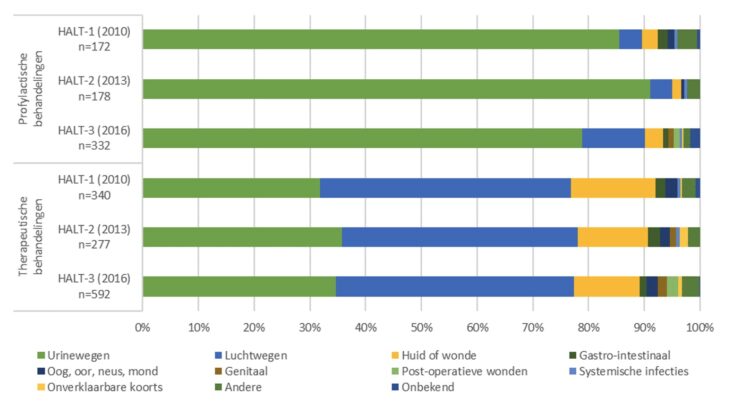
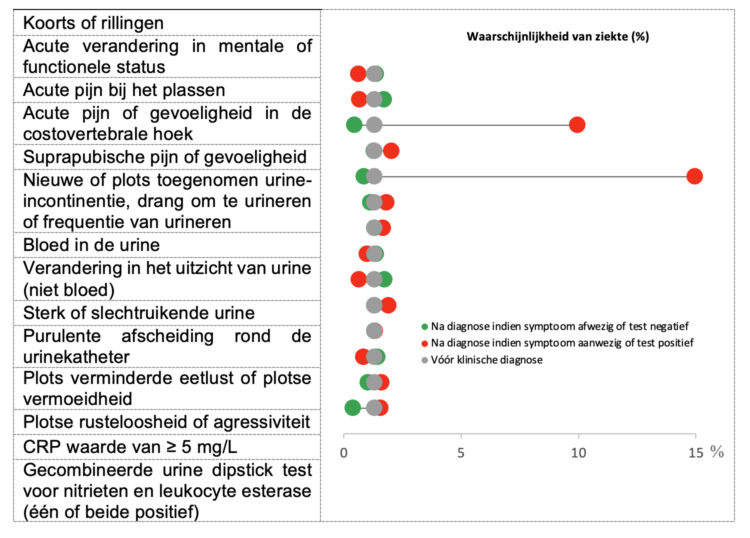
Onakpoya I.J, Heneghan C.J., Spencer E.A., Brassey J., Rosca E.C., Maltoni S., Plüddemann A., Evans D.H., Conly J.M., Jefferson T.
Viral cultures for assessing fomite transmission of SARS-CoV-2: a systematic review and meta-analysis.
J Hosp Infect. 2022 Dec:130:63-94.
Abstract
Background: The role of fomites in the transmission of SARS-CoV-2 is unclear.
Aim: To assess whether SARS-CoV-2 can be transmitted through fomites, using evidence from viral culture studies.
Methods: Searches were conducted in the World Health Organization COVID-19 Database, PubMed, LitCovid, medRxiv, and Google Scholar to December 31st, 2021. Studies that investigated fomite transmission and performed viral culture to assess the cytopathic effect (CPE) of positive fomite samples and confirmation of SARS-CoV-2 as the cause of the CPE were included. The risk of bias using a checklist modified from the modified Quality Assessment of Diagnostic Accuracy Studies – 2 (QUADAS-2) criteria was assessed.
Findings: Twenty-three studies were included. The overall risk of bias was moderate. Five studies demonstrated replication-competent virus from fomite cultures and three used genome sequencing to match fomite samples with human clinical specimens. The mean cycle threshold (CT) of samples with positive viral culture was significantly lower compared with cultured samples that returned negative results (standardized mean difference: -1.45; 95% confidence interval (CI): -2.00 to -0.90; I2 = 0%; P < 0.00001). The likelihood of isolating replication-competent virus was significantly greater when CT was <30 (relative risk: 3.10; 95% CI: 1.32 to 7.31; I2 = 71%; P = 0.01). Infectious specimens were mostly detected within seven days of symptom onset. One study showed possible transmission of SARS-CoV-2 from fomites to humans.
Conclusion: The evidence from published studies suggests that replication-competent SARS-CoV-2 is present on fomites. Replication-competent SARS-CoV-2 is significantly more likely when the PCR CT for clinical specimens and fomite samples is <30. Further studies should investigate the duration of infectiousness of SARS-CoV-2 and the frequency of transmission from fomites.
Mellon G., Mahjoub N., Metivier F.., Osinski N., Gabassi A., Delaugerre C., Vanoli E., Crawford C., Le Goff J.
Enhancing the control of respiratory virus spread: a comprehensive approach integrating airborne virus detection, aerological investigations, and airflow modeling for practical implementation
Infect Control Hosp Epidemiol ., 2025 Jan 10:1-10.
Objective: Patients with chronic kidney disease suffer from immune dysfunction, increasing susceptibility to infections. The aim of the study was to investigate air contamination with respiratory viruses in a dialysis unit at a quaternary hospital using molecular detection techniques and to analyze airflow dynamics through computational fluid dynamics (CFD) simulations for a comprehensive assessment of air transmission risks.
Methods: We conducted dialysis unit air sampling using AerosolSense™ samplers. Air and clinical sampling occurred during three periods in 2022: winter, early, and late fall. A technical team maintained the dialysis unit’s ventilation system during mid fall. Ventilation system capacity and airflow rates were measured. CFD simulations were used to evaluate airflow dynamics.
Results: The investigation collected 144 air samples, revealing heterogeneous virus detection rates across locations and study periods. Virus positivity correlated with the presence of patients and the effectiveness of the ventilation system. The ratio of virus air positivity to virus patient positivity was 1.84 and 3.35 during the first and the second periods, respectively, and collapsed to 0.64 after maintenance. Airflow rate measurements highlighted a ninefold discrepancy between actual and theoretical airflow (393 m3/h vs. 3530 m3/h), which was rectified by maintenance actions. Airflow dynamics and particle dispersion visualization through CFD simulations contributed to a better understanding of transmission risks.
Conclusions: Detection of viruses in the air, combined with CFD, revealed deficiencies in air renewal. Maintenance interventions significantly improved airflow dynamics and particle dispersion, reducing airborne virus spread.
MacIntyre C.R., Chughtai A.A., Kunasekaran M.., Tawfiq E., Greenhalgh T.
The role of masks and respirators in preventing respiratory infections in healthcare and community settings [Review].
BMJ 2025 Feb 27:388:e078573.
Abstract
The covid-19 pandemic saw frequent changes and conflicts in mask policies and politicization of masks. On reviewing the evidence, including studies published after the pandemic, the data suggest respirators are more effective than masks in healthcare, but must be continuously worn to be protective. Healthcare and aged care settings amplify outbreaks, so protection of patients and staff is paramount. Most guidelines assume risk is only present during close contact or aerosol generating procedures, but studies show intermittent use of respirators is not protective. New research in aerosol science confirms the risk of infection is widespread in health facilities. In community settings, any mask use is protective during epidemics, especially if used early, when combined with hand hygiene, and if wearers are compliant. Community use of N95 respirators is more protective than surgical masks, which are more protective than cloth masks, but even cloth masks provide some protection. Mask guidelines should be adaptable to the specific context and should account for rising epidemic activity, and whether a pathogen has asymptomatic transmission. The main rationale for universal masking during pandemics is asymptomatic transmission, which means risk of transmission cannot be self-identified. The precautionary principle should be applied during serious emerging infections or pandemics when transmission mode is not fully understood, or vaccines and drugs are not available. If respirators are not available, medical or cloth masks could be used as a last resort. Data exist to support extended use and reuse of masks and respirators during short supply. In summary, extensive evidence generated during the covid-19 pandemic confirms the superiority of respirators and supports the use of masks and respirators in the community during periods of high epidemic activity. Some gaps in research remain, including economic analyses, research in special population groups for whom masking is challenging, and research on countering disinformation.
Simniceanu A., Satta G.
Infection prevention and control of epidemic-prone acute respiratory infections in healthcare setting
Curr Opin Pulm Med 2025 May 1;31(3):230-236.
Abstract
Purpose of review:
The recent COVID-19 pandemic sparked discussions and highlighted significant gaps on the most appropriate infection prevention and control (IPC) measures when dealing with acute respiratory infections (ARIs). This narrative review aims to provide an overview of the existing international and national guidelines on the IPC measures to control epidemic and pandemic-prone ARIs in healthcare settings.
Recent findings: The WHO has recently produced a report proposing an updated terminology for respiratory pathogens. One of the key outcomes of this consultation was the adoption of the term ‘infectious respiratory particles’ (IRPs). According to the report, IRPs are defined as infectious particles that can be expired from an infected person through activities like breathing, talking, singing, coughing, sneezing, or even spitting. Most notably, there is no longer the clear and traditional distinction between droplet and aerosol based on the cut-off of particle size, but rather a continuum of particle sizes of IRPs.
Summary: Among other recommendations, all international guidelines place emphasis on the use of standard and transmission-based precautions when dealing with respiratory viruses. It is important to assess how the new proposed terminology for respiratory pathogens may affect the current existing IPC measures.
Global technical consultation report on proposed terminology for pathogens that transmit through the air. World Health Organisation (WHO)
April, 2024, 52pp. This document can be downloaded in full (52pp) in PDF format from the following link
https://www.who.int/publications/m/item/global-technical-consultation-report-on-proposed-terminology-for-pathogens-that-transmit-through-the-air
Overview
Terminology used to describe the transmission of pathogens through the air varies across scientific disciplines, organizations and the general public. While this has been the case for decades, during the coronavirus disease (COVID-19) pandemic, the terms ‘airborne’, ‘airborne transmission’ and ‘aerosol transmission’ were used in different ways by stakeholders in different scientific disciplines, which may have contributed to misleading information and confusion about how pathogens are transmitted in human populations.
This global technical consultation report brings together viewpoints from experts spanning a range of disciplines with the key objective of seeking consensus regarding the terminology used to describe the transmission of pathogens through the air that can potentially cause infection in humans.
This consultation aimed to identify terminology that could be understood and accepted by different technical disciplines. The agreed process was to develop a consensus document that could be endorsed by global agencies and entities. Despite the complex discussions and challenges, significant progress was made during the consultation process, particularly the consensus on a set of descriptors to describe how pathogens are transmitted through the air and the related modes of transmission. WHO recognizes the important areas where consensus was not achieved and will continue to address these areas in follow-up consultations
Plachouras D, Kacelnik O., Rodriguez-Bano J., Birgand G., Borg M.A., Kristensen B., Kubele J. Lyytikaïnen O., Presterl E., Reilly J., Voss A., Zing W., Suetens C., Monnet D.L.
Revisiting the personal protective equipment components of transmission-based precautions for the prevention of COVID-19 and other respiratory virus infections in healthcare
Euro Surveill 2023 Aug;28(32):2200718.
Abstract
The COVID-19 pandemic highlighted some potential limitations of transmission-based precautions. The distinction between transmission through large droplets vs aerosols, which have been fundamental concepts guiding infection control measures, has been questioned, leading to considerable variation in expert recommendations on transmission-based precautions for COVID-19. Furthermore, the application of elements of contact precautions, such as the use of gloves and gowns, is based on low-quality and inconclusive evidence and may have unintended consequences, such as increased incidence of healthcare-associated infections and spread of multidrug-resistant organisms. These observations indicate a need for high-quality studies to address the knowledge gaps and a need to revisit the theoretical background regarding various modes of transmission and the definitions of terms related to transmission. Further, we should examine the implications these definitions have on the following components of transmission-based precautions: (i) respiratory protection, (ii) use of gloves and gowns for the prevention of respiratory virus infections, (iii) aerosol-generating procedures and (iv) universal masking in healthcare settings as a control measure especially during seasonal epidemics. Such a review would ensure that transmission-based precautions are consistent and rationally based on available evidence, which would facilitate decision-making, guidance development and training, as well as their application in practice.
Zanella M.C., Rhee C., Klompas M.
Preventing respiratory viral transmission in healthcare settings [Review]
Curr Opin Infect Dis 2025 Aug 1;38(4):339-346.
Purpose of review: The COVID-19 pandemic catalyzed new insights into respiratory viral transmission mechanisms and prevention. We review the most practical and impactful measures to prevent SARS-CoV-2 and other nosocomial respiratory viral infections in healthcare.
Recent findings: Nosocomial respiratory viral infection rates mirror viral activity levels in the surrounding community. During peak periods ∼15-20% of hospitalized patients with respiratory viral infections may have acquired their virus in the hospital. Nosocomial respiratory viral infections are associated with increased lengths-of-stay, risk of respiratory failure, and hospital death. Most procedures contribute minimally to aerosol production compared to labored breathing, coughing, and forced expiration. Masking for source control and exposure control both decrease transmission risk, respirators more so than masks. Likewise, vaccinating healthcare workers decreases transmission risk and is associated with lower patient mortality rates, particularly in long-term care facilities. Increasing air changes, ultraviolet irradiation, and portable HEPA filtration units may also decrease transmission rates but their marginal benefit relative to current healthcare ventilation standards has yet to be established.
Summary: Practical strategies to prevent nosocomial respiratory viral infections include maximizing staff and patient influenza and SARS-CoV-2 vaccination rates and implementing routine masking during patient interactions when community incidence is high.
Gettler E.B., Keipp Talbot H., Zhu Y., Ndi D., Mitchel E, Markus T. M., Schaffner W., Harris B., Talbot T.R.
Respiratory syncytial virus: an under-recognized healthcare-associated infection
Infect Control Hosp Epidemiol. 2025 May 16;46(6):1-5.
Abstract
Objective: Prior reports of healthcare-associated respiratory syncytial virus (RSV) have been limited to cases diagnosed after the third day of hospitalization. The omission of other healthcare settings where RSV transmission may occur underestimates the true incidence of healthcare-associated RSV.
Design: Retrospective cross-sectional study.
Setting: United States RSV Hospitalization Surveillance Network (RSV-NET) during 2016-2017 through 2018-2019 seasons.
Patients: Laboratory-confirmed RSV-related hospitalizations in an eight-county catchment area in Tennessee.
Methods: Surveillance data from RSV-NET were used to evaluate the population-level burden of healthcare-associated RSV. The incidence of healthcare-associated RSV was determined using the traditional definition (i.e., positive RSV test after hospital day 3) in addition to often under-recognized cases associated with recent post-acute care facility admission or a recent acute care hospitalization for a non-RSV illness in the preceding 7 days.
Results: Among the 900 laboratory-confirmed RSV-related hospitalizations, 41 (4.6%) had traditionally defined healthcare-associated RSV. Including patients with a positive RSV test obtained in the first 3 days of hospitalization and who were either transferred to the hospital directly from a post-acute care facility or who were recently discharged from an acute care facility for a non-RSV illness in the preceding 7 days identified an additional 95 cases (10.6% of all RSV-related hospitalizations).
Conclusions: RSV is an often under-recognized healthcare-associated infection. Capturing other healthcare exposures that may serve as the initial site of viral transmission may provide more comprehensive estimates of the burden of healthcare-associated RSV and inform improved infection prevention strategies and vaccination efforts.
Brierley R.C.M., Taylor J., Turner N., Rees S., Thorn J., Metcalfe C., Henderson E.J., et al.
A pragmatic cluster randomised controlled trial of air filtration to prevent symptomatic winter respiratory infections (including COVID-19) in care homes (AFRI-c) in England: Trial protocol.
PLoS One. 2024 Jul 23;19(7):e0304488.
Abstract
Background: Respiratory tract infections are readily transmitted in care homes. Airborne transmission of pathogens causing respiratory tract illness is largely unmitigated. Portable high-efficiency-particulate-air (HEPA) filtration units capture microbial particles from the air, but it is unclear whether this is sufficient to reduce infections in care home residents. The Air Filtration to prevent symptomatic winter Respiratory Infections (including COVID-19) in care homes (AFRI-c) randomized controlled trial will determine whether using HEPA filtration units reduces respiratory infection episodes in care home residents.
Methods: AFRI-c is a cluster randomized controlled trial that will be delivered in residential care homes for older people in England. Ninety-one care homes will be randomised to take part for one winter period. The intervention care homes will receive HEPA filtration units for use in communal areas and private bedrooms. Normal infection control measures will continue in all care homes. Anonymised daily data on symptoms will be collected for up to 30 residents. Ten to 12 of these residents will be invited to consent to a primary care medical notes review and (in intervention homes) to having an air filter switched on in their private room. The primary outcome will be number of symptomatic winter respiratory infection episodes. Secondary outcomes include specific clinical measures of infection, number of falls / near falls, number of laboratory confirmed infections, hospitalisations, staff sickness and cost-effectiveness. A mixed methods process evaluation will assess intervention acceptability and implementation.
Discussion: The results of AFRI-c will provide vital information about whether portable HEPA filtration units reduce symptomatic winter respiratory infections in older care home residents. Findings about effectiveness, fidelity, acceptability and cost-effectiveness will support stakeholders to determine the use of HEPA filtration units as part of infection control policies.