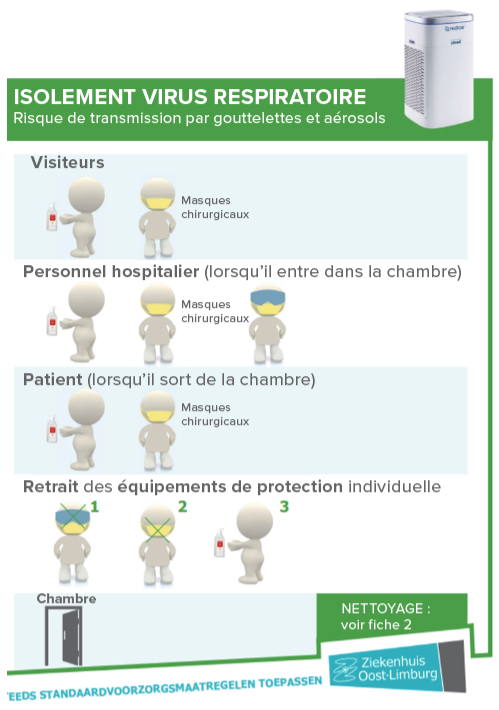
Ces visites partent le plus souvent d’une demande de la part du patient et sont conditionnées à des règles strictes. La plupart du temps, ces visites sont organisées dans un local dédié à cette activité et pas la chambre du patient. Ceci dit, le phénomène s’étend de plus en plus et le cadre évolue.
Les bénéfices de ces visites, pour les patients, sont cliniquement reconnus, tant sur le plan émotionnel que physiologique. Elles peuvent même améliorer le dialogue et renforcer le lien de confiance entre les patients et les soignants.
Les études montrent notamment une réduction de l’anxiété et du stress. Pour les hospitalisations de longue durée, ces visites peuvent également apporter un réconfort et un sentiment de normalité.
En soins palliatifs, vivre un moment en présence de son animal de compagnie est un rappel de la vie en extérieur qui apporte chaleur et stabilité émotionnelle. [1] Le contact tactile avec l’animal peut détourner l’attention portée à l’inconfort et à la douleur. [2-3]
Au CHU Hélora, Hôpital de La Louvière site Jolimont, l’équipe des soins palliatifs a rencontré, en 2023, l’équipe de Prévention et de Contrôle des Infections (PCI) avec la volonté de développer la cynothérapie, c’est à dire de donner la possibilité à un chien, dans ce cas-ci, spécialement formé à accompagner les patients dans leur parcours de soins. Le but étant d’avoir un impact positif sur l’état mental et physique du patient.
Mais en priorité, le souhait de l’équipe était de pouvoir répondre à la demande récurrente des patients d’avoir la possibilité de revoir leur animal de compagnie (chien ou chat).
L’équipe PCI y a été particulièrement sensible et après avoir obtenu l’accord des directions, le travail sur le projet a pu réellement commencer.
Les soins palliatifs nous semblaient être un bon « laboratoire »
pour expérimenter et valider un mode opératoire. Le décret Kama ne tenant compte jusque-là que des chiens d’assistance [4], nous nous sommes rendu compte de l’importance de pouvoir élargir aux animaux de compagnie.
Les premières réunions se sont enchaînées à partir de fin 2023 et le premier chien a pu être accueilli en novembre 2024.
Faisons le point sur les différentes étapes de ce projet !
Réunir les différents acteurs autour de la table
Une première réunion a eu lieu avec la responsable médicale, la cheffe d’unité et la cheffe de service des soins palliatifs, la responsable du service entretien, un membre du Service Interne pour la Prévention et la Protection au travail (SIPP) et l’équipe PCI.
En effet, plusieurs sujets devaient être abordés comme le domaine d’application, les responsabilités, les conditions d’admission dans l’hôpital et dans l’unité dont les exigences spécifiques envers l’animal, la sécurité du personnel, l’entretien des chambres après le passage de l’animal et la définition du circuit autorisé pour la circulation de l’animal au sein de l’hôpital.
Une seconde réunion fût nécessaire afin de pouvoir construire notre procédure d’accueil pour les visites en soins palliatifs.
Elaborer la procédure d’accueil
En voici les points principaux :
Quels animaux de compagnie sont acceptés et dans quelles unités ?
Dans un premier temps, le déploiement du projet a été autorisé uniquement aux chiens et aux chats en dessous de 15kg et seulement pour l’unité des soins palliatifs sur rendez-vous fixé au préalable. Aussi, les NAC (nouveaux animaux de compagnie) posent de réels problèmes de santé publique en raison des maladies importantes qu’ils peuvent transmettre. Ils présentent également un risque plus élevé de zoonose et de morsures.
Quelles sont les exigences avant l’arrivée de l’animal à l’hôpital ?
Au préalable, il est important de définir le cadre juridique. En effet, il est important de connaitre les responsabilités de la direction de l’établissement de soins, du personnel responsable de la prise en charge des animaux , du patient et de sa famille ?
Une rencontre avec la juriste de l’institution s’est imposée.
Voici l’exemple du document qui doit être signé, au préalable, par la personne responsable de l’animal et qui sera versé au dossier du patient par la suite pour des raisons de traçabilité.
L’Hôpital et l’équipe soignante se réserve le droit de refuser ou d’interrompre les visites de l’animal de compagnie si :
• Celui-ci représente un danger tant pour le patient et leurs proches que pour les autres personnes se trouvant au sein de l’unité et à l’extérieur de celle-ci.
• Si un incident survient tel que des aboiements intempestifs. Le bien-être des autres patients doit également être pris en compte.
• Celui-ci n’est pas propre.
• Celui-ci détruit le matériel qui l’entoure.
• Celui-ci est en malade au moment de la visite, s’il présente des diarrhées, des plaies, ou une infection cutanée.

Il est bon à savoir également que la réglementation concernant le port ou non de muselière dans les espaces publiques peut varier d’une commune à l’autre. Une race de chien pourrait être autorisée à circuler sans muselière dans une commune et ne pas l’être dans une autre. Vous pouvez trouver toutes ces informations sur le portail officiel de la police qui permet d’accéder aux sites des différentes zones de police locale.(www.police.be)
Comment procéder ?
1. Prendre contact avec les membres du personnel travaillant dans l’unité des soins palliatifs.
2. Répondre au questionnaire présenté plus haut.
3. Idéalement avoir en votre possession le carnet de santé de votre animal de compagnie. L’animal devra porter un collier antipuce et être vermifugé.
4. La décision sera prise en équipe en premier lieu et ensuite avec la famille et le patient afin d’arriver à un accord sur l’organisation et les modalités pratiques de la visite de l’animal.
Remarques et conditions importantes :
• Le jour et l’heure sont convenus avec l’équipe soignante, vous ne pouvez en aucun cas venir à un autre moment que celui fixé !
• Un trajet spécifique est à respecter ! Une vidéo a été créée et est disponible via QR code afin de visualiser le trajet à suivre avec l’animal, du parking patient à l’unité des soins palliatifs. A l’entrée du bâtiment réservé au passage des animaux, un tapis de 8 mètres de long a été installé. Cette longueur permettant aux pattes de l’animal d’être sèches avant d’entrer dans l’ascenseur en cas de pluie. En voici une petite illustration.
• L’animal est accompagné en permanence par un adulte. S’il se déplace à quattre pattes, il sera tenu en laisse en dehors de la chambre.
• L’animal ne quitte la chambre qu’au moment du retour.
• Aucune nourriture ne peut être administrée à l’animal pendant la visite.
• L’animal aura eu l’occasion de faire ses besoins avant son arrivée.
Une fois l’animal dans la chambre, l’infomation suivante sera apposée sur la porte, à la fois pour ne pas surprendre le personnel et avertir les personnes éventuellement phobiques.
Un entretien classique de la chambre se déroulera au plus tard le lendemain matin de la visite et c’est l’accompagnateur de l’animal qui est chargé de ramasser les saletés visibles qui auront pû être engendrées pendant la visite (selles, urines, vomissements…).
Toutes ces informations se retrouvent dans la brochure réalisée à cet effet à destination des patients et de leur famille

Depuis la mise en route de ce projet, nous, équipe PCI avons demandé à l’équipe des soins palliatifs de nous faire part de quelques retours d’expériences.
En voici quelques lignes :
« Des visites animales bien encadrées : entre cœur et rigueur »
Après une année de réflexion, d’échanges en équipe pluridisciplinaire et de mise en place de protocoles rigoureux, notre service a franchi une étape importante. Accueillir des animaux de compagnie plus précisément chien et chat au sein de l’unité. Ce projet, est né d’un besoin humain de réconfort et d’un profond désir des équipes soignantes dont le but est de continuer à humaniser au maximum les soins. Il a été mis en œuvre dans un cadre strict, respectant les règles d’hygiène hospitalière et les recommandations de sécurité sanitaire.
L’expérience montre que les choses se déroulent globalement très bien. Les patients, les familles et l’équipe en retirent un bénéfice évident, tant sur le plan émotionnel que relationnel. Au niveau des procédures, les éléments les plus sensibles sont généralement bien respectés. Le carnet de vaccination à jour, alors que cela nous semblait être un obstacle lors de nos discussions, est finalement toujours présenté, preuve de l’implication et du sérieux des accompagnants. Les consignes de base en matière d’hygiène sont bien comprises et intégrées, ce qui garantit un cadre sûr pour tous. L’équipe prend le temps avec les familles d’expliquer la procédure et et les éléments qui doivent êtres respectés.
La seule difficulté récurrente concerne le respect de l’horaire d’arrivée, malgré la bonne volonté des familles. Cela peut parfois désorganiser le planning, sachant qu’un membre de l’équipe accueille à l’entrée la famille et l’animal. Toutefois, une fois sur place, le déroulement de la visite se passe sans problème : le trajet a bien été identifié, les consignes sont suivies, et les échanges avec le personnel se font dans un climat respectueux et apaisé.
Témoignages de membres de l’équipe :
·λ « Ce que je retiens, au fil des visites d’animaux de compagnie auprès des patients, ce sont les visages. Celui d’une patiente, qui s’illumine à l’instant précis où son regard croise celui de son chien. Les yeux rayonnants, un sourire sincère aux lèvres… Un instant suspendu, où la maladie s’efface, l’espace d’un instant. D’autre part, je suis admirative de la douceur silencieuse des animaux, leur calme, leur présence rassurante. Ils entrent dans la chambre très calmement, comme s’ils comprenaient l’importance de ce qu’ils apportent. »
λ « À Jolimont, les animaux sont parfois les meilleurs soins. Au sein du service Saint-Alexis de Jolimont, nous avons la chance de pouvoir accueillir les animaux de nos patients (chiens, chats), dans des conditions encadrées et sécurisées. Pour des patients souvent en parcours long, oncologiques ou neurologiques, parfois en fin de vie, ces visites ont une portée immense. Retrouver son compagnon, c’est faire entrer un souffle de vie, un élan de tendresse, là où les soins peuvent être lourds, voire épuisants. Ces retrouvailles réactivent un lien précieux, un lien d’amour et de mémoire. On voit alors, chez le patient comme chez l’animal, une même émotion profonde, une paix silencieuse qui en dit long. C’est cela aussi soigner : faire place à l’essentiel ! »
Ces retours d’expérience soulignent qu’avec un cadre clair, un accompagnement bienveillant et une communication fluide, ces moments précieux peuvent s’inscrire durablement dans nos pratiques de soin !

Merci à Mesdames Marie Christine Tell et Valérie Tell pour leurs témoignages.
Références
1-William R. G. McGhee, Martin Dempster & Lisa Graham-Wisener . The role of companion animals in advanced cancer: an interpretative phenomenological analysis,
BMC Palliative Care volume 21, Article number: 160 (2022)
2-Karina D, Claudia T, Maria de Lourdes Benamor Teixeira, et al. Animal assisted intervention for oncology and palliative care patients: A systematic review PMID: 33691267
3-Yongshen F, Yeqing L, Ningning Z, et al. Effects of Animal-Assisted Therapy on Hospitalized Children and Teenagers: A Systematic Review and Meta-Analysis, Journal of Pediatric Nursing, 2021
4- Décret Kama : https://wallex.wallonie.be/eli/loi-decret/2021/07/15/2021203683/2021/08/06
5- https://www.police.be/fr (En vous localisant dans « Ma police locale)