1. Introduction
Description de l’ Equipe Opérationnelle en Hygiène Hospitalière et de la Cellule Qualité et Sécurité.
Le CHU Brugmann est composé de 3 sites :
-Site Horta (631 lits) à Laeken
-Site Paul Brien (126 lits) à Schaerbeek
-Site Reine Astrid (96 lits) à Neder-over-Hembeek
L’équipe opérationnelle en hygiène hospitalière (EOHH) en place est constituée de deux d’infirmières, une sage-femme, un infirmier chef de service et de deux médecins (dont une microbiologiste), tous n’étant pas temps plein mais bien formés en Prévention et Contrôle des Infections (PCI).
Pendant de nombreuses années, la Cellule Qualité et Sécurité des Soins (CQS) aux patients était constituée de 3 infirmiers avec la participation sur une base volontaire d’un médecin (¼ temps ). La CQS était sous la direction du département infirmier et paramédical, ses activités étaient surtout centrées sur le volet infirmier. Depuis 2022, la CQS dépend de la Direction Générale et est constituée d’une équipe pluridisciplinaire (infirmiers, médecin, chefs de projets).
Historiquement, l’EOHH et la CQS menaient leurs activités d’amélioration continue de manière indépendante.
A titre d’exemple, la CQS a organisé des audits organisationnels auprès des patients, la mise en œuvre et le suivi de la prescription des médicaments à haut risque (’High Risk médication’; HRM) en accord avec les objectifs du SPF Santé Publique. La CQS a également élaboré un projet « Chambre des Erreurs en 2017 », en collaboration avec le département infirmier et paramédical. Pour sa part, l’ EOHH s’est principalement consacrée au suivi de la prévention et du contrôle des infections notamment via la réalisation d’audits centrés sur l’application correcte des mesures de précautions standard et additionnelles.
Lors de ces différents audits au sein des unités de soins et au lit du patient, l’ EOHH avait régulièrement constaté plusieurs erreurs et non-respect des procédures existantes. La mise en application de feedbacks oraux immédiats et écrits suite aux audits ne semblaient pas porter leurs fruits dans certaines unités, chez certains soignants. De même les formations dites « classiques » avaient également leurs limites.
En 2020, la pandémie de Covid a obligé les différents acteurs de l’hôpital à se remettre en question, à se rencontrer et à intensifier leurs efforts de collaboration. Durant cette épidémie, l’EOHH a joué un rôle majeur et la CQS a collaboré sur le terrain en organisant les ressources humaines médicales et en gérant le système documentaire.En 2021, le médecin de la cellule qualité a suivi la formation en prévention et contrôle des infections et l’hygiène hospitalière (H.H.). Cela a facilité le rapprochement entre les deux équipes et a contribué à une meilleure compréhension mutuelle de leur travail.
Comparaison du cadre légal de l’HH et de la CQS
L’ EOHH et la CQS ne sont pas régis par le même cadre légal.
En effet, le statut de l’Hygiène Hospitalière est décrit de manière très précise dans la Loi sur les Hôpitaux et défini dans l’arrêté Royal du 26 avril 20071 précisant que:
• Structurellement :
– « …la promotion de l’hygiène requiert le concours : – du médecin-chef ; – du chef du département infirmier ; – d’une équipe d’hygiène hospitalière ; – et d’un comité d’hygiène hospitalière. »
– « Le médecin hygiéniste hospitalier coordonne le fonctionnement de l’équipe d’hygiène hospitalière. »
– « le médecin hygiéniste hospitalier dépend du médecin-chef de l’établissement, sous la supervision duquel il travaille directement. »
– « …l’infirmier hygiéniste hospitalier dépend du chef du département infirmier… »
– « l’équipe d’hygiène hospitalière se compose : – d’un ou plusieurs médecin(s) – hygiéniste(s) hospitalier(s) ; – et d’un ou plusieurs infirmier(s) – hygiéniste(s) hospitalier(s). »
• Opérationnellement, « l’équipe d’hygiène hospitalière exécute les tâches suivantes :
– le développement, la mise en oeuvre et le suivi, à travers l’hôpital, d’une stratégie relative : a) aux mesures de protection standard ayant pour objet de prévenir la transmission de germes infectieux; b) à l’isolement des patients infectés afin d’endiguer la transmission des maladies infectieuses; c) à la surveillance des infections nosocomiales à l’aide d’indicateurs permettant d’en suivre et d’en corriger l’incidence au sein de l’établissement;
– la mise sur pied d’une stratégie de lutte contre les épidémies;
– le suivi des aspects ayant trait à l’hygiène dans le cadre d’activités hospitalières telles que : a) la construction ou la transformation; b) les activités au quartier opératoire ou en salle d’accouchements; c) l’achat de matériels;
– la mise en oeuvre des directives et recommandations rédigées par des organismes officiels tels que le Conseil supérieur de la Santé;
– l’échange avec d’autres établissements d’informations et de l’expérience acquise… »
1 Arrêté royal modifiant l’arrêté royal du 23 octobre 1964 portant fixation des normes auxquelles les hôpitaux et leurs services doivent répondre, article 1er,point 9 bis
De plus, l’ EOHH est activement impliquée dans la formation en hygiène hospitalière du personnel soignant, comme renseigné dans les Indicateurs Qualité en Hygiène hospitalière définis par Sciensano en 2011 (cf. infra, point 3.6).
Formation en hygiène hospitalière dans l’hôpital

En comparaison, le cadre légal qui régit les activités de la Cellule Qualité et Sécurité est plus récent. Ses activités ont été initialement définies par le SPF Santé Publique via les Programmes Qualités et Sécurités pluriannuels (2007-2012 ; 2013-2017 ; 2018-2022) et par des actions telles que le P4P (Pay for Performance),
Récemment, le cadre légal a été renforcé notamment via la Loi relative à la qualité de la pratique des soins de santé du 22 avril 20192, qui a pour but d’améliorer la qualité des soins en asseyant un socle de critères qualité aux prestataires de soins. De plus, un arrêté du collège réuni de la Commission Communautaire Commune fixant les normes que les hôpitaux doivent respecter, datant du 5 mai 2023 l décrit de manière concrète les objectifs qualités à atteindre dans les hôpitaux et « …plus particulièrement celles permettant :
– d’améliorer le lien entre l’hôpital et la première ligne de soins ;
– d’utiliser les réseaux hospitaliers pour une meilleure adéquation de l’offre ;
– de développer la prise en charge et le suivi en dehors de l’hôpital ;
– d’améliorer l’accessibilité aux structures de prise en charge en santé mentale ;
– d’intégrer dans les conditions d’agrément l’amélioration continue de la qualité et l’implication du patient ;
– de développer des plans de qualité et de sécurité sectoriels. »
Tous ces objectifs sont opérationnalisés par la mise en œuvre d’indicateurs qualités.
L’ensemble de ces mesures contribue à renforcer le cadre légal de la CQS et à en faire un acteur incontournable au sein de l’hôpital.
2 Loi relative à la qualité de la pratique des soins de santé du 22 avril 2019, publiée le 14 mai 2019.
https://www.ejustice.just.fgov.be/cgi/article_body(…)
En conclusion, l’EOHH et la CQS ont comme but commun d’assurer des soins de qualité et en toute sécurité au patient. Leur travail quotidien est basé sur la recherche et la correction des erreurs de sécurité ainsi que sur la surveillance et la mise en œuvre d’actions d’amélioration continue. Suite au tsunami Covid, il est devenu évident que des changements et adaptations de méthodologie d’apprentissage et d’amélioration étaient indispensables au sein de l’institution, sous forme participative et non plus seulement directive. Ceci a été matérialisé en 2022, par la création d’un projet commun à l’ EOHH et à la CQS, intitulé «la chambre des erreurs ».

2. La Chambre des erreurs
Le concept de la chambre des erreurs
La Chambre des erreurs n’est pas nouvelle dans le milieu de la santé.
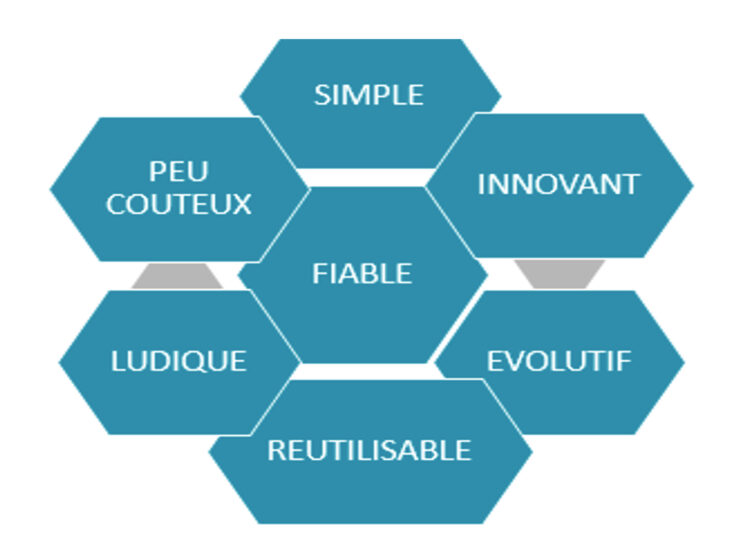
En effet il s’agit d’une méthode d’apprentissage permettant d’initier les soignants aux thèmes qualité et sécurité de leur métier en utilisant la pédagogie par l’erreur, dans un contexte ludique et déculpabilisant. Les caractéristiques de cette méthode sont les suivantes : simple, innovante, fiable, ludique et réutilisable, évolutive et aussi peu coûteuse.
Le concept est simple; dans un environnement de soins reconstitué tel qu’une chambre de patient, une pharmacie, un cabinet médical, un bloc opératoire, etc…., on introduit volontairement des erreurs en nombre limité (8 à 10 maximum). Ces erreurs, mono- ou pluri-thématiques (identito-vigilance (IDV), PCI, médicament) doivent être identifiées par le(s) professionnel(s) de santé lors de leur passage dans la
« chambre des erreurs ».
Revue de la littérature
Une revue de la littérature des 10 dernières années, montre l’application de la chambre des erreurs dans différents secteurs hospitaliers. Une thématique récurrente est la prescription des médicaments dans la pharmacie ( Garnier, 2023 ; Ayed, 2024) , ou en unité d’hospitalisation (Daupin,2016 ;
Joret-Descout, 2015 ). Le quartier opératoire a aussi servi de de sujet à la chambre des erreurs (Turrentine,2020).
L’historique de la chambre des erreurs au CHU Brugmann
Cette initiative n’est pas nouvelle au CHU Brugmann.
En effet, dès 2016, un projet Chambre des erreurs, centré sur la Qualité et la Sécurité des soins au patient, avait été créée par la CQS pour la direction infirmière et paramédicale. Bien que jugé positif, ce projet n’avait plus été réitéré, principalement parce qu’il nécessitait une organisation et une implication importante en ressources humaines.
L’idée de recréer une chambre des erreur communes aux 2 entités (EOHH et CQS) a vu le jour en décembre 2022. Celle-ci s’est concrétisée par l’élaboration d’un projet, présenté et validé au Comité d’Hygiène Hospitalière en janvier 2023.
Description du projet « Chambre des erreurs 2023 »
• Objectifs
1) Rendre le personnel autonome afin de donner des soins de qualité en toute sécurité pour patient
2) Sensibiliser à l’hygiène Hospitalière et à la qualité et sécurité des soins
3) Développer la culture de la qualité et de la sécurité du patient
4) Apprendre à travailler en équipe et à partager l’expérience
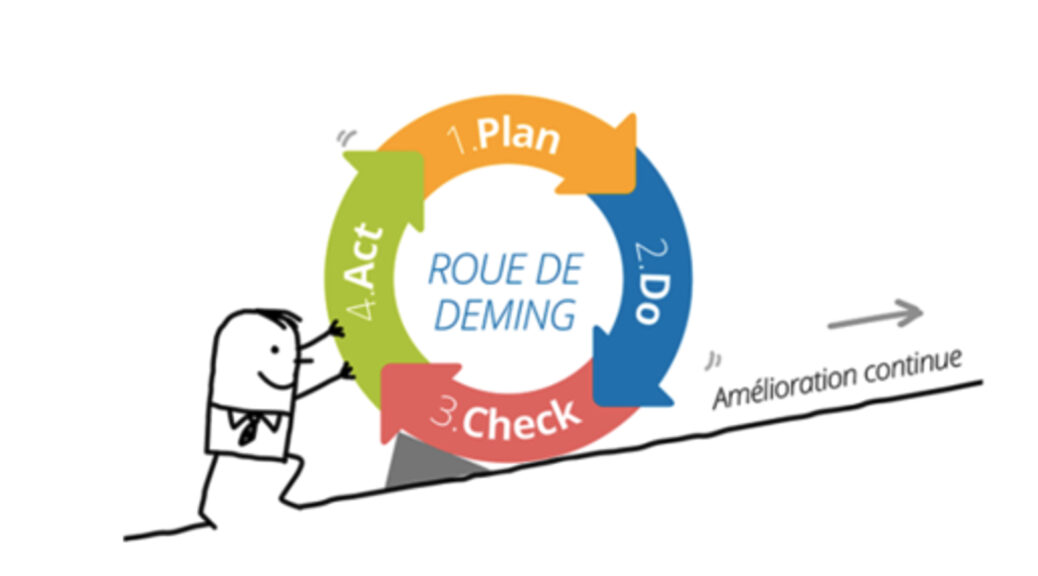
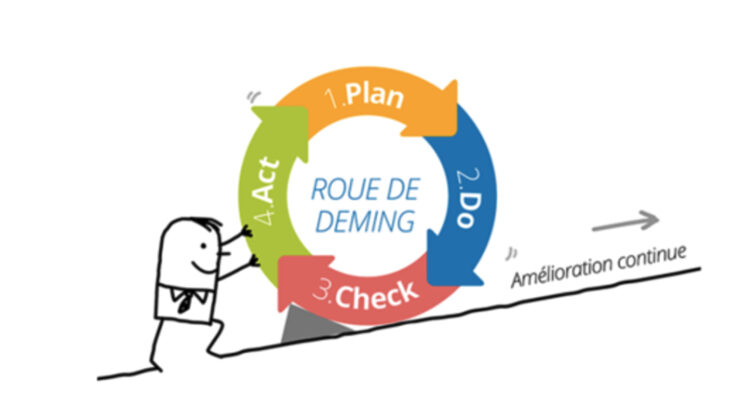
5) Appliquer l’amélioration continue des connaissances en matière de qualité et de sécurité (mise en application du cycle PDCA)
6) Promouvoir la synergie des rôles des cellules qualité de soins et l’hygiène hospitalière en terme de qualité et sécurité des soins du patient
7) Faire partie intégrante de la cellule formation de l’hôpital.
• Le périmètre du projet
Ce projet permettait l’intégration des processus liés à la qualité et la sécurité des soins ainsi que le prévention des infections liées aux soins.
• La méthodologie de la chambre des erreurs au CHU Brugmann.
– La cible :
En priorité les infirmiers référents en hygiène hospitalière et les médecins post-gradués travaillant en unité de soins en chirurgie et en médecine. Les référents sont en moyenne au nombre de 50, de même que les médecins post-gradués.
– Définition des thématiques
Quatre sujets en lien avec l’ hygiène hospitalière ont été retenus :
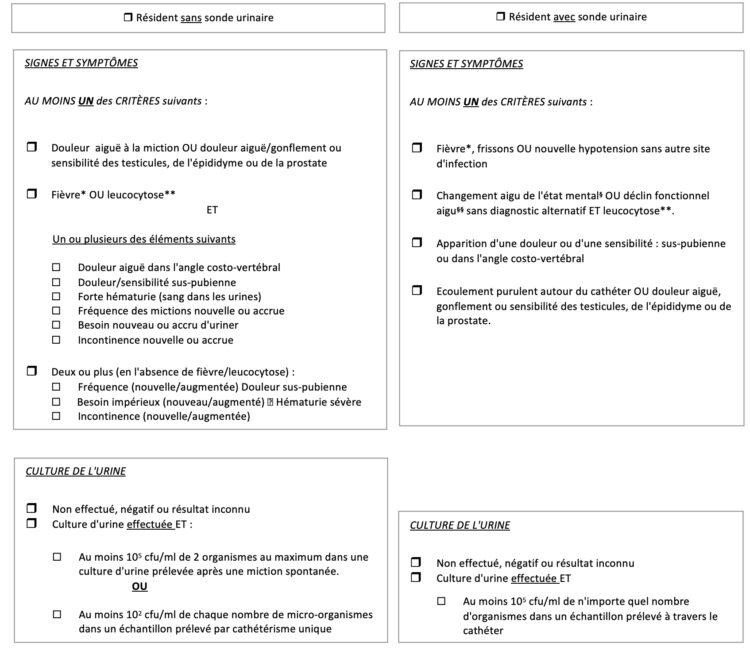
o les sondes urinaires ;
o les cathéters périphériques et centraux ainsi que les perfusions ;
o les précautions standard ;
o les précautions additionnelles.
Les sujets liés à la Cellule Qualité et Sécurité étaient aussi au nombre de 4 :
o l’identitovigilance (IDV) ;
o l’utilisation des médicaments à haut risque (High Risk Médications ; HRM) ;
o le confort et la dignité du patient ;
o la prévention des chutes et des escarres.
– Définition du matériel pédagogique
Neuf scénarios ont été créés, à partir d’ histoires cliniques classiques rencontrées à l’hôpital. Des erreurs d’hygiène hospitalière et de qualité y ont été intégrées, issues des audits en hygiène hospitalière réalisés par l’EOHH ou par la notification d’évènements indésirables à la CQS. Des dossiers médicaux factices ont été créés en imitant au mieux ceux du terrain. Pour chaque dossier médical une liste d’erreurs a été identifiée, avec l’explication et la résolution de celles-ci.
– Définition du matériel et de la logistique
Une liste du matériel par scénario a été définie et envoyée au service achat de l’hôpital. Un maximum de matériel périmé a été demandé. Les frais ont été divisés entre les 2 unités.
Bien que le souhait initial était d’avoir un « faux-vrai patient », un mannequin de réanimation a été emprunté au service des urgences de l’hôpital.
Une chambre libre a été utilisée au sein des 3 sites. Celle-ci était identifiée une semaine avant, en fonction des places disponibles dans le site choisi (en général chambre à rafraichir ou unité de soins temporairement fermée).
– Questionnaire de satisfaction
Un questionnaire de satisfaction a été créé.
– Avant-première
Une avant-première, a été réalisée en mai 2023, permettant aux directeurs médicaux, infirmiers et quelques infirmiers chefs de service de « jouer » et de pouvoir comprendre la méthodologie. Celle-ci a duré quelques heures et a été vécue de manière très positive par les participants.
– Organisation des sessions
Initialement deux sessions, espacées d’un mois, étaient prévues sur chaque site de l’hôpital. Cependant, compte tenu de la complexité d’organisation de ce projet (le CHU Brugmann, étant composé de 3 sites), il a finalement été décidé de ne faire qu’une session par site. Chaque session était organisée sur une semaine (du lundi au vendredi), afin de cibler le maximum de soignants. Chaque infirmier chef de service préparait une liste de passage du personnel des unités dont il était responsable.
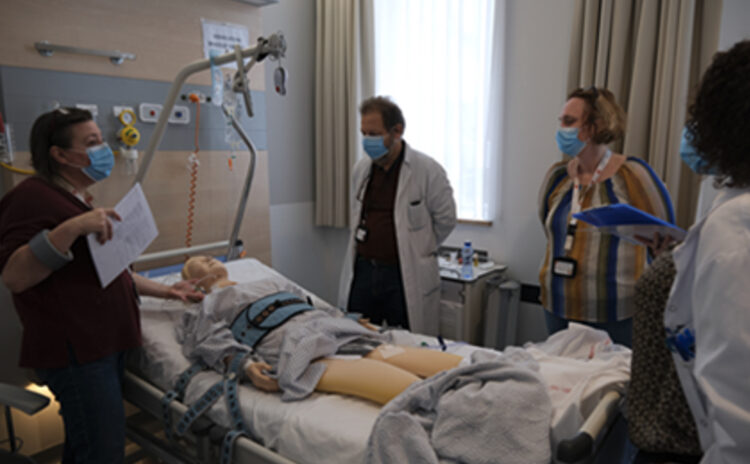
Deux organisations différentes ont été choisies entre la première et la deuxième édition de la Chambre des Erreurs.
La première édition , en 2023 a débuté en mai et s’est terminée en octobre (5 mois). Elle a débuté du 22 au 26 mai sur le site Reine-Astrid, suivi par le site Horta du 12 au 16 juin. Elle s’est clôturée en octobre 2023 par le site de Brien.
La seconde édition, en 2024 a été concentrée sur 1 mois (du 27 mai au 28 juin). L’organisation était la suivante : du 27 au 31 mai à Brien, du 3 au 7 juin à Reine- Astrid et du 24 au 28 juin à Horta .
Résultats de la chambre des erreurs
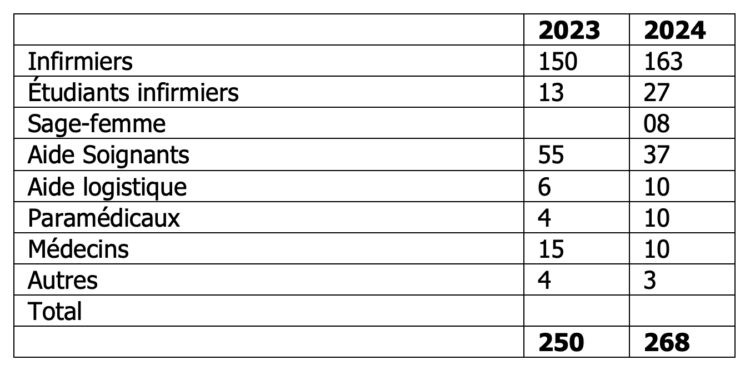
• Nombre et profil des participants
• Enquête de satisfaction

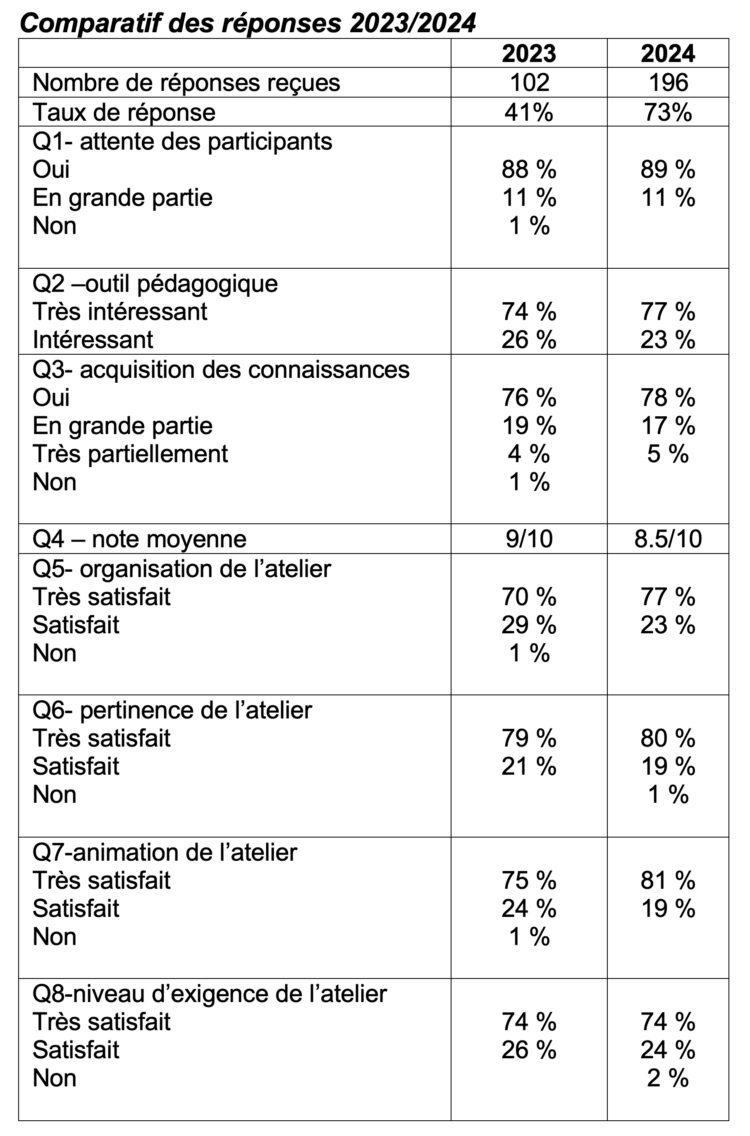
Le nombre de participants a légèrement augmenté entre les 2 années ( 250 participants versus 268 ) mais le taux de réponse a quasi doublé.
Bien qu’on note un score moyen de satisfaction (Q4) qui diminue légèrement (8,5 en 2024 vs 9 en 2023), le taux de remplissage plus élevé des questionnaires met en évidence une implication plus importante des participants, comme le montre la présence de critiques constructive (Q6 et Q7).
Les points positifs :
Méthodologie adaptée au terrain: cette méthode pédagogique est ludique et permet un apprentissage sans stress et avec le sourire. Savoir que la chambre des erreurs a été faite à partir des audits ou des EI (évènement indésirable) a fait comprendre au terrain, l’utilité de ces outils.
La rencontre entre différents soignants : le petit nombre de participants par groupe a permis une rencontre avec « l’autre » et parfois une mise en avant d’autres professionnels que du personnel infirmier.
La visibilité des équipes support : le terrain a rencontré les différents membres des équipes de l’ EOHH et de la CQS et a permis pour certains de mettre une « tête sur un nom ».
Les points négatifs :
La nécessité de « laisser du temps » d’apprentissage : initialement prévue toutes les 30 minutes, il est devenu évident que ce temps devait être augmenté à 45 min afin de laisser plus de temps pour corriger et faire un feed-back suffisant aux participants.
La difficulté de proposer un projet généraliste et le besoin de pédagogie « à la carte » : dès 2024, différentes spécialités ont demandé à avoir leur propre « chambre des erreurs », répondant aux spécificités de leur service (p.ex. : USI, obstétrique …)
2.1. Bilan de la chambre des erreurs
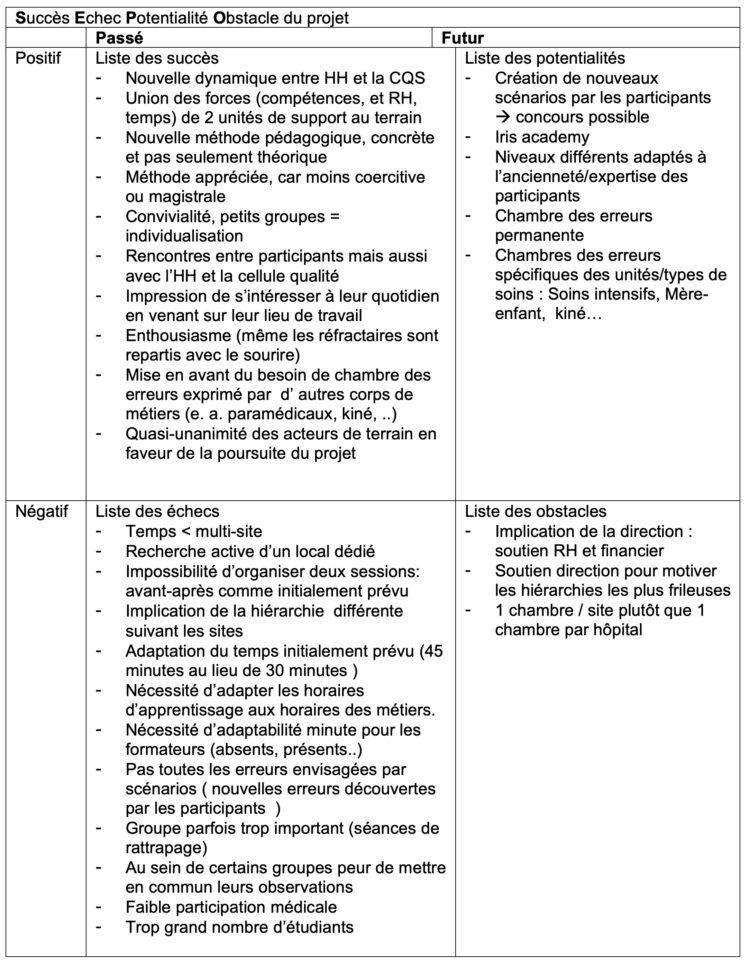
En utilisant la matrice SEPO (Succès, Echecs, Potentialité et Obstacle), nous avons pu analyser les différentes parties du projet.
Les points positifs :
L’union des forces : ce projet n’aurait pu être mis en application par l’EOHH ou la CQS, isolément. En effet, il a demandé beaucoup de temps et un investissement considérable, rendant l’organisation très lourde à gérer par une seule équipe.
Une chambre des erreurs spécifique des unités :
Faisant suite au souhait de chambre des erreurs spécifique des unités exprimé par le terrain, il a été proposé à ce dernier de créer leurs propres scénarios. Une suggestion formulée était d’utiliser les infirmiers référents en hygiène hospitalière afin de les aider à assoir leur rôle au sein des unités.
De plus, le personnel travaillant spécifiquement la nuit, a demandé à avoir un atelier adapté à leur horaire (prévu en 2025).
Une chambre des erreurs permanente : le CHU Brugmann accueille sur son site, l’école infirmière Francisco Ferrer, et il serait possible de créer en son sein une chambre permanente, susceptible d’être adaptée en fonction des scénarios retenus.
Dans cette dernière formule, on parlerait plutôt alors d’une chambre de simulation.
Son inconvénient majeur serait que la formation ne se déroulerait plus sur le site de travail habituel du personnel avec comme corollaire la nécessité que les participants doivent se déplacer pour venir à la formation. Une telle organisation paraît plus compliquée et risquerait d’entraîner une diminution du taux de participation.
L’intégration de la Chambre des erreurs à la cellule formation, qui permettrait de valoriser professionnellement la participation à celle-ci.
La création de la chambre des erreurs HH-CQS à la plateforme de e-learning Iris Academy
Trois scénarios ont été identifiés par l’équipe mixte HH et CQS afin de les intégrer à Iris Academy. Celle-ci pourrait se faire fin 2025.
Les points négatifs :
La difficulté d’organisation de projet dans un hôpital multi-sites: le facteur logistique, le temps de déplacement et le déménagement du matériel ont été mis en évidence. Ces différents éléments doivent être pris en considération lors de l’élaboration du projet.
La difficulté de proposer des projets multidisciplinaires (médecin-infirmier): ceci est dû principalement aux horaires de travail différents des uns et des autres. Les soignants appartenant au DDIP (direction du département infirmier et paramédical) sont plus disponibles durant la pause de midi ou en fin de service vers 15h. Pour les médecins, l’heure de midi semble plus favorable. Cela a conduit à préférer l’horaire 10h-15h.
Les changements inopinés des horaires du personnel ont aussi posé problème. La participation différée de certains membres a entraîné la constitution de groupes trop grands, en particulier sur un site.
La diffusion de l’information a été jugée insuffisante par certains et nécessitera d’inclure le service de communication dans le futur.
Tableau SEPO 3.
Conclusion
L’hygiène hospitalière et de la Qualité et Sécurité des soins ont mis en commun leurs connaissances et expériences pour élaborer le projet commun de la chambre des erreurs. Cette synergie s’est avérée très positive.
Ce projet qui n’a bénéficié d’aucun soutien financier, a été réalisé avec la bonne volonté de tous et les moyens du bord. Parmi les points positifs enregistrés suite à l’initiation de ce projet, on note :
-L’intégration du médecin de la cellule qualité au comité d’ HH ;
-L’intégration de l’infirmier chef de service PCI dans le Comité de Retour d’ Expérience (CREX) ;
-Une meilleure connaissance du fonctionnement mutuel qui favorise l’échange et le partage d’outils d’enregistrement, tels que:
o L’utilisation par l’EOHH des outils d’audit de la CQS (audit avec tablette) ;
o L’utilisation par la CQS des outils de suivi des précautions additionnelles de l’EOHH pour le suivi des précautions spéciales en médecine nucléaire ;
o L’intégration des indicateurs HH au tableau de bord Qualité.
Conscients de ce que la rédaction de cet article n’apporte que peu de contribution à la science, notre retour positif d’expérience met en évidence que des moyens modestes, de la bonne volonté et de l’ingéniosité peuvent améliorer significativement la qualité et la sécurité des soins.
4. Annexe : questionnaire de satisfaction

5. Références
1) Arrêté royal modifiant l’arrêté royal du 23 octobre 1964 portant fixation des normes auxquelles les hôpitaux et leurs services doivent répondre, article 1er,point 9 bis
https://www.ejustice.just.fgov.be/cgi/article_body(…)
2) Loi du 22 août 2002 relative aux droits du patient
https://loi_du_22_aout_2002_relative_aux_droits_du_patient.pdf
Loi modifiant la loi du 22 août 2002 relative aux droits du patient et modifiant les dispositions en matière de droits du patient dans d’autres lois en matière de santé
https://www.ejustice.just.fgov.be/cgi/article_body(…)
3) Loi relative à la qualité de la pratique des soins de santé du 22 avril 2019, publiée le 14 mai 2019.
https://www.ejustice.just.fgov.be/cgi/article_body(…)
4)Arrêté De La Commission Communautaire Commune du 25 mai 2023 publié le 04 août 2023 https://www.ejustice.just.fgov.be/cgi/article_body(…)
5) Garnier, Alexandra. A room of errors simulation to improve pharmacy operators’ knowledge of cytotoxic drug production. J Oncol Pharm Pract. 2023 Dec;29(8):1868-1877. DOI 10.1177
6) Ayed, Amal. Une chambre des erreurs comme moyen d’apprentissage dans une faculté de pharmacie. Can J Hosp Pharm. 2024 Jan 10;77(1):e3436. DOI: 10.4212/cjhp.3436
7) Daupin, Johanne. Medication errors room: a simulation to assess the medical, nursing and pharmacy staffs’ ability to identify errors related to the medication-use system. J Eval Clin Pract. 2016 Dec;22(6):907-916.DOI: 10.1111/jep.12558.
8) Turrentine, Florence.Enhancing Medical Students’ Interprofessional Teamwork Through Simulated Room of Errors Experience. J Surg Res . 2020 Jul:251:137-145.
DOI: 10.1016/j.jss.2020.02.001.
9) Joret-Descout,P. A training medication errors room: simulate to better train health professionals J Pharm Belg. 2015 Jun:(2):10-9. PMID: 26466505