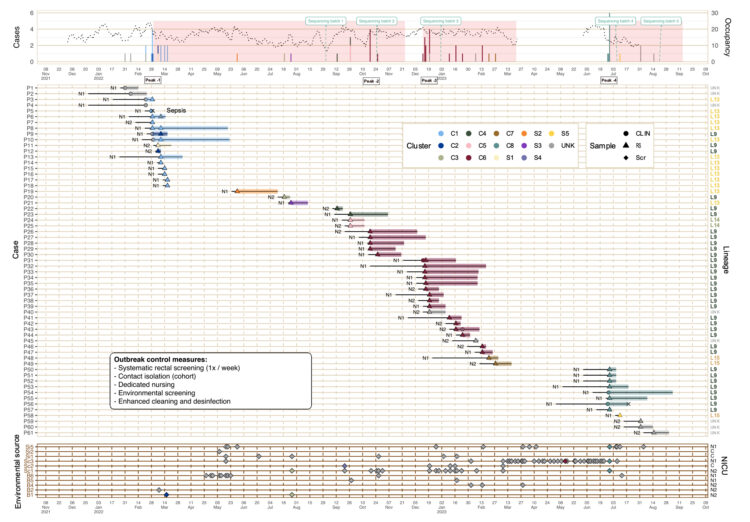
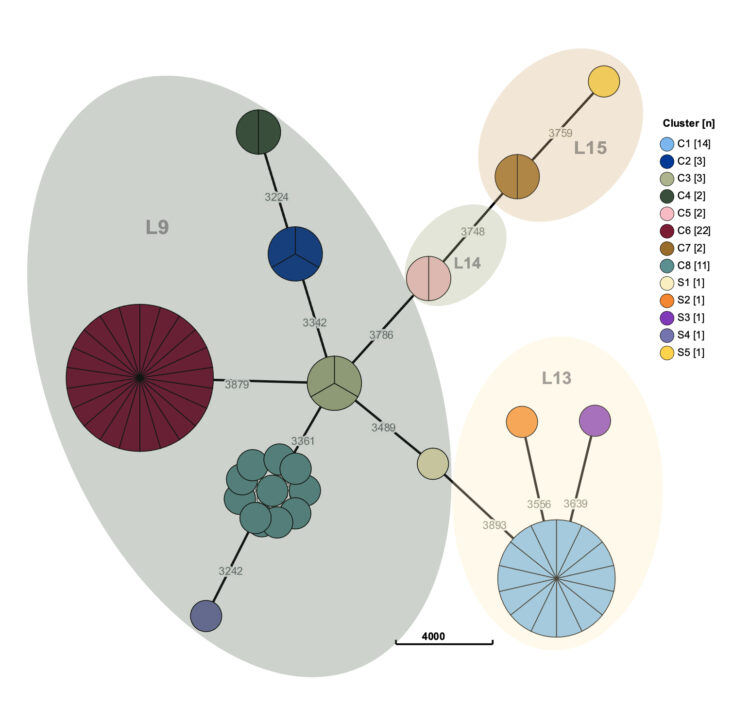
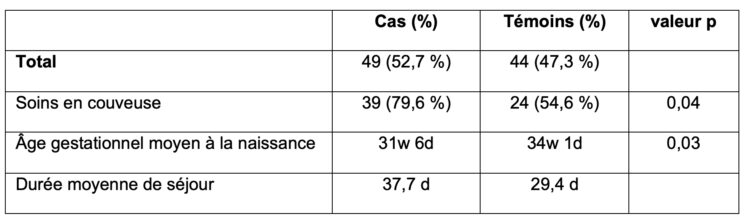
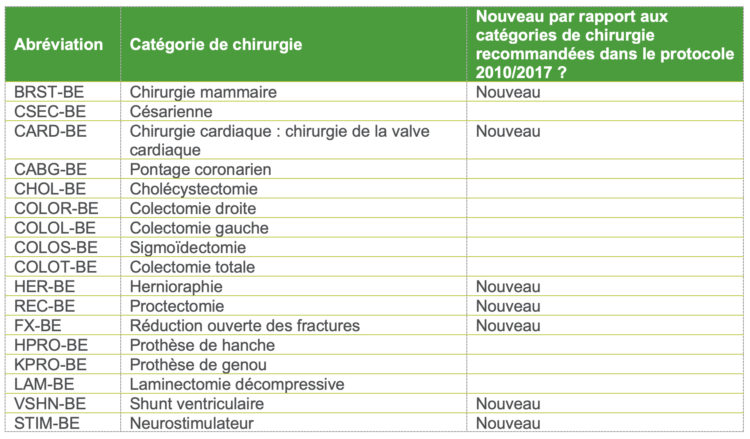
Les services d’urgences pour adultes brassent quotidiennement un grand nombre de patients présentant une voire plusieurs indications de prélèvement d’hémocultures. Ces prélèvements y sont donc nombreux, et font de ces services les plus gros préleveurs d’hémocultures dans nos hôpitaux.
Cependant, le nombre très élevé d’hémocultures prélevées n’est pas la seule spécificité des services d’urgences. Les flux imprévisibles de patients à toute heure du jour ou de la nuit, l’hétérogénéité des cas et la gestion fréquente de situations de crise impliquent que les prélèvements d’hémocultures ne soient pas toujours réalisés dans des conditions optimales.
Ces divers éléments ont suscité l’intérêt des équipes de prévention et contrôle des infections (PCI) du réseau Helora et les ont amener à évaluer le taux de contamination d’hémocultures au sein de ces services. L’intérêt étant commun à plusieurs équipes PCI, HOST a été désigné comme porteur du projet pour le réseau hospitalier. Après une première mesure des indicateurs de contamination d’hémocultures aux urgences sur un trimestre et une comparaison avec les taux décrits pour ce type de service dans la littérature scientifique, une stratégie multimodale a été mise en place afin de diminuer les taux de contamination des hémocultures. L’objectif étant d’obtenir des taux de flacons contaminés inférieurs à 2%, cinq des sept services d’urgences du réseau ont été inclus. Les deux autres ayant des taux déjà inférieurs à cette limite.
Voici une description du projet réalisée selon les cinq éléments de la stratégie multimodale (SMM) de l’Organisation mondiale de la Santé (Organisation mondiale de la Santé, 2009).
Changement de système
Une procédure de prélèvement d’hémocultures commune aux différentes institutions du réseau a été rédigée en se basant sur les dernières recommandations de la littérature ainsi que sur l’expertise des représentant des équipes PCI impliqués dans le projet. Trois points-clés ont été mis en avant pour la prévention des contaminations d’hémocultures :
– L’hygiène des mains avant le prélèvement
– La désinfection des opercules des flacons à l’aide d’un antiseptique alcoolique pendant 15 secondes
– La désinfection du point de ponction à l’aide d’un antiseptique alcoolique pendant 15 à 30 secondes
Il est d’usage dans certains hôpitaux, notamment au nord du pays, d’utiliser un holder neuf pour le prélèvement d’hémocultures afin de limiter le risque de contamination. Cependant, faute d’étude sur le sujet, cette recommandation n’a pas été mentionnée telle quelle dans la version finale de la procédure.
D’autres éléments ont été rappelés dans la procédure. En voici quelques exemples : port de gants non stériles lors du prélèvement, ordre de prélèvement des flacons (aérobie en premier), possibilité de prélever les quatre flacons d’hémoculture sur un même site de ponction, volume de remplissage suffisant des flacons ;
Bien que cette procédure décrive le prélèvement d’hémocultures chez l’adulte dans l’ensemble des unités des hôpitaux du réseau, le fait qu’elle soit appliquée également au sein des services d’urgences a influencé sa rédaction. En effet, la possibilité de prélever les flacons sur cathéter périphérique au moment de la mise en place de celui-ci et plus par la suite (sauf en cas de suspicion d’infection de cathéter) est dérivée des pratiques des services d’urgences.
Les indications de prélèvement n’ont pas été spécifiées dans cette procédure car il a été décidé qu’elles n’entraient pas dans le périmètre du projet.
Pour faciliter l’application de la procédure, l’équipe infirmière d’un des services concernés par le projet a eu l’idée de créer un kit de prélèvement d’hémocultures (figure 1). Celui-ci est assemblé par l’assistante logistique du service. Suivant le même objectif, l’utilisation de chariots de soins lors du prélèvement d’hémocultures a été encouragée et, pour les sites où l’architecture des locaux ne permet pas l’utilisation de chariots, les équipes ont été incitées à utiliser un plateau adapté.
Figure 1 : Kit de prélèvement d’hémocultures

Formation et éducation
Une fois la procédure rédigée, le défi qui se dressait face à HOST et aux équipes PCI était de communiquer à propos de celle-ci vers les préleveurs d’hémocultures aux urgences. Afin de diffuser au mieux les informations, un e-learning (vidéo de 5 minutes suivie d’un quizz de 5 questions) et une formation en présentiel ont été proposés. Ces supports synthétisent l’ensemble des éléments clés de la procédure de prélèvement et résument les résultats obtenus au premier questionnaire concernant les pratiques de prélèvement des infirmiers des urgences. Ils présentent également l’impact des contaminations d’hémocultures pour les patients, l’institution de soins et le système de santé en général. Les infirmiers en chef, partenaires privilégiés de l’équipe projet, ont également eu un rôle de formateur en participant à la communication des informations vers leurs équipes.
Evaluation et restitution des résultats
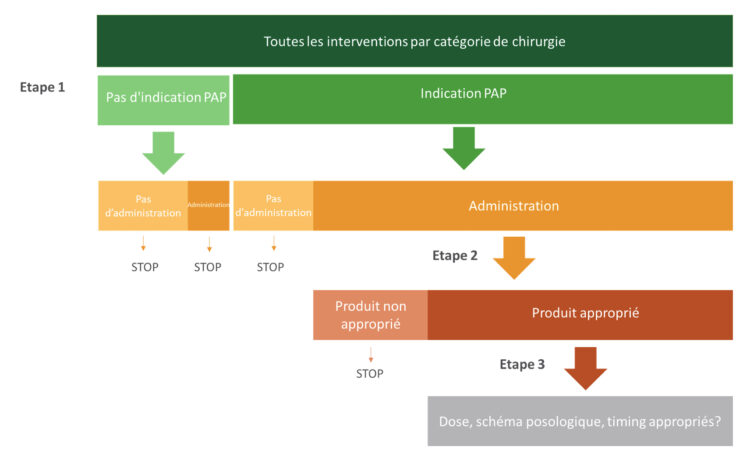
Afin d’établir une mesure des taux de contaminations d’hémocultures aux urgences au fil du temps, deux types d’indicateurs ont été choisis. Le premier est calculé en divisant le nombre de flacons d’hémoculture contaminés par le nombre total de flacons prélevés. Il s’agit de l’indicateur sur lequel se base l’objectif de la stratégie multimodale. Le second indicateur désigne le nombre de patients chez qui au moins un flacon d’hémoculture a été contaminé divisé par le nombre de patients chez qui des hémocultures ont été prélevées. Il a été choisi pour évoquer l’impact potentiel des contaminations d’hémocultures chez les patients. Cependant, l’impact réel sur les patients, représenté par la figure 2, ne peut être évalué avec les outils à disposition. Dans le but d’obtenir des données comparables entre les différents sites hospitaliers, la définition d’hémoculture contaminée utilisée a été standardisée en utilisant les critères définis dans le cadre du programme de surveillance nationale des septicémies de Sciensano (Sciensano, 2019). Suivant cette définition, un médecin PCI, infectiologue ou pharmacien microbiologiste déterminait pour chaque mois le nombre d’hémocultures contaminées parmi les hémocultures positives. L’évolution des taux de contamination d’hémocultures était représentée, pour chaque site hospitalier, sous forme de graphiques (figures 3 à 7). Le premier indicateur y est appelé « taux de flacons contaminés » et le second est identifié par «taux de patients contaminés ».
Figure 2 : Conséquences des contaminations d’hémocultures (Doern et al, 2019)
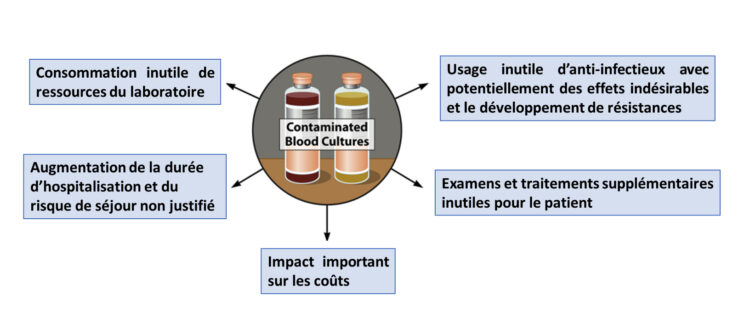
Figure 3 : Représentation des taux de contamination-hôpital 1
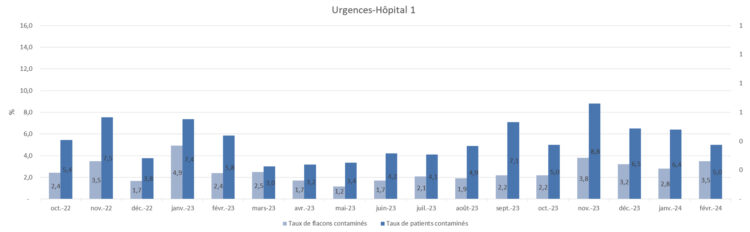
Figure 4 : Représentation des taux de contamination-hôpital 2
Figure 5 : Représentation des taux de contamination-hôpital 3
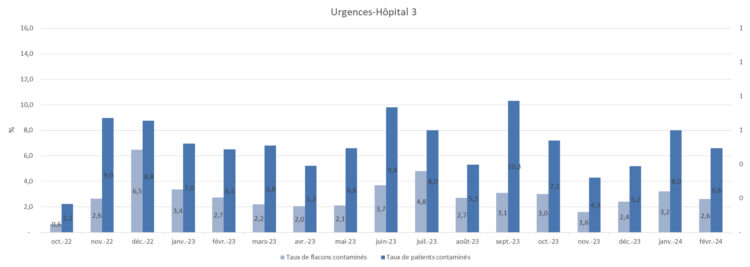
Figure 6 : Représentation des taux de contamination-hôpital 4
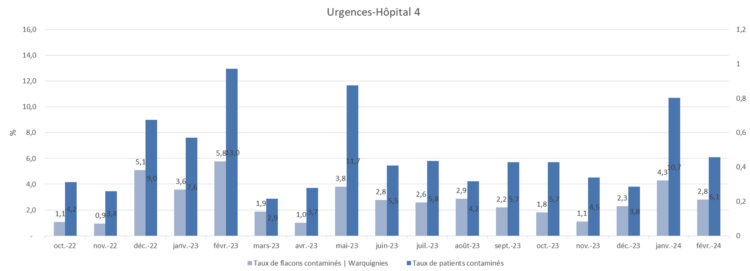
Figure 7 : Représentation des taux de contamination-hôpital 5
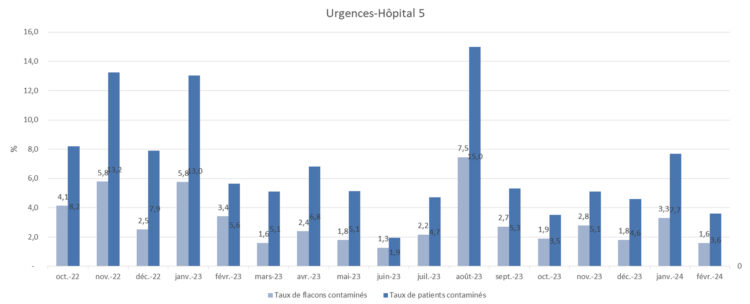
Un questionnaire destiné aux préleveurs d’hémocultures des urgences a été distribué par voie informatique à deux reprises. Le choix d’utiliser un questionnaire de déclaration des pratiques de prélèvement plutôt qu’une observation directe sur le terrain a été fait car le projet concernait plusieurs sites hospitaliers et, pour certains services d’urgences, il y avait moins d’un prélèvement d’hémocultures par jour. Lors de la première distribution du questionnaire, les objectifs étaient de connaitre les pratiques de prélèvement d’hémocultures et d’évaluer la perception de l’impact des contaminations d’hémocultures par les préleveurs avant la communication de la nouvelle procédure. Les répondants restaient anonymes mais devaient indiquer le site hospitalier sur lequel ils travaillaient. Les résultats ont permis de concevoir les outils de formation de manière à insister sur les pratiques qui ne correspondaient pas à la nouvelle procédure. A titre d’exemple, le questionnaire a mis en évidence la non-observance de l’indication d’hygiène des mains avant prélèvement et l’absence quasi systématique de désinfection de l’opercule des flacons d’hémocultures. Cependant, ils n’ont pas permis d’identifier des différences majeures de pratiques entre les sites hospitaliers permettant d’expliquer les écarts importants des taux de contamination observés entre les établissements, notamment dans les services où l’objectif de la SMM était atteint d’emblée. Ce même questionnaire a été distribué une seconde fois près d’un an après la première diffusion. Cette fois, l’objectif était d’évaluer l’application de la nouvelle procédure de prélèvement après la phase de formation des équipes. Les résultats ont permis de faire des communications ciblées par site hospitalier concernant les éléments de la procédure qui ne semblaient pas bien compris.
Un outil d’audit des prélèvements d’hémocultures a été créé et devait être utilisé lors d’audits de l’observance des indications d’hygiène des mains. Cependant, aucun prélèvement d’hémocultures n’a eu lieu à ces moments. L’outil a, toutefois, été utilisé par l’infirmier chef des urgences de l’un des sites suite à une augmentation des taux de contamination inexpliquée en cours de projet. Les résultats de ces audits ont également permis de communiquer vers l’équipe infirmière à propos des observations qui n’étaient pas conformes à la procédure. Celles-ci concernaient la durée de la désinfection du point de ponction qui était inférieure à 15 secondes, le non respect du port des gants à usage unique pour le prélèvement sanguin et l’observance de l’indication d’hygiène des mains juste avant la ponction.
Rappels et incitatifs
Plusieurs rappels et incitatifs ont été mis en place dans le cadre de ce projet. D’abord, les responsables du projet ont rencontré individuellement les infirmiers en chef des services concernés. Lors de ces réunions, le projet a été présenté ainsi que les indicateurs propres au service comparés aux indicateurs consolidés pour les urgences du réseau hospitalier. Les éléments clés de la nouvelle procédure de prélèvement ont également été intégrés à la présentation. De même, les résultats du questionnaire de déclaration des pratiques de prélèvement ont été détaillés à l’infirmier en chef.
Ensuite, une communication mensuelle des indicateurs de contamination des hémocultures aux responsables des unités concernées par le projet a été réalisée par mail. Les données étaient représentées sous forme de graphique présentant les indicateurs de l’unité concernée. Quelques commentaires et encouragements accompagnaient ces informations.
En outre, l’hygiène des mains étant incontournable pour limiter le risque de contamination des hémocultures, des audits de l’observance des indications d’hygiène des mains ont été menés par l’infirmière HOST chaque mois au sein des services concernés. Les résultats de ces audits étaient associés au courriel communiquant l’évolution des indicateurs de contamination.
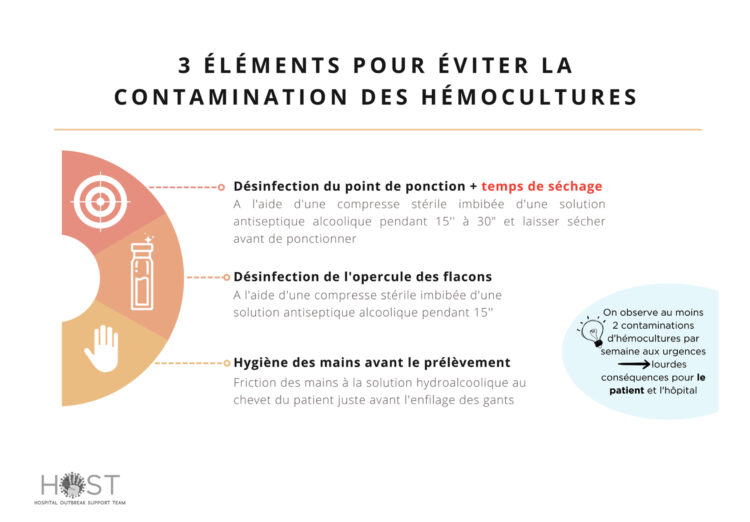
Les infirmiers en chef se chargeaient ensuite de la communication de ces éléments vers leur équipe. Sur les sites où une station de gestion visuelle avait lieu de manière hebdomadaire, les informations étaient transmises à l’équipe lors de cette réunion. Pour les aider dans cette communication, l’affiche présentée en figure 8 a été créée.
Figure 8 : Affiche
Culture institutionnelle
Le projet et ses résultats ont étés présentés aux comités d’hygiène hospitalière et aux différents groupes de gestion des antibiotiques du réseau. Selon les sites et les habitudes des équipes PCI locales, les médecins chefs des urgences et infirmiers chefs de service ont été associés ou non au projet. Par exemple, lors d’une amélioration flagrante des résultats d’audit d’observance des indications de l’hygiène des mains, l’infirmière HOST et l’infirmière chef de service sont allées féliciter l’équipe en question lors de la station de gestion visuelle.
Conclusion
La réalisation de ce projet s’est étalée sur un peu plus d’un an. Il a été nécessaire d’adapter le projet et les ambitions aux réalités des différents services. En effet, les infrastructures mais aussi l’activité des services d’urgences sont hétérogènes dans le réseau. Par exemple, le nombre de flacons prélevés lors d’un mois pouvait être inférieur à 200 sur un site hospitalier et supérieur à 900 sur un autre. Les indicateurs des services d’urgences où les dénominateurs étaient faibles varient très rapidement. Il était donc difficile de mesurer mensuellement l’impact du projet dans ces services. A cela s’ajoutent des influences externes sur le projet comme le caractère saisonnier des infections et des fluctuations dans les ressources humaines. La plupart des équipes ont souhaité que les indicateurs de contamination des hémocultures leur soient toujours communiqués régulièrement que ce soit chaque mois ou chaque trimestre.
Les résultats du projet sont positifs bien que la limite de 2% de flacons contaminés semble trop ambitieuse. Les taux de flacons contaminés se sont stabilisés entre 2 et 3% sur quatre des cinq services d’urgences, sauf augmentation ponctuelle. Pour le dernier service n’ayant pas atteint l’objectif (hôpital 2), la procédure ne semble pas bien comprise. La communication des messages clés de prévention des contaminations d’hémocultures s’y poursuit donc.
Bibliographie
Clinical Practice Guideline: Prevention of Blood Culture Contamination. (2018). Journal of emergency nursing, 44(3), 285.e1–285.e24. https://doi.org/10.1016/j.jen.2018.03.019
Doern, G. V., Carroll, K. C., Diekema, D. J., Garey, K. W., Rupp, M. E., Weinstein, M. P., & Sexton, D. J. (2019). Practical Guidance for Clinical Microbiology Laboratories: A Comprehensive Update on the Problem of Blood Culture Contamination and a Discussion of Methods for Addressing the Problem. Clinical microbiology reviews, 33(1), e00009-19. https://doi.org/10.1128/CMR.00009-19
Organisation mondiale de la Santé. (2009). WHO multimodal improvement strategy. Récupéré sur Organisation mondiale de la Santé: https://cdn.who.int/media/docs/default-source/integrated-health-services-(ihs)/hand-hygiene/tools/ipc-cc-mis.pdf?sfvrsn=425b25d_6&download=true
Sciensano. (2019, Avril). Surveillance des septicémies dans les hôpitaux belges. Récupéré sur Sciensano: https://www.sciensano.be/sites/default/files/bsi_surv_protocol_fr_april2019.pdf
Société Française de Microbiologie (2022). Référentiel de microbiologie médicale (Vol. 7.1). Société Française de Microbiologie