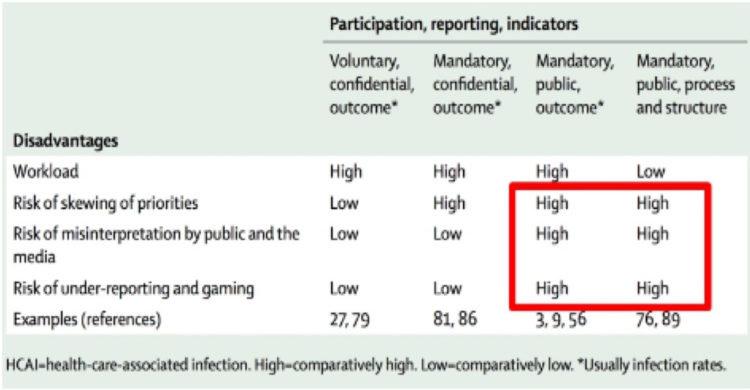
Inleiding
Enterokokken zijn commensale bacteriën van de gastro-intestinale tractus van gezonde personen en kunnen ook aanwezig zijn ter hoogte van het voorste gedeelte van de urethra, de vagina, de huid en de oropharynx. Zij zijn gekend als humane opportunistische pathogenen. Er bestaan verschillende species, maar het zijn vooral Enterococcus faecalis en Enterococcus faecium die bij de mens infecties kunnen veroorzaken. De meest voorkomende ernstige infecties veroorzaakt door enterokokken zijn bloedbaaninfecties (soms met aantasting van de hartkleppen), urineweginfecties, postoperatieve wondinfecties, intra-abdominale infecties en katheterinfecties (1). Vooral patiënten met een verminderde immuniteit lopen een verhoogd risico. Het gaat meestal om patiënten die langere tijd in het ziekenhuis hebben doorgebracht en antibiotica kregen (2). Wereldwijd wordt sedert enkele decennia resistentie van enterokokken tegen vancomycine beschreven. Vancomycine resistente enterokokken (VRE) zijn meestal niet pathogener dan gevoelige stammen, al bemoeilijkt hun resistentiepatroon de behandeling van infecties met VRE. Daarnaast hebben zij ook de neiging om endemisch te worden, doordat ze gemakkelijk overleven in de omgeving.
Tijdens de eerste drie maanden van 2015 ontving het Nationaal Referentiecentrum (NRC) een toenemend aantal VRE isolaten van ziekenhuizen, waarvan zich enkele in een epidemische situatie bevonden. In oktober 2015 kregen de ziekenhuizen een bericht (“VRE alert”) van het Agentschap Zorg en Gezondheid waarin aandacht gevraagd werd voor de in ons land opduikende VRE (4).
Tot in 2011 werd in het Universitair Ziekenhuis Brussel (UZ Brussel) sporadisch VRE gedetecteerd. Na een kleine cluster in 2012 bleef de incidentie laag met een lichte stijging in 2015. In juni 2016 werden we plots geconfronteerd met een stijging van VRE-detectie op de verpleegeenheid nefrologie en de eenheid hemodialyse.
In dit artikel geven we een beschrijving van het verloop van de uitbraak en de stappen die ondernomen werden om verdere transmissie te voorkomen.
Materiaal en Methoden
Achtergrond
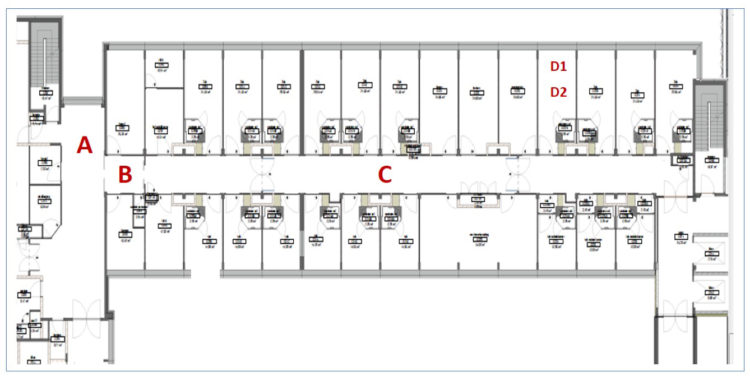
Op het ogenblik van de uitbraak bestond de verpleegeenheid nefrologie uit 29 bedden met 9 éénpersoonskamers met een eigen sanitaire cel en 10 tweepersoonskamers met gemeenschappelijk sanitair. Op deze eenheid worden zowel patiënten met geneeskundige als heelkundige problemen aan de nier- en urinewegen behandeld, zoals bijvoorbeeld dialyse- en niertransplantpatiënten, patiënten met infecties van de urinewegen alsook patiënten met algemeen internistische aandoeningen.
Op de eenheid hemodialyse worden zowel ambulante als gehospitaliseerde patiënten behandeld. De eenheid bestaat uit 5 zalen verdeeld over 2 verdiepingen. In totaal kunnen er 70 patiënten per dag behandeld worden in het UZ Brussel, 6 dagen op 7. Er worden ook patiënten gedialyseerd in 2 eenheden op sites buiten het ziekenhuis.
De uitbraak werd gedetecteerd op de eenheid nefrologie bij patiënten die tevens behandeld werden met hemodialyse in het UZ Brussel. Op het moment van de uitbraak werden er gemiddeld 26 patiënten kort- en langdurend gehospitaliseerd op de eenheid.
Microbiologie
Rectale swabs (eSwab, Copan, Brescia, Italië) van patiënten werden uitgeplaat op een selectief chromogeen medium (ChromID VRE, bioMérieux, Marcy l’Etoile, Frankrijk). De platen werden na 24 en 48 uur incubatie op 35°C onderzocht op de aanwezigheid van VRE. Enterokokken die intrinsiek resistent zijn tegen vancomycine (E. gallinarum en E. cassiflavus) groeien in normale omstandigheden niet op deze platen. Verdachte kolonies hebben een roze blauwe kleur. Deze kolonies werden geselecteerd voor verdere identificatie door middel van Matrix-assisted laser desorption/ionization time of flight mass spectrometry (MALDI-TOF MS) met behulp van een Microflex LT massaspectrometer met MALDI Biotyper 3.0 software en Reference Library 3.2.1.0 (Bruker DaltonikGmbH, Bremen, Duitsland). In het geval van de aanwezigheid van enterokokken, werd er een multiplex PCR uitgevoerd om de aanwezigheid van van-genen te detecteren (vanA, vanB (B-1, B-2 van B-3), vanC-1 en vanC-2/C-3).
Een VRE wordt gedefinieerd als een Enterococcus faecium stam met een MIC> 4mg/l voor vancomycine door het verwerven van een vanA- of vanB-gen. (HGR 9277)
Alle isolaten werden verzonden naar het referentielaboratorium voor verdere typering. Multilocus sequence typing (MLST) gebeurde op alle stammen. Pulsed field gel electrophoresis (PGFE) werd slechts uitgevoerd op een gedeelte van de stammen.
Verloop van de epidemie en getroffen maatregelen
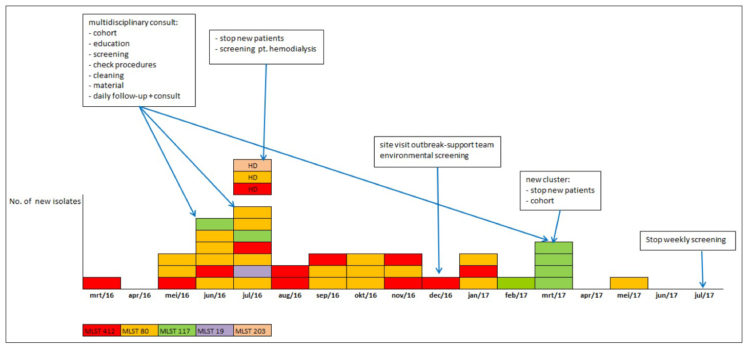
Van juni 2016 tot juni 2017 werden op de eenheid nefrologie 37 patiënten met vermoedelijk nosocomiaal verworven vanA-positieve VRE gedetecteerd, waarvan 4 in klinische stalen en 33 in rectale uitstrijken.
In het voorjaar van 2016 steeg het aantal nieuwe patiënten met VRE op de nefrologie-eenheid van één geval in maart tot zes gevallen in mei en juni (waarvan 3 met positieve rectale uitstrijken en 4 met positieve klinische monsters). Drie van de VRE-positieve patiënten werden behandeld op de eenheid hemodialyse. Om verdere verspreiding tegen te gaan, werden, naast de bijkomende voorzorgsmaatregelen (BVM), aanvullende acties ondernomen op de verpleegeenheid nefrologie en de eenheid hemodialyse. Voorzorgsmaatregelen en aanvullende acties worden hieronder verder beschreven (3-4-5-6-7).
Er werd een multidisciplinair outbreakteam samengesteld met vertegenwoordigers van beide eenheden, dat voor het eerst samenkwam op 29 juni 2016. Alle aanwezige patiënten op de verpleegeenheid nefrologie werden onmiddellijk en vervolgens wekelijks gescreend. Alle hemodialysepatiënten (N= 100) werden éénmalig gescreend. Dit gaf aanleiding tot de detectie van 3 bijkomende VRE positieve patiënten.
Preventie van overdracht werd gerealiseerd door cohortering van VRE- positieve patiënten met zorgverleners, die specifiek aan hen werden toegewezen, zowel op de verpleegeenheid als op de eenheid hemodialyse. Doorgedreven reiniging en desinfectie van materiaal en kamers werden benadrukt door uitbreiding van patiëntgebonden materiaal en speciale aandacht voor “high touch” oppervlakken en het sanitair. Sommige procedures werden onvoldoende nageleefd en er bleken ook enkele grijze zones, zoals de reiniging en desinfectie van de weegstoel tussen 2 patiënten. Continue (her)opleiding en opvolging van personeel en patiënten werden georganiseerd.
Omdat de incidentie ondanks deze voorzorgsmaatregelen, verder bleef toenemen werden er gedurende 3 weken geen nieuwe patiënten meer opgenomen op de eenheid nefrologie, tenzij gekende VRE-dragers. Nieuwe patiënten werden opgenomen op een andere eenheid. VRE-positieve gehospitaliseerde dialyse patiënten werden tijdens hun dialyse-behandeling gecohorteerd in één dialysezaal. Deze zaal heeft een capaciteit van 5 bedden, met een extra isolatiebox (1 bed). Deze isolatiebox is voorbehouden voor patiënten in contactisolatie met multiresistente micro-organismen of Clostridium difficile diarree. De toegang tot deze isolatiebox gebeurt via een sas waar de nodige elementen voor een goede handhygiëne aanwezig zijn zoals lavabo, handzeep, papieren wegwerphanddoekjes en handalcohol. Bij het betreden van dit sas wordt steeds een wegwerp overschort aangetrokken.
Een aantal van de gehospitaliseerde VRE-dragers waren niertransplantpatiënten. Na ontslag uit het ziekenhuis werden zij gevolgd op de poliklinische raadpleging. Het toepassen van bijkomende voorzorgsmaatregelen voor deze VRE-dragers werd bemoeilijkt door het ontbreken van een duidelijke signalisatie (BVM) in het elektronisch patiëntendossier voor ambulante patiënten en het feit dat er op de raadpleging geen apart sanitair beschikbaar is. Er was ook geen scheiding van onderzoeksruimte, medisch materiaal of wachtzaal. Om de transmissie te beperken, werd ingezet op patiënteneducatie door middel van herhaaldelijke mondelinge training en schriftelijke informatiebrochures. Er werd een beleid opgesteld om huisartsen van betrokken patiënten correct te informeren over het beleid bij VRE-dragerschap.
Het ziekenhuishygiëneteam was dagelijks aanwezig op de verpleeg- en hemodialyse-eenheid om toe te zien op de correcte toepassing van de voorzorgsmaatregelen en continu bij te sturen waar nodig.
Daarnaast werd het Outbreaksupport team (OST) van de federale overheid geraadpleegd (afgevaardigden van het Agentschap Zorg en Gezondheid, afgevaardigden van het toenmalig WIV (Sciensano) en experts van het Nationaal Referentiecentrum). Ze namen deel aan verschillende vergaderingen, brachten een onverwacht bezoek op de eenheden, observeerden en namen monsters van oppervlakken en handen van de zorgverleners. Er werd door hen geen VRE gedetecteerd. Sommige monsters vertoonden wel een verhoogd kiemgetal.
Na een daling van de incidentie werd er in maart 2017 een nieuwe cluster opgemerkt en gebeurde er opnieuw een cohortering van patiënten en personeel. De schoonmaak werd gecontroleerd d.m.v. bacteriologische monsters, maar er werd geen VRE gevonden.
In juni 2017 werd de wekelijkse screening van gehospitaliseerde patiënten gestopt, 4 weken na de laatste detectie van een nieuwe drager op de eenheid. Alle nieuwe hemodialysepatiënten worden nog steeds gescreend. Patiënten die terugkeren uit vakantie en tijdelijk gedialyseerd waren in een ander centrum worden ook gescreend.
VRE-dragers worden van nabij opgevolgd. Bijkomende voorzorgsmaatregelen worden gestopt na 3 negatieve screenings met een interval van 1 maand.
Microbiologische resultaten
MLST en PGFE wezen op een polyclonale uitbraak. Er werden 5 verschillende MLS types gedetecteerd: MLST 19 (N=1), MLST 80 (N=19; waarvan 16 werden getypeerd met PFGE, die 7 verschillende pulsotypes aantoonde), MLST 117 (N=7; typering van 2 stammen met PFGE toonde verschillende pulsotypes), MLST 203 (N=1) en MLST 412 (N=12; typering van 8 isolaten toonde 3 verschillende pulsotypes). MLST 412 komt enkel voor in het UZ Brussel, de overige MLST-types zijn ook terug te vinden in andere zorginstellingen.
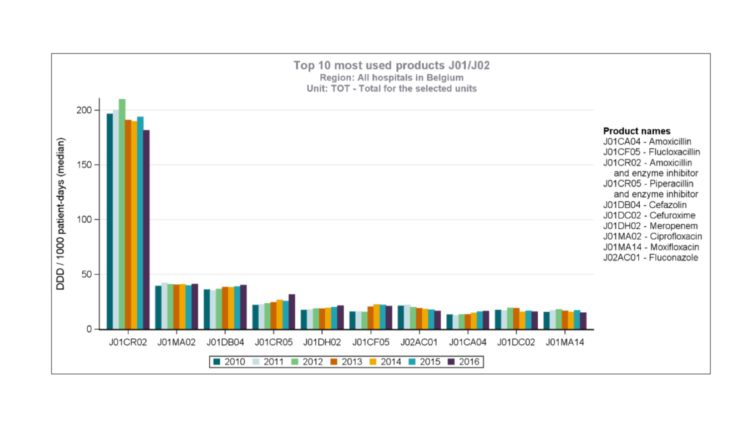
Figuur 1: Epidemisch verloop
Discussie/ besluit
Deze outbreak werd gedetecteerd door een verhoogde incidentie van VRE in klinische stalen. Mede door uitbreiding van het screeningsbeleid van juni 2016 tot juni 2017, werden er 37 patiënten met vanA-positive VRE gedetecteerd. In 89% van de gevallen werd VRE enkel gedetecteerd in screeningsstalen. Microbiologische analyses wezen op een polyclonale uitbraak. Recente studies hebben aangetoond dat – naast clonale verspreiding – het vanA gen zich ook kan verspreiden via horizontale transfer naar multipele populaties van Enterococcus faecium op mobiele elementen zoals transposons en plasmiden (8-9).
De verhoogde waakzaamheid, betere handhygiëne en onderhoud van gemeenschappelijk materiaal hebben geresulteerd in het beheersen van deze uitbraak. Stopzetten van de wekelijkse screening kan er toe leiden dat de huidige incidentie van VRE-dragerschap wordt onderschat.
De uitbraak en de ingevoerde maatregelen hadden een grote impact op de patiënten en de gezondheidswerkers: werklast, isolatie van patiënten, onderzoeken uit te stellen naar einde van de dag, kostprijs voor patiëntgebonden materiaal, tijdelijke opnamestop met meer patiënten die op een ‘verkeerde eenheid’ (= andere medisch discipline dan deze waarvoor ze opgenomen werden) terecht komen …
Gekende dragers worden verder opgevolgd en bijkomende voorzorgsmaatregelen worden toegepast bij hospitalisatie of dialysesessies. De bijkomende voorzorgsmaatregelen worden slechts gestopt na 3 negatieve screenings, telkens met een interval van 1 maand.
Niet alle aanbevelingen van het OST konden gerealiseerd worden. In de huidige setting van de eenheid hemodialyse is er geen apart toilet voor patiënten met bijkomende voorzorgsmaatregelen. Maar de vraag is of dit een meerwaarde is, aangezien het gaat om ambulante patiënten die ook de andere openbare toiletten in het ziekenhuis gebruiken en vervoerd worden in dezelfde taxi. Omdat het gros van deze patiënten ambulant aanwezig is in het ziekenhuis, werd vooral ingezet op patiënteneducatie en aangedrongen op een doorgedreven handhygiëne op de consultatie- en medisch-technische diensten.
Nefrologische patiënten behoren tot de risicogroep voor het verwerven van multiresistente micro-organismen, dus continue waakzaamheid is nodig om clusters te voorkomen.
Bibliografie
1.https://www.gezondheid.nl/medische-dossiers-aandoeningen/enterococcus-faecium, geraadpleegd op 01/06/2016
2. Enterococcal Infections, Vancomycin Resistant» (PDF). Infectious Disease Epidemiology Section Office of Public Health, Louisiana Dept of Health & Hospitals. 8 September 2008)
3. https://www.gezondheidsnet.nl/bacterien/hoe-gevaarlijk-is-de-vre-bacterie geraadpleegd op 15/07/2016
4. Agentschap zorg en gezondheid, Wetenschappelijk Instituut Volksgezondheid. Toename van het aantal uitbraken met vancomycine resistente enterokokken (VRE) in ziekenhuizen in België. VRE alert oktober 2015/21.10.2015.
5. Jansens H. et al, Succesful control of vancomycine-resistant enterococci outbreak in a hematology unit. Antimicrobial Resistance and Infection Control, 2015, 4, p.199
6. Fournier S. et al, Long-term control of vancomycin-resistant Enterococcus faecium at the scale of a large multihospital institution: a seven-year experience, Surveillance and outbreak reports, 26/07/2012
7. Katrine Gram Landerslev et al., Polyclonal spread of vanA Enterococcus faecium in Central Denmark Region, 2009–2013, investigated using PFGE, MLST and WGS, International Journal of Antimicrobial Agents (2016), doi: 10.1016/j.ijantimicag.2016.09.001
8. Pinholt Mette et al, Genomic analysis of 495 vancomycin-resistant Enterococcus faecium reveals broad dissemination of a vanA plasmid in more than 19 clones from Copenhagen, Denmark. Journal of antimicrobial chemotherapy September 7, 2016.
9. Bodrick Hayley et al, Whole-genome sequencing reveals transmission of vancomycin-resistant Enterococcus faecium in a healthcare network. Genome Medicine (2016)8:4.



 Inleiding
Inleiding