Risques de la transmission du cytomégalovirus par le lait maternel chez les prématurés
Introduction
Membre de la famille des Β–herpesviridae, le cytomégalovirus (CMV) est un virus ubiquitaire, responsable d’infection latente avec un potentiel de réactivation. Sa transmission se fait par les fluides biologiques dont la salive, les urines et les sécrétions génitales (1). Il est aussi retrouvé dans le sang, le lait maternel (LM) et tous les tissus mais surtout les tissus épithéliaux et ganglionnaires (2). Sa séroprévalence varie de 45 à 100% (3). Le CMV est considéré comme la première cause d’infection congénitale dans les pays développés (4, 5) et représente l’agent étiologique principal des retards mentaux et des atteintes auditives neurosensorielles non héréditaires (2).
Dans la population néonatale, il peut également être responsable d’infections postnatales transmises principalement par le lait maternel (LM) des mères séropositives. En effet, 66 à 96% des mères immunisées excrètent du CMV dans leur lait dans les trois premiers mois post-partum (6).
Chez le nouveau-né à terme, protégé par les anticorps de sa mère, l’infection postnatale est généralement asymptomatique et sans influence sur le devenir cognitif de l’enfant. Par leur immaturité immunitaire et par le transfert transplacentaire incomplet d’IgG maternels, les nouveau-nés prématurés de moins de 32 semaines d’âge gestationnel (SAG) ou de poids de naissance inférieure à 1500 g, sont à plus haut risque de transmission et d’infections symptomatiques susceptibles d’entrainer des conséquences à long terme (7-9). Le taux de transmission observé chez le prématuré varie de 5,6 à 58,6% en fonction du type de traitement du lait et du design de l’étude (6). Le risque d’infection symptomatique peut atteindre 34,5% et celui des manifestations cliniques sévères 14% (6).
Le risque de conséquences à long terme est moins bien connu et le peu d’études sur le sujet n’a pas encore permis d’établir un consensus sur la nécessité de mesures préventives.
Le lait de mère a une composition adaptée pour l’enfant né prématurément et possède des propriétés nutritionnelles et anti-infectieuses uniques. En outre, il contient des lipides aux propriétés antivirales et des IgA protecteurs. La vitamine A, la monolaurine et la lactorferrine ont montré une capacité d’inhibition de la croissance du CMV dans le LM in vitro (10). Actuellement chez les mères immunisées, les techniques d’inactivation virale dans le lait ne sont pas satisfaisantes car elles entraînent la perte de substances bioactives. Le bénéfice de l’administration de leur lait cru est donc à mettre en balance avec le risque d’infection à CMV chez les prématurés.
Cinétique de l’excrétion du CMV dans le LM
Il est possible de détecter la présence de CMV dans le LM par culture cellulaire (virolactie) et par PCR qualitative et quantitative (DNAlactie). L’échantillon doit d’abord être centrifugé pour isoler le lactosérum afin d’éliminer les problèmes de toxicité intrinsèque du lait non fractionné et permettre aux virus libres d’être détectés (11). On retrouve chez les mères immunisées allaitantes une DNAlactie dans 67 à 97% des cas et une virolactie dans 63 à 85% des cas (12). L’excrétion du CMV dans le LM est un processus autolimité. Il débute dans les premières semaines post-partum : la charge virale est maximale entre 4-8 semaines après la naissance et elle diminue drastiquement vers 12 semaines (11). Le virus est donc plus souvent retrouvé dans le LM mature que dans le colostrum. Néanmoins des cultures virales positives ont été rapportées des premiers jours jusqu’à 9 mois postpartum (13).
La DNAlactie et la virolactie sont des facteurs de risque de transmission du CMV. La DNAlactie dans le lactosérum est une condition nécessaire à la transmission contrairement à la virolactie (14, 15).
Ces techniques ont mis en avant peu de différence entre la dynamique d’excrétion des mères conductrices des non conductrices. Le moment de la transmission coïncide avec la virolactie et la DNAlactie maximale sans néanmoins de seuil établi (11). Cependant, le statut sérologique (IgM) et la PCR dans le sang sont généralement négatifs chez les mères conductrices. La réactivation durant l’allaitement serait donc un phénomène limité à la glande mammaire mais le mécanisme exact reste inconnu (11, 16, 17).
Conséquences cliniques à court terme
Chez le nouveau-né à terme, l’infection à CMV est généralement asymptomatique. Il est cependant reconnu comme agent responsable de pneumonies du nourrisson (9, 18).
En raison de leur immaturité immunitaire et du transfert transplacentaire incomplet d’IgG anti-CMV maternels, les prématurés sont à plus haut risque d’infections sévères, en particulier ceux nés avant 30 SAG ou avec un poids de naissance inférieur à 1000g (19, 20). L’infection symptomatique à CMV se manifeste essentiellement par des anomalies biologiques telles que thrombopénie, neutropénie, altération des tests hépatiques et/ou élévation de la C-reactive protein. Une cholestase, une dégradation clinique, des signes de « sepsis like syndrome », une pneumonie ou encore une entérocolite nécrosante peuvent également survenir (6, 12, 15, 21). De rares cas de syndrome d’activation macrophagique, d’ulcères périnéaux ou de perforations digestives ont été décrits (22-24). Néanmoins, le CMV provoquerait peu de symptômes chez le prématuré en bonne santé, mais serait plutôt un co-facteur aggravant la situation clinique lorsqu’il existe une atteinte pulmonaire, hépatique ou hématologique préexistante (25, 26). Dans une étude rétrospective portant sur 40 prématurés infectés, les auteurs n’observaient pas de morbidité surajoutée en cours d’hospitalisation. En effet, l’étude ne montre pas d’association avec la survenue d’hémorragie intraventriculaire, de leucomalacie périventriculaire, de bronchodysplasie, de rétinopathie du prématuré supérieur au stade 2 ou d’entérocolite nécrosante. De plus, la durée d’hospitalisation, d’intubation ou d’oxygénothérapie, et les données anthropométriques à la sortie n’étaient pas significativement différentes entre les cas et le groupe témoin (25).
Le CMV est considéré comme l’agent causal de ces infections lorsqu’il est détecté en association avec des signes cliniques compatibles. Un traitement par ganciclovir pour une durée de 2 à 6 semaines peut être donné dans des cas sévères mais le plus souvent l’infection se résout spontanément (6, 9).
Les facteurs de risque d’une infection symptomatique sont la réactivation maternelle précoce (< 1 semaine), l’infection postnatale précoce (< 2 mois), l’immaturité (< 32 SAG, < 1500g) (9, 15), ainsi qu’un terrain de morbidité surajoutée (25, 26). Aussi, plus la prématurité est grande et plus l’infection est précoce, plus le risque d’infection symptomatique est élevé (27).
Conséquences cliniques à long terme
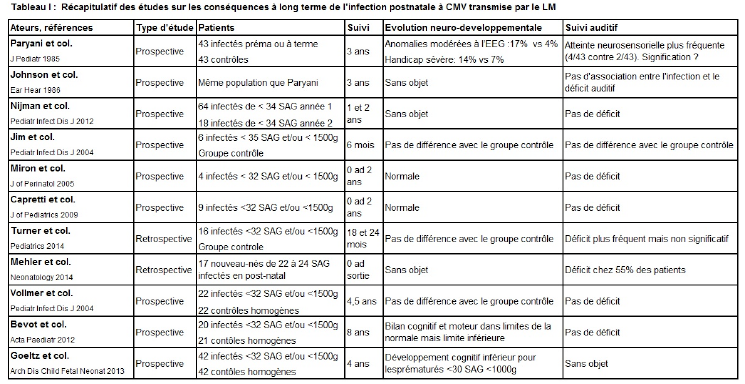
Les séquelles à long terme des infections postnatales précoces à CMV chez les prématurés sont peu étudiées. Ces dernières sont principalement constituées de troubles neurologiques, cognitifs et/ou auditifs. Les résultats de ces études sont résumés dans le Tableau I.
Paryani et col (28) ont évalué les séquelles à 3 ans chez les nouveau-nés infectés quel que soit leur âge gestationnel. L’incidence de séquelles neurologiques n’était pas augmentée chez les enfants nés avec un poids de naissance de plus de 2000g. Par contre, chez ceux nés avec un poids inférieur à 2000g, le risque de séquelle ou de handicap chez le prématuré en cas d’infection avant 2 mois de vie était augmenté. L’atteinte auditive neurosensorielle était deux fois plus fréquente dans le groupe infecté mais statistiquement non significative (28, 29). Dans la cohorte de prématurés de moins de 34 SAG de Nijman et col, aucun déficit auditif n’était observé à 2 ans mais, durant la deuxième année, seulement 8 prématurés de < 27 SAG et 2 symptomatiques ont été testés (30).
Dans l’étude de Jim et col, le suivi neuro-développemental et auditif à 6 mois était comparable entre 6 prématurés infectés et le groupe contrôle (31). De même, le suivi des 4 nouveau-nés infectés de l’étude de Miron et col. était normal à 24 mois (32). Les observations de Capretti et col. sont également rassurantes : les 9 prématurés infectés par le LM avaient un suivi neuro-développemental, visuel et auditif normal à 2 ans. Mais, il faut souligner que seulement 3 des enfants avaient présenté une infection symptomatique (26).
Par contre, Turner et col. ont montré une atteinte auditive plus fréquentes chez les enfants infectés. Leurs résultats sont toutefois non significatifs (33). Enfin, dans la cohorte d’extrêmes prématurés de Mehler et col, 55% des patients infectés avaient un test auditif anormal à la sortie du service. Une infection symptomatique était présente chez 65% des patients et 55% d’entre eux ont présenté un « sepsis like » (34).
Dans le centre de Tübingen, Vollmer et col. ont comparé l’évolution à 2 et 4,5 ans de 22 prématurés infectés avec un groupe contrôle homogène. Les données anthropométriques et le développement psychomoteur étaient comparables entre les groupes. Ils n’ont pas observé d’atteinte auditive (35). A 8 ans, ces mêmes paramètres restaient dans les normes mais les fonctions motrices et cognitives étaient légèrement inférieures chez les cas infectés en période postnatale précoce (36). Goeltz et col. ont repris la même cohorte en y incluant les patients recrutés durant 2 années supplémentaires. Leur but était de quantifier les capacités cognitives des sujets après 4 ans de suivi, grâce à une batterie de tests appelée le Kaufman Assessment Battery for Children (K-ABC). Les scores des 42 enfants infectés semblaient inférieurs par rapport au groupe contrôle, en particulier dans le sous-groupe des enfants nés avant 30 SAG ou de poids de naissance < 1000g (37).
Par ailleurs, des études se sont attardées aux imageries réalisées chez ces patients, à court et long terme. Dans une étude, un tiers des nouveau-nés infectés en postnatal par le CMV ont développé une vascularite lenticulostriée. Cette image échographique était 4x plus fréquente chez les prématurés infectés que chez les non infectés et ce en l’absence de symptômes. Les répercussions sur le développement neurologique sont inconnues et un suivi à long terme est conseillé. Tous les patients infectés de cette étude étaient asymptomatiques (38).
Récemment, une autre étude a analysé les IRM de 34 anciens prématurés (15 avec et 19 sans antécédent d’infection postnatale à CMV) en comparaison à celles de 37 contrôles sains. Les auteurs ont conclu que les conséquences neurobiologiques à long terme d’une infection postnatale à CMV sont détectables chez les enfants plus âgés et chez les adolescents, (auparavant) nés prématurément. Les images suggèrent une activité cérébrale compensatoire plus importante lors de l’exécution d’une tâche cognitive, chez les anciens prématurés infectés.
Leurs résultats sont concordants avec les études récentes et démontrent que l’effet préjudiciable de cette infection peut être observé cliniquement (Bevot et col., Goelz et col.). Ils fournissent la première preuve que de telles conséquences neurobiologiques peuvent être détectées même chez les enfants et les adolescents avec un QI normal (39).
Une autre équipe a analysé les IRM cérébrales d’enfants nés avant 32 SAG avec un antécédent d’infection postnatal à CMV. Les images étaient réalisées à 40 SAG. Ils ont observé des changements microstructuraux dans la substance blanche occipitale, mais, pas de différence à l’évaluation neuro-développementale à 16 mois d’âge corrigé (40).
Prévention
Un taux de transmission postnatale du CMV par le LM cru de 37% chez le prématuré de < 32 SAG et/ou < 1500g a été publié par Hamprecht en 2001 (15), mais ce taux varie fortement selon les études.
Plusieurs techniques d’inactivation virale dans le lait maternel peuvent être utilisées. La « holder pasteurisation » (62,5°C, 30 min) et la « short-term pasteurisation » (72°C, 5-10 sec) sont considérées comme les méthodes les plus efficaces pour éliminer le virus du LM (20, 41). Néanmoins ces techniques altèrent la qualité du lait.
La congélation à -20°C pendant 72h permet de préserver les propriétés immunologiques et nutritives du LM et diminue l’infectivité, mais n’inactive pas complètement le virus (26). Néanmoins, lors d’une charge virale faible, soit au début et à la fin de la période de réactivation, la congélation serait capable d’inactiver complètement le virus (41, 42). Dans la méta-analyse de Lanzieri et col, la taux d’infection chez les enfants nourris avec du lait congelé était de 13% contre 19% chez ceux nourris avec du lait cru. Le taux de « sepsis like syndrom » attribué au CMV était par contre comparable entre les deux groupes (27). D’autres études font état d’une sévérité moindre de l’infection acquise malgré le traitement du LM par congélation (8, 43).
Discussion
Les conséquences à court terme sont variées. De asymptomatique à sévère, l’infection postnatale à CMV est d’autant plus importante lorsqu’elle survient en présence d’une atteinte préexistante. Néanmoins, un terrain aggravant tel qu’une bronchodysplasie, est souvent inconnu, lorsque doit être prise la décision de pasteurisation ou non du lait des mères immunisées contre le CMV. Malgré tout, l’infection est le plus souvent spontanément résolutive, et à ce jour, aucun consensus thérapeutique n’est établi.
Les études sur le devenir à long terme de ces enfants alimentent le débat sur la nécessité de prévenir la transmission du CMV par le LM chez le prématuré. Peu nombreuses, elles portent sur des petits nombres de patients et deux seulement ont suivi les enfants jusqu’à l’âge scolaire. De plus, la majorité des données actuelles proviennent de la cohorte du centre de Tübingen (35-37, 39). Enfin, les groupes de patients sont souvent inhomogènes, ce qui rend difficile la distinction entre les séquelles liées à l’infection et celles liées à la grande prématurité.
Chez le plus jeune enfant, les études de suivi n’ont pas montré de séquelles neurologiques ou neurocognitives tandis que des effets sont détectés à l’âge scolaire. Le devenir à 2,5 et 4 ans publié par Völlmer ne montrait pas de différence entre les patients infectés et leur groupe contrôle homogène (35). Dans le suivi à l’âge scolaire, les fonctions cognitives étaient néanmoins inférieures au groupe contrôle en particulier chez les prématurés nés avant 30 SAG (37). Les résultats de l’étude de Dorn et col. (39), dans laquelle des IRM ont été réalisées sur les enfants de cette même cohorte, apportent des arguments supplémentaires en faveur d’effets préjudiciables à long terme de l’infection postnatale à CMV.
La valeur prédictive des signes échographiques fréquemment observés lors d’une infection postnatale à CMV même asymptomatiques n’est pas connue à ce jour. Les résultats de l’étude de Nijman (38) (suivi à 5 ans) sont dès lors fortement attendus.
Les recommandations concernant l’alimentation des prématurés nés de mères immunisées contre CMV diffèrent selon les pays. L’AAP ne statue pas et recommande le LM cru de sa propre mère pour l’alimentation du prématuré avec toutefois la recommandation d’être prudent pour les prématurés de < 32 SAG ou < 1500g nés de mères immunisées pour le CMV (44).
En Suède, pour les nouveau-nés de < 32 SAG, le lait est congelé. Le Comité de nutrition de l’Austrian Society of Pediatric and Adolescent Medecine recommande de déterminer le statut de toutes les mères et en cas d’IgG anti-CMV positives de réaliser la « holder pasteurisation » ou la congélation jusqu’à 35 SAG, colostrum y compris. (6, 9, 45) En Allemagne, le statu CMV est déterminé pour toutes mères ayant donné naissance à un prématuré < 33 SAG et/ou < 1500g. En cas de sérologie positive, une information est donnée aux parents et le lait peut être administré cru ou après congélation avec leur accord (45, 46). En France, la pasteurisation est systématique chez les prématurés < 32 SAG et/ou < 1500g nés de mères immunisées (6, 45). Dans notre centre, en cas de sérologie maternelle positive, le LM est donné cru les 5 premiers jours (colostrum) puis il est pasteurisé pour les nouveau-nés de moins de 30 SAG et ce jusqu’à 34 SAG.
Conclusion
Alors que la majorité des études sur les conséquences à court et à long terme sont rassurantes, celles concernant le suivi à l’âge scolaire et en particulier les données récentes du suivi radiologique de l’infection postnatale à CMV sont interpellantes. Des travaux ultérieurs incluant un plus grand nombre de patients, s’attachant plus particulièrement aux prématurés < 30 semaines et/ou < 1000g, et, prolongeant le suivi clinique jusqu’à l’âge scolaire, seraient nécessaires afin de valider leurs résultats.
Il est également important de mieux comprendre les mécanismes de réactivation virale et, de mieux cibler la population et la période à risque, afin d’éviter un traitement inutile du lait. En effet, une conduite individualisée basée sur les facteurs de risque et l’état de santé du nouveau-né serait idéale, afin de minimiser le risque infectieux tout en conservant les bénéfices du LM cru.
Néanmoins, en attendant la publication de nouvelles données, le principe de précaution est de mise. En cas de décision, après information parentale, de non pasteurisation du lait maternel à risque, un consentement préalable est requis.
Bibliographie
- Munro SC, Hall B, Whybin LR, Leader L, Robertson P, Maine GT, et al. Diagnosis of and screening for cytomegalovirus infection in pregnant women. Journal of clinical microbiology. 2005;43(9):4713-8.
- Nassetta L, Kimberlin D, Whitley R. Treatment of congenital cytomegalovirus infection: implications for future therapeutic strategies. The Journal of antimicrobial chemotherapy. 2009;63(5):862-7.
- Cannon MJ, Schmid DS, Hyde TB. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection. Reviews in medical virology. 2010;20(4):202-13.
- Bate SL, Dollard SC, Cannon MJ. Cytomegalovirus seroprevalence in the United States: the national health and nutrition examination surveys, 1988-2004. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2010;50(11):1439-47.
- Dollard SC, Grosse SD, Ross DS. New estimates of the prevalence of neurological and sensory sequelae and mortality associated with congenital cytomegalovirus infection. Reviews in medical virology. 2007;17(5):355-63.
- Kurath S, Halwachs-Baumann G, Muller W, Resch B. Transmission of cytomegalovirus via breast milk to the prematurely born infant: a systematic review. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 2010;16(8):1172-8.
- Yeager AS, Palumbo PE, Malachowski N, Ariagno RL, Stevenson DK. Sequelae of maternally derived cytomegalovirus infections in premature infants. The Journal of pediatrics. 1983;102(6):918-22.
- Bryant P, Morley C, Garland S, Curtis N. Cytomegalovirus transmission from breast milk in premature babies: does it matter? Archives of disease in childhood Fetal and neonatal edition. 2002;87(2):F75-7.
- Lombardi G, Garofoli F, Manzoni P, Stronati M. Breast milk-acquired cytomegalovirus infection in very low birth weight infants. The journal of maternal-fetal & neonatal medicine : the official journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstet. 2012;25 Suppl 3:57-62.
- Clarke NM, May JT. Effect of antimicrobial factors in human milk on rhinoviruses and milk-borne cytomegalovirus in vitro. Journal of medical microbiology. 2000;49(8):719-23.
- Hamprecht K, Maschmann J, Jahn G, Poets CF, Goelz R. Cytomegalovirus transmission to preterm infants during lactation. Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology. 2008;41(3):198-205.
- Maschmann J, Hamprecht K, Dietz K, Jahn G, Speer CP. Cytomegalovirus infection of extremely low-birth weight infants via breast milk. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2001;33(12):1998-2003.
- Vochem M, Hamprecht K, Jahn G, Speer CP. Transmission of cytomegalovirus to preterm infants through breast milk. The Pediatric infectious disease journal. 1998;17(1):53-8.
- van der Strate BW, Harmsen MC, Schafer P, Swart PJ, The TH, Jahn G, et al. Viral load in breast milk correlates with transmission of human cytomegalovirus to preterm neonates, but lactoferrin concentrations do not. Clinical and diagnostic laboratory immunology. 2001;8(4):818-21.
- Hamprecht K, Maschmann J, Vochem M, Dietz K, Speer CP, Jahn G. Epidemiology of transmission of cytomegalovirus from mother to preterm infant by breastfeeding. Lancet. 2001;357(9255):513-8.
- Numazaki K, Chiba S, Asanuma H. Transmission of cytomegalovirus. Lancet. 2001;357(9270):1799-800.
- Hamprecht K, Witzel S, Maschmann J, Dietz K, Baumeister A, Mikeler E, et al. Rapid detection and quantification of cell free cytomegalovirus by a high-speed centrifugation-based microculture assay: comparison to longitudinally analyzed viral DNA load and pp67 late transcript during lactation. Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology. 2003;28(3):303-16.
- Stagno S, Brasfield DM, Brown MB, Cassell GH, Pifer LL, Whitley RJ, et al. Infant pneumonitis associated with cytomegalovirus, Chlamydia, Pneumocystis, and Ureaplasma: a prospective study. Pediatrics. 1981;68(3):322-9.
- Hamele M, Flanagan R, Loomis CA, Stevens T, Fairchok MP. Severe morbidity and mortality with breast milk associated cytomegalovirus infection. The Pediatric infectious disease journal. 2010;29(1):84-6.
- Hamprecht K, Goelz R, Maschmann J. Breast milk and cytomegalovirus infection in preterm infants. Early human development. 2005;81(12):989-96.
- Fischer C, Meylan P, Bickle Graz M, Gudinchet F, Vaudaux B, Berger C, et al. Severe postnatally acquired cytomegalovirus infection presenting with colitis, pneumonitis and sepsis-like syndrome in an extremely low birthweight infant. Neonatology. 2010;97(4):339-45.
- Knorr B, Kessler U, Poschl J, Fickenscher H, Linderkamp O. A haemophagocytic lymphohistiocytosis (HLH)-like picture following breastmilk transmitted cytomegalovirus infection in a preterm infant. Scandinavian journal of infectious diseases. 2007;39(2):173-6.
- Hancox JG, Shetty AK, Sangueza OP, Yosipovitch G. Perineal ulcers in an infant: an unusual presentation of postnatal cytomegalovirus infection. Journal of the American Academy of Dermatology. 2006;54(3):536-9.
- Cheong JL, Cowan FM, Modi N. Gastrointestinal manifestations of postnatal cytomegalovirus infection in infants admitted to a neonatal intensive care unit over a five year period. Archives of disease in childhood Fetal and neonatal edition. 2004;89(4):F367-9.
- Neuberger P, Hamprecht K, Vochem M, Maschmann J, Speer CP, Jahn G, et al. Case-control study of symptoms and neonatal outcome of human milk-transmitted cytomegalovirus infection in premature infants. The Journal of pediatrics. 2006;148(3):326-31.
- Capretti MG, Lanari M, Lazzarotto T, Gabrielli L, Pignatelli S, Corvaglia L, et al. Very low birth weight infants born to cytomegalovirus-seropositive mothers fed with their mother’s milk: a prospective study. The Journal of pediatrics. 2009;154(6):842-8.
- Lanzieri TM, Dollard SC, Josephson CD, Schmid DS, Bialek SR. Breast milk-acquired cytomegalovirus infection and disease in VLBW and premature infants. Pediatrics. 2013;131(6):e1937-45.
- Paryani SG, Yeager AS, Hosford-Dunn H, Johnson SJ, Malachowski N, Ariagno RL, et al. Sequelae of acquired cytomegalovirus infection in premature and sick term infants. The Journal of pediatrics. 1985;107(3):451-6.
- Johnson SJ, Hosford-Dunn H, Paryani S, Yeager A, Malachowski N. Prevalence of sensorineural hearing loss in premature and sick term infants with perinatally acquired cytomegalovirus infection. Ear and hearing. 1986;7(5):325-7.
- Nijman J, van Zanten BG, de Waard AK, Koopman-Esseboom C, de Vries LS, Verboon-Maciolek MA. Hearing in preterm infants with postnatally acquired cytomegalovirus infection. The Pediatric infectious disease journal. 2012;31(10):1082-4.
- Jim WT, Shu CH, Chiu NC, Kao HA, Hung HY, Chang JH, et al. Transmission of cytomegalovirus from mothers to preterm infants by breast milk. The Pediatric infectious disease journal. 2004;23(9):848-51.
- Miron D, Brosilow S, Felszer K, Reich D, Halle D, Wachtel D, et al. Incidence and clinical manifestations of breast milk-acquired Cytomegalovirus infection in low birth weight infants. Journal of perinatology : official journal of the California Perinatal Association. 2005;25(5):299-303.
- Turner KM, Lee HC, Boppana SB, Carlo WA, Randolph DA. Incidence and impact of CMV infection in very low birth weight infants. Pediatrics. 2014;133(3):e609-15.
- Mehler K, Oberthuer A, Lang-Roth R, Kribs A. High rate of symptomatic cytomegalovirus infection in extremely low gestational age preterm infants of 22-24 weeks’ gestation after transmission via breast milk. Neonatology. 2014;105(1):27-32.
- Vollmer B, Seibold-Weiger K, Schmitz-Salue C, Hamprecht K, Goelz R, Krageloh-Mann I, et al. Postnatally acquired cytomegalovirus infection via breast milk: effects on hearing and development in preterm infants. The Pediatric infectious disease journal. 2004;23(4):322-7.
- Bevot A, Hamprecht K, Krageloh-Mann I, Brosch S, Goelz R, Vollmer B. Long-term outcome in preterm children with human cytomegalovirus infection transmitted via breast milk. Acta paediatrica. 2012;101(4):e167-72.
- Goelz R, Meisner C, Bevot A, Hamprecht K, Kraegeloh-Mann I, Poets CF. Long-term cognitive and neurological outcome of preterm infants with postnatally acquired CMV infection through breast milk. Archives of disease in childhood Fetal and neonatal edition. 2013;98(5):F430-3.
- Nijman J, de Vries LS, Koopman-Esseboom C, Uiterwaal CS, van Loon AM, Verboon-Maciolek MA. Postnatally acquired cytomegalovirus infection in preterm infants: a prospective study on risk factors and cranial ultrasound findings. Archives of disease in childhood Fetal and neonatal edition. 2012;97(4):F259-63.
- Dorn M, Lidzba K, Bevot A, Goelz R, Hauser TK, Wilke M. Long-term neurobiological consequences of early postnatal hCMV-infection in former preterms: a functional MRI study. Human brain mapping. 2014;35(6):2594-606.
- Nijman J, Gunkel J, de Vries LS, van Kooij BJ, van Haastert IC, Benders MJ, et al. Reduced occipital fractional anisotropy on cerebral diffusion tensor imaging in preterm infants with postnatally acquired cytomegalovirus infection. Neonatology. 2013;104(2):143-50.
- Hamprecht K, Maschmann J, Muller D, Dietz K, Besenthal I, Goelz R, et al. Cytomegalovirus (CMV) inactivation in breast milk: reassessment of pasteurization and freeze-thawing. Pediatric research. 2004;56(4):529-35.
- Maschmann J, Hamprecht K, Weissbrich B, Dietz K, Jahn G, Speer CP. Freeze-thawing of breast milk does not prevent cytomegalovirus transmission to a preterm infant. Archives of disease in childhood Fetal and neonatal edition. 2006;91(4):F288-90.
- Sharland M, Khare M, Bedford-Russell A. Prevention of postnatal cytomegalovirus infection in preterm infants. Archives of disease in childhood Fetal and neonatal edition. 2002;86(2):F140.
- Gartner LM, Morton J, Lawrence RA, Naylor AJ, O’Hare D, Schanler RJ, et al. Breastfeeding and the use of human milk. Pediatrics. 2005;115(2):496-506.
- Buxmann H, Falk M, Goelz R, Hamprecht K, Poets CF, Schloesser RL. Feeding of very low birth weight infants born to HCMV-seropositive mothers in Germany, Austria and Switzerland. Acta paediatrica. 2010;99(12):1819-23.
- Goelz R, Hamprecht K, Vochem M, Maschmann J, Speer CP, Jahn G, et al. [Breast feeding of very preterm infants of HCMV-seropositive mothers]. Zeitschrift fur Geburtshilfe und Neonatologie. 2004;208(3):118-21.
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)



