Gestion d’une épidémie à parainfluenza en néonatologie intensive
Introduction
Faisant partie de la famille des Paramyxoviridae, le virus parainfluenza (PIV) constitué de 4 sérotypes différents, est un virus enveloppé à ARN simple brin [1-4]. Responsable d’infections respiratoires hautes et basses, le PIV constitue après le virus respiratoire syncytial, la 2ème cause de pneumonie et de bronchiolite chez le jeune enfant [2]. Le PIV est un agent nosocomial majeur et de nombreuses épidémies en unités de néonatologie intensive et non intensive ont déjà été décrites [3-6]. Distinctement ce sont les prématurés d’un âge avancé qui sont le plus touchés par le virus en opposition aux prématurés nouveaux-nés qui bénéficient encore d’une immunité passive conférée par les anticorps PIV neutralisants de la maman [4].
Dans ce travail, nous rapportons une épidémie nosocomiale à PIV dans l’unité de néonatologie intensive des Cliniques Universitaires Saint-Luc en juillet 2013. Nous soulignons l’intérêt majeur de la détection rapide de l’épidémie permettant la mise en place immédiate de mesures additionnelles de prévention de la transmission et l’importance de la collaboration soutenue entre l’équipe opérationnelle d’hygiène hospitalière (EOHH) et l’équipe de soin de l’unité concernée. Finalement nous discuterons diverses recommandations de gestion d’une épidémie à PIV où sont confrontées les règles théoriques et leur mise en pratique.
Description de l’épidémie
L’épidémie à PIV a eu lieu dans le service de néonatologie (NN) des Cliniques Universitaires Saint-Luc, hôpital universitaire de 964 lits. Le service est constitué d’une unité intensive (22 lits agréés) répartie sur 3 locaux et 1 chambre d’isolement ainsi que d’une unité non intensive (5 lits) avec 1 local unique situé à un étage différent. Une équipe soignante multidisciplinaire englobant des médecins, des infirmiers, des aides-soignants, un pédopsychiatre, un psychologue et des kinésithérapeutes prend en charge les prématurés aussi bien de l’unité intensive que non intensive.
Le 1er juillet 2013, un membre de l’équipe soignante de NN informe l’EOHH de la détection du PIV dans l’aspiration naso-pharyngée de 2 patients prématurés (patients A et D) hospitalisés dans le service. La procédure locale « Gestion d’une épidémie » est d’emblée mise en application.
1. Constitution d’une équipe de gestion
Une équipe de gestion de l’épidémie incluant un infirmier hygiéniste, un médecin hygiéniste, une infirmière cadre du service affecté, un médecin superviseur du service et un infectiologue pédiatrique est constituée. Ces personnes étaient en première ligne pour la prise de décisions et la bonne gestion de l’épidémie.
2. Définition et comptage des cas
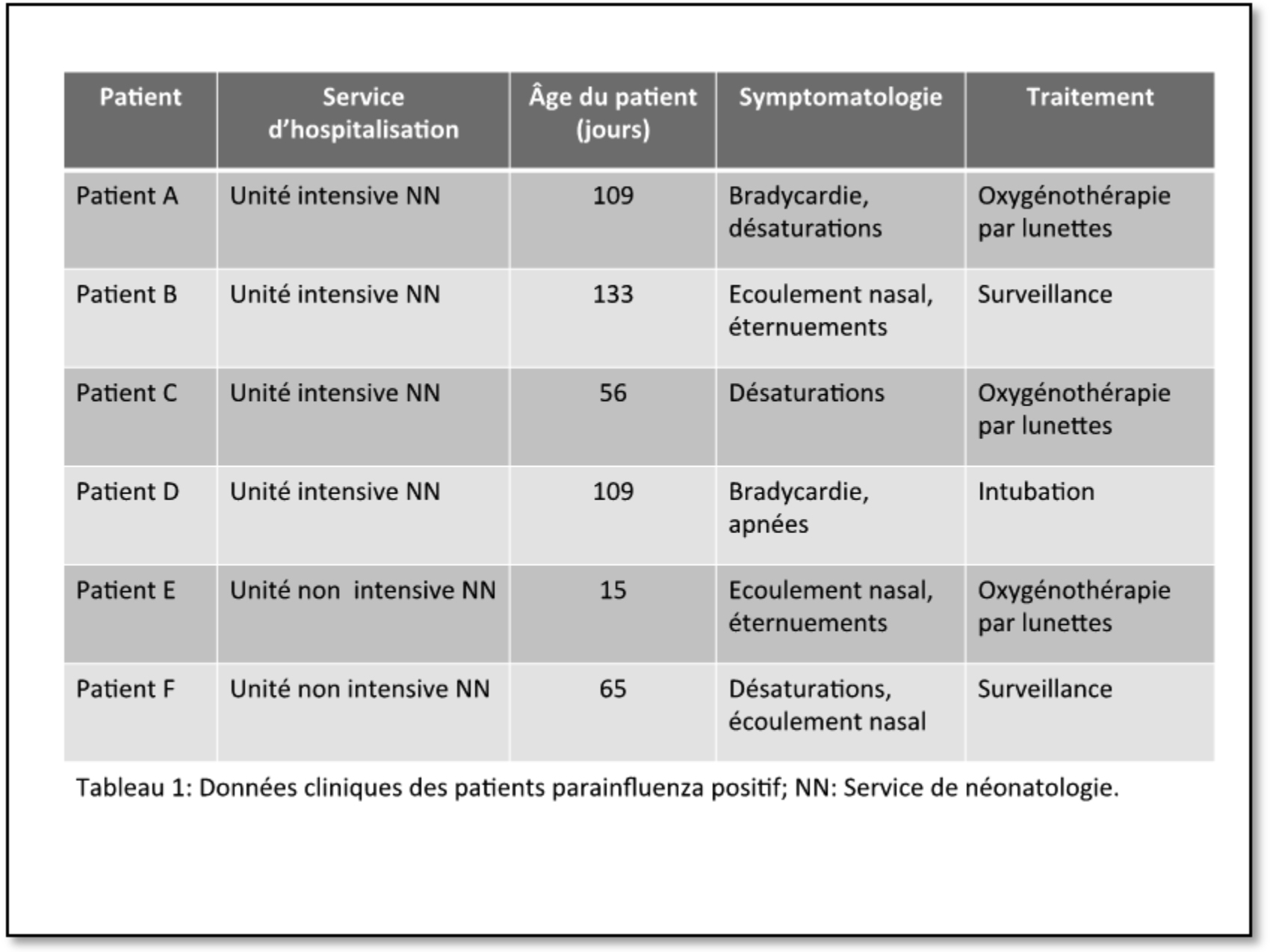
L’évaluation clinique des patients de l’unité intensive de NN au jour 1 de l’épidémie soit le 1er juillet 2013, a permis d’identifier 4 patients symptomatiques (patients A, B, C et D) et 18 patients non symptomatiques. Parallèlement dans l’unité non intensive de NN, 2 enfants symptomatiques (patients E et F) et 3 enfants non symptomatiques ont été identifiés. La recherche par immunofluorescence (Light Diagnostics™Para-influenza DFA Kit, Merck Millipore, Massachusetts, USA) du PIV sur aspiration naso-pharyngée chez l’ensemble des patients de NN a permis d’identifier 6 patients PIV positif (patient A, B, C, D, E et F) correspondant à l’ensemble des patients symptomatiques. Les données cliniques des patients PIV positif sont reprises dans le tableau 1.
Les patients PIV positif étaient hospitalisés dans 2 locaux différents de l’unité intensive de NN ainsi que dans l’unité non intensive. La figure 1 montre la configuration du service et la localisation des patients PIV positif au 1er juillet 2013.
- Mise en place des précautions additionnelles et cohortage
Tous les patients symptomatiques ont bénéficié de la mise en place de précautions additionnelles de type contact et de type gouttelette. Chaque soin apporté à un de ces patients exigeait le port de gants, d’une blouse et d’un masque chirurgical par le personnel.
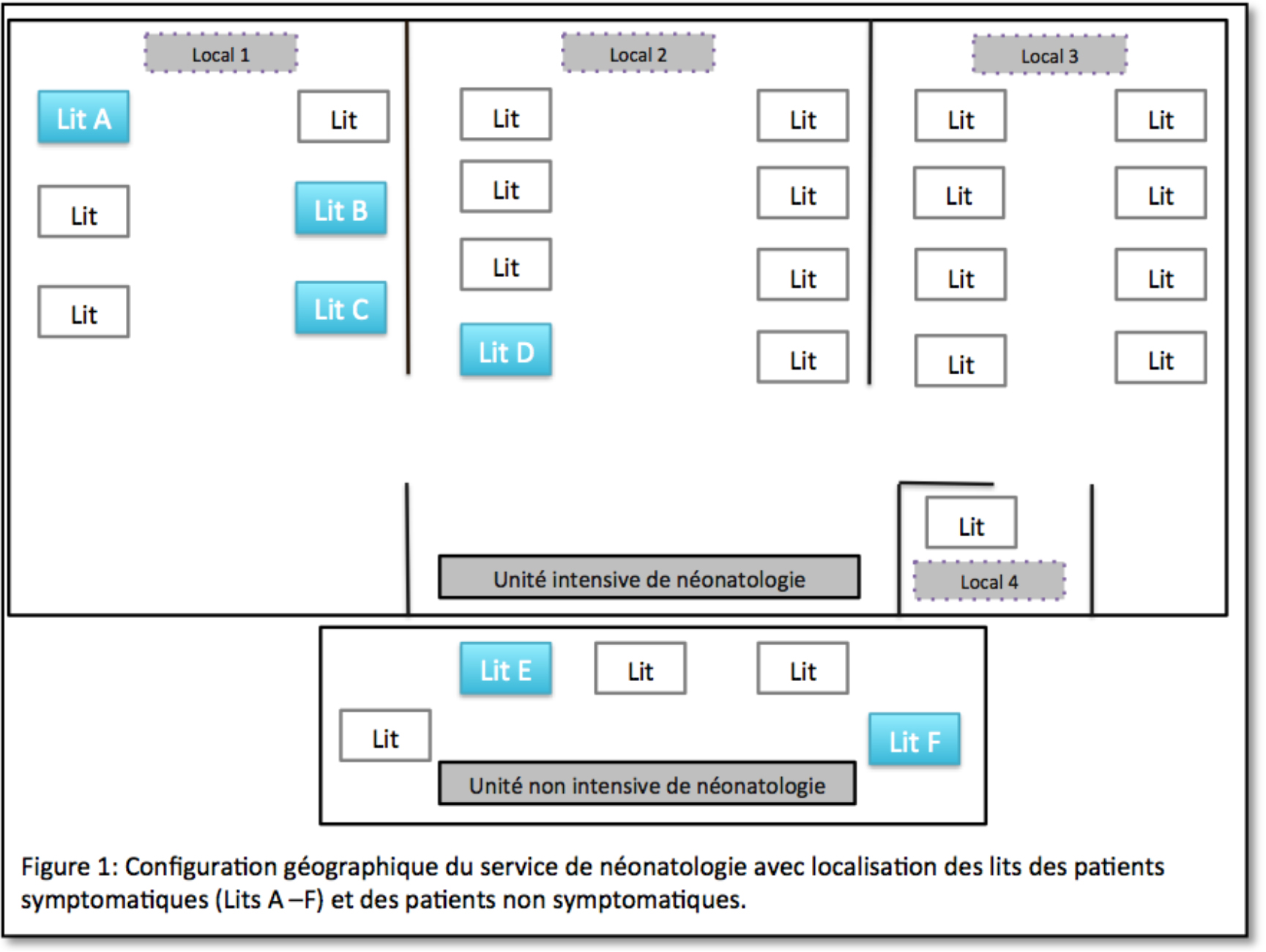
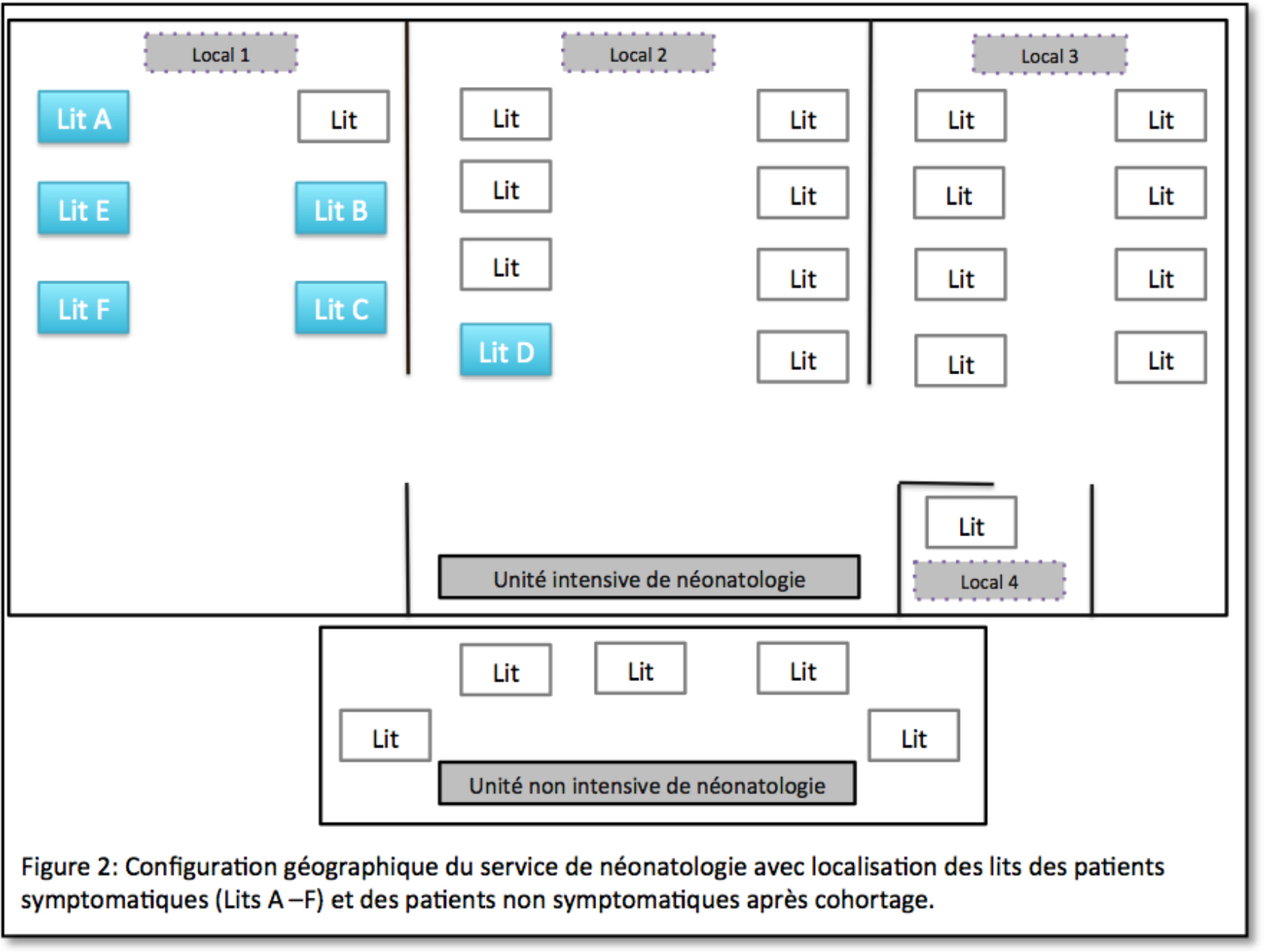
Un cohortage des patients symptomatiques a conduit à rassembler l’ensemble des patients dans le local 1 de l’unité intensive de NN hormis le patient D fortement fragilisé par d’autres comorbidités et exigeant une prise en charge et une surveillance très soutenue proche du bureau du personnel soignant. La figure 2 montre le cohortage réalisé.
Le personnel soignant (principalement l’équipe des infirmiers et des aides-soignants) a également été cohorté avec une équipe définie dédiée aux patients PIV positif et une équipe ne prenant en charge que les patients non PIV. Ce cohortage a nécessité l’augmentation temporaire des effectifs en NN.
- Identification de la source de l’épidémie
Une enquête a été effectuée quant à la présence d’une symptomatologie respiratoire récente auprès des membres du personnel soignant ainsi qu’auprès des parents et de la fratrie des enfants hospitalisés. Deux membres du personnel de nuit ayant travaillé simultanément dans l’unité intensive et non intensive de NN le 28 et le 29 juin, avaient présenté une symptomatologie de rhinorrhées, toux et éternuements. Aucun membre des familles des patients ne présentait de plaintes respiratoires.
- Surveillance et évolution
Sur base de la symptomatologie, aucun nouveau cas de PIV n’a été détecté au delà des 6 premiers cas identifiés le 1er juillet. Aucune analyse de laboratoire pour la détection du PIV n’a été réalisée ultérieurement. Les précautions additionnelles ont été levées à l’arrêt de la symptomatologie soit après un maximum de 18 jours pour le dernier enfant (patient D). Aucun décès n’a été observé.
Discussion
La détection rapide d’une épidémie joue un rôle majeur dans sa gestion et son contrôle par la mise en route immédiate de mesures de prévention. Dans notre situation, c’est l’équipe soignante du service lui-même qui est à l’origine de la suspicion d’épidémie à PIV soulignant l’intérêt d’une collaboration continue entre les équipes de soins sur le terrain et l’EOHH. La constitution et la formation de référents en hygiène dans les unités de soins peuvent y contribuer en jouant un rôle de « relais » avec l’EOHH.
Dans cette épidémie, une concordance complète a été observée entre les patients symptomatiques et les patients ayant une aspiration naso-pharyngée détectant le PIV. Il faut néanmoins aborder les autres cas de figure. La sensibilité des tests de laboratoire détectant le PIV par immunofluorescence n’est pas optimale et des faux négatifs ont déjà été décrits. Dès lors la non-détection du virus par le laboratoire ne peut pas exclure sa présence dans les sécrétions respiratoires d’un enfant symptomatique. C’est véritablement sur la symptomatologie qu’il y a lieu de se baser dans la gestion d’une telle épidémie par virus respiratoire. La présence d’une symptomatologie, qui peut durer jusqu’à 3-4 semaines, doit générer la mise en place de précautions additionnelles. Les examens de détection du virus respiratoire en laboratoire sont une aide au diagnostic clinique mais ne peuvent en aucun cas être à l’origine des choix de mise en place de mesures de prévention de la transmission. Un dépistage du PIV dans les aspirations naso-pharyngées de l’ensemble des enfants de NN n’est donc pas recommandé.[7].
Une infection à PIV est rarement asymptomatique .Généralement on retrouve une symptomatologie de type respiratoire avec la présence de toux, d’éternuements et d’écoulement nasal[1-2]. Des signes généraux sont également observés tels que bradycardie, tachypnée, apnées et désaturations. Ce tableau clinique plus général et aspécifique rend parfois le diagnostic d’infection à PIV difficile.
La prise en charge thérapeutique d’une infection à PIV est très limitée et consiste plutôt en un traitement supportif respiratoire allant de l’oxygénothérapie par lunettes à l’intubation. L’outcome clinique est rarement fatal. Une hyperréactivité bronchique à long terme a été décrite [4]. Dans notre situation, l’ensemble des patients a rapidement évolué vers une amélioration clinique sans aucune séquelle observée à moyen terme.
Le PIV se transmet par l’intermédiaire de grosses gouttelettes et secondairement par les mains du personnel [8-9]. La survie du virus sur des surfaces inertes est très limitée. Dans une unité de néonatologie où la transmission directe entre patients est impossible, c’est généralement le personnel soignant qui est à l’origine du transfert du virus entre 2 patients. L’hygiène des mains et l’écartement du personnel soignant malade sont des éléments clés pour freiner l’évolution vers une épidémie[1]. Un enfant symptomatique doit être isolé et bénéficier de précautions additionnelles de type contact et de type gouttelettes. L’évolution d’une épidémie doit mener à la mise en place rapide de mesures additionnelles tels que le cohortage des patients symptomatiques et le cohortage du personnel. Ben-Shimol et al. suggère de diviser l’unité épidémique concernée en 3 parties avec 3 équipes de soignants afin de prendre en charge respectivement un groupe « patients infectés », un groupe « patients contacts » et un groupe «autres patients : nouvelles entrées»[3]. Même si optimale, cette gestion est rarement applicable sur le terrain.
La levée des précautions additionnelles reste un élément complexe à gérer dans les unités de soins. L’excrétion du virus peut durer jusqu’à 3 semaines impliquant le maintien des mesures tout au long de cette durée [3]. Cette période est rarement respectée car contraignante pour le personnel soignant qui choisit généralement de lever les précautions additionnelles d’un patient à la fin de la symptomatologie.
L’évolution des épidémies décrites dans la littérature est très variable. La détection rapide de l’épidémie et sa gestion immédiate permettent de freiner sa transmission. Son contrôle peut être statué 3 jours après la découverte du dernier cas clinique étant donné que la durée médiane d’incubation est de 2,6 jours [10]. Des unités surchargées, la promiscuité des incubateurs et du personnel manquant ou mal formé sont des éléments décrits comme à l’origine du non contrôle d’une épidémie à PIV[6].
Conclusions
Dans notre situation, la détection immédiate des patients infectés à PIV a permis une gestion efficace de l’épidémie par la mise en place de mesures de prévention de la transmission et le cohortage du patient et du personnel. La coordination multi-disciplinaire joue un rôle majeur dans la prise en charge de l’épidémie.
Take-hospital message
- PIV est un agent nosocomial connu à l’origine d’épidémies dans les unités de néonatologie.
- La symptomatologie est l’élément clé dans la mise en place des précautions additionnelles.
- Les mesures additionnelles pour le PIV sont l’isolement, les précautions additionnelles contact et gouttelettes.
- L’isolement est levé à l’arrêt de l’excrétion du virus soit 3-4 semaines après le début de la symptomatologie.
- Une épidémie doit mener au cohortage des patients et du personnel.
- Le personnel malade doit être écarté afin d’éviter la transmission d’agents infectieux.
Bibliographie
- Mayhall GC. Hospital epidemiology and infection control. Baltimore : Williams & Wilkins, 1996.
- Référentiel en virologie médicale, 2ième édition. Paris : Vivactis Plus éditions, 2007.
- Ben-Shimol S, Landau D, Zilber S, Greenberg D. Parainfluenza virus type 3 outbreak in a neonatal nursery. Clinical Pediatrics 2013; 52:866-70.
- Teo WY, Rajadurai VS, Sriram B. Morbidity of parainfluenza 3 outbreak in preterm infants in a neonatal unit. Ann Acad Med Singapore 2010; 39:837-42.
- Meissner H, Murray SA, Kiernan MA, Snydman DR, McIntosh K. A simultaneous outbreak of respiratory syncytial virus and parainfluenza virus type 3 in a newborn nursery. J Pediatr1984; 104:680-684.
- Singh-Naz N, Willy M, Riggs N. Outbreak of parainfluenza virus type 3 in a neonatal nursery. Pediatr Infect Dis J 1990; 9:31-33.
- Freymuth F, Vabret A, Galateau-Salle F, et al. Detection of respiratory syncitial virus, parainfluenza virus 3, adenovirus and rhinovirus sequences in respiratory tract of infants by polymerase chain reaction and hybridization. Clin DiagnVirol 1997; 8:31-40.
- Ansari SA, Springthorpe S, Sattar SA, Rivard S, Rahman M. Potential role of hands in the spread of respiratory viral infections: studies with human parainfluenza virus 3 and rhinovirus. J Clin Microbiol 1991; 29:2115-2119.
- Brady MT, Evans J, Cuartas J. Survival and disinfection of parainfluenza viruses on environmental surfaces. Am J Infect Control 1990; 18:18-23.
- Lessler J, Reich NG, Brookmeyer R, Perl TM, Nelson KE, Cummings DAT. Incubation periods of acute respiratory viral infections : a systematic review. Lancet Inf Dis 2009; 9:291-300.
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)