Robot UVC : une nécessité ? Etat des lieux en 2022
Contexte
Depuis la pandémie du SRAS-CoV2, l’utilisation de systèmes industriels « no touch automated room desinfection » (NTD) est vivement encouragée. Dans notre hôpital, tant le service de nettoyage que le bureau innovation s’intéressent à l’utilisation d’un robot UVC (désinfection UVC à l’aide d’un robot autonome). Dans le cadre d’un programme de l’UE visant à soutenir les États membres dans la lutte contre le coronavirus, la Commission européenne a fait don en 2021 de 200 robots autonomes UVC (robots UVD – Blue Ocean Robotics) aux hôpitaux des États membres de l’UE, dont 10 à des hôpitaux du Benelux1. Un geste qui renforce la perception interne selon laquelle un robot équipé d’une technologie UV devrait être introduit dans un hôpital innovant.
Figure 1 robot de nettoyage adapté à l’entretien du sol

La robotisation est de plus en plus utilisée dans le secteur du nettoyage. Des robots de nettoyage sont proposés pour nettoyer les sols de manière autonome sur la base d’une navigation cartographiée (Figure 1). Cette nouvelle technologie (semi-)automatique peut clairement aider le secteur des soins à rendre le travail de nettoyage plus efficace et plus ciblé. En principe, on ne peut que se féliciter de l’introduction de cette technique innovante, compte tenu de l’importance de l’environnement hospitalier en tant que réservoir et vecteur potentiel de contamination croisée. Le nettoyage et la désinfection manuelle sont laborieux et l’entretien manuel terminal est souvent suboptimal2,3. Une méthode automatisée de désinfection terminale sans contact élimine les approximations et les variations inhérentes au travail humain, garantissant ainsi un niveau optimal de qualité ainsi que la possibilité de surveillance.
Actuellement, il existe 3 systèmes NTD sur le marché : nébulisation au peroxyde d’hydrogène (brouillard humide), peroxyde d’hydrogène en aérosol (brouillard sec) et utilisation d’une source lumineuse UVC. Tous ces systèmes NTD supposent un nettoyage manuel préalable correct des locaux/salles à traiter 4-6. Le choix d’un système donné tiendra compte de l’efficacité antimicrobienne éprouvée, de la durée de traitement, des coûts de l’appareil, des cycles de désinfection et de l’entretien, des éventuelles limitations dues au volume ou à la conception de l’espace, des exigences logistiques, des capacités de validation des processus (via des systèmes de suivi et/ou des bandelettes de test spécifiques), de la sécurité du personnel et des patients. Pour tous les systèmes de NTD, il est impératif d’éviter l’exposition des personnes pendant le processus de désinfection.
L’AZ Groeninge a, par le passé, suite à une épidémie d’Acinetobacter baumannii multirésistantes productrices de carbapénèmase de type OXA-24, opté pour la nébulisation au peroxyde d’hydrogène avec un diffuseur de type ‘Aerocept compact 250’. Cet appareil nébulise une solution de peroxyde d’hydrogène et d’acide peracétique (Aseptanios AD). Le choix avait à l’époque été dicté par l’activité antimicrobienne éprouvée conformément à norme française NF T 72-281, le caractère biodégradable des ingrédients inclus dans la solution de nébulisation avec absence de molécules d’argent, la possibilité de lire le processus de désinfection, le prix de revient et la documentation scientifique de son efficacité par une étude de cohorte prospective contrôlée7. La nébulisation au peroxyde d’hydrogène est encore utilisée actuellement dans la désinfection terminale des chambres en présence de souches d’entérobactéries ou d’Acinetobacter baumannii multirésistantes productrices de carbapénèmases, de VRE et de Norovirus, en complément du nettoyage et de la désinfection manuels des chambres. L’utilisation de la NTD est indiquée dans le cas des agents pathogènes précités, car la littérature indique clairement que l’admission dans une chambre où un patient a été colonisé ou infecté au préalable par l’un de ces agents pathogènes accroît de manière significative le risque d’acquisition de ces microorganismes par un nouveau patient . Ceci s’explique par le fait ces microorganismes sont capables de survivre pendant des périodes prolongées (de quelques jours à plusieurs mois) sur des surfaces contaminées de l’environnement dans la chambre3,8.
Bien que l’utilisation des systèmes NTD pour la désinfection des chambres de patients soit de plus en plus courante dans les hôpitaux belges, l’évidence scientifique attestant de manière convaincante leur efficacité en terme de réduction du nombre d’infections de soins de santé reste encore limitée. Une revue systématique récente de Dancer & King est cependant très instructive à cet égard9.
Bien que les études in vitro montrent clairement une réduction de la charge microbienne9, la preuve de l’impact bénéfique de ces systèmes NTD au niveau clinique reste plus difficile à démontrer10,11. Selon la classification des niveaux de preuve proposée par McDonald, on peut distinguer 4 niveaux (voir figure 2)12. Les niveaux 3 et 4 représentant l’impact clinique en terme de réduction d’acquisition d’infections et de taux de transmission.
Figure 2 hiérarchie des preuves de la technologie « no touch » (modèle McDonald modifié par De Bel 2017) 11
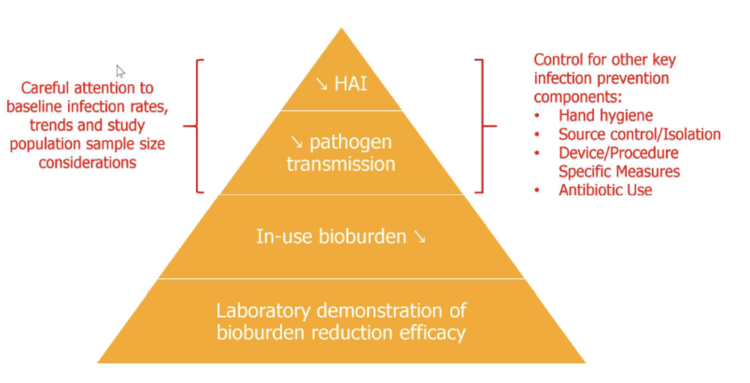
Le niveau 1 (base de la pyramide de preuves) comprend des études de laboratoire dans lesquelles l’efficacité de la technique est étudiée dans des chambres contaminées artificiellement. L’inoculum utilisé dans ces études est souvent très élevé et vise à tester la capacité de réduction maximale de la technique plutôt que de simuler un degré réaliste de contamination des chambres. Dans ce type d’étude les résultats sont donc souvent exprimés en capacité de réduction log10. Les études de niveau 2 évaluent la réduction réelle du niveau de contamination des surfaces à contact élevé dans des chambres d’isolement par contact, en comparant la situation pré- et post-traitement. Comme la charge microbienne dans ces chambres est nettement inférieure à celle utilisée dans les études de niveau 1, les résultats ne sont généralement pas exprimés en capacité de réduction log10, mais plutôt comme un pourcentage comparant les points de prélèvements positifs avant et après traitement. Les études de niveau 3 et 4 fournissent les informations cliniques les plus précieuses, mais sont difficiles à réaliser, car il existe de nombreuses variables confondantes. Ces études analysent comme paramètre d’efficacité le degré de réduction des taux de transmission verticale et/ou le nombre d’infections par des pathogènes nosocomiaux11.
Dans la revue systématique de Dancer et King, 43 études publiées dans la période 2005-2020 ont été retenues9. 84 pour cent de ces études de niveau 3 et de niveau 4 utilisaient une méthodologie comparative de type ‘avant/après’, qui ne permettait pas de démontrer un impact clinique favorable de l’utilisation de la désinfection NTD au niveau des patients. Dans ce type d’études, il existe une multitude de variables confondantes telles par ex. les facteurs de risque des patients, les pratiques de prévention des infections et les aspects liés aux soins. Ces différentes variables ne sont souvent pas prises en compte ni contrôlées dans les résultats rapportés avant et après utilisation de la NTD13. Ce design d’étude ne permet dès lors pas d’obtenir des preuves suffisamment fiables et solides.
La lumière ultraviolette (UV) est invisible à l’œil nu et est divisée en UV-A, UV-B et UV-C. Les UV-C sont présents dans la plage de longueur d’onde de 100-280 nm. Les lampes professionnelles au mercure ionisé produisent principalement de la lumière UVC d’une longueur d’onde de 254 nm, c’est-à-dire la longueur d’onde assortie de l’action de désinfection la plus puissante (voir figure 3).
Figure 3. Désactivation cellulaire des micro-organismes par la lumière UV-C.
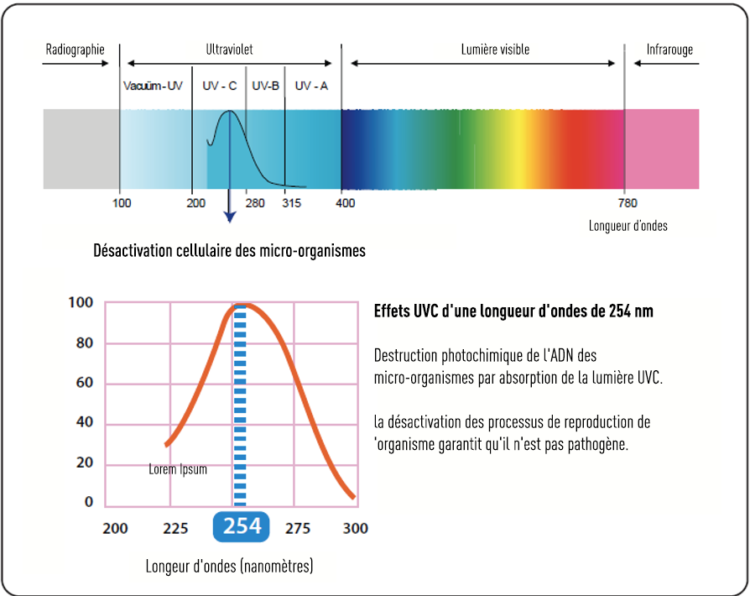
La lumière UVC déstabilise l’ADN et l’ARN des agents pathogènes et empêche ainsi leur multiplication. La résistance effective des micro-organismes au rayonnement UV-C diffère considérablement, et la dose totale d’UV exprimée en nombre de MJ/cm2 pour obtenir une réduction log suffisante varie selon les micro-organismes à éliminer. La désinfection par UVC est une technologie à visibilité directe, c’est-à-dire qu’une exposition directe des surfaces à la lumière UVC est nécessaire pour obtenir un effet germicide, les zones d’ombre ne sont pas atteintes et ne sont pas désinfectées. C’est la raison pour laquelle des robots UVC ne peuvent jamais être utilisés de manière totalement autonome pour la désinfection de salles. La distance par rapport à la source lumineuse UVD est également importante. L’intensité du rayonnement UV est inversement proportionnelle au carré de la distance entre la lampe UV et la surface exposée. La conception de la source lumineuse UVC mobile peut varier en fonction du fabricant, ce qui a un impact sur les performances. Contrairement à la NTD basée sur le peroxyde d’hydrogène, où l’efficacité antimicrobienne de la désinfection aérobie peut être testée conformément à la norme EN7272, il n’existe pas de norme d’essai internationale standard permettant de démontrer l’efficacité antimicrobienne des UVC. Ceci complique la comparaison des différents systèmes UVC disponibles sur le marché.
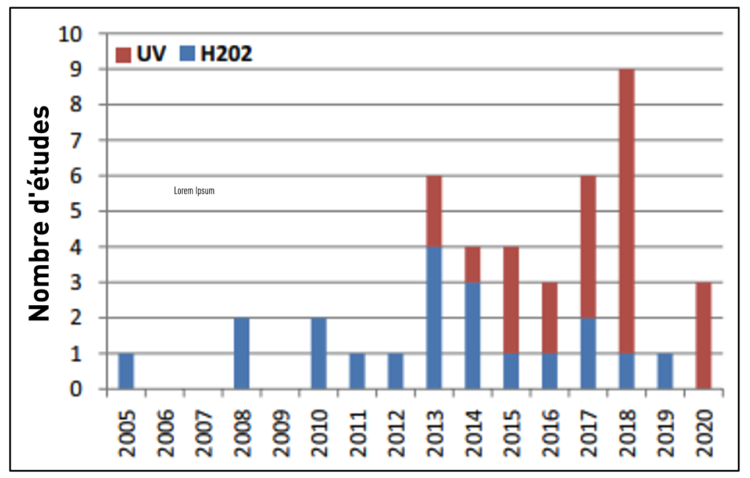
La figure 4 montre une nette augmentation du nombre de publications relatives aux UVC, mais de manière frappante aucune de ces études ne provient d’Europe.
Figure 4 Aperçu du nombre de publications annuelles par type de NTD (UVC vs H2O2) au cours de la période 2005-2020 9
Les partisans des systèmes de désinfection UVC mobiles peuvent se référer à deux publications qui font partie de l’étude BETR (‘Benefits of Enhanced Terminal Room Disinfection Study’). En 2017, Anderson et al. ont publié les résultats d’une étude croisée-randomisée pragmatique en grappe, dans laquelle l’effet de quatre régimes différents pour la désinfection terminale des chambres a été étudié concernant Clostridiodes difficile, MRSA, VRE et Acinetobacter baumannii multirésistants14 en milieu hospitalier. Les différents protocoles évalués pour la désinfection terminale de chambres étaient les suivants : désinfection avec un dérivé ammonium quaternaire et seulement dans le cas de Clostridiodes difficile utilisation d’eau de Javel
(« référence »), référence avec application d’UVC en complément, désinfection avec eau de Javel seule, désinfection avec eau de Javel et application d’UVC en complément. Au cours de la période d’étude de 2 ans, 31 226 chambres de patients (21 395 patients représentant 97 833 jours d’exposition) ont été intégrées dans l’analyse en intention de traiter (‘intention-to-treat’). Tous les patients étaient hospitalisés depuis minimum 24 heures et le statut de colonisation/ infection acquise dans la communauté a été exclu pour les pathogènes étudiés.
Le risque relatif de contamination à Clostridiodes difficile, MRSA, VRE ou Acinetobacter baumannii multirésistants par rapport à la méthode de désinfection « référence » était de 0,70 (IC95 % I 0,5-0,98) dans le groupe UVC, 0,85 (IC95% 0,69-1,04) dans les groupe eau de Javel et 0,91 (IC95% 0,76-1,09) dans l’eau de Javel avec en complément. Les résultats spécifiques selon les agents pathogènes sont beaucoup moins convaincants et ne montrent aucune réduction significative pour les UVC vis-à-vis de Clostridiodes difficile, MRSA et VRE. Dans le cas des Acinetobacter baumannii multirésistants, ’aucune explication plausible n’est avancée pour expliquer la quasi absence de survenue de cas (un seul cas enregistré ’tout au long de la période’ d’étude).
En 2018, Anderson et al. ont publié les résultats d’une analyse secondaire des données recueillies au cours de l’étude BETR15. Cette fois, tous les patients hospitalisés depuis au minimum 48 heures ont été repris dans l’étude, en excluant les cas de patients’colonisés/infectés au niveau de la communauté pour Clostridiodes difficile MRSA, VRE ou Acinetobacter baumannii multirésistants. L’analyse a porté sur 31 4637 admissions, représentant 1 169 416 jours-patients. Ce n’est que pour Clostridiodes difficile et pour VRE qu’ une réduction significative des risques a été observée lors de’l’utilisation des UVC.
Dans le groupe UVC, les risques relatifs de contamination par Clostridiodes difficile et par VRE par rapport à la « référence »
était de 0,89 (IC 95% 0,80-0,99) et de 0,56 (IC 95% B.I. 0,31-0,99), respectivement. Les résultats obtenus sont entièrement conformes à ceux de la revue systématique et de la méta-analyse de Marra, Schweizer et Edmond 16.
Bien que la technologie NTD offre un intérêt potentiel son bénéfice réel en matière de réduction des infections dans le secteur de la santé reste encore peu démontré à ce jour.
Les NTD à base de peroxyde d’hydrogène sont chronophages, laborieuses et posent un problème de contrôle de processus et/ou de critères clairs inadéquats, comme la concentration volumique (ppm) de peroxyde d’hydrogène nécessaire pour valider un cycle en tant qu’utilisateur final, ce qui n’est pas superflu étant donné que chaque pièce est différente 11.
La décontamination à base d’UVC offre un certain nombre d’avantages par rapport au peroxyde d’hydrogène. Aucune préparation ni suivi spécifique n’est nécessaire pour la salle à désinfecter, il n’y a aucune utilisation de produits chimiques, une absence de résidus toxiques (notamment pas de particules d’argent), un délai de traitement de quelques minutes au lieu de plusieurs heures, après la désinfection la pièce traitée étant ainsi immédiatement accessible et prête pour sa réutilisation. Cependant, comme pour les NTD à base de peroxyde d’hydrogène, il existe également une multitude de solutions UVC disponibles sur le marché. Contrairement à la décontamination au peroxyde d’hydrogène qui permet une désinfection complète de la chambre – la décontamination par UVC se limitera aux zones déterminées par l’utilisateur final comme étant à risque pour la transmission d’infections nosocomiales et effectivement exposées à la lumière UVC pendant une durée et à une distance qualifiées de suffisantes.
Conclusion
Les études publiées sur les NTD présentent souvent un design d’étude inapproprié et sont principalement sponsorisées par l’industrie. Une analyse approfondie prenant en compte le rapport coûts-avantages doit être effectuée, et il n’existe à ce jour aucune étude capable de démontrer une économie de coûts9. La mise en œuvre d’un bon programme de nettoyage professionnel est une nécessité avant tout investissement dans la nouvelle technologie NTD. « One wipe, one site and one direction with detergent and water is easy, cheap and effective and will not upset the surface ecology or create a futuristic superbug » 9. La NTD peut apporter une valeur ajoutée, mais ne permet pas de pouvoir économiser du personnel de nettoyage.
Il est prévu que les hôpitaux de Nivelles, Mons et Warquignies, faisant partie du pôle hospitalier Jolimont appliquent également cette procédure dans le futur.
Références
1. -, Coronavirus: 200th EU disinfection robot delivered to European hospital, a further 100 confirmed, European Commission, press corner, daily news 21/09/2021.
2. Carling P.C. et al., Improving cleaning of the environment surrounding patients in 36 acute care hospitals, Infect Control Hosp Epidemiol, 2008 nov, 29(11):1035-41.
3. Otter J.A., Evidence that contaminated surfaces contribute to the transmission of hospital pathogens and an overview of strategies to adressed contaminated surfaces in hospital settings, Am J Infect Control, 2013, may, 41(5 suppl):S6-11.
4. Boyce J.M., Modern technologies for improving cleaning and disinfection of environmental surfaces in hospitals, Antimicrob Resist Infect Control, 2016:5:10.
5. Carling P.C., The need for clinical relevant studies of no-touch disinfecting systems, J Hosp Infect, 2013:84:33940.
6. Dancer S.J., Floor wars: the battle for clean surfaces, J Hosp Infect, 2013:84:339-340.
7. Passaretti C.L. et al., An evaluation of environmental decontamination with hydrogen peroxide vapor for reducing the risk of patient acquisition of multidrug-resistant organisms, Clin Infect Dis, 2013:56 (1 january), 27-35.
8. Mitchell B.G. et al., Risk of organism acquisition from prior room occupants: a systematic review and meta-analysis, J Hosp Infect, 2015, 91:211-17.
9. Dancer S.J., KingM., Systematic review on use, cost and clinical efficacy of automated decontaminatjon devices, Antimicrob Resist Infect Control, 2021, 10:34.
10. Weber D.J. et al., Effectiveness of ultraviolet devices and hydrogen peroxide systems for terminal room decontamination: focus on clinical trials, Am J Infect Control, 2016, 44:e77-84.
11. De Bel A., Kamerdecontaminatie met “no touch” technologie: vergelijkende studie tussen waterstofperoxide en quaternaire ammoniumderivaten, ManaMa ziekenhuishygiëne, Universiteit Gent, 2017, 49pp.
12. McDonald L.C., Arduino M., Climbing the evidentiary hierachy for environmental infection control, Clin Infect Dis, 2013 january, 56(1):36-39.
13. Caluwaerts A. Is UV-straling het nieuwe wondermiddel om patiëntenkamers te desinfecteren?, examenopdracht Evidence Based Heathcare Critically Appraised Topic, KU Leuven, 2020.
14. Anderson D.J. et al., Enhanced terminal room disinfection and acquisition and infection caused by multidrug-resistant organisms and Clostridium difficile (the Benefits of Enhanced Terminal Room Disinfection study): a cluster-randomised, multicentre crossover study, The Lancet, 2017, jan 16.
15. Anderson D.J. et al., Effectiveness of targeted enhanced terminal room disinfection on hospital-wide acquisition and infection caused by multidrug-resistant organisms and Clostridium difficile: a secondary analysis of a multicentre cluster randomised controlled trail with crossover design (BETR Disinfection), Lancet infect Dis, 2018, june 4.
16. Marra A.R., (M.L.), (M.L.) Schweizer, (M.B.) Edmond, No touch disinfection methods to decrease multidrugresistant organism infections: a systematic review and meta-analysis, Infect Control Hosp Epidemiol, 2017, 1-12.
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)



