Nouveaux critères d’interprétation de l’antibiogramme de l’EUCAST : Quel impact pour les équipes d’hygiène hospitalière dans le cadre de la détection, de la prévention et du contrôle des MDRO ?

Mais au fait, qu’est-ce que l’EUCAST ? Quelques petits rappels en guise de préambule :
Le Comité Européen des tests de sensibilité aux agents antimicrobiens (EUCAST) est un comité scientifique qui est chargé de définir les lignes directrices d’interprétation de l’antibiogramme. L’EUCAST est organisé conjointement par l’ESCMID (la Société Européenne de Microbiologie et des Maladies Infectieuses), l’ECDC (le Centre Européen de Prévention et de Contrôle des maladies) et d’autres laboratoires européens. L’EUCAST définit les ‘clinical breakpoints’ (points ou seuils critiques cliniques) permettant la catégorisation des résultats de l’antibiogramme (SIR : Sensible, Intermédiaire ou Résistant) et aide ainsi à l’utilisation clinique des antibiotiques (en accord avec l’Agence Européenne des médicaments, l’EMA) et à la surveillance épidémiologique de la résistance (en accord avec l’ECDC). Depuis 1997, année de sa création, le comité de l’EUCAST a contribué de façon déterminante à l’harmonisation de la surveillance de la résistance aux antibiotiques en Europe où il représente aujourd’hui le référentiel standard de l’antibiogramme et est utilisé par la grande majorité des laboratoires (>90% en Belgique). La vocation première de l’EUCAST est de traiter les aspects techniques des tests phénotypiques de sensibilité in vitro aux agents antimicrobiens et d’aider à optimiser leur usage clinique par l’établissement des valeurs des points seuils cliniques critiques individualisées pour chaque antibiotique (les ‘clinical breakpoints’ représentent la concentration d’antibiotique utilisée pour déterminer si une infection occasionnée par une souche bactérienne particulière est susceptible d’être traitée efficacement chez le patient, dans ce cas la souche est dite ‘sensible’). A noter que si l’EUCAST émet aussi des recommandations pour la détection de mécanismes de résistance ou de résistances spécifiques d’importance clinique et/ou épidémiologique (p.ex. : BLSE, carbapénèmases,…) elle n’en donne par contre aucune pour la détection du portage de bactéries résistantes transmissibles responsables d’infections nosocomiales, ni pour les mesures de préventions et/ou de contrôle à appliquer.
En 2019, de nouvelles définitions et de nouveaux critères d’interprétation des résultats de l’antibiogramme ont été édictés par l’EUCAST; ceci concerne plus particulièrement la
catégorie ‘I’ Intermédiaire dont la définition initiale référait à un résultat indéfini (traduisant soit une incertitude technique (variation dans la méthode ou dans l’interprétation du résultat) soit une concentration limite de l’antibiotique au site de l’infection (incertitude quant à l’efficacité clinique). Cette catégorisation des résultats ‘I’ était souvent incomprise par les cliniciens avec comme conséquence la non utilisation des antibiotiques ainsi rapportés. Par ailleurs, les résultats des laboratoires des catégories I (Intermédiaire) et R (Résistant) étaient souvent regroupés dans les programmes de surveillance épidémiologique (en ‘non-sensibles’) ce qui contribuait également à la non utilisation par les cliniciens des antibiotiques catégorisés en résultat ‘I’.
Depuis 2020, l’EUCAST recommande le maintien de la catégorie ‘I’ par les laboratoires (référendum conduit par l’EUCAST entre 2015 et 2019) mais avec une nouvelle signification ; celle-ci étant dorénavant considérée comme indiquant une sensibilité à dose plus élevée (Susceptible, Increased Exposure) par opposition à ‘S’ (Sensible à posologie standard). La catégorie ‘I’ reflète une sensibilité naturelle (intrinsèque) moindre aux antibiotiques de certaines espèces bactériennes (p.ex :
Pseudomonas aeruginosa) et la nécessité de recourir à une posologie plus élevée pour certains antibiotiques ou encore elle peut traduire la présence de mécanismes de résistance acquise faiblement exprimés
qui diminuent la sensibilité de la bactérie. Cette nouvelle catégorisation et les règles d’interprétation basées sur l’utilisation de nouveaux points seuils critiques a fait l’objet d’une révision complète par l’EUCAST pour l’ensemble des agents antimicrobiens, anciens et nouveaux) qui prend en compte des différentes posologies utilisées en cliniques (dose standard (S) et dose élevée (I).
L’impact de ces nouvelles recommandations (en particulier l’absence dans certains cas selon le pathogène et l’agent antibiotique de catégorie ‘S’ et son remplacement par une catégorie unique ‘I’ (sensibilité à dose élevée) concerne en premier la gestion des agents antimicrobiens et les conséquences éventuelles que ces changements peuvent entraîner au niveau des choix des molécules antibiotiques et des stratégies thérapeutiques en particulier en milieu hospitalier (agents utilisés par voie parentérale (IV), posologie adaptée au type de microorganisme, ….). Il est primordial que les groupes de gestion de l’antibiothérapie vérifient que les posologies d’antibiotiques utilisés localement sont en accord avec les dosages recommandés par l’EUCAST, et que le cas échéant celles-ci soient modifiées. Une information des cliniciens hospitaliers (mais aussi des praticiens en médecine ambulatoire) sur les changements qui résultent de ces nouveaux critères et de leur conséquence pour le traitement des patients doit être réalisée par les laboratoires.
Cependant l’effet que ces modifications de catégories auront sur la surveillance de la résistance aux agents antimicrobiens n’est pas encore connu et doit faire l’objet d’un monitoring tant au niveau national que local.
D’une manière générale, il est important que les laboratoires établissent dans leurs rapports de surveillances épidémiologiques une séparation claire entre les souches résistantes (R) par rapport à celles qui sont sensibles (S + I). La globalisation en catégorie ‘non-sensible’ (R+ I) souvent utilisée par le passé dans les surveillances (tant locales que nationales) n’est plus acceptable.
Concernant les bactéries multi-résistantes souvent référées sous le vocable de « Multi-drug Resistant Organisms » (MDRO), il n’existe malheureusement à ce jour pas de consensus quant aux critères permettant de les définir dans le cadre des mesures de prévention et de contrôle à appliquer chez les patients hospitalisés porteurs de ces bactéries. Certains pays comme l’Allemagne ou les Pays-Bas ont publié des recommandations nationales (basées sur des définitions différentes) (J. Müller et al. Antimicrobial Resistance and Infection Control 2015 ; 4:7)
En Europe l’ECDC a proposé via un consensus d’experts internationaux (AP Magiorakos et al. Clin Microb Infect 2012, 18(3) : 268-81) une série de définitions visant à créer une terminologie standard internationale des critères utilisés pour caractériser un profil de multirésistance acquises chez les principaux pathogènes bactériens responsables d’infections nosocomiales. Des classes d’antibiotiques et les différentes molécules au sein de chacune des classes considérées ont été construites et proposées pour chaque groupe bactérien. Ceci implique que les laboratoires testent les antibiotiques nécessaires à la détection des MDRO et rapportent les résultats (sans masque de réponse sélective sur les protocoles d’analyse). En Belgique, le National Antibiogram Committee – NAC (Comité national de l’antibiogramme) a publié récemment des recommandations sur les antibiotiques à tester sur l’antibiogramme standard des principaux groupes de bactéries pathogènes ainsi que des suggestions pour le rapportage des résutats (incluant également les MDRO). Ces recommandations peuvent être trouvées sur le website du NAC à l’adresse suivante : https://www.bvikm.org/national-antimicrobial-committee-fr.
Les critères de multirésistance établis par l’ECDC étaient les suivants: multirésistance (MDR; Multidrug resistant)): résistance à au moins un agent antimicrobien au sein de trois classes ou plus de trois classes d’antibiotiques; la résistance étendue (XDR; extensively resistant): résistance à au moins un agent dans toutes les classes d’antibiotiques sauf une ou deux; résistance complète (PDR ; Pandrug resistant) comme une résistance à tous les agents antimicrobiens dans toutes les classes d’antibiotiques. A noter que ces définitions qui datent de 2011 étaient basées sur les seuils cliniques définis à l’époque par l’EUCAST. Ceci incluait donc à la fois les souches dites intermédiaires (I) et les souches résistantes (R), soit les catégories non-sensibles (catégories I+R). Compte tenu des changements intervenus depuis 2020 au niveau de l’EUCAST, Il est important de s’assurer que les laboratoires utilisent dorénavant bien dans les définitions précitées des MDRO uniquement la catégorie de résistance (R) et que les données de surveillance épidémiologique soient bien exprimées en %R vs %S+I. Ceci doit également s’appliquer dans le cadre des mesures de prévention et de contrôle de la transmission des MDRO pour lesquelles seule la catégorie R (et non R+I) doit être prise en considération.
Ces propositions même si elles ont le mérite d’exister, laissent cependant place à de nombreuses variations et interprétations possibles (p.ex. : choix approprié des molécules testées au sein d’une classe, absence de critère de priorité dans le choix des classes d’antibiotiques en fonction de leur importance clinique (poids identique), utilisation du critère I+R, différences de critères à utiliser pour qualifier un MDRO très variables selon les pays. Ainsi, des études récentes ont montré que l’utilisation de définitions variables de la multi résistance pouvaient entrainer des modifications substantielles des taux d’isolats bactériens multi-résistants ainsi que du pourcentage de patients porteurs de bactéries multirésistantes. Ceci a surtout été observé pour les bactéries à Gram-négatif. Ces différences proviennent des différences qui existent dans les critères utilisés portant à la fois sur les nombres et les types de classe d’antibiotiques nécessaires pour remplir les conditions de multirésistances, les antibiotiques considérés comme pertinents (au sein d’une classe) et du panel d’antibiotiques testés. Une étude rétrospective réalisée par Wolfensberger et coll. (Antimicrob Res Infect Control, 2019) dans un hôpital universitaire Suisse sur une période de plus de 3 ans (2013-2015) a ainsi montré que selon l’application des critères de multirésistance utilisés en Allemagne, ceux édictés par l’ECDC ou encore ceux utilisés localement à l’hôpital universitaire de Zürich (en l’absence de recommandations nationales pour la Suisse) des variations importantes des pourcentages de bactéries à gram-négatif MDR pouvaient être observées (en moyenne de l’ordre de 3x) en particulier lors de l’utilisation des critères ECDC qui tiennent compte du nombre de classes résistantes d’antibiotiques (1 agent dans 3 classes d’antibiotiques) par rapport aux critères allemands exigeant jusqu’à 4 classes et plus spécifiques dans les antibiotiques considérés au sein de celles-ci. En l’état, cette étude a été réalisée dans un contexte épidémiologique de faible taux de résistances et il est fort possible que l’impact puisse être encore plus marqué dans des endroits avec des taux de prévalence de résistance plus élevée. A noter aussi que cette étude utilisait les critères d’interprétation de l’EUCAST avant les changements d’interprétation intervenus de la catégorie de résultat ‘I’, ceux-ci étant interprété globalement (I + R, non-sensibles). A ce jour, l’effet des changements de l’EUCAST sur l’interprétation de la catégorie ‘I’ intervenus en 2020 et leur conséquence sur les précautions d’IPC ne sont pas encore connus et doivent faire l’objet d’une évaluation et d’une surveillance.
Il est important que les critères de multirésistances soient bien choisis en fonction des objectifs (surveillance épidémiologique vs guidance des mesures d’IPC) et des taux de résistance locaux car les définitions guidant les précautions d’IPC entraînent des effets directs sur les coûts et les soins aux patients. A titre de rappel, le tableau 1 résume les critères utilisés pour la définition des bactéries à Gram-négatif multi-résistantes (GN-MDRO) en Belgique selon les recommandations du Conseil Supérieur de la Santé (Avis N° 9277, Avril 2019).
Outre les différences dans les critères de multirésistance utilisés, plusieurs études réalisées récemment dans le cadre de réseau de surveillances européens transnationaux au niveau de zones frontalières (Allemagne-Pays-Bas, Allemagne-Suisse-France) ont mis en évidence la grande variabilité et l’hétérogénéité locale dans la prévalence de portage des différents MDRO mais surtout dans les protocoles de dépistage (différences dans les facteurs de risques considérés pour le dépistage, différences dans les sites d’écouvillonnage,…) ainsi que dans les mesures IPC mises en œuvre (équipements de protection individuelle, mesures d’isolement préconisées,…) pour limiter la dissémination des MDRO.
Ces études ont également montré que malgré l’existence de recommandations nationales ou locales, celles-ci étaient sujettes à de nombreuses interprétations et souvent mal appliquées (taux d’observance de moins de 30% à 60% selon les critères analysés). Les audits réalisés localement ainsi que les enquêtes effectuées auprès d’experts pointent le manque de responsabilisation des acteurs de soins impliqués dans la décision du dépistage, ainsi que la nécessité impérieuse d’amélioration de l’éducation en matière de protocoles de dépistage des MDRO. Il apparaît aussi très clairement que les différences dans les protocoles de dépistage compliquent la prise en charge des patients et ce pas seulement dans un contexte transnational mais aussi au niveau régional dans un même pays. A cet égard l’action des plates-formes régionales d’hygiène hospitalière et notamment la mise sur pied d’équipes pluridisciplinaires dans le cadre des projets-pilote HOST récemment créés constituent des opportunités pour renforcer et optimiser la collaboration inter-hospitalière au niveau régional. La problématique complexe des MDRO (standardisation des protocoles de dépistage, signalétique et documents de transferts communs, programme de formation continue) constitue certainement un domaine d’application idéal dans ce cadre.
Les références relatives à cet article peuvent être trouvées dans la liste choisie des résumés cités dans la rubrique ‘Nous avons lu pour vous’ de ce numéro de NOSO-Info.
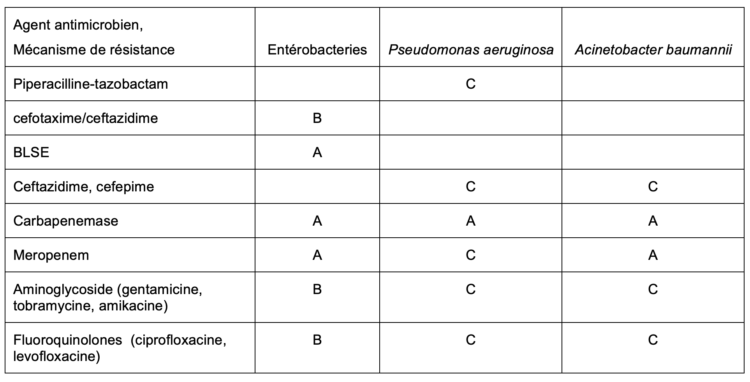
Tableau 1. Critères utilisés pour la définition des bactéries à Gram-négatif multi-résistantes (GN-MDRO) selon les recommandations belges (Conseil Supérieur de la santé, CSS Avis n° 9277, Avril 2019)
A : BLSE + (toutes les espèces d’Entérobactéries sauf
E. coli), présence d’une carbapénémase (Entérobactéries, Pseudomonas aeruginosa, Acintetobacter) ; ou R à Meropenem (Enterobactéries, Acinetobacter) sont considérés d’office comme MDRO
B : Enterobactéries résistantes à >1 antibiotique dans 3 classes d’AB (cephalo 3G, aminoglycosides, fluoroquinolones)
C : Pseudomonas aeruginosa, Acinetobacter baumannii résistant à > 1 antibiotique dans > 3 classes d’antibiotiques (pipera/tazo, Cephalo 3G/4G, carbapénèmes, aminoglycosides, fluoroquinolones)
Pour la qualification de GN-MDRO, il y a lieu de considérer uniquement les résultats ‘R’ (résistant) sur base des points critiques cliniques selon les recommandations actualisées de l’EUCAST (à partir de la version 10, ou supérieure à partir de 2020) et non plus comme sur la base des résultats « non-sensibles » (I + R). Dans ses recommandations actuelles de l’EUCAST, les points critiques qui définissent la catégorie ‘I’ sont interprétés comme sensible à exposition augmentée « increased » (posologie/nombre de doses/mode d’administration)
Nombre de classe et nombre d’antibiotiques par classe d’antibiotique testés doit être suffisant pour pouvoir catégoriser les souches comme MDRO.
En cas de résultats non répondus (réponse masquée), les données de base doivent être disponibles au laboratoire. Les tests diagnostiques commerciaux complémentaires à l’antibiogramme standard (profil phénotypique de résistance) actuellement sur le marché (phénotypiques, colorimétriques/biochimiques, antigéniques, moléculaire), permettent normalement de détecter de manière fiable les mécanismes de résistance importants en terme de mesures d’IPC et de classifier rapidement de manière fiable la majorité des GN-MDRO sans attendre la confirmation du résultat d’un laboratoire de référence (CNR) lorsque la souche est envoyée avant de déployer des mesures de prévention (précautions de contact/isolement en chambre seul).
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)


