Installations sanitaires et canalisations d’eaux usées comme sources de propagation au long cours de Citrobacter freundii producteur de carbapénémase en milieu hospitalier

Introduction
Les entérobactéries productrices de carbapénémase (EPC) ont été catégorisées par l’Organisation mondiale de la santé comme pathogènes de priorité 1 (critique) dans le classement des bactéries résistantes aux antibiotiques [2]. Une colonisation à EPC est associée à un risque d’infection de 16,5 %. Ce risque augmente considérablement chez les personnes âgées et les patients immunodéprimés [3, 4]. Les EPC étant généralement multirésistantes, les infections sont souvent difficiles à traiter car les options antibiotiques disponibles sont peu nombreuses. Par conséquent, le pronostic clinique est péjoratif et la morbidité globale, la durée du séjour et la mortalité sont plus élevées comparativement aux infections à entérobactéries non productrices de carbapénémase [4].
Citrobacter freundii est une bactérie à Gram négatif, anaérobie facultative, de forme bacillaire, que l’on trouve dans le sol, l’eau, les aliments et les intestins. Elle est souvent considérée comme un contaminant ou un colonisateur inoffensif. Pourtant, Citrobacter spp. peut occasionner des infections sévères et difficiles à traiter, en particulier chez les nouveau-nés, les personnes âgées et chez les patients immunodéprimés [5]. Il est de plus en plus évident que Citrobacter freundii joue un rôle croissant dans les foyers d’EPC dans les établissements de santé [6, 7].
La colonisation à EPC chez les patients se produit généralement dans le tractus gastro-intestinal, et l’on peut donc s’attendre à sa présence dans les eaux usées des hôpitaux. Les installations sanitaires des hôpitaux, comme les lavabos, les toilettes et les douches sont reconnus comme constituant des réservoirs d’EPC [7, 8]. L’environnement humide crée des conditions favorables à une colonisation microbienne. En outre, il a été démontré dans plusieurs établissements de soins de santé que l’eau des toilettes constituait un réservoir de choix pour la transmission d’EPC, y compris dans le service des grands brûlés de notre propre établissement [9].
Les canalisations d’eaux usées sont considérées comme une voie de propagation possible. Cependant, il n’existe encore que peu de données dans la littérature sur leur importance en milieu hospitalier. Dans notre étude, des isolats cliniques et environnementaux d’EPC C. freundii collectés entre 2015 et 2022 ont été analysées sur le plan de leur parenté clonale par le séquençage de génome complet (WGS) suivi de leur génotypage par comparaison des séquences d’un série de gènes du génome de base (core genome MLST ou cgMLST). Notre travail avait comme objectif d’évaluer l’importance des systèmes d’évacuation d’eaux usées en tant que réservoirs et vecteurs de transmission des EPC et de pouvoir introduire ainsi des mesures préventives ciblées.
Méthode
Suite à la survenue fréquente et inattendue de Citrobacter freundii producteurs de carbapénémase chez des patients du service gériatrique de l’hôpital universitaire de Gand, nous avons réalisé de manière rétrospective une analyse moléculaire d’isolats bactériens provenant de patients (n=30) et d’échantillons environnementaux (n=23) afin d’obtenir une vision plus détaillée de la situation. Les échantillonnages ont été effectués entre 2015 et 2022.
Les analyses conventionnelles comprennent l’identification des bactéries par MALDI-TOF MS et la détection du type de carbapénémases par PCR [9]. L’extraction de l’ADN a ensuite été réalisée sur des isolats sélectionnés, suivie du séquençage du génome complet par la méthode Illumina (HiSeq 3000/NovaSeq 6000). L’analyse génomique a été réalisée par comparaison des séquences de gènes du génome par cgMLST, qui permet de déterminer si les isolats sont apparentés les uns aux autres (différence de moins de 20 allèles) ou non (différence de plus de 40 allèles).
Le service de gériatrie où l’étude a été réalisée se compose de 17 chambres de patients situées du même côté du couloir ; chaque chambre dispose d’une petite salle de bains. Les eaux grises (lavabo/douche) et brunes (toilettes) sont transportées par des tuyaux adjacents distincts dans 2 circuits (chambre R1-R9 et chambre R10-R16). Lors de leur admission dans le service de gériatrie, tous les patients ont fait l’objet d’un dépistage systématique des EPC par écouvillonnage rectal. En cas de test positif pour EPC pendant l’hospitalisation, l’ensemble des patients du service faisaient l’objet d’un dépistage hebdomadaire. Les patients porteurs d’EPC étaient maintenus en isolement, avec des procédures de nettoyage strictes après leur sortie. Toutes les chambres étaient nettoyées quotidiennement.
Résultats
Détection d’EPC
Sur une décennie (2012-2021), une ou plusieurs espèces d’EPC ont été isolées chez 65 patients du service gériatrique de l’hôpital universitaire de Gand, parmi lesquels 14 avaient développé une infection. La grande majorité des cas étaient nosocomiaux (92,3 %) et Citrobacter freundii a été détecté chez près de la moitié des patients (47,7 %), comme le montre la figure 1. Les autres espèces fréquemment détectées étaient K. pneumoniae (38,4 %) et E. coli (29,2 %).
L’examen de l’environnement s’est concentré sur l’eau des toilettes, les canalisations d’évacuation des douches et les siphons de lavabos ; les environnements positifs faisant l’objet d’un suivi régulier. Les tuyaux de collecte des eaux usées (gris et bruns) ont également été examinés. Au total, la présence d’une ou de plusieurs ECP a été détectée dans 77 des 389 échantillons environnementaux analysés, comme le montre la figure 1. Les taux de détection les plus élevés ont été observés dans les canalisations d’évacuation des douches (38,2 %) et dans des échantillons d’eau des toilettes (25,0 %). Les taux de positivité pour EPC relevés dans les échantillons prélevés étaient dix fois inférieurs (3,3 %) dans les siphons de lavabos. Citrobacter freundii était l’espèce la plus fréquemment détectée (52,1 %), suivie du complexe Enterobacter cloacae (41,1 %), de Klebsiella pneumoniae (9,6 %) et de Klebsiella oxytoca (6,8 %).
Analyse de clonalité des souches
Pour étudier la parenté clonale entre isolats de patients et isolats environnementaux, le séquençage du génome entier (WGS) a été réalisé sur 53 isolats de Citrobacter freundii. Le clustering, basé sur l’arbre couvrant minimum (Minimum Spanning Tree, MST) créé après analyse cgMLST, a mis en évidence 12 cas dans lesquels aucune relation clonale n’a pu être trouvée : « sporadique », voir figures 2 & 3. Les 41 autres isolats étaient distribués dans 5 clusters différents : Cluster A-E.
Le cluster B (ST170) comprend 12 isolats dont 9 sont étroitement liés et 4 sont plus distants. Tous les échantillons, sauf un, ont été prélevés dans la même pièce : R06, voir Figure 3. Le premier isolat provenait d’un patient en 2015 et le dernier d’un échantillon prélevé dans la conduite d’évacuation des eaux brunes des chambres R01-R09 en 2022. Au total, 8 patients, classés comme nosocomiaux, ont été associés à ce cluster. Trois ans séparent le deuxième (2015) et le troisième (2018) patient. Le retour du clone en 2018 n’a pas pu être expliqué par la réintroduction d’un ancien résident. En 2017, cependant, le même clone de ClusterB a été détecté dans l’eau des toilettes de la chambre R06. Un clone associé a été retrouvé dans l’eau des toilettes en 2019 et en 2021, indiquant la présence probable d’un réservoir dans les toilettes. Une situation similaire a été observée pour le ClusterC (ST421). Ce groupe se compose de deux isolats de patients et d’un isolat de toilettes, tous collectés dans la même pièce : R02. Les échantillons ont été prélevés à plus d’un an d’intervalle (2018, 2019 et 2021).
Le clusterA (ST22) compte 21 isolats, dont 12 sont issus de patients entre 2018 et 2021. Au cours de la période étudiée, le cluster semble se déplacer progressivement dans le couloir, en démarrant dans les chambres situées dans la deuxième moitié du couloir pour s’étendre ensuite aux chambres situées au début, comme le montre la figure 3. Plusieurs mois séparaient les cas de la plupart des patients ; la présence d’un réservoir dans l’environnement a donc été suspectée. Des isolats provenant de 6 échantillons de toilettes et de 2 canaux d’évacuations de douche ont été classés dans le même cluster. Dans la chambre R04, la présence de Citrobacter freundii ClusterA a pu être confirmée plusieurs semaines avant le diagnostic du premier patient ClusterA dans cette chambre. Finalement (en 2022), le ClusterA a également été détecté dans la conduite d’évacuation des eaux grises des chambres R01-R09.
Discussion
Réservoirs d’eau
Les réservoirs d’eau jouent un rôle crucial dans la transmission des EPC, et cela a été bien décrit surtout pour les lavabos [3]. Dans notre étude, les échantillons prélevés dans les toilettes et les drains de douche se sont révélés plus souvent positifs pour EPC que ceux prélevés au niveau des siphons de lavabos. L’analyse cgMLST a mis en évidence deux clusters qui se sont manifestés exclusivement dans des chambres spécifiques. Ces clusters ont également été détectés dans l’eau des toilettes des chambres respectives. Bien qu’il soit difficile de prouver que les toilettes jouent un rôle de récepteur ou de disséminateur [10], un rôle de disséminateur est suspecté ici, étant donné que les clusters ont été détectables pendant plusieurs années, même à des moments où aucun patient porteur d’EPC n’occupait la chambre. La transmission pourrait être due à la formation de gouttelettes ou de bioaérosols, comme cela a également été décrit dans d’autres foyers d’EPC [8, 9]. À cause de la chasse d’eau et de la formation subséquente de bioaérosols, les bactéries (pathogènes) peuvent se répandre dans la zone (> 0,5 m) et rester en suspension dans l’air pendant de longues périodes (> 15 min), entraînant une transmission par contact avec la peau, contamination des surfaces ou inhalation [11]. En outre, la transmission peut se faire par la diffusion de gouttelettes lors de la chasse d’eau et de la miction [12]. L’hypothèse d’un rôle important des sanitaires dans la conservation d’un réservoir d’organismes multirésistants est de plus en plus souvent avancée, en particulier dans les services où l’exposition aux antibiotiques est élevée [13].
Migration par l’intermédiaire d’un biofilm
Le plus grand cluster de Citrobacter freundii producteur de carbapénémase s’est répandu dans tout le service. Une part considérable des transmissions n’a pu être expliquée par des transmissions de patient à patient du fait des longs intervalles entre les admissions, souvent de plusieurs mois. Des recherches antérieures menées à l’UZ Gent ont révélé que les conduites d’évacuation étaient une voie possible de contamination croisée d’EPC d’une chambre à l’autre par migration rétrograde de biofilms [9]. Nous partons de l’hypothèse d’un mécanisme similaire pour la diffusion de ce vaste cluster. Nous supposons que la transmission interne par la formation rétrograde d’un biofilm dans les conduites d’évacuation s’est produite dans au moins trois situations. De plus, cette hypothèse est étayée par la détection du cluster dans le tuyau d’évacuation des eaux grises situé à quelques mètres de là, plus d’un an après la détection du dernier patient du cluster. Des études portant sur des souches d’Escherichia coli ont montré que la propagation par biofilm de tuyaux d’évacuation à des drains en milieu hospitalier pouvait se produire à une vitesse d’environ 2,5 cm par jour [14]. Théoriquement, une distance de quelques mètres pourrait être parcourue en moins de 6 mois, ce qui semble réaliste au vu de la chronologie des événements de notre étude. A notre connaissance, un biofilm d’EPC se propageant sur plusieurs mètres dans des canalisations d’évacuation n’a jamais été rapportée à ce jour.
Élimination des réservoirs
En 2020, il y a eu nettement moins de cas d’EPC chez les patients. Cela pourrait être attribué à une plus grande adhésion aux protocoles d’hygiène des mains et de nettoyage durant la pandémie de SARS-CoV-2. Un autre facteur contributif pourrait être la désinfection quotidienne des toilettes avec une solution d’eau de Javel diluée entre décembre 2019 et janvier 2021. Bien qu’un nettoyage régulier à l’eau de Javel ou à l’acide acétique puisse réduire temporairement le nombre de micro-organismes résistants, le remplacement des réservoirs contaminés est souvent considéré comme la méthode la plus efficace. Cependant, le remplacement des installations sanitaires n’est pas une garantie de succès en raison du risque de recolonisation par les patients ou de migration rétrograde de biofilms dans le système d’égouttage. Une expérience avec de nouvelles toilettes dans une chambre a révélé une recolonisation en l’espace de deux semaines. La suppression totale des lavabos et les soins aux patients sans eau se sont avérés bénéfiques dans certains contextes, mais ces mesures sont difficiles à mettre en œuvre dans les services hospitaliers ordinaires [15]. Un essai contrôlé randomisé suggère qu’une combinaison de nettoyage chimique, mécanique et thermique au niveau du siphon P fournit la meilleure désinfection à court terme pour les drains de lavabos et de douches, mais la mise en œuvre de ces méthodes est compliquée au niveau des siphons P des douches et pour les toilettes [16].
Réduction de l’exposition
Le lavage sans eau, grâce à l’utilisation de lingettes nettoyantes, est devenu la norme dans le service. Notons que les douches étaient déjà peu utilisées par la population gériatrique. En outre, des autocollants imprimés indiquant « Fermez le couvercle des toilettes avant de tirer la chasse » ont été placés sur toutes les toilettes au cours des premiers mois de la pandémie (mai 2020) afin de réduire la propagation des micro-organismes sur les surfaces environnantes. Toutefois, on ne sait pas dans quelle mesure cette instruction a été suivie. Les salles de bains des hôpitaux sont souvent petites et les lavabos, les toilettes et la douche sont proches les uns des autres. Cela peut entraîner une contamination croisée des installations sanitaires par bioaérosols. C’est pourquoi il est préférable d’installer les toilettes dans une pièce séparée ou d’utiliser des écrans de protection pour créer une barrière physique. Une nouvelle technique visant à réduire la diffusion des bioaérosols et des gouttelettes d’eau dans la cuvette des toilettes consiste à créer une couche de mousse, comme le décrivent Arena et al. [12]. Pour remédier au problème de la propagation par biofilm, la conception et l’entretien des canalisations hospitalières revêtent une importance cruciale. La formation d’un biofilm est favorisée par la stagnation de l’eau, la corrosion des tuyaux, une température ambiante élevée et la présence de nutriments. Le système de canalisation et l’utilisation des installations sanitaires doivent donc être évalués et améliorés dans la mesure du possible, éventuellement à l’aide de directives telles que celles émises par les Centres de contrôle et de prévention des maladies (CDC). Enfin, le comportement des prestataires de soins de santé est également considéré comme un facteur crucial, notamment le respect des directives en matière d’hygiène des mains et l’utilisation correcte des installations sanitaires.
Conclusion
Cette étude rétrospective suggère fortement l’implication des sanitaires et des conduites d’évacuation dans la propagation et la transmission d’EPC en milieu hospitalier. La clonalité a été démontrée pour cinq clusters de Citrobacter freundii producteur de carbapénémase par séquençage complet du génome suivi d’une analyse par cgMLST. Trois clusters comprenaient des isolats de patients ainsi que des isolats provenant de l’eau des toilettes et des drains de douches. La transmission indirecte semble résulter de la formation de bioaérosols et de gouttelettes lors de l’utilisation des toilettes ou de la douche. L’eau des toilettes ou le drain de la douche était colonisé par le même cluster de Citrobacter freundii dans plus d’une chambre sur trois au service de gériatrie. La propagation semble s’être faite graduellement sur plusieurs années, malgré les mesures d’isolement de contact et les procédures de nettoyage et de désinfection. En outre, des isolats de la même souche ont été détectés dans la conduite d’évacuation des eaux usées. C’est pourquoi nous suggérons que la propagation interne s’est produite à travers le système de drainage par la formation rétrograde de biofilms. Une approche pluridisciplinaire est nécessaire pour résoudre ce problème complexe, notamment en améliorant l’utilisation, le nettoyage, la conception et l’entretien des installations sanitaires et de la plomberie dans les établissements de soins de santé.
Figure 1 : Visualisation des entérobactéries productrices de carbapénémase (EPC) par espèce au fil du temps dans des échantillons de patients et d’environnement dans le service gériatrique de l’UZ Gent [1].
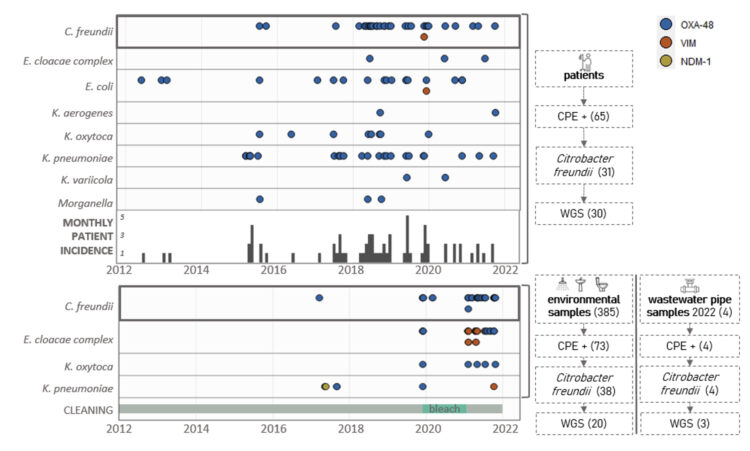
Figure 2 : Analyse en cluster de 53 isolats de Citrobacter freundii [1].
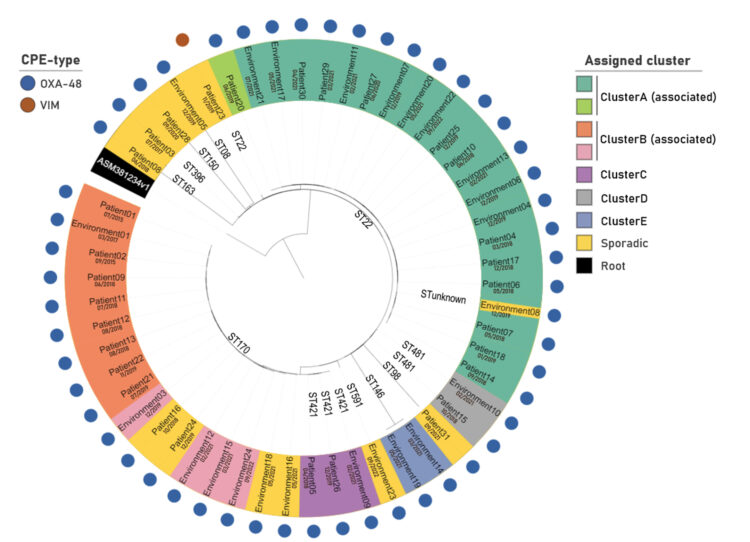
Un cladogramme permet de visualiser les résultats du clustering hiérarchique de l’analyse cgMLST. Les isolats bactériens regroupés dans le cluster (vert, rouge, violet, gris, bleu) présentent moins de 20 allèles de différence entre eux. Les isolats associés présentent moins de 40 allèles de différence entre eux. Tous les autres sont classés dans la catégorie « sporadique » (jaune).
Figure 3 : Visualisation de 53 isolats de Citrobacter freundii au fil du temps en fonction du site de collecte [1].
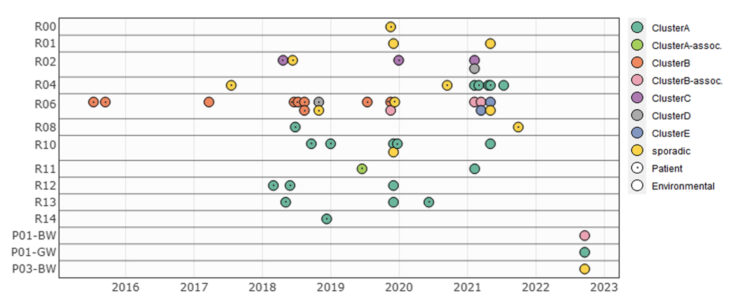
BW=eau brune, GW=eau grise, P=groupe de conduites d’eaux usées (P01 collecte les chambres R01 à R09 ; P03 collecte les chambres R10 à R16), R=numéro de chambre du patient. Les isolats bactériens sont colorés en fonction du cluster qui leur a été attribué, les isolats de patients sont indiqués par un point à l’intérieur.
Références :
1.Hamerlinck, H., et al., Sanitary installations and wastewater plumbing as reservoir for the long-term circulation and transmission of carbapenemase producing Citrobacter freundii clones in a hospital setting. Antimicrob Resist Infect Control, 2023. 12(1): p. 58.
2.Tacconelli, E., et al., Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. The Lancet Infectious Diseases, 2018. 18(3): p. 318-327.
3.Kizny Gordon, A.E., et al., The Hospital Water Environment as a Reservoir for Carbapenem-Resistant Organisms Causing Hospital-Acquired Infections-A Systematic Review of the Literature. Clin Infect Dis, 2017. 64 (10) : p. 1435-1444.
4.Tischendorf, J., R.A. de Avila, and N. Safdar, Risk of infection following colonization with carbapenem-resistant Enterobactericeae: A systematic review. Am J Infect Control, 2016. 44 (5) : p. 539-43.
5.Lipsky, B.A.H.I., E. W. ; Smith, A. A. ; Plorde, J. J., Citrobacter Infections in Humans: Experience at the Seattle Veterans Administration Medical Center and a Review of Literature. Reviews of Infectious Diseases, 1980. 2(5).
6.Yao, Y., et al., Carbapenem-Resistant Citrobacter spp. as an Emerging Concern in the Hospital-Setting: Results From a Genome-Based Regional Surveillance Study. Front Cell Infect Microbiol, 2021. 11 : p. 744431.
7.Jolivet, S., et al., Outbreak of OXA-48-producing Enterobacterales in a haematological ward associated with an uncommon environmental reservoir, France, 2016 to 2019. Euro Surveill, 2021. 26(21).
8. Smismans, A., et al., New environmental reservoir of CPE in hospitals. The Lancet Infectious Diseases, 2019. 19(6): p. 580-581.
9.Heireman, L., et al., Toilet drain water as a potential source of hospital room-to-room transmission of carbapenemase-producing Klebsiella pneumoniae. J Hosp Infect, 2020. 106(2): p. 232-239.
10.Park, S.C., et al., Risk Factors Associated with Carbapenemase-Producing Enterobacterales (CPE) Positivity in the Hospital Wastewater Environment. Appl Environ Microbiol, 2020. 86 (24).
11.Knowlton, S.D., et al., Bioaerosol concentrations generated from toilet flushing in a hospital-based patient care setting. Antimicrob Resist Infect Control, 2018. 7: p. 16.
12.Arena, F., et al., Droplets generated from toilets during urination as a possible vehicle of carbapenem-resistant Klebsiella pneumoniae. Antimicrob Resist Infect Control, 2021. 10(1): p. 149.13.Neidhofer, C., et al., Hospital sanitary facilities on wards with high antibiotic exposure play an important role in maintaining a reservoir of resistant pathogens, even over many years. Antimicrob Resist Infect Control, 2023. 12(1): p. 33.
14.Kotay, S., et al., Spread from the Sink to the Patient: In Situ Study Using Green Fluorescent Protein (GFP)-Expressing Escherichia coli To Model Bacterial Dispersion from Hand-Washing Sink-Trap Reservoirs. Appl Environ Microbiol, 2017. 83 (8).
15.Shaw, E., et al., Control of endemic multidrug-resistant Gram-negative bacteria after removal of sinks and implementing a new water-safe policy in an intensive care unit. J Hosp Infect, 2018. 98(3): p. 275-281.
16. Jamal, A.J., et al., Standard versus combined chemical, mechanical, and heat decontamination of hospital drains harboring carbapenemase-producing organisms (CPOs): A randomized controlled trial. Infect Control Hosp Epidemiol, 2021. 42(10): p. 1275-1278.
9.sciensano.be [Internet]. [cited 2023 Dec 11]. Surveillance-sentinelle des syndromes grippaux (y compris COVID-19) dans les maisons de repos (et de soins) belges. Available from: https://www.sciensano.be/fr/projets/surveillance-sentinelle-des-syndromes-grippaux-y-compris-covid-19-dans-les-maisons-de-repos-et-de
10. Janssens R, Hanoteaux S, Maloux H, Klamer S, Laisnez V, Verhaegen B, et al. SARS-CoV-2 Surveillance in Belgian Wastewaters. Viruses. 2022 Sep 2;14(9):1950.
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)


