Caractéristiques et évolution clinique de 29 infections à Enterobactéries productrices de carbapénemase type OXA-48-like dans un hôpital périphérique belge.
Introduction
Les infections à Enterobactéries productrices de carbapénemases (CPE) sont en augmentation partout dans le monde et ce depuis plusieurs années (1). La première étude de surveillance européenne réalisée en 2013-2014 (étude EuSCAPE) pour les souches cliniques hospitalières de Klebsiella pneumoniae et Escherichia coli CPE a montré une incidence de 1.3 patients/10 000 admissions, soit 2.5 patients/100 000 journées d’hospitalisation (1). L’incidence maximale a éte retrouvée dans les pays méditerranéens et dans la région des Balkans.
Dans cette étude, les carbapénemases prédominantes pour les souches de Klebsiella pneumoniae étaient de type KPC (45%), suivie d’OXA- 48-like (37%). Pour E. coli, OXA-48-like était prédominante (56%), suivie de NDM (26%).
L’incidence retrouvée Belgique dans EuSCAPE pour Klebsiella pneumoniae et E. coli CPE était de 0 .124/10 000 admissions en 2013 et de 0.223 /10 000 admissions en 2014 (2).
Pour Klebsiella pneumoniae, OXA-48-like représentait 37% des carbapnenémases et 31% pour E. Coli (1).
De 2012 à 2015, l’incidence des CPE dans les échantillons cliniques des hôpitaux belges est passée de 0.25% à 0.55% (3). Cette augmentation d’incidence des CPE est préoccupante car ces infections sont associées à une mortalité élevée. Un nombre restreint d’antibiotiques est actifs sur ces bactéries (4-10). Le traitement optimal de ces infections est toujours débattu, vu le peu d’études randomisées ayant pu être réalisées (7-10). Dans notre hôpital, pour la période de janvier 2016 à octobre 2017, 29 infections à CPE ont été enregistrées. Toutes étaient de type OXA-48- like. Les dossiers des patients ont été revus pour mieux caractériser ces infections dans le but d’en améliorer la prise en charge.
Méthodologie :
1. Récolte des données cliniques :
Les dossiers des patients ayant présenté une infection à CPE au CHU Tivoli pour la période janvier 2016- octobre 2017 ont été revus. Le CHU Tivoli est un hôpital périphérique de 518 lits, avec un nombre d’admissions annuel de 20 984 patients en 2016 et 17 745 (janvier à octobre 2017) pour 138.550 journées d’hospitalisations en 2016 et 115 131 (janvier-octobre 2017). Le type d’infection a été répertorié en fonction du diagnostic du clinicien au moment de la prise en charge du patient et des résultats microbiologiques disponibles. Un score de gravité pour ces infections n’a pas pu être réalisé rétrospectivement. Les caractéristiques cliniques des patients ont été récoltées (données démographiques, unité d’hospitalisation au moment de l’infection et facteurs de co-morbidités). La mortalité associée à ces infections a été enregistrée au quatorzième jour. Les patients ont été classés en «survivants» et «non survivants», dans le but de dégager un éventuel profil associé à un échec clinique au traitement de ces infection CPE OXA-48-like.
2. Détermination microbiologique de la résistance au carbapénem :
La production de carbapénemase était suspectée par méthode de disque diffusion selon les critères EUCAST 2016 (11). La détermination de la production de l’enzyme OXA-48-like était déterminée par méthode immunochromatographique (OXA-48 K-Set, Coris BioConcept®, Belgium). La détermination des concentration minimales inhibitrices (CMI) pour le meropenem était déterminée par la méthode E-test (Biomérieux®). La CMI pour la colistine était déterminée par la méthode E-test (Liofilchem®) pour 24 des infections et par méthode de microdilution pour les 5 autres (Liofilchem® SensiTest Colistin). Les souches n’ont pas systématiquement été envoyées au laboratoire de référence des Bacilles Gram Négatifs (BGN). Les valeurs des CMI pour le meropenem ont été classées en 7 catégories, réparties entre des valeurs < 1 μg/ml à ≥ 32 μg/ml.
3. Récolte des données relatives au traitement antibiotique reçu :
Les traitements administrés ont été catégorisés en monothérapie, bithérapie, trithérapie et absence de traitement. Les antibiotiques suivants ont été utilisés : meropenem, colistiméthate sodique (colistine), tigecycline, trimethoprim/sulfamethoxazole, amikacine et nitrofurantoine. Les doses de charge et d’entretien, ainsi que le mode d’administration des molécules ont été récoltées. Pour le colistiméthate, une dose de charge de 9 millions d’unités internationales était administrée indépendamment de la fonction rénale. La dose unitaire de meropenem était de 1g pour les CMI < 2 μg/ml et de 2g pour les CMI ≥ 2 <16 μg/ml. Le meropenem était perfusé en 3h.
Résultats :
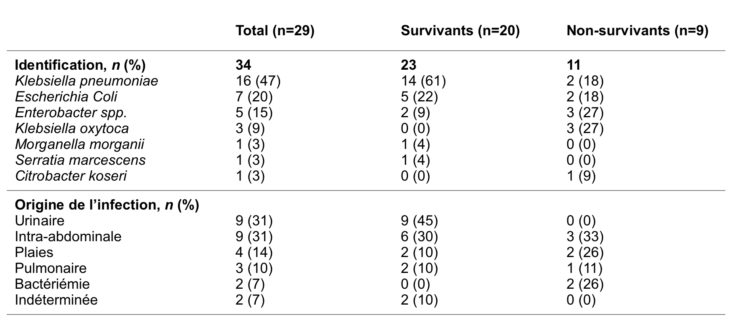
Parmi les 29 infections à CPE, 34 Enterobactéries ont été isolées, plusieurs infections étaient polymicrobiennes. Le type de carbapnénemase identifié pour ces 34 souches était de type OXA-48-like.
Vingt patients (69%) étaient en vie au quatorzième jour de l’infection (« survivants ») et neuf (31%) étaient décédés (« non-survivants ») (tableau 1). Parmi les 29 infections, Klebsiella pneumoniae représentait 47% des souches, suivi par E. Coli (20%). Klebsiella oxytoca et les Enterobacters spp prédominaient à 27% dans le groupe « non-survivants ». L’origine de l’infection était urinaire dans 31% des cas, intra-abdominale dans 31%, due à des plaies dans 14%, respiratoire dans 10% et 7% étaient des bactériémies. L’origine de l’infection était indéterminée dans 7% des cas. Cette répartition était différente dans les groupes « survivants » et « non-survivants».
Dans le premier groupe, la majorité des infections étaient urinaires (45%), comparativement au groupe des « non-survivants, où les infections intra-abdominales prédominaient (33%), suivie des bactériémies (26%) et des plaies (26%).
Tableau 1 : Identifications et origine des 29 infections
à CPE OXA-48-like (n=29) :
 L’âge médian des patients était de 74 ans, avec une prédominance de femmes (55%) (tableau 2). Les patients étaient majoritairement hospitalisés dans les unités de médecine (48%) et aux Soins Intensifs (31%). Dans le groupe des « non-survivants», 78% des patients séjournaient aux Soins Intensifs. Le nombre de co-morbidités, en particulier la présence d’un diabète (44%), d’une insuffisance rénale (44%), d’une cirrhose hépatique (33%), d’ un traitement immunosuppresseur et d’une chirurgie récente (dans les 3 mois qui précèdent) étaient plus nombreux dans les groupe « non-survivants » (tableau 2).
L’âge médian des patients était de 74 ans, avec une prédominance de femmes (55%) (tableau 2). Les patients étaient majoritairement hospitalisés dans les unités de médecine (48%) et aux Soins Intensifs (31%). Dans le groupe des « non-survivants», 78% des patients séjournaient aux Soins Intensifs. Le nombre de co-morbidités, en particulier la présence d’un diabète (44%), d’une insuffisance rénale (44%), d’une cirrhose hépatique (33%), d’ un traitement immunosuppresseur et d’une chirurgie récente (dans les 3 mois qui précèdent) étaient plus nombreux dans les groupe « non-survivants » (tableau 2).
Tableau 2 : Caractéristiques des patients (n=29) :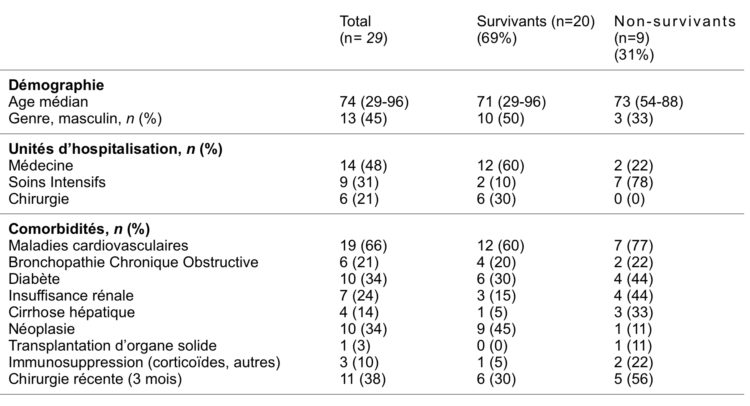
Concernant les CMI au meropenem, elles ont été déterminées sur 29 des 34 souches cliniques (tableau 3). Pour les 5 autres, la CMI a été déterminée sur des frottis de dépistage réalisés antérieurement. La majorité des souches (13/29) avaient une CMI < 1 mg/ml. Pour 9 souches, les CMI étaient très élevées (≥32 mg/ml), sans confirmation de ces valeurs par le laboratoire de référence. Ces CMI élevées étaient prédominantes dans le groupe des patients « non-survivants » (36%).
Tableau 3 : Distribution des CMI du meropenem pour les souches CPE OXA-48-like 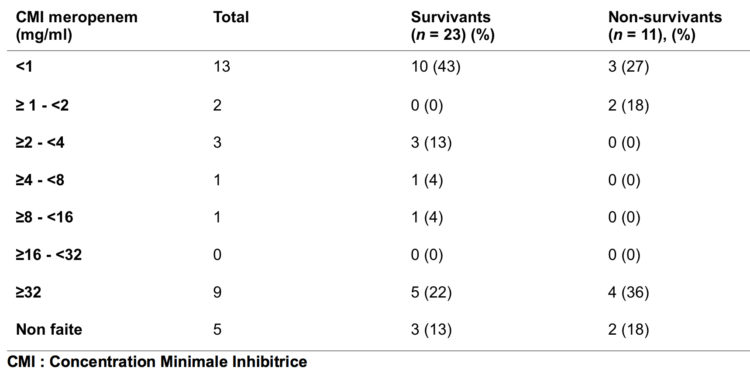
Le traitement antibiotique administré a été déterminé par l’infectiologue, en collaboration avec le clinicien, et était fonction de l’état clinique du patient. Cinquante-neuf pourcent des patients ont reçu une monothérapie, 31% une bithérapie (majoritairment combiné a du meropenem ou de la colistine) et 7% une trithérapie. Un patient n’a pas été traité car il était en Soins Palliatifs. Le choix d’une monothérapie, bithérapie ou trithérapie était déterminé par la gravité de l’infection et de l’antibiogramme de la CPE. Les bithérapies sont prédominantes dans le groupe « non-survivants (56%) vu l’état clinique plus sévère de ces patients. Les trithérapies ont peu été prescrites, et n’étaient pas toujours possible vu la résistance des CPE aux différents antibiotiques testés disponibles en 2016-2017 en Belgique (tableau 4).
Tableau 4 : traitements antibiotiques administrés 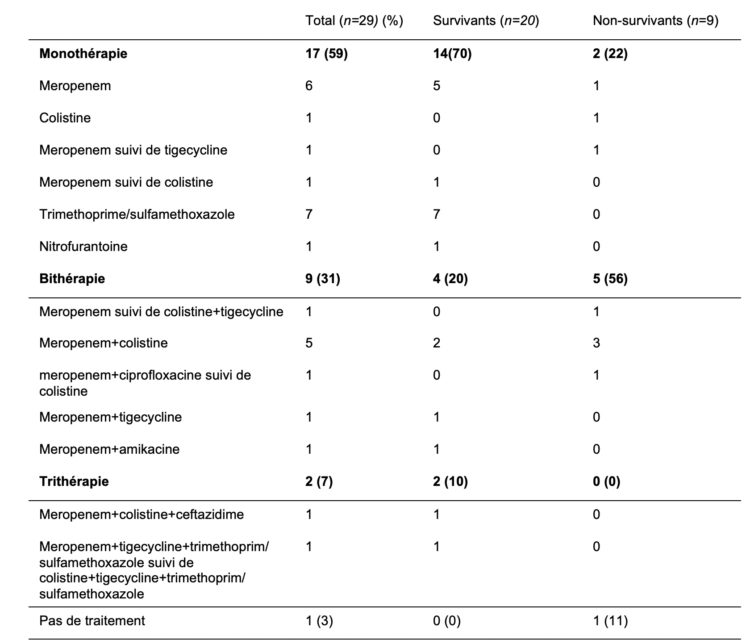
Discussion
Le traitement des infections à CPE constitue un challenge pour le clinicien. Peu d’antibiotiques sont actifs sur les CPE. Une importante mortalité (entre 39 et 71%) est associée aux infections sévères, en particulier aux bactériémies (4-10). Les drogues de derniers recours sont le plus souvent la colistine, la tigecycline, la fosfomycine (non disponible en Belgique) et les aminoglycosides.
Les données disponibles pour le traitement de ces infections, avant la publication de l’étude multicentrique AIDA (9) étaient issues d’études rétrospectives (4-7). Il était suggéré que les thérapies combinées étaient supérieures aux monothérapies. Ces études ont été réalisées majoritairement pour les Klebsiella pneumoniae productrices de carbapénemase KPC (5, 6).
Les bithérapies peuvent en outre engendrer le développement de bacteries résistantes au carbapénem et la survenue d’infection à Clostridium difficile (9).
Dans ce contexte, l’étude randomisée contrôlée AIDA a comparé le traitement « colistine seule » versus « colistine plus carbapenem » pour les infections sévères à bacilles gram négatif résistants au carbapénem. Les résultats de cette étude ont montré que la bithérapie n’était pas supérieure à la monothérapie « colistine seule » dans le groupe Acinetobacter baumannii. Des conclusions concernant les Enterobactéries n’ont pu être tirées, vu le manque de puissance de l’étude pour ce groupe. Il est à noter que les CMI meropenem étaient majoritairement supérieures à 8 mg/l dans cette étude.
La méta-analyse réalisée par Vardakas et al (10) comparant les « traitements combinés colistine « versus « colistine seule » a conclu que le traitement combiné ne diminue pas la mortalité des infections sévères à BGN résistants au carbapénem. Il pourrait peut-être y avoir un bénéfice quand la colistine est administrée à haute dose (>6 millions unités internationales/jour) chez les patients avec une bactériémie en Asie ou une infection à Acinetobacter baumannii.
Toutes ces études ne permettent donc pas d’établir le meilleur traitement pour les infections sévères à CPE.
Dans notre revue de 29 cas d’infections CPE OXA-48-like, de gravité différentes, les bithérapies ont été majoritairement prescrites pour les cas sévères. Dans la majorité des cas, vu les CMI meropenem <16mg/ml, le meropenem a pu être prescrit. La colistine était utilisée avec une dose de charge de 9 millions unités internationales, indépendamment de la fonction rénale, et suivie d’une dose d’entretien adaptée à la clearance de créatinine. Il n’y a pas eu de Therapeutic Drug Monitoring (TDM).
Les infections urinaires non compliquées ont pu être traitées par du trimethoprime/sulfamethoxazole ou nitrofurantoine, avec une bonne évolution clinique.
Les trithérapies ont uniquement été prescrites dans les cas très sévères, quand l’antibiogramme permettait la combinaison de 3 molécules.
La mortalité associée à ces 29 infections OXA-48-like est élevée, puisque de 31% des patients sont décédés. La majorité d’entre eux présentaient plusieurs facteurs de comorbidités.
Conclusions
A ce jour il n’y a pas de recommandations claires pour le traitement des infections sévères à CPE. Il n’est pas encore formellement établi dans des études randomisées que les thérapies combinées soient supérieures aux monothérapies.
D’autres études seront nécessaires pour clarifier cette prise en charge, et idéalement en fonction du type de carbapénemase impliquée.
De nouvelles molécules sont attendues prochainement sur le marché (ceftazidime+avibactam, meropenem-vaborbactam), ce qui permettra d’élargir le choix des molécules utilisables pour traiter ces infections, de nouveau en fonction du type de carbapénémase impliquée, en espérant que cela puisse en améliorer le pronostic.
Références :
1. Grundmann H, Glasner C, Albiger B, et al. Occurrence of carbapenemase-producing Klebsiella pneumoniae and Escherichia coli in the European survey of carbapenemase-producing Enterobacteriaceae (EuSCAPE): a prospective, multinational study. Lancet Infect Dis. 2017 Feb;17(2):153-163.
2. De Laveleye M, Huang TD, Bogaerts P, et al. Increasing incidence of carbapenemase-producing Escherichia coli and Klebsiella pneumoniae in Belgian hospitals. Eur J Clin Microbiol Infect Dis. 2017 Jan;36(1):139-146.
3. Huang TD, Bogaerts P, Berhin C, Hoebeke M, Bauraing C, Glupczynski Y; a multicentre study group. Increasing proportion of carbapenemase-producing Enterobacteriaceae and emergence of a MCR-1 producer through a multicentric study among hospital-based and private laboratories in Belgium from September to November 2015. Euro Surveill. 2017 May 11;22(19).
4. Balkan II, Aygün G, Aydın S, Mutcalı SI, et al. Blood stream infections due to OXA-48-like carbapenemase-producing Enterobacteriaceae: treatment and survival. Int J Infect Dis. 2014 Sep;26:51-6.
5. Daikos GL, Tsaousi S, Tzouvelekis LS, et al. Carbapenemase-producing Klebsiella pneumoniae bloodstream infections: lowering mortality by antibiotic combination schemes and the role of carbapenems. Antimicrob Agents Chemother. 2014;58(4):2322-8.
6. Tumbarello M, Viale P, Viscoli C, et al.Predictors of mortality in bloodstream infections caused by Klebsiella pneumoniaecarbapenemase-producing K. pneumoniae: importance of combination therapy. Clin Infect Dis. 2012 Oct;55(7):943-50.
7. Gutiérrez-Gutiérrez B, Salamanca E, de Cueto M, Hsueh PR, et al. Effect of appropriate combination therapy on mortality of patients with bloodstream infections due to carbapenemase-producing Enterobacteriaceae (INCREMENT): a retrospective cohort study. Lancet Infect Dis. 2017 Jul;17(7):726-734.
8. Pletz MW, Hagel S, Forstner C. Who benefits from antimicrobial combination therapy? Lancet Infect Dis. 2017 Jul;17(7):677-678.
9. Paul M, Daikos GL, Durante-Mangoni E, Yahav D, Carmeli Y, et al. Colistin alone versus colistin plus meropenem for treatment of severe infections caused by carbapenem-resistant Gram-negative bacteria: an open-label, randomised controlled trial. Lancet Infect Dis. 2018 Apr;18(4):391-400.
10. Vardakas KZ, Mavroudis AD, Georgiou M, Falagas ME. Intravenous colistin combination antimicrobial treatment vs. monotherapy: a systematic review and meta-analysis. Int J Antimicrob Agents. 2018 Apr;51(4):535-547
11. EUCAST. Breakpoints table for interpretation of MICs and zone diameter 2016. www/eucast.org
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)