Prévalence et facteurs de risque de portage de MRSA à l’admission dans une unité d’hospitalisation gériatrique
D’après un article publié dans The Journal of Hospital Infection : « Prevalence and factors associated with methicillin-resistant Staphylococcus aureus (MRSA) colonisation on admission to geriatric care units: impact on screening practices » A. Bruyneel, I. Miesse, D. Mathieu, C. Djuidjé Yuemo, A. Simon
Introduction
Bien que Sciensano indique que sa prévalence diminue ces dernières années (Latour, Goossens, Hallin, & Huang, 2020), le Staphylocoque doré résistant à la méticilline (MRSA) reste responsable de nombreuses infections associées à des taux de morbidité et mortalité élevés (Dantes et al., 2013; Li et al., 2021). Ces infections peuvent entrainer une augmentation de la durée de séjour, de la fréquence des réadmissions et impliquer des traitements particuliers qui accroissent les coûts pour la sécurité sociale et les hôpitaux (Andreassen et al., 2017; European Centre for Disease Prevention and Control (ECDC), 2009; Nelson et al., 2022). Dans nos régions, de nombreuses personnes sont porteuses asymptomatiques de MRSA. On estime que 9 à 33% d’entre elles déclareront un jour une infection à MRSA (Popovich et al., 2023).
Dans la population gériatrique, les acquisitions de MRSA et les bactériémies à MRSA sont plus fréquentes que dans la population générale. Les taux de mortalité suite à une bactériémie à MRSA sont également plus élevés chez les patients âgés (Cuervo et al., 2016). Cette population, avec ses caractéristiques propres, nécessite donc une attention particulière en ce qui concerne le MRSA. Toutefois, il n’existe actuellement pas de consensus concernant le dépistage de MRSA dans la population gériatrique.
Récemment, une étude réalisée en Allemagne et publiée dans Nature (Raschpichler et al., 2020) a permis, sur base d’un dépistage systématique des patients admis aux urgences pour le MRSA, de mettre en évidence 3 critères : le patient a déjà été porteur de MRSA, le patient nécessite des soins chroniques et le patient est en cours de traitement oncologique. Le dépistage des patients pour le MRSA suivant ces critères réduit le nombre de patients dépistés à 25% des admissions tout en conservant de bonnes sensibilité et spécificité. Cependant, l’étude ayant été réalisée sur les patients admis aux urgences, ses résultats ne sont pas applicables tel quels aux unités de soins gériatriques.
Par conséquent, les objectifs de la présente étude sont de déterminer la prévalence de MRSA à l’admission dans les unités d’hospitalisation gériatrique et d’identifier les facteurs de risque de portage de MRSA dans ce contexte. Suivant ces résultats, un modèle de dépistage selon les critères issus des facteurs de risque sera testé.
Méthodes
Il s’agit d’une étude cas-témoin (1 : 1) réalisée au sein des unités d’hospitalisation gériatrique de six sites hospitaliers du réseau Helora. Ces sites ont été sélectionnés car les patients y étaient systématiquement dépistés pour le MRSA lors de leur admission en gériatrie via un frottis poolé (nez-gorge-périnée) et des frottis au niveau des plaies et appareillages le cas échéant. De plus, les prélèvements réalisés dans le cadre du dépistage de MRSA sont analysés de la même manière sur tous les sites hospitaliers inclus. L’étude rétrospective a été réalisée sur la base de dossiers des patients admis dans ces unités entre le 1er janvier 2021 et le 31 décembre 2022.
Un cas se définit par un patient admis dans une des unités de gériatrie incluses qui a été dépisté pour le MRSA dans les 48 heures suivant son admission et pour qui le dépistage s’est révélé positif. Un témoin se définit par un patient admis dans une des unités de gériatrie incluses au cours de la même année que le cas auquel il est apparié qui a été dépisté pour le MRSA dans les 48 heures suivant son admission et pour qui le dépistage s’est révélé négatif.
Les données des patients inclus ont été collectées sur la base de leur dossier informatisé. Il s‘agit du site de portage de MRSA pour les cas et, pour les cas ainsi que les témoins, il s’agit des facteurs de risque de portage de MRSA décrits dans la littérature scientifique (Jans et al., 2013; Latour et al., 2019; Raschpichler et al., 2020; Roth et al., 2016). Ces données ont été analysées d’abord par des méthodes univariées puis, via une méthode d’analyse multivariée, toujours avec un risque d’erreur de 5%.
Résultats
La figure 1 décrit la prévalence annuelle de MRSA à l’admission par 100 patients admis en unité d’hospitalisation gériatrique avec un intervalle de confiance à 95% par site hospitalier.
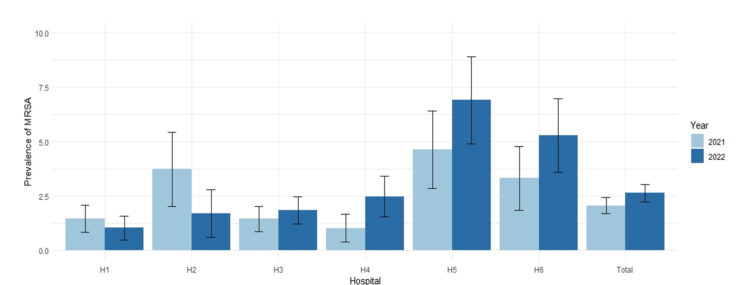
Les prévalences de MRSA sont fort hétérogènes que ce soit entre les sites hospitaliers mais aussi d’une année à l’autre. On observe toutefois des prévalences comparables pour les sites hospitaliers d’un même bassin de soins (H1 et H3).
La figure 2 représente les sites de portage de MRSA des cas (nez-gorge-périnée ou site clinique)
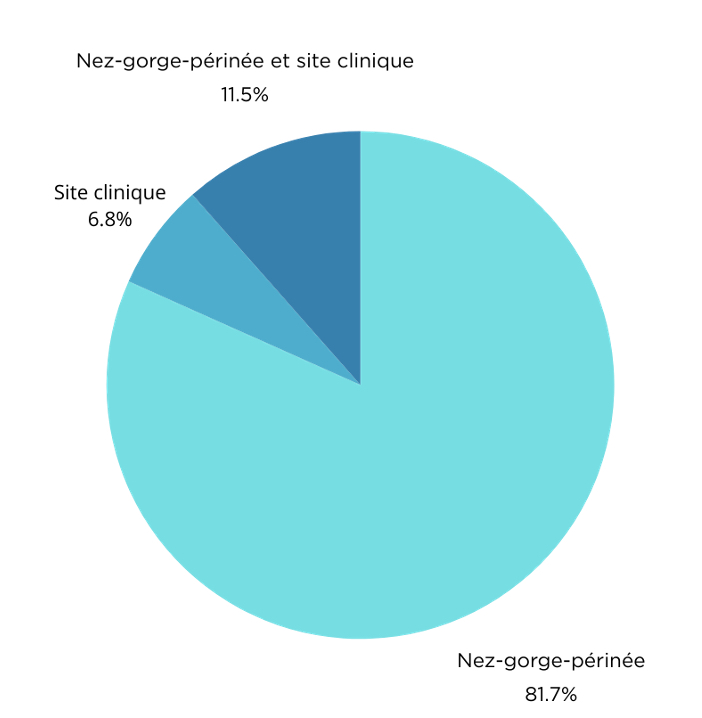
Dans la majorité des cas, le portage de MRSA se situe au niveau du nez, de la gorge et/ou du périnée. On retrouve plus rarement un portage simultané au niveau d’un site clinique (plaie, urines, appareillage) et du nez, de la gorge et/ou du périnée. Enfin, les sites cliniques colonisés ou infectés par le MRSA associés à un dépistage négatif au niveau du nez, de la gorge et du périnée sont très rares.
Tableau 1 : La description sociodémographique de l’échantillon au moment de son admission en fonction des différents groupes.
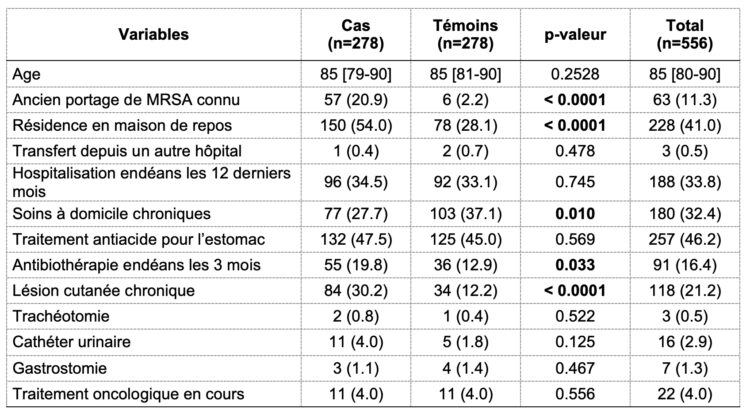
Légende : fréquence absolue (fréquence relative) ; médiane [p25-p75].
Selon les résultats de la méthode d’analyse univariée, il existe une différence significative entre les cas et les témoins pour les variables suivantes : ancien portage connu de MRSA, résidence en maison de repos (ou maison de repos et de soins), soins à domicile chroniques (plus fréquents chez les témoins), traitement antibiotique reçu endéans les 3 mois et lésion cutanée chronique. Ces variables ont, ensuite, été intégrées dans un modèle d’analyse multivariée dont les rapports de cote ajustés et p-valeur sont présentés dans le tableau 2.
Tableau 2 Variables intégrées dans un modèle d’analyse multivariée avec rapports de cote et p-valeur
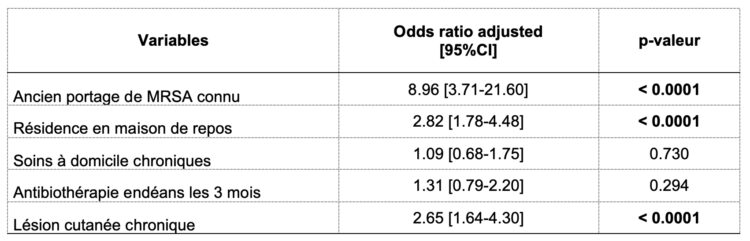
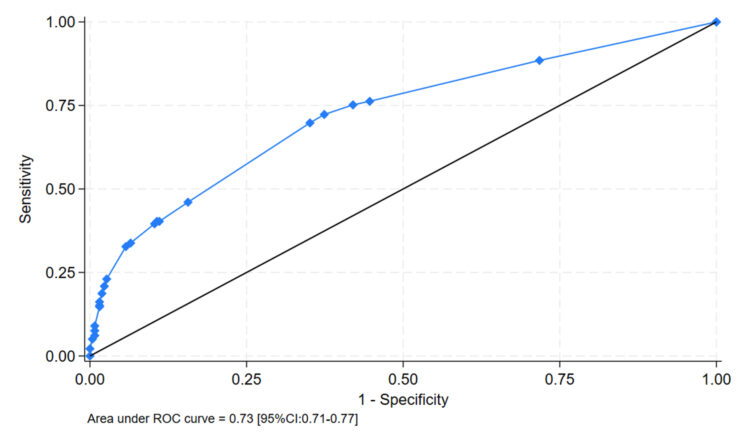
Cette analyse indique que les facteurs de risque de portage de MRSA à l’admission dans une unité d’hospitalisation gériatrique sont l’ancien portage de MRSA, la résidence en maison de repos et la présence de lésions cutanées chroniques. En appliquant un modèle de dépistage de MRSA sur base de la présence d’un de ces trois critères à notre échantillon, l’aire sous la courbe ROC (figure 3) est de 73% tandis que la sensibilité et la spécificité du modèle s’élèvent respectivement à 72.3% (IC95% : 69.8-75.7%) et 62.6% (IC95% :
58.2-66.4%). L’utilisation de ces critères de dépistage à la place du dépistage systématique permettrait de ne dépister que 55% des patients admis.
Figure 3 AUROC, area under the receiver operating characteristic
Discussion
Cette étude porte sur la prévalence et les facteurs de risque de portage de MRSA à l’admission dans une unité de gériatrie. Les résultats de celle-ci permettent de faire différents constats.
D’abord, la prévalence du portage de MRSA à l’admission dans les unités étudiées peut être considérée comme faible en comparaison avec les résultats de différentes études antérieures sur le sujet que ce soit par rapport à des unités de gériatrie (Dulon et al., 2011; Nitti et al., 2023; Sax et al., 2005) ou, plus généralement, à des unités aiguës (Dulon et al., 2011; Marzec and Bessesen, 2016; Roth et al., 2016). En outre, l’hétérogénéité de cette prévalence entre les différents sites hospitaliers peut certainement trouver, en partie, une explication par la provenance de nombreux cas issus de 2 maisons de repos. Celles-ci ont été identifiées et leurs responsables ainsi que les autorités régionales ont été informés de la possible prévalence importante de portage de MRSA chez leurs résidents.
Ensuite, les facteurs de risque de portage de MRSA mis en évidence dans cette étude (ancien portage de MRSA, résidence en maison de repos et présence de plaie chronique) ont déjà été évoqués par les auteurs d’autres études sur le sujet (Harbarth et al., 2006, 2008; Raschpichler et al., 2020; Tacconelli et al., 2009). D’un autre côté, certains facteurs de risque de portage de MRSA évoqués dans la littérature scientifique ne peuvent être considérés comme des facteurs de risque dans cette étude. Néanmoins, les articles présentant des facteurs de risques absents des résultats de la présente étude ne ciblent pas les spécificités de la population gériatrique ou ont été réalisées à une époque où la prévalence de MRSA était beaucoup plus élevée qu’à l’heure actuelle (Sax et al., 2005).
En outre, l’évaluation de tous les avantages et inconvénients de l’application d’un modèle de dépistage basé sur les critères proposés ici est importante. En effet, l’application d’un tel modèle permet, par rapport à un dépistage systématique des patients admis, une diminution des coûts liés au dépistage, une diminution de la charge de travail pour le personnel soignant et une augmentation du confort pour les patients. De plus, un dépistage ciblé du MRSA semble obtenir un meilleur rapport coût-efficacité que le dépistage systématique(Dymond et al., 2020; Joubert et al., 2022; Raschpichler et al., 2020). Une étude canadienne a démontré que, si le dépistage systématique permet d’identifier trois fois plus de patients porteurs de MRSA, celui-ci ne permettait pas de réduire les acquisitions nosocomiales de MRSA (Roth et al., 2016). Toutefois, il convient de rester attentif à une potentielle augmentation de la colonisation des patients par le MRSA qui pourrait engendrer des effets négatifs sur les patients. L’application du modèle de dépistage en gériatrie selon les 3 critères mis en avant ne devrait cependant pas causer de grande augmentation de la transmission de MRSA au sein des hôpitaux car l’un des critères de dépistage est la présence de plaie cutanée. Or, plusieurs études ont démontré que les plus grands disséminateurs de MRSA étaient les patients qui étaient porteurs de ce germe au niveau de leurs plaies (Campbell et al., 2004; Peters et al., 2017). Avec le modèle proposé, ces disséminateurs devraient être identifiés et des mesures pourraient être prises pour limiter le risque de contamination d’autres patients.
Enfin, les recommandations en faveur d’un dépistage systématique de tous les patients à l’admission ne concernent que les hôpitaux avec une prévalence de MRSA à l’admission élevée ou les cas sporadiques d’augmentation brutale d’incidence de MRSA.
Limites
Cette étude présente plusieurs limites. Premièrement, aucune pondération menant à un score de dépistage n’a été accordée aux facteurs de risque en fonction de leur importance. Cependant, l’identification d’un facteur de risque conduisant à un dépistage est plus facile à utiliser que le calcul d’un score sur base de facteurs de risque menant à un dépistage. Deuxièmement, la taille de l’échantillon peut paraitre restreinte par rapport à celles d’autres études sur le sujet. Toutefois, cette étude est multicentrique et inclus les données de deux années. Troisièmement, les facteurs analysés ont été sélectionnés sur la base de la littérature traitant des facteurs de risque de portage de MRSA mais d’autres facteurs auraient pu être inclus au modèle multivarié. Quatrièmement, il s’agit d’une étude observationnelle qui peut entrainer des biais de sélection et d’observation. De plus, les données ont été récoltées à partir des dossiers des patients, certaines données peuvant donc être manquantes. Enfin, le taux de patients testés pour le MRSA à leur admission n’a pu être récolté ce qui peut être considéré ….comme un biais potentiel de sélection.
Conclusions
La prévalence de portage de MRSA à l’admission en hospitalisation gériatrique était faible dans cette étude. Cependant, des différences significatives de prévalence ont été observées entre les hôpitaux inclus. Trois facteurs de risque de portage de MRSA ont été identifiés : ancien portage de MRSA connu, présence de lésion cutanée chronique et résidence en maison de repos. L’utilisation de ces facteurs de risque en tant que critères de dépistage au sein des unités d’hospitalisation gériatrique permettrait de réduire de manière significative le nombre de patients dépistés pour le MRSA tout en conservant des sensibilité et spécificité acceptables.
Références
1. Andreassen AES, Jacobsen CM, De Blasio B, et al. (2017) The impact of methicillin-resistant S. aureus on length of stay, readmissions and costs: a register based case-control study of patients hospitalized in Norway. Antimicrobial Resistance & Infection Control 6(1): 74. DOI: 10.1186/s13756-017-0232-x.
2. Barlow G, Duffy S, Monnet D, et al. (2017) Economic Evaluations of Interventions to Prevent Healthcare-Associated Infections Literature Review. Stockholm: ECDC.
3. Campbell KM, Vaughn AF, Russell KL, et al. (2004) Risk factors for community-associated methicillin-resistant Staphylococcus aureus infections in an outbreak of disease among military trainees in San Diego, California, in 2002. Journal of Clinical Microbiology 42(9): 4050–4053. DOI: 10.1128/JCM.42.9.4050-4053.2004.
4. Carrington AM, Manuel DG, Fieguth PW, et al. (2023) Deep ROC Analysis and AUC as Balanced Average Accuracy, for Improved Classifier Selection, Audit and Explanation. IEEE Transactions on Pattern Analysis and Machine Intelligence 45(1): 329–341. DOI: 10.1109/TPAMI.2022.3145392.
5. Chrétien L, Massicotte Josée and Pilon PA (2006) Mesures de prévention et de contrôle des infections à Staphylococcus aureus résistant à la méthicilline (SARM) au Québec: guide de prévention et de contrôle à l’intention des établissements de soins. 2e éd., version intérimaire. Montréal: L’Institut : AMMIQ.
6. Cuervo G, Gasch O, Shaw E, et al. (2016) Clinical characteristics, treatment and outcomes of MRSA bacteraemia in the elderly. Journal of Infection 72(3): 309–316. DOI: 10.1016/j.jinf.2015.12.009.
7. Cuschieri S (2019) The STROBE guidelines. Saudi Journal of Anaesthesia 13(Suppl 1): S31–S34. DOI: 10.4103/sja.SJA_543_18.
8. Dantes R, Mu Y, Belflower R, et al. (2013) National burden of invasive methicillin-resistant Staphylococcus aureus infections, United States, 2011. JAMA internal medicine 173(21): 1970–1978. DOI: 10.1001/jamainternmed.2013.10423.
9. Denis O, Jans B, Deplano A, et al. (2009) Epidemiology of methicillin-resistant Staphylococcus aureus (MRSA) among residents of nursing homes in Belgium. Journal of Antimicrobial Chemotherapy 64(6): 1299–1306. DOI: 10.1093/jac/dkp345.
10. Dulon M, Haamann F, Peters C, et al. (2011) MRSA prevalence in european healthcare settings: a review. BMC Infectious Diseases 11(1): 138. DOI: 10.1186/1471-2334-11-138.
11. Dymond A, Davies H, Mealing S, et al. (2020) Genomic Surveillance of Methicillin-resistant Staphylococcus aureus: A Mathematical Early Modeling Study of Cost-effectiveness. Clinical Infectious Diseases 70(8): 1613–1619. DOI: 10.1093/cid/ciz480.
12. Elias J, Heuschmann PU, Schmitt C, et al. (2013) Prevalence dependent calibration of a predictive model for nasal carriage of methicillin-resistant Staphylococcus aureus. BMC infectious diseases 13: 111. DOI: 10.1186/1471-2334-13-111.
13. European Centre for Disease Prevention and Control (ECDC) (ed.) (2009) The Bacterial Challenge, Time to React: A Call to Narrow the Gap between Multidrug-Resistant Bacteria in the EU and the Development of New Antibacterial Agents. ECDC/ EMEA joint technical report. Stockholm: ECDC. DOI: 10.2900/2518.
14. Harbarth S, Sax H, Fankhauser-Rodriguez C, et al. (2006) Evaluating the probability of previously unknown carriage of MRSA at hospital admission. The American Journal of Medicine 119(3): 275.e15–23. DOI: 10.1016/j.amjmed.2005.04.042.
15. Harbarth S, Sax H, Uckay I, et al. (2008) A predictive model for identifying surgical patients at risk of methicillin-resistant Staphylococcus aureus carriage on admission. Journal of the American College of Surgeons 207(5): 683–689. DOI: 10.1016/j.jamcollsurg.2008.05.023.
16. High Council for Health (2019) Recommendations for the prevention, control and management of patients carrying multidrug-resistant bacteria in healthcare settings (MDRO). Available at: https://www.health.belgium.be/sites/default/files/uploads/fields/fpshealth_theme_file/20200910_css-9277_mdro_update_vweb.pdf (accessed 8 August 2023).
17. Huang SS, Singh R, McKinnell JA, et al. (2019) Decolonization to Reduce Postdischarge Infection Risk among MRSA Carriers. New England Journal of Medicine 380(7): 638–650. DOI: 10.1056/NEJMoa1716771.
18. Jans B, Schoevaerdts D, Huang T-D, et al. (2013) Epidemiology of Multidrug-Resistant Microorganisms among Nursing Home Residents in Belgium. PLoS ONE Kluytmans J (ed.) 8(5): e64908. DOI: 10.1371/journal.pone.0064908.
19. Joubert D, Cullati S, Briot P, et al. (2022) How to improve hospital admission screening for patients at risk of multidrug-resistant organism carriage: a before-and-after interventional study and cost-effectiveness analysis. BMJ Open Quality 11(2): e001699. DOI: 10.1136/bmjoq-2021-001699.
20. Latour K, Huang T-D, Jans B, et al. (2019) Prevalence of multidrug-resistant organisms in nursing homes in Belgium in 2015. PLOS ONE Kluytmans J (ed.) 14(3): e0214327. DOI: 10.1371/journal.pone.0214327.
21. Latour K, Denis O, Goossens H, et al. (2022) Epidemiology and public health – Healthcare-associated infections and antimicrobial resistance. ISSN: 2593-7073. Sciensano. Available at: https://www.sciensano.be/fr/biblio/surveillance-antimicrobial-resistant-bacteria-belgian-hospitals-report-2019-2020 (accessed 30 August 2023).
22. Latour K, Catry B, Devleesschauwer B, et al. (2022) Healthcare-associated infections and antimicrobial use in Belgian nursing homes: results of three point prevalence surveys between 2010 and 2016. Archives of Public Health = Archives Belges De Sante Publique 80(1): 58. DOI: 10.1186/s13690-022-00818-1.
23. Li Z, Zhuang H, Wang G, et al. (2021) Prevalence, predictors, and mortality of bloodstream infections due to methicillin-resistant Staphylococcus aureus in patients with malignancy: systemic review and meta-analysis. BMC infectious diseases 21(1): 74. DOI: 10.1186/s12879-021-05763-y.
24. Marzec NS and Bessesen MT (2016) Risk and outcomes of methicillin-resistant Staphylococcus aureus (MRSA) bacteremia among patients admitted with and without MRSA nares colonization. American Journal of Infection Control 44(4): 405–408. DOI: 10.1016/j.ajic.2015.11.006.
25. Nelson RE, Hyun D, Jezek A, et al. (2022) Mortality, Length of Stay, and Healthcare Costs Associated With Multidrug-Resistant Bacterial Infections Among Elderly Hospitalized Patients in the United States. Clinical Infectious Diseases 74(6): 1070–1080. DOI: 10.1093/cid/ciab696.
26. Nitti MT, Sleghel F, Kaczor M, et al. (2023) Colonization of Residents and Staff of an Italian Long-Term Care Facility and an Adjacent Acute Care Hospital Geriatrics Unit by Multidrug-Resistant Bacteria. Microbial Drug Resistance: mdr.2023.0019. DOI: 10.1089/mdr.2023.0019.
27. Peters C, Dulon M, Kleinmüller O, et al. (2017) MRSA Prevalence and Risk Factors among Health Personnel and Residents in Nursing Homes in Hamburg, Germany – A Cross-Sectional Study. PloS One 12(1): e0169425. DOI: 10.1371/journal.pone.0169425.
28. Popovich KJ, Aureden K, Ham DC, et al. (2023) SHEA/IDSA/APIC Practice Recommendation: Strategies to prevent methicillin-resistant Staphylococcus aureus transmission and infection in acute-care hospitals: 2022 Update. Infection Control & Hospital Epidemiology 44(7): 1039–1067. DOI: 10.1017/ice.2023.102.
29. Raschpichler G, Raupach-Rosin H, Akmatov MK, et al. (2020) Development and external validation of a clinical prediction model for MRSA carriage at hospital admission in Southeast Lower Saxony, Germany. Scientific Reports 10(1): 17998. DOI: 10.1038/s41598-020-75094-6.
30. Roth VR, Longpre T, Coyle D, et al. (2016) Cost Analysis of Universal Screening vs. Risk Factor-Based Screening for Methicillin-Resistant Staphylococcus aureus (MRSA). PLOS ONE Schildgen O (ed.) 11(7): e0159667. DOI: 10.1371/journal.pone.0159667.
31. Sasahara T, Ae R, Yoshimura A, et al. (2020) Association between length of residence and prevalence of MRSA colonization among residents in geriatric long-term care facilities. BMC Geriatrics 20(1): 481. DOI: 10.1186/s12877-020-01885-1.
32. Sax H, Harbarth S, Gavazzi G, et al. (2005) Prevalence and prediction of previously unknown MRSA carriage on admission to a geriatric hospital. Age and Ageing 34(5): 456–462. DOI: 10.1093/ageing/afi135.
33. Schubert M, Clarke SP, Aiken LH, et al. (2012) Associations between rationing of nursing care and inpatient mortality in Swiss hospitals. International Journal for Quality in Health Care 24(3): 230–238. DOI: 10.1093/intqhc/mzs009.
34. Suetens C, Niclaes L, Jans B, et al. (2006) Methicillin-Resistant Staphylococcus aureus Colonization Is Associated with Higher Mortality in Nursing Home Residents with Impaired Cognitive Status: MRSA: HIGHER MORTALITY IN NURSING HOMES. Journal of the American Geriatrics Society 54(12): 1854–1860. DOI: 10.1111/j.1532-5415.2006.00972.x.
35. Tacconelli E, De Angelis G, de Waure C, et al. (2009) Rapid screening tests for meticillin-resistant Staphylococcus aureus at hospital admission: systematic review and meta-analysis. The Lancet. Infectious Diseases 9(9): 546–554. DOI: 10.1016/S1473-3099(09)70150-1.
36. Vincent J-L, Sakr Y, Singer M, et al. (2020) Prevalence and Outcomes of Infection Among Patients in Intensive Care Units in 2017. JAMA 323(15): 1478. DOI: 10.1001/jama.2020.2717.
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)



