Les prélèvements d’hémoculture

D’après le REMIC 1
Objectif :
Un prélèvement d’hémoculture doit être réalisé chez tout patient présentant de la fièvre surtout s’il présente des signes cliniques évocateurs d’infection.
L’objectif de ce prélèvement est de détecter la présence de bactéries ou de champignons dans le sang et d’en déterminer la sensibilité pour aider le clinicien dans le choix de l’antibiotique ou de l’antifongique. Le type de micro-organisme identifié est un élément important dans le diagnostic de l’origine du foyer infectieux: endocardite ou autre foyer profond.
Mode de prélèvement :
Seule la ponction veineuse est une technique valable pour le prélèvement d’hémoculture.
Les prélèvements par des dispositifs intra-vasculaires augmentent significativement le risque de contamination. Quand on suspecte une infection de voie centrale, on peut prélever une hémoculture par le cathéter central et une autre hémoculture par voie périphérique, pour autant que le laboratoire réalise des cultures quantitatives. La meilleure façon de faire le diagnostic d’une septicémie liée au cathéter (CRBSI) est de mettre le cathéter en culture.
Les autres facteurs de risque de contamination du prélèvement sont : le site de prélèvement mal préparé, des mains mal ou pas désinfectées, une mauvaise technique de prélèvement, les prélèvements via des dispositifs invasifs, la multiplication des prélèvements, une mauvaise asepsie des bouchons des flacons d’hémocultures, …
Dans le cadre des précautions générales, tout prélèvement sera réalisé avec des gants après désinfection des mains à la solution hydro-alcoolique.
Pour diminuer ce risque de contamination, la séquence idéale des actions :
- Se frictionner les mains à la solution hydro-alcoolique,
- Placer le garrot,
- Repérer la veine,
- Désinfecter le site de ponction avec un produit à base d’alcool: Polyvidone iodée en solution alcoolique ou Chlorhexidine alcool/ Attendre que la zone soit parfaitement sèche,
- Désinfecter les opercules des flacons avec le même type de solution,
- Se frictionner les mains à la solution hydro-alcoolique, enfiler des gants non stériles, ne plus palper la veine après cette étape,
- Prélever en contrôlant le remplissage optimal des flacons, trop de flacons sont insuffisamment remplis,
- Identifier correctement les flacons, le bon de demande en précisant le site de prélèvement et les renseignements cliniques pertinents.
Quantité de sang prélevé :
La chance de cultiver un germe est directement corrélée au volume de sang prélevé. Chez l’adulte, ce volume, par ponction veineuse, est de minimum 20 ml à distribuer dans 2 flacons d’hémoculture (aérobie et anaérobie).
Chez le jeune enfant, la concentration de germes/ml est beaucoup plus importante et de ce fait un volume plus faible peut être prélevé pour un même rendement pour autant qu’on utilise un flacon pédiatrique.
Prélèvement d’hémoculture chez l’adulte :
Chez l’adulte, le volume minimum de sang est de 20 ml. Le volume optimal est variable suivant les publications mais une étude de 2007 a déterminé la sensibilité cumulée de une, deux, trois et quatre paires d’hémocultures prélevées sur 24h. 2
Sur 629 épisodes de septicémies, 73.1% ont été détectés après 1 paire, 89.07% détectés après 2 paires, 98.2% après 3 paires et 99.8% détectés après quatre paires prélevées sur une période de 24h.
L’intervalle entre les prélèvements de flacons n’a aucune importance sur le diagnostic. Il est recommandé de les prélever le plus près possible du pic fébrile. Les flacons sont généralement prélevés en plusieurs fois (prélèvements multiples) mais une alternative est donc de les prélever tous en même temps (prélèvement unique) ce qui diminue le risque de contamination. Ces contaminations ont comme conséquences potentielles un doute sur le diagnostic, une antibiothérapie inappropriée, le retrait inutile d’un cathéter et l’augmentation de la durée de séjour et des dépenses.
Prélèvement d’hémoculture chez l’enfant: les recommandations aux Cliniques Universitaires Saint-Luc
- Chez le nouveau-né
Eviter tout prélèvement dit de routine (ex : au retrait des voies centrales si l’enfant n’est pas septique), ce qui augmente la charge de travail du laboratoire et présente le risque d’avoir une contamination. De plus cela ne comporte pas de bénéfice pour le patient.
- Volumes à prélever : se référer au tableau ci-dessous.
- Afin d’optimaliser la technique il faut être au minimum 2 personnes dont une qui tient le bébé.
- Désinfection double à la Chlorhexidine alcoolique, enfiler des gants stériles, attendre 1 minute afin que le site soit sec avant de prélever le sang.
- En néonatologie le système vacuum ne fonctionne pas car les veines collabent très vite.
La technique utilisée est celle de la ponction à l’aiguille laissant couler au goutte à goutte le sang dans une seringue dont le piston a été enlevé. La seringue est munie d’une aiguille capuchonnée. On désinfecte l’embout du flacon d’hémoculture et on laisse sécher. On perce ensuite l’embout avec l’aiguille de la seringue contenant le sang.
Cette technique n’est pas la plus rigoureuse sur le plan aseptique ni sur le plan du risque d’incident pour le personnel qui prélève mais il n’y a pas à notre connaissance de système plus pratique actuellement.
- Chez l’enfant
Eviter également les hémocultures dites de routine, celles prélevées dans un contexte d’infection virale démontrée ou suspectée 2-3 jours auparavant, celles faites en postop immédiat d’une intervention sans risque connu d’infection secondaire.
- Pour les volumes à prélever : se référer au tableau ci-dessous
- Idéalement il faut être minimum 2 personnes afin d’optimaliser l’asepsie.
- Désinfection double à la Chlorhexidine alcoolique, enfiler des gants (stériles si nourrisson de moins d’un an), attendre 1 minute afin que le site soit sec avant de prélever le sang.
- Dès que possible on peut utiliser le système vacuum connecté à l’aiguille à ailettes (à partir d’1 an). Si cette technique n’est pas faisable vu le jeune âge de l’enfant, on utilisera alors la technique néonatale (cf plus haut).
- Volume de sang idéal à prélever
Voici un tableau qui reprend les quantités idéales requises en fonction du poids ou de l’âge de l’enfant, tableau utilisé aux Cliniques universitaires Saint-Luc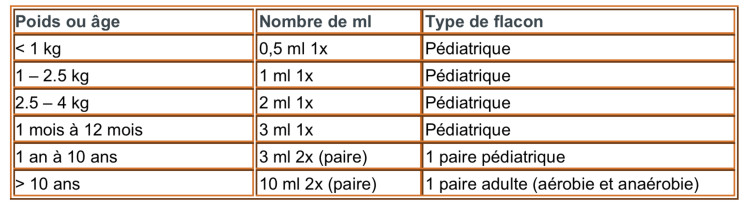
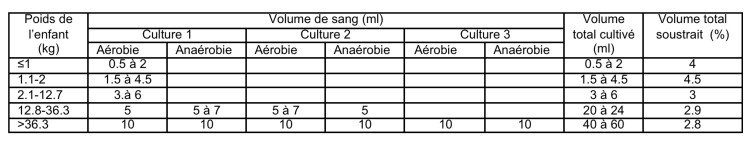
Dans la 5ème édition du référentiel en microbiologie médicale de la Société française de microbiologie (REMIC) tout récemment paru (2015) existe un tableau quelque peu différent reprenant les volumes de sang à prélever en fonction du poids de l’enfant repris ci-dessous :
Transport des flacons d’hémoculture :
Les flacons doivent être acheminés le plus rapidement possible et à température ambiante au laboratoire. En cas de délai d’acheminement au laboratoire (à éviter) les flacons sont conservés à température ambiante et surtout pas au frigo.
L’introduction différée des flacons dans l’automate n’est pas du tout recommandée car dans ce cas de figure, que ce soit avec ou sans pré-incubation, le risque de retard de croissance ou de faux négatifs est avéré.
Les flacons doivent donc être incubés le plus rapidement possible dans l’automate. Il existe d’ailleurs actuellement des automates de petite dimension pour l’incubation délocalisée des flacons garantissant le délai le plus court possible entre le prélèvement et le début de l’analyse.
Durée d’incubation des flacons :
5 à 7 jours en fonction des systèmes et en dehors de toute suspicion d’endocardite
Le cas particulier de l’endocardite :
Idéalement avant toute antibiothérapie, il est recommandé de prélever trois paires d’hémoculture dont l’incubation sera prolongée de 5 à 7 jours à 21 jours minimum.
Il n’y a pas de pic de température en général donc les prélèvements peuvent s’échelonner sur la journée en prélevant à distance des injections d’antibiotiques et si possible dans les flacons contenant des inhibiteurs. Si les trois premiers prélèvements sont négatifs, il est conseillé de prélever à nouveau deux à trois jours plus tard selon les mêmes modalités.
Références
1 REMIC Référentiel en microbiologie médicale 5ème édition 2015 (SFM, SFP, SFMM)
2 Detection of bloodstream infections in adults: how many blood cultures are needed? Lee A, Mirrett S, Reller LB, Weinstein MP. J Clin Microbiol. 2007 Nov;45(11):3546-8.
Nouveautés
Agenda scientifique
- mars 2024
-
28/03
Symposium BICS
- avril 2024
-
du 8/04 au 11/04 || à Edinburgh
The Microbiology Society Annual Conference
-
du 23/04 au 24/04 || à Birmingham
Prévention et Contrôle des infections (IPC)
-
du 27/04 au 30/04 || à Barcelone
34th European Congress of Clinical Microbiology and infectious diseases
- mai 2024
-
du 16/05 au 17/05 || à Louvain-La-Neuve
18ème Rencontre Internationale Francophone des Infirmiers et Infirmières (RIF)