Gestion d’une épidémie à Klebsiella pneumoniae productrice d’OXA-48 parmi les patients COVID-19 d’une Unité de Soins Intensifs
I – Introduction
Le 31 décembre 2019, le bureau régional de l’OMS prend connaissance de l’existence de cas de pneumonie virale d’origine inconnue, à Wuhan en République Populaire de Chine (1). L’agent infectieux, un nouveau coronavirus, est désigné d’abord 2019-nCoV puis SARS-CoV-2 (Severe Acute Respiratory Syndrome-related Coronavirus 2) par l’International Committee on Taxonomy of Viruses. Ce virus se dissémine rapidement à travers le monde ; la propagation et la gravité de la maladie dont il est responsable, la COVID-19 (Coronavirus Disease 2019), sont suffisamment alarmantes pour pousser l’OMS à déclarer la pandémie le 11 mars 2020. Alors que l’Europe est devenue l’épicentre de la pandémie (1), la Belgique débute le confinement national le 18 mars 2020. En milieu hospitalier, l’émergence du virus pandémique SARS-CoV-2 a induit non seulement le renforcement des mesures préventives pour le contrôle de la transmission (usage des précautions gouttelettes et contact) mais également la mise en oeuvre d’une série de mesures additionnelles visant notamment à protéger les soignants au contact des malades de la COVID-19. Toutefois, malgré ce renforcement des procédures de contrôle des infections, de nombreuses équipes hospitalières rapportent au niveau international, dès 2020, des expériences répétées de transmission non contrôlée de bactéries multi-résistantes (BMR) au sein des unités COVID-19 (2,3,4, 5).
Dans cet article, nous souhaitons rapporter notre expérience d’une épidémie à Entérobactéries Productrices de Carbapénèmase (CPE) de type OXA-48, survenue chez des patients COVID-19 de l’Unité de Soins Intensifs du CHR Haute Senne de Soignies. Cette épidémie détectée en octobre 2020, parallèlement à la seconde vague de COVID-19 s’est présentée sous la forme de deux éclosions de cas, distinctes dans le temps. Dans la première partie, nous décrivons pour chacune des éclosions les investigations réalisées et qui ont permis d’appréhender les modalités de transmission de cette BMR et de cibler les mesures efficaces pour contrôler l’épidémie.
Dans la seconde partie, nous passons brièvement en revue la littérature scientifique faisant état des épidémies à BMR dans les Unités de Soins Intensifs pendant la pandémie COVID-19.
II – Première éclosion
A/ Description
L’épidémie de Klebsiella pneumoniae productrice de carbapénémase de type OXA-48 est survenue dans l’unité de soins intensifs (USI) du Centre Hospitalier Régional de la Haute Senne, hôpital possédant 246 lits agrées. Le service est une unité de 10 lits dont l’activité couvre 520 admissions par an, avec une durée moyenne de séjour de 4,5 jours. Quatre des 10 chambres sont des chambres d’isolement avec SAS. A l’admission dans l’unité, tous les patients sont soumis à un dépistage systématique de MRSA par triple écouvillonnage (nez, gorge, frottis inguinal), et de BLSE, CPE et VRE par écouvillonnage rectal. Ces dépistages ne sont pas répétés pendant le séjour du patient, ni à sa sortie.
L’épidémiologie locale montre alors que 20,5% des Klebsiella pneumoniae retrouvées dans les prélèvements cliniques des patients hospitalisés au CHR Haute Senne sont non-sensibles aux céphalosporines de 3e génération, et que 8,4% d’entre elles sont non sensibles aux carbapénèmes. L’incidence des entérobactéries productrices d’OXA-48 (échantillons cliniques) est de 4,6 par 1000 admissions, et la densité d’incidence de 0,8 par 1000 jours d’hospitalisation pour l’ensemble de l’hôpital. L’incidence des entérobactéries productrices d’OXA-48 (échantillons cliniques) est de 5,8 par 1000 admissions pour l’USI. Les carbapénémases de types OXA-48 représentent alors le mécanisme exclusif des CPE relevées en 2020 au CHR Haute Senne.
Le 8 octobre 2020, alors que la deuxième vague COVID-19 est en cours, survient le premier signe d’une transmission non contrôlée de BMR à l’USI, lorsqu’un patient non-COVID-19 (patient A), présent depuis 6 jours dans l’unité, développe une bactériémie à Klebsiella pneumoniae productrice de carbapénémase OXA-48, de même profil de sensibilité aux antimicrobiens que celle qu’un autre patient non-COVID-19 (patient Index) présentait en portage rectal à son arrivée à l’USI le 20 août 2020.
Le dépistage par écouvillonnage rectal de tous les patients présents dans l’unité montre l’acquisition entérique nosocomiale de la bactérie épidémique chez un autre patient (Patient B), atteint de la COVID-19.
Le taux d’attaque dans cette première phase de l’épidémie, soit le nombre de patient colonisés/infectés (dépistage CPE+) par rapport au nombre total de patients ayant séjourné dans l’unité pendant le mois d’octobre, est de 7%.
Toutes les souches bactériennes, cliniques et environnementales, isolées par culture dans le cadre de l’épidémie ont été envoyées au Centre National de Référence (CNR) des bacilles Gram-négatifs multi-résistants, pour typage. Cependant les analyses n’ont pas pu être réalisées suite à la paralysie de l’activité du CNR par la seconde vague de COVID-19. Nous ne pouvons dès lors pas présenter les données de typage et notamment de comparaison de séquence des génomes des isolats qui auraient permis d’établir leur degré de similitude génétique.
B/ Investigation
Un audit des pratiques et applications de procédures sur le terrain permet de relever une série d’éléments en faveur d’une transmission manuportée liée à une mauvaise utilisation des équipements de protection individuelle (EPI).
Lors de la seconde vague, le personnel soignant de l’USI porte, par-dessus son uniforme de travail, une tenue complexe associant plusieurs EPI : combinaison, charlotte, masque FFP2, visière. Cette tenue est complétée d’une double paire de gants, dont seule la paire superficielle est changée entre chaque patient (Cf. Figure 1). L’investigation relève cependant l’oubli fréquent de cette étape cruciale de changement de paires superficielles de gants entre chaque patient.
Figure 1 Séquence de revêtement de la tenue Covid-19 d’un infirmier de l’USI.

L’infirmier positionne d’abord son masque FFP2, puis la charlotte et enfin la première paire de gant. Il revêt ensuite une combinaison dotée d’une capuche. La tenue est complétée d’une seconde paire de gant superficielle qui permet de sceller les manches et qui est changée entre chaque patient.
L’infirmier positionne d’abord son masque FFP2, puis la charlotte et enfin la première paire de gant. Il revêt ensuite une combinaison dotée d’une capuche. La tenue est complétée d’une seconde paire de gant superficielle qui permet de sceller les manches et qui est changée entre chaque patient.
Le mauvais usage des EPI combiné à la circulation accrue du personnel entre les chambres, et à la cohabitation dans l’unité de patients avec différents risques infectieux, COVID-19 ou non, colonisés ou non par la Klebsiella pneumoniae productrice d’OXA-48, est probablement responsable de la dissémination épidémique de la bactérie au sein de l’unité.
Une enquête visant à démontrer une contamination environnementale est réalisée en parallèle au dépistage systématique des patients. Celle-ci consiste en l’écouvillonnage des éviers (brise-jet, orifice de trop- plein et orifice d’évacuation), ainsi que des claviers d’ordinateur dans les 10 chambres de l’unité. et la mise en culture pour recherche d’entérobactéries productrice d’OXA-48. La présence de CPE ne pourra être démontrée pour aucun évier d’aucune des chambres de l’USI. Par contre, la présence de K. pneumoniae productrice de carbapénémase OXA-48 sera documentée au niveau d’un clavier d’ordinateur d’une chambre occupée par un patient porteur de cette même bactérie ; cet élément sera utilisé à titre pédagogique comme illustration de la contamination des surfaces environnementales à partir de la flore microbienne des patients.
C/ Mesures de contrôle de l’épidémie
Les mesures de contrôle de l’épidémie ont reposé essentielle-ment sur trois piliers : Le cohortage géographique des patients dans l’unité et du personnel pour les soins prodigués aux patients CPE+ et CPE-, la restauration du bon usage des EPI et le renforcement du nettoyage et de la désinfection de l’environnement.
1-Cohortage des patients avec personnel soignant dédié :
Une bâche est suspendue du plafond pour représenter la séparation de l’unité en deux sections : les porteurs de la bactérie épidémique, indépendamment de leur statut COVID-19, sont regroupés d’un même côté de l’unité. Des équipes différentes s’occupent, de jour comme de nuit, des patients porteurs de la bactérie épidémique et des patients non porteurs.
Cette mesure a impliqué la nécessité de renforcer en nombre le personnel soignant de l’USI.
2-Restauration de la bonne utilisation des EPI :
Un retour sur l’investigation de l’épidémie est réalisé par l’équipe de prévention et de contrôle des infections (PCI) auprès du personnel de soins de l’USI afin de focaliser l’attention sur le transfert par voie manuportée de la bactérie épidémique et d’exclure l’hypothèse de son origine ou de son relais à partir de sources environnementales.
Il est convenu avec l’équipe USI de standardiser l’usage de la surblouse jetable avec les gants, pour tout patient USI pendant la période d’épidémie à Klebsiella pneumoniae productrice d’OXA-48.
3-Renforcement du nettoyage et de la désinfection de l’environnement :
Le nettoyage à l’USI est renforcé pendant la période d’épidémie à Klebsiella pneumoniae productrice d’OXA-48 : deux fois par jour les points de contact sur les portes sont désinfectés, le personnel d’entretien est renforcé à l’USI pour garantir la désinfection de tous les appareils médicaux, les sanitaires et les surfaces des chambres « OXA-48 », sans que le protocole de désinfection ne soit adapté, et la remise en disponibilité de ces chambres est supervisée par l’équipe PCI.
Un dépistage deux fois par semaine des patients non colonisés par la Klebsiella pneumoniae épidémique est mis en place.
D/ Conclusion de la première éclosion
Seules deux des trois mesures proposées ont pu être mises en place en un premier temps; le cohortage des patients porteurs de la bactérie épidémique a du être reporté au vu des difficultés de recrutement de personnel supplémentaire pour renforcer l’équipe.
Le 4 novembre 2020, le dépistage bihebdomadaire révèle un nouveau cas d’acquisition de K. pneumoniae OXA-48 chez un patient COVID-19 présent depuis un mois à l’USI (patient C). A noter que trois autres nouveaux patients (D, E et F) contracteront la bactérie épidémique dans le cours du mois de novembre (Cf. figure 2).
Figure 2 : Diagramme représentant sous la forme d’une ligne du temps l’acquisition successive de la bactérie épidémique par les 7 patients (patient index inclus) impliqués dans cette éclosion.
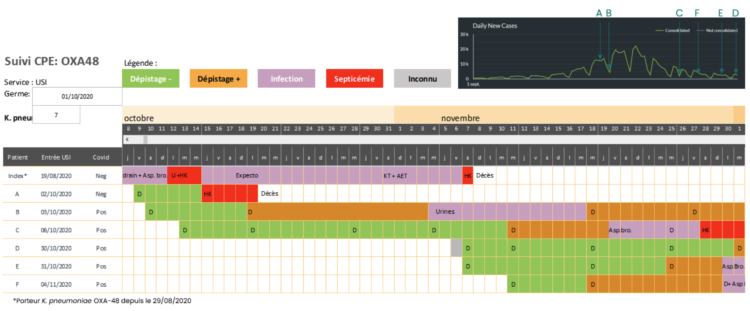
Un code couleur permet de distinguer le statut non-porteur entérique (vert), le statut porteur entérique (orange) et le statut infecté sans bactériémie (mauve) ou avec bactériémie (rouge). En haut, à droite, la représentation graphique de l’incidence des nouveaux cas COVID-19 en Belgique (6) est centrée sur la même période (entre le 1ier septembre et le 1ier décembre 2020), permettant de suivre la relation de temporalité entre l’acquisition successive de la bactérie épidémique à l’USI d’une part, et la seconde vague COVID-19 d’autre part.
Le renforcement du personnel de soins de l’USI et la mise en place du cohortage géographique des patient CPE+ avec un personnel de soins dédié, en décembre 2020, permettront de contrôler la transmission et de résoudre temporairement l’épidémie à Klebsiella pneumoniae productrice d’OXA-48.
Finalement, 7 patients (dont le patient index) ont été affectés par cette épidémie entre octobre et décembre 2020. Cinq patients sur 7 ont plus de 70 ans, 5 patients sur 7 sont COVID-19 et 6 patients sur 7 développent une infection à Klebsiella pneumoniae productrice d’OXA-48 (pneumonies (n=2), septicémies (n=3), infection du tractus urinaire (n=1)). Trois des 7 patients décèdent à l’USI : 2 sur septicémie à Klebsiella pneumoniae productrice d’OXA-48 et un patient sur pneumonie hypoxémiante à SARS-CoV-2. Cette éclosion est restée strictement cantonnée au seul USI et n’a pas présenté d’extension vers d’autres services.
III – Deuxième éclosion
A/ Description
Entre décembre 2020 et février 2021, aucun nouveau cas de colonisation ou d’infection nosocomiale à entérobactérie productrice d’OXA-48 n’a été mis en évidence à l’USI.
L’ensemble des mesures appliquées lors de l’épidémie de 2020 (renforcement des EPI, du nettoyage/désinfection de l’environnement) ont été arrêtées après le départ du dernier patient porteur. A noter cependant que la un dépistage rectal hebdomadaire des BMR a été maintenu pour les patients séjournant à l’USI. Le 25 février 2021 un patient est hospitalisé à l’USI pour détresse respiratoire sur COVID-19. Le frottis rectal à la recherche de BMR (VRE/BLSE/CPE) est négatif à l’admission. Le dépistage répété ensuite une fois par semaine restera négatif jusqu’au 1ier avril 2021, date à laquelle une Klebsiella pneumoniae productrice d’OXA-48 est détectée pour la première fois dans le frottis rectal. Or l’USI ne comprend aucun patient porteur depuis l’entrée du patient.
B/ Investigation
L’hypothèse d’une contamination à partir de l’environnement est alors envisagée et une nouvelle enquête environnementale est menée, sur la base du même protocole que celle réalisée en 2020, par l’écouvillonnage (brise-jet, orifice de trop- plein et orifice d’évacuation) des éviers de 7 des 10 chambres de l’USI. Alors que l’enquête de 2020 n’avait pas permis de mettre en évidence la présence de CPE, la présence de diverses espèces d’entérobactéries productrices d’OXA-48 (Klebsiella pneumoniae, Citrobacter freundii, Escherichia coli, Enterobacter cloacae, et Serratia marcescens) sera mise en évidence dans les prélèvements des sanitaires de 5 des 7 chambres investiguées en 2021.
C/ Mesures de contrôle de l’épidémie
Des mesures de contrôles sont immédiatement mises en place, et d’autres mesures de contrôle à long terme sont ensuite décidées.
Mesures de contrôle immédiates :
Les éviers de toutes les chambres sont condamnés et la procédure de soins corporels à l’USI est modifiée, celle-ci visant à restreindre l’utilisation du réseau de distribution local d’eau dans les chambres et à promouvoir exclusivement la toilette sèche des patients (usage de gants de toilette préimprégnés à usage unique, charlotte pour shampooing sans rinçage). Une sensibilisation du personnel de soins est réalisée quant au rôle de l’environnement inanimé, et plus particulièrement sur l’importance des biofilms, de l’eau et des installations sanitaires (lavabos, robinets, siphons) en tant que réservoir ou vecteur relais d’épidémies est donnée au personnel. La Direction est informée de la nécessité de remplacer les éviers et les siphons et de mettre en place un plan d’action à long terme de révision des points critiques de la structure et infrastructure de l’USI (Cf. ci-dessous).
Mesures de contrôle à long terme :
Le Comité d’hygiène hospitalière et la Direction de l’hôpital valident le plan de révision de l’architecture et des processus clef de l’USI, élaboré conjointement par les équipes PCI et USI :
– Il est décidé de conserver la présence d’éviers en chambre USI dans un souci du respect du cadre légal (« Il doit être possible de se laver les mains à proximité de chaque lit »1)
– Un remplacement des lavabos et des siphons des chambres est envisagé selon les critères édictés par les recommandations du Conseil Supérieur de la Santé n°8580 (vasque en porcelaine, bords périphériques arrondis et inclinés vers la cuvette, absence de trop-plein, de bouchon et d’empreinte à savon, robinet automatique avec détecteur, absence de mousseur, siphon facilement démontable)
– Un affichage sur les conditions d’utilisation autorisées de l’évier est placé en chambre en face de chaque évier (Cf. figure 3)
– Un protocole de désinfection régulier, des éviers et siphons est mis en place (eau de Javel à 2.6%, 300 ml, temps de contact 15 minutes, rinçage à l’eau froide, à chaque sortie de patient)
– Une canalisation distincte est dédiée pour l’évacuation du dialysat, dans chaque chambre
– La procédure de gestion des excrétas et liquides biologiques à l’USI est adaptée de manière à retracer les différentes filières d’élimination de déchets, l’usage du laveur-désinfecteur lors de l’usage de sanitaires mobiles et la stérilisation terminale du matériel réutilisable à la sortie du patient. Pour les patients en isolement infectieux, du matériel à usage unique et du matériel pour une toilette sèche sont recommandés.
Figure 3 : Identification des éviers en chambre

IV – Discussion
Les retours d’expérience d’épidémies de bactéries multi-résistante survenues chez des patients hospitalisés dans les unités COVID-19 pendant la pandémie sont nombreux et largement analysés dans la littérature scientifique.
De multiples causes de dysfonctionnement des mesures de prévention et de contrôle des infections sont signalées (7). Parmi celles-ci, l’équipement et les mesures COVID-19, qui protègent le soignant, pourraient lui procurer une fausse sécurité, et ce d’autant plus la complexité de l’équipement ne favorise pas la répétition des gestes de désinfection des mains ni la fréquence requise de changement de gants dans le cadre des soins prodigués dans une unité de soins. Une mauvaise utilisation des EPI est, effectivement, régulièrement mise en exergue, alors qu’en parallèle l’encadrement de l’Equipe PCI diminue sur le terrain, du fait de son importante sollicitation durant la pandémie. La pénurie de matériel, et la créativité dont ont fait preuve les équipes pour y pallier, provoquent des changements réguliers dans les procédures. Le personnel est confronté à une charge de travail extrême qui pourrait impacter sur la vigilance et la compliance aux procédures d’hygiène. De surcroît, on peut également souligner l’encadrement par un personnel de renfort peu expérimenté, ne travaillant pas habituellement à l’USI, et probablement plus susceptible de commettre des erreurs dans la pratique de procédures critiques pour la prévention des infections. Par ailleurs, le manque de personnel de soins constitue en soi une cause bien documentée de risques majorés de transmission croisée de bactéries multi-résistantes (8).
La pandémie, du fait de sa capacité à générer des situations fluctuantes et instables, a donc fragilisé l’ensemble des éléments du système de contrôle des infections des hôpitaux, et en ce qui concerne notre expérience au CHR Haute Senne nous avons pu établir des analogies avec toutes les causes de dysfonctionnement susmentionnées.
Toutefois le système de contrôle des infections n’est pas seul à être mis en cause. En effet, les patients présentant un COVID-19 sévère ont été reconnus comme étant plus à risque de développer des (co)infections bactériennes, probablement en raison de leurs multiples facteurs de comorbidité, d’une durée prolongée d’hospitalisation -particulièrement en unité de soins intensifs, et d’une dysfonction du système immunitaire associée au SARS-CoV-2 (9). Ainsi, à titre d’exemple, G Zhang et al (10) rapportent sur une cohorte de 221 patients COVID-19, un taux de co-infection bactérienne chez les patients COVID-19 sévères (USI + ventilation mécanique) de 25,5% vs 1,8% seulement chez les patients COVID-19 NON-sévères (p<0,001).
Par ailleurs, il semble évident que l’augmentation de l’usage des antibiotiques chez les patients hospitalisés en période de pandémie représente un facteur majeur de sélection de BMR dans la flore des patients (11).
L’augmentation de l’incidence de la colonisation des patients par des BMR pendant la pandémie COVID-19 pourrait être illustrée par l’étude rétrospective observationnelle menée par B Tiri et al (2). Dans l’USI de 14 lits de l’hôpital de Terni (554 lits, Umbria, Italie), l’incidence de colonisation par des entérobactéries résistantes aux carbapénèmes, et le taux d’ acquisition nosocomiale étaient significativement plus importants pendant la première vague COVID-19 (mars-avril 2020) que dans l’ère pré-COVID-19 ou dans la phase ayant suivi la première vague. Ce phénomène n’a pas été observé au CHR Haute Senne pendant la première vague, et, lors de la seconde vague, nous n’avons pas observé pour notre part d’augmentation de l’incidence de la colonisation des patients à l’entrée de l’USI. Seul a été observé un pic élévé d’acquisition nosocomiale lié à la première éclosion dont il est question dans cet article.
Finalement, V Pintado et al (12), montrent qu’entre le 1er mars et le 31 mai 2020, à l’Hôpital Universitaire Ramón y Cajal de Madrid, les infections à CPE étaient plus fréquentes chez les patients COVID-19 que chez les patients non COVID-19 (1,1% vs 0,5%, p=0,005). L’usage d’antimicrobiens (p=0.004), la ventilation mécanique (p<0,001) et l’admission à l’USI (p<0,001) étaient plus fréquents chez les patients COVID-19. Les épisodes d’infection à CPE ont été plus fréquemment diagnostiqués comme infections nosocomiales à l’USI chez les patients COVID-19 (p<.001). La fréquence du sepsis sévère, du choc septique (p=0.01) ainsi que le score SOFA (Sequential Organ Failure Assessment) (p=0,04) était plus élevé chez les cas COVID-19 que chez les témoins. Le taux de mortalité global à 30 jours des patients COVID-19 et des témoins était de 30% et 16,7%, respectivement (p = 0.25).
Dans ce dernier cas la différence est statistiquement non significative, mais il est intéressant de garder à l’esprit que la petite taille des cohortes dans cette étude (30 patients COVID-19 et 24 patients non-COVID-19) limite la puissance du test statistique.
La hausse générale de la charge de travail pour les unités de soins intensifs en période COVID peut être évaluée notamment par le Nursing Activities Score (NAS) et le calcul du ratio idéal du nombre d’infirmiers par patient COVID-19, compte tenu de l’élévation de l’activité. Les données du CHR Haute Senne sur la période s’étendant entre le 14 mars et le 30 avril 2020 confirment un NAS significativement plus élevé suggérant un ratio idéal de 0,82 infirmiers par patient COVID-19 (13). Ces données locales sont confirmées sur un échantillonnage plus grand regroupant les cinq unités USI de trois hôpitaux du Hainaut, dont le CHR Haute Senne (14). Il est donc important de ne pas négliger le rôle joué par ce facteur de charge de travail sur l’apparition de l’épidémie, alors que l’USI présentait une carence en personnel, et que le renforcement du personnel soignant dans l’Unité et le cohortage des soins se sont avérés comme des mesures efficaces dans l’éradication définitive de l’épidémie.
Ces différentes données illustrent comment la pandémie COVID-19 génère des facteurs de désorganisation du système, d’épuisement du personnel, de fragilité des patients souffrant de COVID-19, d’excès d’utilisation d’antibiotiques à large spectre, qui sont toutes autant de conditions qui contribuent à l’augmentation de l’incidence du portage, de l’acquisition nosocomiale et des taux d’infections occasionnées par diverses BMR, dont notamment les CPE.
L’expérience au CHR Haute Senne d’une épidémie à CPE en
pleine deuxième vague COVID-19 montre à quel point l’intégration de l’ensemble des éléments du système dans la gestion d’une épidémie est un élément fondamental. L’identification d’éléments critiques pour expliquer la transmission croisée, notamment le mauvais usage des équipements de protection, sous-tendu par la carence et la fatigue du personnel, a certes permis de décider des mesures les plus adéquates pour mettre fin à la première éclosion. Toutefois nos données permettent d’émettre l’hypothèse qu’un déplacement du réservoir de CPE avec contamination de réservoirs secondaires dans l’environnement ait pu se constituer silencieusement pendant cette période, (de la flore des patients vers les siphons des éviers), lié à une dérive des pratiques d’évacuation des liquides biologiques, des eaux de nettoyages, et autres déchets pour toutes les raisons de désorganisation susmentionnées. Ce phénomène pourrait avoir contribué à la seconde éclosion.
Les données ne permettent toutefois pas d’exclure la possibilité d’une persistance de patients porteurs asymptomatiques non détectés par les prélèvements (éventuellement la présence de porteurs asymptomatiques au niveau du personnel) qui aurait également pu être à la base de la résurgence de l’épidémie.
Par ailleurs l’absence de données de typage moléculaire comparant les souches cliniques des épidémies de 2020 et 2021, et les souches environnementales ne permet pas non plus d’établir formellement le lien entre la première et la seconde éclosion.
V- Conclusions
À la suite de la conjonction entre la seconde vague de COVID-19 et la présence d’un patient au long séjour porteur de bactérie multi-résistante, une épidémie de Klebsiella pneumoniae productrice de carbapénémase OXA-48 s’est produite à l’unité de soins intensifs du CHR Haute Senne de Soignies, au début du dernier trimestre 2020. Sur les sept patients testés positifs, un seul est resté asymptomatique tandis que les 6 autres ont développé une infection à Klebsiella pneumoniae OXA-48. Bien que de nombreux facteurs aient vraisemblablement participé à l’émergence de l’épidémie, le mauvais usage des gants a constitué l’élément le plus critique pour expliquer la transmission croisée. Alors que l’épidémie était maitrisée, plusieurs mois plus tard, une nouvelle acquisition nosocomiale de Klebsiella pneumoniae OXA-48, au sein de la même unité, a permis d’identifier et de planifier l’assainissement d’un réservoir d’entérobactéries productrices d’OXA-48 au niveau des éviers des chambres, bien que le rôle exact de ce réservoir dans l’émergence de la seconde éclosion reste actuellement non démontré.
VI – Bibliographie
(1) https://www.who.int/fr/news/item/29-06-2020-covidtimeline
(2) B Tiri et al, Antimicrobial Stewardship Program, COVID-19, and Infection Control: Spread of Carbapenem-Resistant Klebsiella Pneumoniae Colonization in ICU COVID-19 Patients. What Did Not Work? J Clin Med. 2020 Aug 25;9(9):2744
(3) R Amarsy et al, Outbreak of NDM-1-producing Klebsiella pneumoniae in the intensive care unit during the COVID-19 pandemic: Another nightmare, Am J Infect Control. 2021 Oct; 49(10): 1324-1326.
(4) E Farfour et al, Carbapenemase-producing Enterobacterales outbreak: Another dark side of COVID-19, Am J Infect Control. 2020 Dec; 48(12): 1533–1536.
(5) G Montrucchio et al, Carbapenem-resistant Klebsiella pneumoniae in ICU-admitted COVID-19 patients : Keep an eye on the ball, J Glob Antimicrob Resist. 2020 Dec; 23: 398-400.
(6) Belgium COVID-19 Dashboard – Sciensano > Cases : https://datastudio.google.com/embed/reporting/c14a5cfc-cab7-4812-848c-0369173148ab/page/tpRKB
(7) W Medrzycka-Dabrowska et al, Carbapenem-Resistant Klebsiella pneumoniae Infections in ICU COVID-19 Patients—A Scoping Review, J Clin Med. 2021 May; 10(10): 2067.
(8) C Legeay et al, Is cohorting the only solution to control carbapenemase-producing Enterobacteriaceae outbreaks? A single-centre experience, J Hosp Infect. 2018 Aug; 99(4): 390-395
(9) Lai CC et al. Co-infections among patients with COVID-19: the need for combination therapy with non-anti-SARS-CoV-2 agents? J Microbiol Immunol Infect 2020; 53: 505–12.
(10) Zhang G et al. Clinical features and short-term outcomes of 221 patients with COVID-19 in Wuhan, China. J Clin Virol 2020; 127: 104364.
(11) Lai CC et al, Increased antimicrobial resistance during the COVID-19 pandemic, Int J Antimicrob Agents 2021 Apr; 57(4): 106324.
(12) V Pintado et al, Carbapenemase-producing Enterobacterales infections in COVID-19 patients, Infect Dis (Lond). 2021: 1–10
(13) P Reper et al, Nursing Activities Score is increased in COVID-19 patients, Intensive Crit Care Nurs. 2020 Oct; 60: 102891
(14) A Bruyneel et al, Impact of COVID-19 on nursing time in intensive care units in Belgium, Intensive Crit Care Nurs. 2021 Feb; 62: 102967.
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)