Alerte au rotavirus en néonatologie
1. Introduction
Le rotavirus est longtemps resté la principale cause de gastroentérite virale de l’enfant de moins de 5 ans en Belgique, donnant parfois lieu à des épidémies nosocomiales. Le tableau clinique est classiquement dominé par des diarrhées aqueuses d’une durée de 3 à 7 jours, associées à un risque de déshydratation, de déséquilibre ionique et d’acidose métabolique particulièrement important chez l’enfant de moins de 2 ans. En néonatologie, la symptomatologie est plus variable et atypique (selles plutôt glaireuses et hémorragiques, ballonnement abdominal, instabilité hémodynamique, bradycardie, apnées…) et une possible association avec l’entérocolite nécrosante reste suspectée, bien que controversée.1-3 Un portage asymptomatique est également possible à tout âge.
Le virus se transmet par voie féco-orale ou via les vomissures du patient, de façon directe ou indirecte. La contagiosité est maximale en période symptomatique, mais peut persister, à moindre échelle, jusqu’à 10 jours après la fin des diarrhées. La période d’incubation est classiquement inférieure à 48h.
En 2006, la commercialisation européenne par GSK du Rotarix®, vaccin vivant atténué oral monovalent, a considérablement modifié l’épidémiologie de ce virus. Ce premier vaccin fut suivi en 2007 d’un second vaccin oral, pentavalent, le RotaTeq® (Sanofi Pasteur MSD). La Belgique, accompagnée de l’Autriche, du Luxembourg et de la Finlande, fut l’un des premiers pays d’Europe de l’Ouest à l’introduire dans son calendrier de vaccination. La première dose peut être administrée dès 6 semaines, et l’intervalle minimal entre deux doses est de 4 semaines. Le Rotarix® nécessite deux doses, contre trois pour le RotaTeq®.
L’impact de cette vaccination a récemment été évalué en se basant sur les données collectées entre 2005 et 2013 dans 11 hôpitaux belges.4 Une réduction de 70 à 80% du nombre absolu de tests diagnostiques positifs a ainsi été objectivée entre 2006 et 2012. La diminution d’incidence de cette pathologie dans la population générale permet de protéger indirectement les nourrissons de moins de 2 mois qui n’ont pas encore pu être vaccinés. Dans cette tranche d’âge, la diminution du nombre de cas depuis l’introduction de la vaccination a été estimée à 50%.
2. Point de vue du biologiste6
Le diagnostic de l’infection à rotavirus repose essentiellement sur la détection directe des constituants viraux sur un prélèvement de selles. La recherche dans d’autres prélèvements biologiques (sang, LCR) peut également se faire mais reste du domaine de la recherche.
Cette détection se fait le plus souvent à l’aide de tests immunochromatographiques utilisant des anticorps ciblant la protéine virale VP6. Cette technique simple et rapide offre des performances analytiques théoriques excellentes (sensibilité 80% et spécificité 100% par rapport à la PCR) et offre l’avantage de permettre une détection simultanée de plusieurs virus entériques (rotavirus, adénovirus, plus rarement norovirus).
Le diagnostic peut également se faire par technique immuno-enzymatique (ELISA), dont les performances sont similaires à l’immunochromatographie. Cette technique est plus adaptée aux grandes séries d’analyse qu’à la routine d’un laboratoire périphérique.
Une détection du génome viral par RT-PCR est enfin possible. Elle offre des performances supérieures aux deux autres techniques mais reste encore trop coûteuse pour être effectuée en routine.
Un résultat positif signe la présence de rotavirus dans les selles, mais n’élimine pas la possibilité d’une co-infection par un autre entéropathogène (10% des cas). En l’absence de symptomatologie digestive, un test positif signera un simple portage asymptomatique.
3. Le point de vue de l’hygièniste7
Le rotavirus, fort contagieux, est transmis par contact direct ou indirect via les selles et vomissures du patient. Il convient donc de renforcer les mesures de précautions générales et d’y ajouter les précautions additionnelles s’appliquant aux germes transmis par contact.
Ceci implique donc une hygiène des mains rigoureuse avec présence de solution hydro-alcoolique en chambre, le port de gants et d’une blouse à usage unique, un hébergement en chambre seule ou cohorté avec d’autres patients symptomatiques, un nettoyage quotidien de la chambre à l’aide d’un détergent-désinfectant type Incidin ® (désinfectant sans aldéhyde, à base de 1-propanol et 2-propanol), et la présence en chambre d’un matériel de soin dédicacé au patient (tensiomètre, pèse-personne, porte-perfusion, stéthoscope, …) qui sera convenablement lavé et désinfecté à l’Incidin ® avant sa réutilisation pour un patient tiers. Notons que le virus est également sensible à l’éthanol 95%, au formol 2%, à l’hypochlorite de sodium 2% ainsi qu’à une combinaison d’ammonium quaternaire et d’alcool, mais il nécessite toujours une exposition prolongée.
Ces mesures devront être maintenues durant toute la durée de la symptomatologie du patient soit environ 7 jours.
Au départ du patient, le personnel d’entretien devra nettoyer la chambre avec un détergent suivi d’eau de javel à 1000 ppm ou 2%.
4. Rapport de cas
L’unité de néonatologie des Cliniques universitaires Saint-Luc comprend 28 lits répartis en 5 salles, et accueille 300-350 enfants chaque année. Ce service a connu une importante épidémie à K. pneumoniae OXA-48 en septembre 2014, événement qui a fortement sensibilisé le personnel aux règles de prévention de la transmission des infections.
En février 2015, l’équipe d’hygiène hospitalière fut contactée par le service suite au retour d’un test rotavirus positif, prescrit pour bilan de fébricules. Ce cas index ne présentant pas de diarrhée, son isolement ne fut pas recommandé. Un renforcement des mesures d’hygiène des mains et le port de gants lors des manipulations fut préconisé. Les autres patients de l’unité furent tous testés négatifs.
Douze jours plus tard, l’équipe d’hygiène fut recontactée à propos d’un deuxième cas positif. Il s’agissait d’une jeune fille de 5 jours, transférée d’une autre institution dans laquelle elle avait déjà été testée positive pour le rotavirus. Son isolement fut décidé suite à la présence de symptômes digestifs, bien que frustres.
Trois jours plus tard, un troisième patient, asymptomatique et préalablement testé négatif, fut testé positif. La clinique ayant motivé la prescription de ce test ne put être clarifiée. S’agissant ici d’une acquisition documentée dans l’unité, le patient fut isolé avec précautions additionnelles de type contact (gants, blouse). Il fut alors décidé de dépister l’ensemble des patients non-documentés positifs de l’unité (15). Aucun ne présentait de symptomatologie, mais la fragilité des patients présents et la documentation de cas d’entérocolite nécrosante associée au rotavirus poussèrent l’équipe à une prise de mesure de protection maximale. Le seuil épidémique fut fixé à 2 acquisitions.
Dix selles purent être envoyées au laboratoire le jour-même, trois d’entre elles furent testées rotavirus positives. La cellule de crise fut activée, les patients positifs furent tous isolés, les enfants et le personnel infirmier furent cohortés.
Malgré ces mesures sévères, de nouveaux cas de portage asymptomatique furent mis en évidence. Certains patients positifs furent ultérieurement testés négatifs, puis à nouveau positifs quelques jours plus tard.
Suite à ce manque de reproductibilité des résultats et à la non-compréhension des causes de la progression de l’épidémie, la fiabilité du test diagnostic utilisé fut remise en question. Le laboratoire utilisait depuis plusieurs années le test immuno-enzymatique (Elisa) Premier Rotaclone® commercialisé par la firme Meridian Bioscience Inc et dont les performances analytiques rapportées tant par la firme que dans la littérature apparaissaient tout à fait satisfaisantes (Sensibilité = 81-100%, spécificité = 92-100%).8-10 Ce test est d’ailleurs utilisé par le Centre National de Référence (CNR) belge du rotavirus situé à l’UZ Leuven. Ce test était réalisé tous les jours par une équipe de technologues bien formée et expérimentée. Le kit était conservé dans un frigo dont la température est monitorée, comme recommandé dans la procédure, et la date de péremption en était vérifiée à chaque nouvelle série d’analyse. Les résultats étaient rendus par détermination visuelle comme conseillé par la firme : les puits présentant une coloration bleue plus marquée que le contrôle négatif étaient considérés positifs. Jusqu’alors aucun problème n’avait été posé sur les échantillons provenant de l’unité de néonatologie (+/- 35-40 échantillons testés par an).
Les selles positives (1/patient), conservées à 4°C, furent alors envoyées au CNR (UZ Leuven) pour recherche de rotavirus par RT-PCR. Toutes revinrent négatives. Il s’agissait donc d’une pseudo-épidémie, qui aura finalement duré près d’un mois.
5. Discussion
Le rotavirus est une étiologie bien décrite d’épidémies nosocomiales de gastroentérite. Si l’incidence de telles épidémies a nettement reculé depuis l’instauration de la vaccination, les nourrissons, non vaccinés, restent encore une population à risque. Ils constituent une population difficile à diagnostiquer ; leur symptomatologie peut être absente ou très atypique et le taux d’excrétion de particules virales dans les selles peut être nettement plus modeste que dans le reste de la population. Néanmoins, les associations décrites par certains auteurs entre le rotavirus et des affections menaçant le pronostic vital de ces nouveau-nés (entérocolites nécrosantes, bactériémies secondaires, …) rendent les pédiatres sensibles à ce pathogène.
Le test immuno-enzymatique (Elisa) Premier Rotaclone® est utilisé au laboratoire depuis plusieurs années sans qu’aucun incident n’ait été jusqu’ici à déplorer. Si la firme signale la possibilité de faux négatifs sur échantillons néonatals, le taux d’excrétion virale dans les selles des nouveau-nés pouvant être très faible, elle ne rapporte pas de faux positifs dans cette tranche d’âge. 8
En relisant la procédure à suivre, il s’est avéré que deux étapes analytiques pouvaient être améliorées :
• D’une part, il est apparu que l’équipe technique diluait trop peu les selles des patients avant analyse. Les selles étaient en effet diluées à 1/10 dans du PBS (tampon phosphate salin sans conservateur) plutôt qu’à 1/30 dans le diluant fourni par la firme (solution saline tamponnée avec 0.02% de thimérosal). Cette erreur de dilution a aujourd’hui été corrigée.
• D’autre part, les modifications de couleurs étaient lues à l’œil nu et non par un spectrophotomètre, ce qui apporte une part de subjectivité au test. Ceci était néanmoins en accord avec les recommandations de la firme, qui ne favorisait pas l’une ou l’autre alternative. La lecture des tests positifs de cette pseudo-épidémie au spectrophotomètre a rapporté des résultats douteux (Absorbance à 450 nm proche du seuil de positivité, fixé par la firme à 0.150) rapportés « positifs faibles ».
La lecture oculaire n’a depuis plus été autorisée sur les échantillons douteux ou provenant de l’unité de néonatologie.
Suite à ces changements, les selles « positives faibles » se sont fortement raréfiées sans totalement disparaître dans les jours suivant l’identification de la pseudo-épidémie. Plus aucun cas douteux ou positif faible n’a été rapporté par la suite.
Une unité de néonatologie de Taiwan a rapporté en 2014 une expérience similaire.11 En 2011, 7 jeunes patients présentant une symptomatologie abdominale furent testés positifs sur une période de 2 mois, résultats ultérieurement infirmés par RT-PCR. Le laboratoire utilisait alors un kit de détection immuno-enzymatique différent de celui utilisé aux Cliniques Universitaires Saint-Luc (RIDASCREEN Rotavirus, R-Biopharm AG, Darmstadt, Germany). L’équipe n’avait pu expliquer ces faux-positifs, mais un changement de version du kit avait permis une résolution de la situation.
D’autres faux-positifs et d’autres pseudo-épidémies de ce type ont également été décrites en néonatologie pour d’autres virus pathogènes du système digestif (tableau 1).12-16 L’histoire des pseudo-épidémies est toujours identique : un test immunoenzymatique ou immunochromatographique sur selles est prescrit pour documenter une symptomatologie atypique et revient positif. L’unité est dans un second temps dépistée, que les patients soient symptomatiques ou non. Face à l’incohérence des résultats ou de l’évolution, les selles sont envoyées pour confirmation par PCR et reviennent négatives. Les tests utilisés varient, et ne sont pas commercialisés par la même firme.
L’origine de ces faux-positifs propres aux nouveau-nés n’est pas encore élucidée. Si l’on peut raisonnablement suspecter l’existence d’interférences entre certains éléments présents dans les selles des nouveau-nés et les tests immunologiques commercialisés, le ou les facteurs à l’origine de ces interférences restent indéterminés. Ces éléments pourraient n’être présents que de façon épisodique voire épidémique, ce qui expliquerait l’existence de « clusters » de faux-positifs. Ainsi par exemple, la présence de grande quantité de protéine A de Staphylococcus aureus dans l’échantillon a été rapportée par la firme Fisher Scientific comme cause possible de faux positif sur les tests immunochromatographiques de détection d’adénovirus. Il n’est pas précisé sur quel type de prélèvement cette interférence a été observée. 17
Dans notre situation, si une partie du problème peut être attribuée à l’erreur de dilution de la selle, le fait que malgré des années d’utilisation aucun problème de ce type n’ait été déploré auparavant plaide en faveur de l’existence d’un facteur surajouté, microbiologique, médicamenteux ou autre, qui interférerait avec le test. La dilution supplémentaire de la selle entraînerait une dilution supplémentaire de ce facteur qui ne serait alors plus présent en quantité suffisante pour que l’interférence soit visible.
Tableau 1 : Caractéristiques de différentes pseudo-épidémies à virus entéropathogènes rapportées au sein de services de néonatologie.
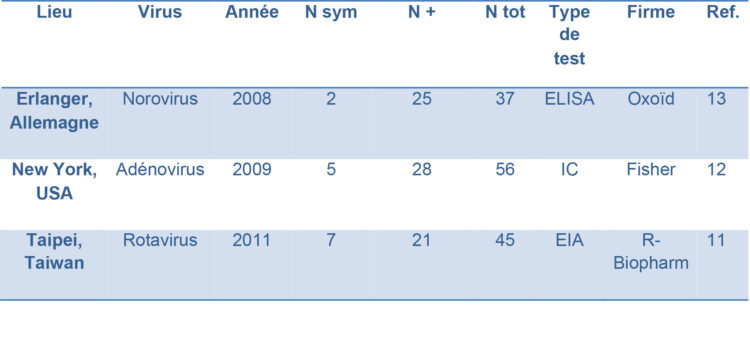
N sym = Nombre de patients présentant des symptômes digestifs, frustres ou francs.
N + = Nombre de patients testés positifs
N tot = Nombre total de patients testés.
IC = Immunochromatographie.
Une pseudo-épidémie peut être définie comme un faux cluster de vraies infections ou un vrai cluster de fausses infections. 18-19
Dans la première situation, des patients réellement infectés sont erronément reliés comme cas d’une épidémie. Ceci peut être par exemple le cas lorsqu’un laboratoire change de méthode diagnostique pour une pathologie : si le nouveau test utilisé offre une sensibilité supérieure au test précédent, une fausse augmentation de l’incidence de la pathologie peut être objectivée et erronément interprétée comme une épidémie.
Dans le deuxième cas, il s’agit d’une erreur de diagnostic touchant une population par ailleurs reliée, que ce soit par la localisation des patients, leur groupe d’âge, ou autre. Ceci peut survenir lorsqu’un test est prescrit de façon inappropriée et/ou suite à un problème au laboratoire (erreur de manipulation, contaminations, réactifs périmés,…).
Ces pseudo-épidémies sont coûteuses tant sur le plan humain que financier, particulièrement lorsqu’elles sont liées à une erreur diagnostique. Elles peuvent engendrer une charge de travail supplémentaire pour l’équipe soignante, un traitement inapproprié des patients, un stress inutile pour tous, ainsi qu’une perte de confiance dans le laboratoire quand celui-ci joue un rôle dans leur genèse.20 Leur identification est donc primordiale. Il est, pour ce faire, capital d’envisager cette possibilité face à toute situation épidémique, en particulier lorsqu’il existe des points nébuleux (résultats contradictoires, germes atypiques, discordances clinico-biologiques, …) et d’engager alors une discussion pluridisciplinaire.
6. Conclusion
Les pseudo-épidémies sont des événements indésirables coûteux, qui peuvent impacter négativement la bonne prise en charge des patients et la confiance entre les différents acteurs du secteur médical. En situation épidémique, toute incohérence devra donc faire envisager cette possibilité, qui devra faire l’objet d’une discussion entre l’équipe soignante, l’équipe d’hygiène hospitalière et le laboratoire.
Il semble exister des interférences non élucidées lorsque les tests immunochromatographiques ou immunoenzymatiques sont utilisés sur les selles de patients hospitalisés en néonatologie. Ces interférences peuvent être responsables de faux-positifs et donc de pseudo-épidémies. Afin d’éviter leur survenue, il est important de connaître les tests réalisés par le laboratoire et de veiller à ce que ceux-ci soient prescrits avec parcimonie, dans un cadre symptomatologique bien délimité.
7. Références bibliographiques
1. Haffejee IE. Neonatal rotavirus infection. Rev Infect Dis 1991 ; 13 :957-62
2. Sharma R et al. Clinical manifestations of rotavirus infection in the neonatal intensive care unit. Pediatr Infect Dis J 2002 Dec;21(12):1099-105.
3. Tai IC et al. Clinical manifestations of a cluster of rotavirus infection in young infants hospitalized in neonatal care units. J Microbiol Immunol Infect. 2012 Feb;45(1):15-21
4. Standaert B. et al Medium to long-term impact of rotavirus vaccination on hospital care in Belgium : a 7-yeat follow-up of the Rotavirus Belgium Impact Study (RotaBIS) Infect Dis Ther 2015 Dec 31 (epub)
5. Avis du Conseil Supérieur de la Santé n°9295 et 8883 :
Analyse du risque bénéfice de la vaccination contre le rotavirus en Belgique (réaction suite à une prise de position française récente). Juillet 2015.
6. REMIC Référentiel en microbiologie médicale 5ème édition 2015 (SFM, SFP, SFMM)
7. The Sanford Guide to Antimicrobial Therapy 2012-2013: 23ème edition Belgique/Luxembourg.
8. Meridian Bioscience, Inc. Premier® Rotaclone® product insert. Cincinnati, Ohia, USA. Révision: 01/2015.
9. Gautam R. et al. Comparison of Premier™ Rotaclone®, ProSpecT ™, and RIDASCREEN ® rotavirus enzyme immunoassay kits for detection of rotavirus antigen in stool specimens. J Clin Virol. 2013 Sep ; 58 (1) : 292-294
10. Evaluation of seven commercial assays for detecting group A rotavirus antigen. PHLS East Virology Advisory Committee, internal document.
11. Tan BF et al. Pseudo-outbreak of rotavirus infection in a neonatal intensive care unit. J Microbiol Immunol Infect. 2014 Nov 22.
12. Faden H et al. Pseudo-outbreak of adenovirus infection in a neonatal intensive care unit due to a false –positive antigen detection test. J Clin Microbiol. 2010 Nov;48(11):4251-2
13. Köhler H, Jüngert J and Korn K : Norovirus pseudo-outbreak in a neonatal intensive care unit. J Pediatr Gastroenterol Nutr 2008 Apr ; 46(4) :471-2
14. Terashita Gastelum D et al. Pseudo-outbreak of respiratory syncytial virus infection in a neonatal intensive care unit due to cross-reactivity of surfactant and a rapid immunoassay. Infect Control Hosp Epidemiol. 2009 Sep;30(9):890-2.
15. Rand KH, Houck HJ, Swingle HM. Rotazyme assay in neonates without diarrhea. Results of screening survey and preliminary analysis of false positive specimens. Am J Clin Pathol 1985 Dec; 84(6):748-51.
16. Niizuma T et al. False positive of an immunochromatography kit for detection of norovirus in neonatal feces. J Infect Chemother 2013 Feb ; 19(1) : 171-3.
17. Fischer Scientific Company. Sure-Vue™ Adeno Test Kit product insert. Pittsburgh, Pennsylvania, USA. Révision : 2002.
18. Curran ET. Outbreak Column 7: Pseudo-outbreaks part 1. Journal of infection prevention 2013 March ; 14(2) : 69-74
19. Curran ET. Outbreak Column 7: Pseudo-outbreaks part 2. Journal of infection prevention 2013 May ; 14(3) : 108-113
20. Shears P. Pseudo-Outbreaks. Lancet 1996 Jan ;347:138
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)