Prévention et surveillance de l’aspergillose chez des patients hématologiques à l’Universitair Ziekenhuis Antwerpen (UZA).
Introduction
Au cours de ces dernières années, l’UZA a rénové différents de ses services de soins. En 2000, ce fut au tour du service d’ hématologie. Avant la rénovation, les patients séjournaient dans un espace minuscule, protégé par du verre, dont la taille permettait juste d’accueillir un filtre à air, un lit, une table et une chaise percée. De telles chambres étaient à l’époque qualifiées à mauvais escient de « chambres stériles ». Dans d’autres hôpitaux, même des membres de la famille n’étaient pas autorisés et la communication se faisait par téléphone (1). Ces mesures ont été adoptées afin de protéger les patients fortement immunocompromis contre des infections fongiques mortelles comme l’aspergillose pulmonaire.
Les rénovations de l’UZA ont permis de mettre définitivement un terme au concept de petites chambres « stériles » dans lesquelles les patients devaient parfois séjourner pendant une longue durée. Il a en effet été opté pour l’installation de deux filtres à air (filtres HEPA, catégorie H13 avec une capacité de filtrage de > 99,95 %) dans le plafond de chaque chambre de patient. En guise de mesure complémentaire, un gradient atmosphérique a été appliqué pour éviter que des particules de poussière et micro-organismes ne pénètrent dans le service. Une légère surpression a en effet été créée dans la chambre, par rapport au couloir du service infirmier. Une même surpression est créée par rapport au couloir et au reste de l’hôpital. L’ensemble du service infirmier est fermé du reste de l’hôpital par un sas (photo 1). Grâce à ces rénovations, le nombre de chambres « stériles » a été porté de 6 à 20 (29 lits).
Photo 1 : Le sas qui sépare le service infirmier hématologie du reste de l’hôpital

Le service d’ hématologie clinique de l’UZA a obtenu en novembre 2012 pour l’ensemble de son programme de transplantation de cellules souches une accréditation JACIE (Joint Accreditation Committee of the International Society for Cellular Therapy (ISCT) et du European Group for Blood and Marrow Transplantation (EBMT)). Il s’agit d’un label de qualité important pour un programme européen de transplantation de cellules souches. Étant donné que les normes JACIE stipulent que le transport des micro-organismes par l’air doit être limité au minimum (2), la qualité de l’air est contrôlée depuis quelques années. Des mesures de particules sont dans ce cadre effectuées, et des échantillons d’air pour la culture de champignons sont prélevés. Il est également procédé à une surveillance d’Aspergillus fumigatus auprès de patients hématologiques. Les résultats sont décrits ci-après.
2. Matériel et méthodes
a) échantillonnages d’air
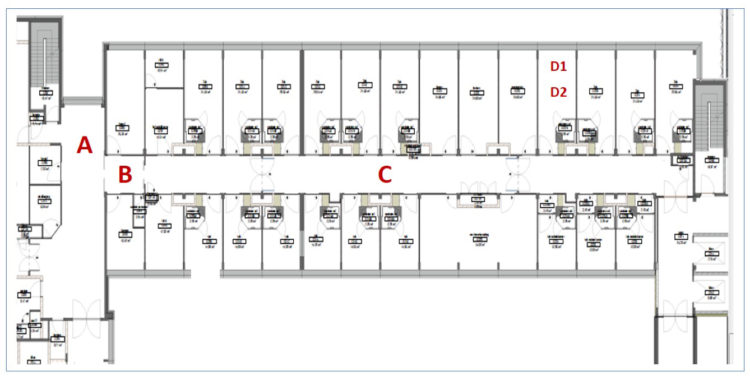
Les échantillonnages d’air sont depuis 2009 réalisés deux fois par an par l’équipe d’hygiène hospitalière (détection des champignons) ainsi que par le service technique (mesure des particules). Un échantillon est à chaque fois prélevé en 4 endroits : le couloir adjacent (A), le sas (B), le couloir du service infirmerie (C) et, enfin, une chambre de patients dont la porte est ouverte (D1) et une dont la porte est fermée (D2) (Figure 1).
Figure 1 : Lieux dans lesquels il ont été réalisés des échantillons d’air
Pour la culture de champignons, il est fait appel à des géloses de Sabouraud agar qui sont placées dans un échantillonneur d’air (MAS-100), paramétré sur 100 litres par minute pendant 2,5 min. (250 dm³). Après échantillonnage, les géloses sont cultivées pendant 1 jour dans une pièce chauffée à 37°C et ensuite conservées à température ambiante. Les colonies sont comptées pendant une semaine et le résultat final est mentionné dans un rapport. Il n’est procédé à aucune identification des champignons.
Les mesures de particules de 0,5 micron (et 0,3 micron) sont effectuées à l’aide d’un « compteur de particules laser », de type « Met One », dans lequel 1 cfm d’air/minute est analysé (1 cfm = 1,7m3). Les valeurs mesurées sont automatiquement converties par l’appareil de mesure en nombre de particules par litre (ou dm³) d’air.
b) Surveillance aspergillose
De 1994 à 2017 inclus, l’incidence d’Aspergillus fumigatus chez les patients a été calculée par 1000 journées d’hospitalisation dans le service hématologie. Pour le calcul du nombre de journées d’hospitalisation, on a tenu compte que des patients appartenant à la discipline médicale hématologie. Seules les cultures positives des échantillons d’air et des hémocultures prélevés plus de 2 jours après l’admission ont été prises en compte dans le calcul de l’incidence.
c) Nombre de patients neutropéniques
Les patients du service hématologie étaient considérés comme neutropéniques à partir de < 500 neutrophiles/µl dans une hémoculture (« absolute neutrophil count »). Cette valeur est une indication qui justifie l’installation de tels patients en isolement protecteur. Les patients y sont soignés dans une chambre privée, les visites sont limitées à deux personnes à la fois, les visiteurs et le personnel doivent porter un masque chirurgical lorsqu’ils se trouvent dans la chambre. Dans le sas, toutes les personnes (visiteurs inclus) sont en outre invitées à se désinfecter les mains avant de pénétrer dans le service (photo 2).
Photo 2 : Affiche dans le sas

Pour terminer, les fleurs et plantes en pot sont interdites dans l’ensemble du département. Il n’est cependant procédé à aucun enregistrement du nombre de patients neutropéniques. Sur la base des données d’enregistrement du nombre d’isolements protecteurs signalés par le département hématologie à l’équipe opérationnelle hygiène hospitalière, l’évolution du nombre d’épisodes d’isolement protecteur a été répertoriée depuis 1997 ; cette approche permet de refléter l’évolution du nombre de patients neutropéniques. L’évolution du nombre de transplantations de moelle et de cellules souches allogéniques et autologues a également été suivie.
3. Résultats
a) échantillonnages d’air microbiologiques
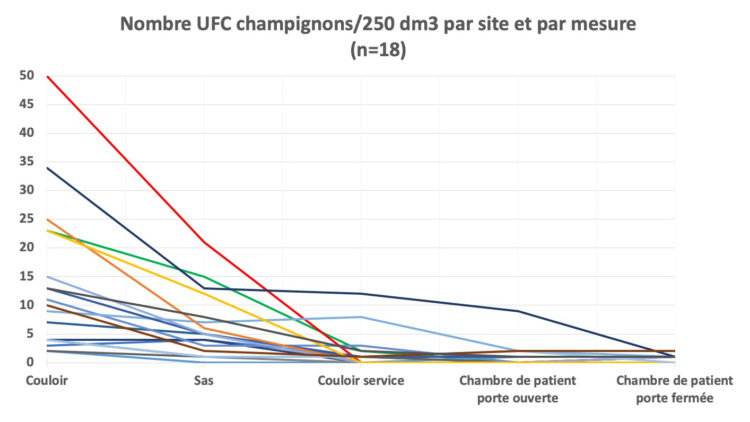
Le tableau 1 et le graphique 1 illustrent pour chaque site le nombre de champignons cultivés/250 dm3 d’air. Il s’agit des résultats de 18 mesures (90 échantillons) d’air au total.
Tableau 1 : Aperçu du nombre de champignons cultivés par site
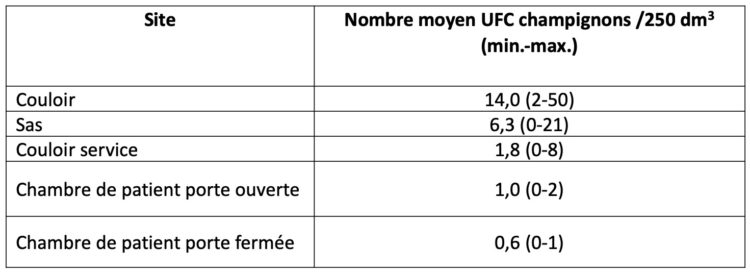
Graphique 1 : Nombre de champignons cultivés par site et par mesure
b) Mesures des particules dans l’air
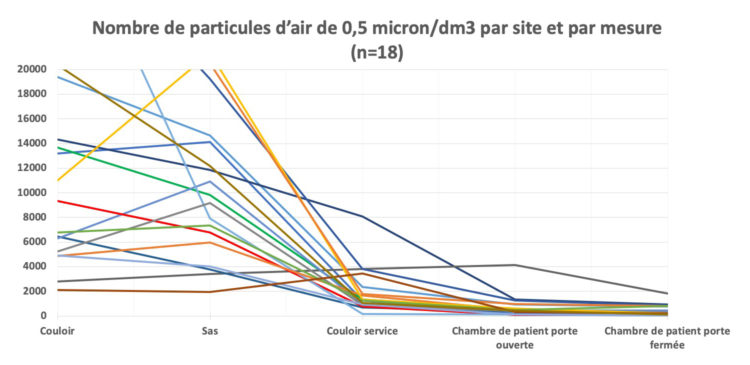
Le tableau 2 et le graphique 2 illustrent pour chaque site le nombre de particules mesurées/dm3 d’air. Il s’agit des résultats de 18 mesures (90 échantillons) d’air au total.
Tableau 2 : Aperçu du nombre de particules mesurées par site
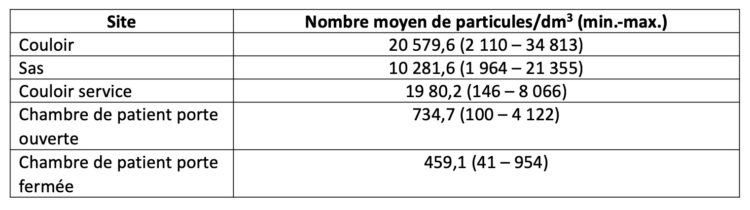
Graphique 2 : Nombre de particules d’air par site et par mesure
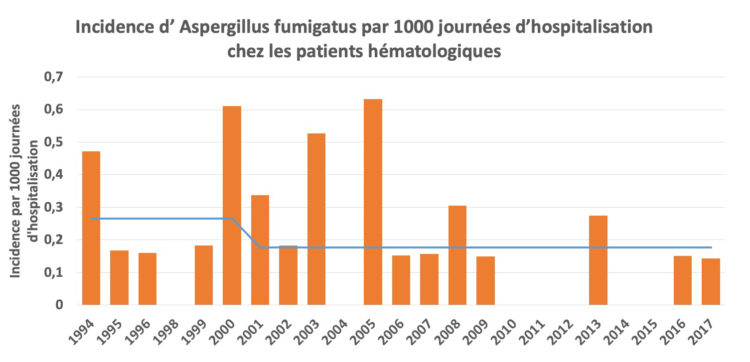
c) Incidence d’Aspergillus fumigatus
L’incidence moyenne d’Aspergillus fumigatus avant les rénovations (donc avant 2001) a été comparée à l’incidence moyenne de 2001 à 2007. Elle a diminué de 0,27 avant les rénovations à 0,18 par 1000 journées d’hospitalisation après les rénovations (graphique 3).
Graphique 3 : Incidence d’Aspergillus fumigatus chez les patients hématologiques
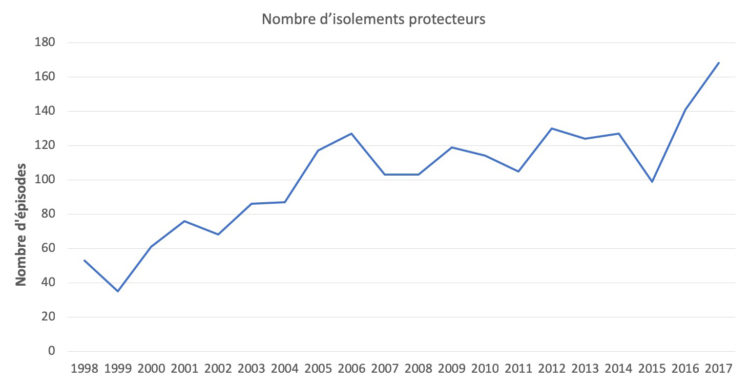
d) Nombre de patients neutropéniques
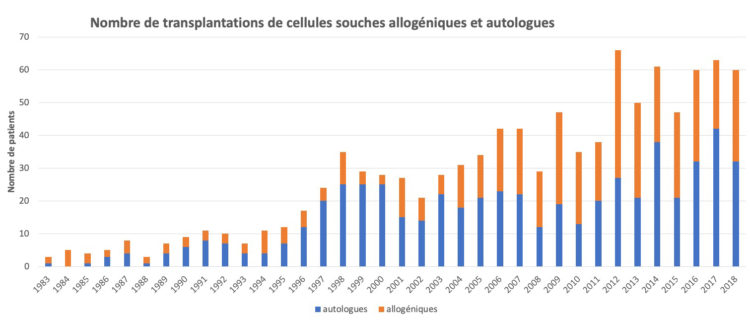
Le graphique 4 illustre l’évolution du nombre d’isolements protecteurs, pour cause de neutropénie et le graphique 5 le nombre de transplantations de cellules souches allogéniques et autologues depuis 1983.
Graphique 4 : Nombre d’isolements protecteurs (1998-2017)
Graphique 5 : Nombre de transplantations de cellules souches allogéniques et autologues (1983-2018)
4. Discussion
L’utilité d’échantillonnages routiniers d’air, comme ceux effectués depuis 2009 dans le service d’ hématologie, est remise en question. Plusieurs directives ont déjà mis l’accent sur notamment l’entretien préventif adéquat du système de traitement de l’air, l’enregistrement des différences de pression et la surveillance des chantiers de construction (3). Les normes JACIE ne font également aucune mention explicite de l’obligation d’exécution d’échantillonnages d’air.
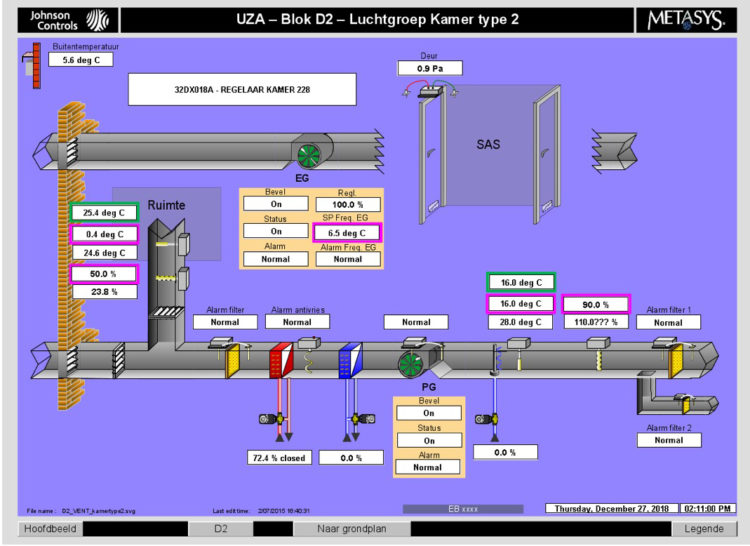
L’UZA assure une surveillance continue des groupes d’air et il est procédé à un entretien annuel des chambres des patients du service d’ hématologie, dont les résultats sont documentés dans un rapport. Un contrôle de pression continu des préfiltres et filtres HEPA dans le groupe d’air est assuré (voir figure 2). Sur la base des pressions mesurées avant et après le filtre, une alarme se déclenchera en cas de différence de pression trop élevée ; ce qui signifie que le filtre est saturé et doit donc être remplacé.
Figure 2: Contrôle de pression continue des préfiltres et filtres HEPA dans le groupe d’air
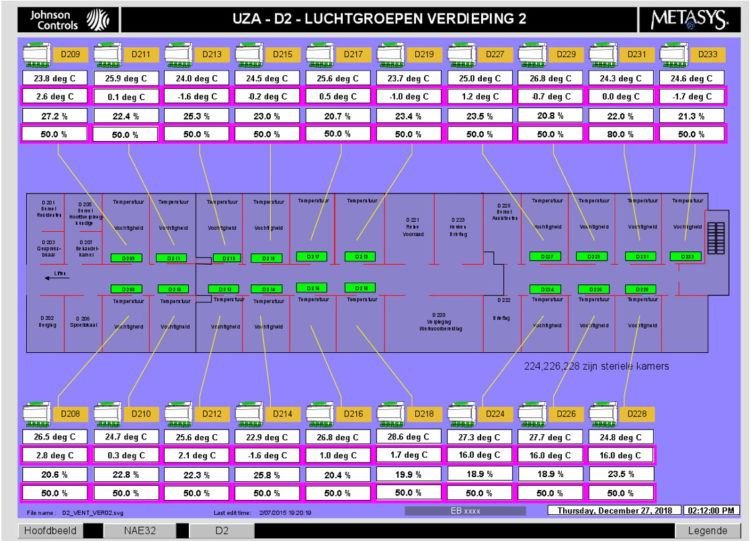
La figure 3 représente de manière schématique la position de ces alarmes dans les chambres des patients. Les barres vertes mentionnant le numéro de chambre vont automatiquement se colorer en rouge dès que les différences de pression deviennent trop importantes.
Figure 3: Représentation schématique du département dans le système de contrôle de la pression
L’entretien annuel des chambres des patients s’effectue sur la base d’une liste de vérification détaillée, incluant le contrôle des filtres HEPA et un contrôle de la surpression dans la chambre à l’aide d’un test de fumée.
Après l’application d’un gradient atmosphérique et de la filtration de l’air à l’aide de deux filtres HEPA par chambre de patient, des précautions supplémentaires sont adoptées si des travaux de rénovation sont organisés dans les unités de soins adjacentes. Il est fait appel à une matrice des risques pour définir les mesures à prendre. En cas de production de poussière trop importante, les travaux sont notamment compartimentés à l’aide de l’installation de parois de séparation et des filtres à air mobiles de type Plasmair® (4) sont placés à proximité des rénovations pour assurer un filtrage supplémentaire de l’air.
Les résultats des échantillonnages d’air démontrent que la contamination de l’air diminue à mesure que l’on pénètre dans une chambre de patient à partir du couloir extérieur. La contamination atmosphérique moyenne avec des particules de 0,5 micron dans une chambre de patient à la porte fermée est de 459 particules/litre (41-1845) ou 459.000 particules par m3, ce qui est inférieur au nombre maximal autorisé de particules (selon l’EU GMP 2008) de classe D (maximum 3.520.000) et se rapproche de la classe C (maximum 352.000) (5).
Les résultats de la surveillance de l’aspergillose démontrent que les modifications structurelles apportées au département n’ont pas eu d’influence négative sur l’incidence d’aspergillose en dépit du fait que le nombre de patients neutropéniques et/ou ayant subi une transplantation de cellules souches a augmenté au fil des ans. À l’exception des salles d’opération et « cleanrooms » (5,6), il n’existe cependant en Belgique aucune norme pour la qualité de l’air dans les hôpitaux. Les normes françaises mentionnent quant à elles explicitement que l’absence d’Aspergillus (ou d’autres champignons filamenteux) par m3 est la norme pour les chambres équipées d’un Laminair Air Flow (LAF) pour les patients souffrant d’une aplasie longue; en présence d’une ou de plusieurs espèces Aspergillus (ou d’autres champignons) par m³, une action doit être entreprise (7).
Cette étude a cependant quelques limitations. Il a été tenu compte de toutes les cultures positives d’Aspergillus fumigatus des échantillonnages d’air ; il se peut qu’il soit question d’une surestimation de l’incidence, étant donné que sur la simple base des données microbiologiques, aucune distinction n’a pu être établie entre possibles contaminations par le laboratoire, colonisations ou aspergillose pulmonaire invasive.
5. Conclusion
Cette étude prouve que les adaptations structurelles apportées au département en 2000 n’ont pas eu d’impact négatif sur l’incidence d’Aspergillus fumigatus chez les patients hématologiques, en dépit du nombre accru de patients neutropéniques depuis 2000. Les résultats des échantillonnages d’air indiquent en outre une diminution progressive de la contamination atmosphérique à mesure que l’on se déplace de l’extérieur du département vers les chambres de patients. L’utilité des échantillonnages d’air est cependant remise en question, raison pour laquelle la documentation correcte du remplacement et/ou de l’entretien des filtres HEPA peut être une alternative à la conformité aux normes JACIE.
6. Littérature
1. Meer comfort dankzij Xluchtfilter. UZA magazine. December 2000.
2. JACIE. Hematopoietic cellular therapy. Accreditation Manual. Seventh edition 7.0. March 2018.
3. Advies van de Hoge Gezondheidsraad nr. 8364. Aanbevelingen inzake bacteriologische controles van de omgeving binnen de verzorgingsinstellingen, 4 augustus 2010.
4. F. Van Laer. Luchtdecontaminatie zonder HEPA-filtratie. Noso-info, 2008; 12(2):7-10.
5. Advies van de Hoge Gezondheidsraad nr. 9453. Kwalificatie van cleanrooms en monitoring van aseptische processen binnen banken voor menselijk lichaamsmateriaal, intermediaire structuren en productie-instellingen, september 2018.
6. Advies van de Hoge Gezondheidsraad nr. 8573. Aanbevelingen voor de beheersing van de postoperatieve infecties in het operatiekwartier, mei 2013.
7. Direction Générale de la Santé. Direction de l’hospitalisation et de l’organisation des soins. Comité technique national des infections nosocomiales. Surveillance microbiologique de l’environnement dans les établissements de santé. Air, eaux et surfaces. 2002.
Nouveautés
Agenda scientifique
- janvier 2026
-
27/01
Symposium georganiseerd door de BICS, ABIHH en WIN Opleiding van zorgprofessionals in infectie-preventie en controle (IPC)
- mars 2026
-
5/03
Kennis delen samen sterker – intercollegiale uitwisseling infectiepreventie (CONTRAIN)
-
21/03
Symposium Séminaire de diagnostic des maladies infectieuses.(SSID)
-
26/03
WZC symposium – zorginfecties en antimicrobiële resistentie (SCIENSANO)
- juin 2026
-
du 3/06 au 5/06 || à Lille
36ème Congrès de la Société Française en Hygiène Hospitalière (SF2H)



