Septicémies associées aux cathéters veineux centraux dans les hôpitaux Belges : données de surveillance 2000 – 2014
1. Introduction
Les septicémies acquises à l’hôpital (HA-SEP) sont les plus sévères des infections hospitalières1-3. En Belgique, 24% des HA-SEP sont associées à l’utilisation de cathéters veineux centraux (CVC) et l’unité de soins la plus souvent impliquée est l’unité de soins intensifs (USI) (données 2014)4,5. La littérature a bien démontré un potentiel de réduction important pour les septicémies associées à un CVC (SEP-CVC). Les stratégies de prévention ciblent d’une part une diminution de l’exposition au facteur de risque (CVC) et d’autre part des pratiques adéquates au niveau de l’insertion et la maintenance du cathéter.6-9 Certaines études estiment que jusqu’à 70% des SEP-CVC pourraient être évitées avec la mise en œuvre de ces stratégies10-12.
Dans ce cadre, un programme de surveillance des septicémies à l’hôpital est essentiel et a été mis en place depuis 1992 en Belgique. Les données du programme de surveillance permettent de suivre l’évolution des SEP-CVC et d’évaluer le résultat des actions de prévention mises en place dans les hôpitaux belges.
Cet article fait la synthèse des données de surveillance relatives à l’épidémiologie des SEP-CVC en Belgique, y compris l’impact d’un changement dans la définition de cas.
2. Méthodes – Surveillance des septicémies acquises à l’hôpital en Belgique
Le programme national de surveillance des septicémies à l’hôpital (SEP) en Belgique a été institué en 1992. Le protocole de surveillance est disponible sur le site web de l’Institut Scientifique de Santé Publique (WIV-ISP)13. La surveillance a comme objectif de suivre les tendances des septicémies (tant au niveau de l’hôpital que national) afin de guider et d’évaluer les efforts de prévention. La participation est devenue obligatoire par Arrêté Royal à partir de 2014.
En bref, la surveillance des SEP comprend l’enregistrement pendant une période minimale de 3 mois par an de tous les cas de septicémies acquises à l’hôpital (HA-SEP). Les HA-SEP, par définition, sont des septicémies survenant chez un patient hospitalisé depuis au moins 2 jours et confirmées par hémocultures; au moins une hémoculture positive pour un micro-organisme pathogène reconnu, ou deux hémocultures provenant de prélèvements différents lorsque seuls des micro-organismes contaminants de la peau ont été isolés. Le clinicien doit indiquer l’origine suspectée de la septicémie parmi différentes options, dont «CVC» et «inconnue», ainsi que la confirmation éventuelle de cette suspicion (c’est-à-dire même micro-organisme retrouvé dans les hémocultures et au niveau du site d’origine suspecté; par exemple le CVC).
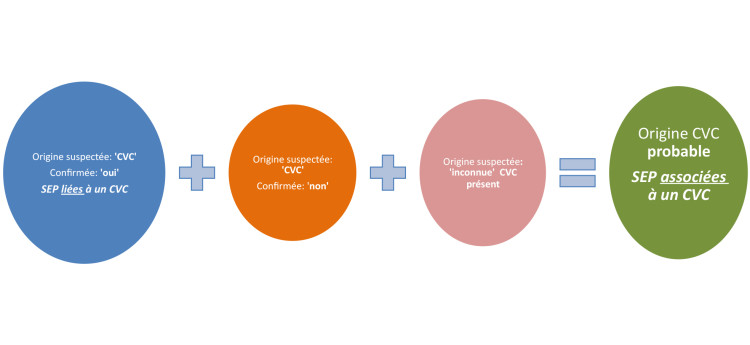
Lors de l’analyse des données, le total des septicémies dont l’origine probable est un CVC est calculé de la manière suivante : (1) HA-SEP avec CVC comme origine «suspectée» (confirmée, ou non) + (2) HA-SEP sans cause identifiée (origine inconnue) avec présence d’un CVC au moment de l’infection, ou endéans les 2 jours précédant celle-ci (Figure 1). Cette dernière catégorie a été ajoutée en 2013 afin de correspondre à la définition du CDC (Centres for disease control & prevention, USA). Ce regroupement est fait lors de l’analyse des données, et a donc pu être appliqué aux données récoltées avant ce changement de définition. En pratique, les septicémies avec «origine CVC confirmée» sont l’équivalent américain de CR-BSI (central-line related bloodstream infection) ou «septicémies liées à un CVC»; les septicémies avec «origine CVC probable» sont l’équivalent américain de CLABSI (central line-associated bloodstream infections) ou «septicémies associées à un CVC», que nous appelons ici CVC-SEP.
Figure 1: Septicémies associées aux cathéters veineux centraux, origine confirmée versus origine probable, surveillance SEP 2013
CVC; cathéter veineux central, SEP ; septicémies
Les résultats complets sont présentés dans le rapport annuel4.
3. Résultats
• Description des cas
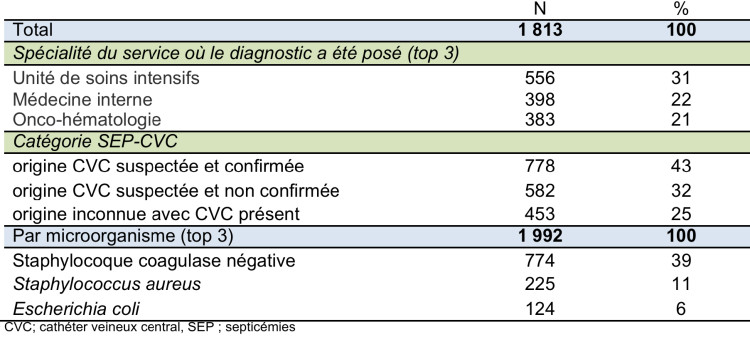
En 2014, 130 hôpitaux ont rapporté 6.847 HA-SEP; parmi lesquelles 1 813 (26%) étaient des septicémies associées à un CVC (c’est-à-dire CVC considéré comme l’origine probable de l’infection selon les définitions exposées ci-dessus). L’origine CVC était confirmée pour 43% des cas (778/1 813). Pour 25% des cas (482/1 813) le clinicien avait indiqué «origine de l’infection : inconnue» cependant un CVC était présent au moment de l’infection ou endéans les 2 jours avant le début de l’infection. Cette dernière proportion varie d’un hôpital à l’autre (médiane 19% ; P25-75 : 0-39%). Un tiers des septicémies dont l’origine probable est un CVC a été diagnostiqué dans une USI. Les microorganismes en cause sont principalement des germes Gram positifs. La médiane du délai d’acquisition (P25-P75) est de 23 jours (8-27) après l’admission à l’hôpital.
Tableau 1: Description des épisodes de septicémies associées à un cathéter veineux central, 2014
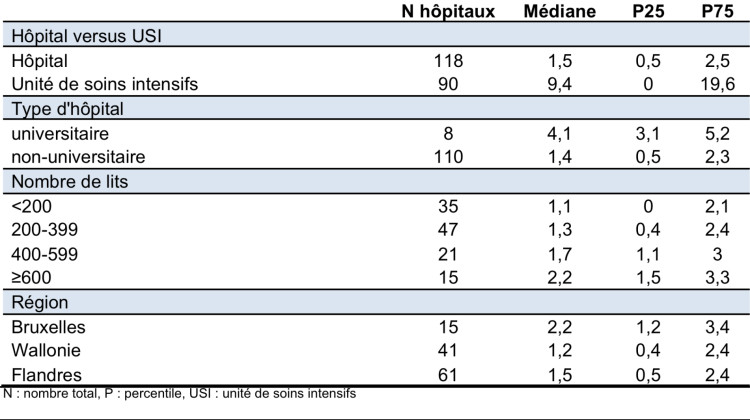
En 2014, 118/130 hôpitaux ont rapporté des données complètes (numérateur et dénominateur) permettant le calcul de l’incidence des septicémies associées à un CVC. Celle-ci est plus élevée dans les hôpitaux universitaires, les USI et dans la région de Bruxelles. A noter que la proportion d’hôpitaux universitaires est la plus élevée à Bruxelles (4 hôpitaux universitaires /15 hôpitaux participants en 2014). (tableau 2)
Tableau 2: Incidence des septicémies associées à un cathéter veineux central par 10.000 journées d’hospitalisation, 2014
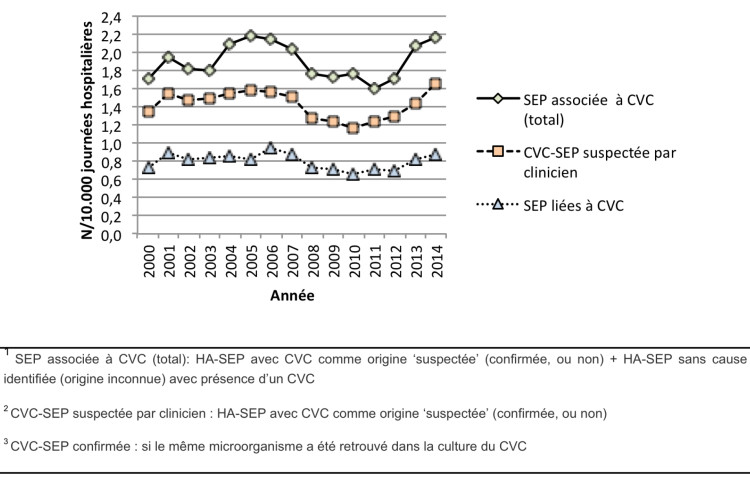
La figure 2 montre l’incidence moyenne nationale des CVC-SEP pour 2000 – 2014. En 2014, l’incidence moyenne des septicémies associées à un CVC, par 10.000 journées d’hospitalisation était de 2,2 à l’hôpital et 13,3 à l’USI. Ces chiffres sont les plus élevés depuis 2011. Ces infections sont néanmoins peu fréquentes en nombre absolu, avec une médiane (P25-P75) de 3 épisodes (0-6) par trimestre et par hôpital.
Figure 2 : Incidence des septicémies associées au cathéter veineux central dans les hôpitaux belges, 2000-2014
4. Discussion
Un grand nombre d’hôpitaux a participé à la surveillance des septicémies acquises à l’hôpital en 2014. Il existe une grande variabilité entre les hôpitaux, laquelle persiste après stratification selon différentes catégories (taille de l’hôpital, hôpital universitaire ou non). Cela pointe vers un important potentiel de prévention6-9,14.
Le système de surveillance documente une augmentation des septicémies associées à un CVC depuis 2011. Cette augmentation est marquée, que l’on prenne ou non en compte les septicémies pour lesquelles le clinicien a enregistré «origine inconnue» et qui ont été à l’analyse classées comme «origine CVC probable». Depuis 2011 et l’importante révision du protocole de surveillance, le nombre d’hôpitaux enregistrant des données a beaucoup augmenté. Une augmentation de la détection due à une meilleure sensibilisation autour de la problématique des septicémies associées au CVC est probable.
Ces données soulignent l’importance des définitions de cas, et de leur interprétation. Il est clair que la définition utilisée pour «septicémies associées au CVC» (CVC : origine probable) est très sensible mais manque de spécificité. Considérer – par défaut – une septicémie comme associée à un CVC, du simple fait qu’un CVC était présent avant l’infection, alors que le clinicien a estimé l’origine inconnue, inclut vraisemblablement certains faux positifs. Or cette catégorie représente un quart des septicémies associées au CVC. D’un autre côté, la définition utilisée pour les septicémies liées à un CVC (origine CVC confirmée) manque de sensibilité, car souvent le CVC n’a pas été mis en culture, et la confirmation de l’origine «CVC» n’a pas été obtenue. Il faut se rappeler qu’une définition de cas utilisée dans un but de surveillance doit avant tout être reproductible quitte à être moins fiable car le but est de suivre les tendances. (Au contraire d’un diagnostic clinique qui doit être fiable, car le but est de traiter un patient). Si les biais restent relativement constants, l’interprétation des tendances reste possible. La proportion de septicémies «origine inconnue, avec CVC présent» dans le total des septicémies associées à un CVC est restée remarquablement stable au niveau national entre 2000 et 2014. Il est donc important de présenter ensemble les données de septicémies associées au CVC et liées à un CVC, la «vérité» se trouvant quelque part entre les deux.
Il faut également dissocier l’utilisation de ces données pour le suivi des tendances au niveau national, et au niveau local. Les hygiénistes, qui avec les cliniciens, utilisent les chiffres de surveillance pour le suivi dans leur hôpital, sont les mieux placés pour interpréter leurs propres données, et apprécier les biais inhérents aux définitions de cas utilisées. Si ces données sont utilisées de cette façon, le système de surveillance atteint son objectif.
Des tentatives d’amélioration de la définition de cas sont cependant en cours. Environ un quart des septicémies associées au CVC dans la catégorie «origine inconnue avec présence d’un CVC» est situé en hémato-oncologie; certaines pourraient être dues à des bactériémies primaires associées à une rupture de la barrière muqueuse digestive chez des patients neutropéniques ou des greffés de la moelle osseuse (mucosal barrier injury, MBI)15. Le groupe de travail SEP a pris la décision d’inclure cette origine possible dans la liste des options offertes comme «origine suspectée» de la septicémie
(http://www.nsih.be/download/SEP/Minutes_SEP_WG_2015-06-24.pdf).
Nous pourrons suivre l’impact de cet ajout sur la proportion des SEP-CVC avec origine «inconnue».
En Belgique, les données concernant les septicémies associées au CVC (au niveau de tout l’hôpital) sont rapportées par patient jours, et non par journées cathéters ce qui est habituellement recommandé. Cependant le comptage des journées cathéter pour tout l’hôpital implique une charge de travail substantielle, et le calcul d’une incidence par journées d’hospitalisation permet à l’hôpital de suivre son propre problème (peut-être moins de se comparer aux autres, mais ce n’est pas le but). Une publication récente comparant pour le même hôpital les incidences de septicémies associées au CVC par nombre de journées d’hospitalisation, et par journées cathéter a montré que ces chiffres étaient fortement corrélés16.
Le comptage des journées cathéter est optionnel dans la surveillance SEP, mais a néanmoins un intérêt si le but est de suivre le ratio d’utilisation des CVC (‘device utilization ratio’=nombre de journées cathéter/nombre de journées patients), par exemple dans une perspective de diminution de l’exposition au CVC. Nous avons effectué une étude explorant la validité d’un échantillonnage hebdomadaire en USI (à la place d’un comptage exhaustif). Ceci sera ajouté au protocole SEP en 2016, mais restera limité aux USI.
Conclusion
Nous observons en Belgique depuis 2011 une augmentation des septicémies associées au CVC qui est sans doute due à une amélioration de la détection. Le problème est réel et en grande partie évitable. Notre unité a lancé une enquête internationale en ligne qui s’adresse aux médecins et aux infirmières travaillant dans des unités de soins intensifs (pas aux hygiénistes !) et dont le but est de mesurer les pratiques de prévention des septicémies associées aux CVC.
N’hésitez pas à diffuser cette enquête auprès des personnes concernées dans votre hôpital !
http://www.world-critical-care.org/index.php?option=com_content&view=article&id=266
Références
1. Vrijens F, Hulstaert F, Gordts B et al. Nosocomial infections in Belgium, part 2 : Impact on Mortality and Costs. 2009 KCE reports Vol 102C.
2. Vrijens F, Hulstaert F, Van de Sande S, Devriese S, Morales I, Parmentier Y. Hospital-acquired, laboratory-confirmed bloodstream infections: linking national surveillance data to clinical and financial hospital data to estimate increased length of stay and healthcare costs. Journal of Hospital Infection 2010;75(3):158-162.
3. Vrijens F, Hulstaert F, Devriese S, Van de Sande S. Hospital-acquired infections in Belgian acute-care hospitals: an estimation of their global impact on mortality, length of stay and healthcare costs. Epidemiol Infect 2012;140(1):126-136.
4. Hammami N, Lambert ML. Surveillance of bloodstream infections in Belgian hospitals (‘SEP’) – Annual report 2014, Surveillance data 2000-2014 – Hospital stay data 2000-2012. 2015
5. Mertens K. Surveillance national acquises dans les unités de soins intensifs – Rapport annuel 2012. 2014
6. Pronovost PJ, Goeschel CA, Colantuoni E et al. Sustaining reductions in catheter related bloodstream infections in Michigan intensive care units: observational study. BMJ 2010;340:c309.
7. Palomar M, Alvarez-Lerma F, Riera A et al. Impact of a National Multimodal Intervention to Prevent Catheter-Related Bloodstream Infection in the ICU: The Spanish Experience. Crit Care Med 2013;41(10):2364-2372.
8. Berenholtz SM, Pronovost PJ, Lipsett PA et al. Eliminating catheter-related bloodstream infections in the intensive care unit. Crit Care Med 2004;32(10):2014-2020.
9. Blot K, Bergs J, Vogelaers D, Blot S, Vandijck D. Prevention of central line-associated bloodstream infections through quality improvement interventions: a systematic review and meta-analysis. Clin Infect Dis 2014;59(1):96-105.
10. Umscheid CA, Mitchell MD, Doshi JA, Agarwal R, Williams K, Brennan PJ. Estimating the proportion of healthcare-associated infections that are reasonably preventable and the related mortality and costs. Infect Control Hosp Epidemiol 2011;32(2):101-114.
11. Lambert ML, Silversmit G, Savey A et al. Preventable proportion of severe infections acquired in intensive care units: case-mix adjusted estimations from patient-based surveillance data. Infect Control Hosp Epidemiol 2014;35(5):494-501.
12. Rossello-Urgell J, Vaque-Rafart J, Hermosilla-Perez E, Allepuz-Palau A. An approach to the study of potentially preventable nosocomial infections. Infect Control Hosp Epidemiol 2004;25(1):41-46.
13. Hammami N, Lambert ML. Nationale surveillance voor septicaemieën in het ziekenhuis (SEP) – Revisie SEP surveillance protocol v4.2. 2015
14. Marschall J, Mermel LA, Fakih M et al. Strategies to prevent central line-associated bloodstream infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol 2014;35(7):753-771.
15. Centers for Disease Control and Prevention (CDC). Bloodstream Infection Event (Central Line-Associated Bloodstream Infection and Non-central line-associated Bloodstream Infection)-January 2015. 2015 http://www.cdc.gov/nhsn/PDFs/pscManual/4PSC_CLABScurrent.pdf
16. Horstman MJ, Li YF, Almenoff PL, Freyberg RW, Trautner BW. Denominator Doesn’t Matter: Standardizing Healthcare-Associated Infection Rates by Bed Days or Device Days. Infect Control Hosp Epidemiol 2015;36(6):710-716.
Nouveautés
Agenda scientifique
- avril 2025
-
du 11/04 au 15/04 || à Vienne
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juin 2025
-
du 4/06 au 6/06 || à Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
du 17/06 au 18/06 || à Londres
Congrès HIS (Healthcare Infection Society)
- septembre 2025
-
du 16/09 au 19/09 || à Genève
International Conference on Prevention and Infection control (ICPIC)
- octobre 2025
-
du 19/10 au 22/10 || à Atlanta
Society for Health Care Epidemiology of America (SHEA)